ヒストン脱メチル化酵素
中川 拓海、中島 欽一
九州大学 大学院医学研究院 応用幹細胞医科学部門 基盤幹細胞学分野
DOI:10.14931/bsd.10200 原稿受付日:2023年4月26日 原稿完成日:2023年5月XX日
担当編集委員:古屋敷 智之(神戸大学大学院医学研究科・医学部 薬理学分野)
英:histone demethylase
ヒストン脱メチル化酵素とは、メチル化されたヒストン尾部から、メチル基を除去する脱メチル化反応を触媒する酵素である。これまでに同定されたヒストン脱メチル化酵素として、lysine-specific demethylase (LSD) family と jumonji-C (JmjC) domain-containing protein familyが知られている。神経系においては、胎生期神経前駆細胞や神経幹細胞の増殖及び分化の制御や、ニューロンの成熟や保護などへ関与し、様々な神経疾患との関連が報告されている。
歴史・背景

Wikipediaより。
ヒストン脱メチル化酵素の探索は、1964年に遊離モノ/ジメチル化リジン(図1)を脱メチル化する酵素の存在が報告されたことに始まる[1](ref 1)。その後、メチル化ヒストンを脱メチル化する酵素の存在を示唆する報告もなされ[2][3](ref 2, 3)、小分子の脱メチル化が酸化酵素によって触媒されることなどから、脱メチル化反応も酸化酵素によって誘導されるのではと考えられるようになった[4][5](ref 4, 5)。しかし、その分子実体は長年にわたり不明であった。
そのような中、Shiらの研究グループは、Flavin adenine dinucleotide(FAD)依存的アミン酸化酵素に配列が類似しているKIAA0601というタンパク質が、様々なヒストン脱アセチル化酵素複合体の構成因子であることに注目し、この分子のヒストン脱メチル化酵素としての可能性を調査した。その結果、KIAA0601がモノ/ジメチル化されたヒストン3の4番目のリジン(H3K4)の脱メチル化反応を触媒する酵素であることを示し、Lysine-specific demethylase 1(LSD1)と名付け、2004年に論文として報告した[6](ref 6)。またこの発見により、それまで不可逆的な修飾であると考えられていたヒストンのメチル化は、アセチル化同様に可逆的な修飾であることが証明された。
最初のヒストン脱メチル化酵素の発見から2年後、Zhangらの研究グループによって、ヒストンH3の36番目のリジン残基(H3K36)を特異的に脱メチル化する新規酵素JmjC Domain-Containing Histone Demethylation Protein 1(JHDM1/FBXL11)が、クロマトグラフィーを用いた生化学的手法により精製された[7](Ref 7)。また、JHDM1が持っているJumonji-C (Jmjc)ドメインは、Fe(II)及びα-ケトグルタル酸(α-KG) 依存的にヒストン脱メチル化を誘導し、この酵素活性が酵母からヒトまで保存されていることが明らかにされた[7] (ref 7)。
サブファミリーと構造
LSDファミリー
LSD1とLSD2が属し、共にヒストン脱メチル化酵素活性を持つ。LSD familyは、アミンオキシダーゼ様(AOL)ドメインと、クロマチン関連タンパク質に特有のSWIRM(SWI3、RSC8、Moira)ドメインを持っている。AOLドメインは、FAD結合ドメインと基質結合ドメインに分かれており、触媒活性を持っている。LSD1はTowerドメインを、LSD2は2種類のzinc finger(ZFs)ドメインを特異的に持っている(表)。また、LSD2のSWIRMドメインには、LSD1には無いAOLに隣接するcoil loop(residues 273-278)が存在しており、LSD2の酵素活性に必要であることが報告されている[8](ref 8)。
JmjCドメイン含有タンパク質ファミリー
共通してJmjCドメインを持つが、各々が保持する他のドメインや構造から、さらにいくつかのサブファミリーに分類される[9](ref 9)。酵素活性を持たない、もしくは報告されていないものが存在するが、ここでは酵素活性を持つものについて、各サブファミリーの構造[9](ref 9)や各酵素が標的とするヒストン修飾を表にまとめた。
| 遺伝子名 | 標的 | 遺伝子発現の組織特異性 The Human Protein Atlasより |
構造[8][9](ref 8, 9) | |
|---|---|---|---|---|
| リジン特異的脱メチル化酵素 (lysine specific demethylase, LSD)ファミリー | ||||
| LSD1 (KDM1A) | H3K4/K9me1, me2 | 低 (多くの組織) | ||
| LSD2 (KDM1B) | H3K4me1, me2 H3K9me1, me2 |
低 (多くの組織) | ||
| Jumonji (JmjC)ドメイン含有タンパク質ファミリー | ||||
| FBXL11 (KDM2A) | H3K36me2 | 低 (多くの組織) | ||
| FBXL10 (KDM2B) | H3K36me1, me2 H3K4me3 |
低 (多くの組織) | ||
| JMJD1A (KDM3A) | H3K9me1, me2 | 低 (多くの組織) | ||
| JMJD1B (KDM3B) | H3K9me2 | 低 (多くの組織) | ||
| HR | H3K9me2,me1 | 食道、皮膚で高発現 | ||
| JMJD2A (KDM4A) | H3K9/K36me3 H1.4K26me3 |
低 (多くの組織) | ||
| JMJD2B (KDM4B) | H3K9/K36 me3 H1.4K26me3 |
低 (多くの組織) | ||
| JMJD2C (KDM4C) | H3K9/K36me3 H1.4K26me3 |
低 (多くの組織) | ||
| JMJD2D (KDM4D) | H3K9me2, me3 H1.4K26me2,me3 |
精巣で高発現 | ||
| JARID1A (KDM5A, RBP2) | H3K4me2, me3 | 腸管で高発現 | ||
| JARID1B (KDM5B, PLU1) | H3K4me1, me2, me3 | 精巣で高発現 | ||
| JARID1C (KDM5C, SMCX) | H3K4me2, me3 | 低 (多くの組織) | ||
| JARID1D (KDM5D, SMCY) | H3K4me2, me3 | 低 (多くの組織) | ||
| UTX (KDM6A) | H3K27me2, me3 | 低 (多くの組織) | ||
| JMJD3 (KDM6B) | H3K27me2, me3 | 低 (多くの組織) | ||
| KIAA1718 (KDM7A) | H3K9me1,me2 H3K27me2 H4K20me1 |
低 (多くの組織) | ||
| PHF8 (KDM7B) | H3K9me2,me1 H3K27me2 H4K20me1 |
精巣上体で高発現 | ||
| PHF2 (KDM7C) | H3K9me2,me1 | 低 (多くの組織) | ||
| JMJD5 (KDM8) | H3K36me2 | 肝臓で高発現 | ||
| NO66 | H3K4me1, me3 H3K36me3, me2 |
低 (多くの組織) |
凡例
H3K4me2:ヒストン3の4番目のジメチルリジンを標的とする。
タンパク質ドメイン
LSDファミリー:![]() :SWIRM
:SWIRM
![]() :AOL
:AOL
![]() :Tower
:Tower
![]() :ZF
:ZF
![]() :ZF_CW
:ZF_CW
Jumonjiドメイン含有タンパク質ファミリー:![]() :JmjC
:JmjC
![]() :JmjN
:JmjN
![]() :PHD
:PHD
![]() :FBOX
:FBOX
![]() :Bright/Arid
:Bright/Arid
![]() :C5HC2-ZF
:C5HC2-ZF
![]() :Tudor
:Tudor
![]() :CXXC-ZF
:CXXC-ZF
![]() :TPR
:TPR
![]() :ZF-like
:ZF-like
![]() :JmjC
:JmjC
組織分布
多くのヒストン脱メチル化酵素は、広汎の組織で発現しているが、腸管や精巣などに特異的に高発現しているものも存在する。その概要をHuman Protein Atlas, Tissue RNA expression "Tissue specificity"(ref 10)から抜粋して表にまとめた。 JmjN: Jumonji N domain; PHD: plant homeobox domain; TPR: tetracopeptide repeat domain; ZF-like: zinc-finger-like domain.
機能
LSDファミリー
分子機能
LSD1及びLSD2は、FAD依存的な酸化反応により、リジンからのメチル基除去を触媒する(図2)。この反応は、側鎖上のプロトン化された窒素原子に依存しているため、LSDはモノ及びジメチル化されたリジンを脱メチル化できるが、トリメチル化されたリジンを脱メチル化できない。
LSD1はヒストン尾部上のメチル化リジンのほかに、転写因子p53(K370)、E2F1 (K185)、 DNAメチルトランスフェラーゼ1(DNMT1; K1096)のメチル化リジンを脱メチル化することが報告されている[10][11][12](ref 11-13)。
LSD1は、SWIRMドメインを介して他のタンパク質と相互作用するが、相互作用分子依存的に脱メチル化のターゲットが変化する。例えば、アンドロゲン受容体(AR)と結合すると、PSA遺伝子座のプロモーター領域におけるH3K9me2及びH3K9me1の脱メチル化を誘導し[13](ref 14)、CoRESTと複合体を形成するとH3K4me2及びH3K4me1の脱メチル化を誘導することが知られている[14](ref 15)。
LSD2は、SWIRM ドメインを介してglyoxylate reductase 1 homolog(GLYR1/NPAC)と結合するだけでなく、この結合によって自身の脱メチル化活性が増強される[8](ref 8)。
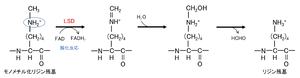
LSDによる脱メチル化反応は、楕円で囲まれたプロトン化された窒素原子に依存している。文献[15](ref 27)の図を改変。
個体での機能
Lsd1(Kdm1a)欠損マウスは、胎生7.5日以前に胎生致死となる[16](ref 16)。
Lsd1欠損ES細胞では、リン酸化Dnmt1の脱メチル化が減少することでDnmt1の安定性が低下し、ゲノム全体のDNAメチル化レベルが減少する[12](ref 13)。この結果から、Lsd1は間接的にDNAのメチル化レベルも制御していると考えられる。
下垂体前駆細胞マーカー遺伝子であるPitx1を発現した細胞特異的にLsd1を欠損させたマウスでは、正常の下垂体が形成されるが、終末分化のマーカーである成長ホルモン(Gh)・甲状腺刺激ホルモンβ(Tshb)・性腺刺激ホルモンと、副腎皮質細胞のマーカーである黄体形成ホルモンβ(Lhb)・プロオピオメラノコルチン(Pomc1)などの発現が、消失もしくは減少する。したがって、Lsd1は下垂体ホルモンの正しい発現に必須であると考えられている[16](ref 16)。
ES細胞でLsd1は、ニューロン分化に重要な遺伝子(Pax3, Ascl1, Zic1, Zic4, Neurog1)のプロモーターのH3K4me2やH3K4me1を脱メチル化し、これらの遺伝子の発現を抑制することでES細胞の未分化性を維持している[17](ref 17)。またこのLsd1による未分化性の維持機能は、E3ユビキチンリガーゼであるJade2によってLsd1がユビキチン―プロテアソーム経路を介して分解されることで解除され、ES細胞が神経系細胞系譜に分化可能になる[17](ref 17)。
Lsd1は、神経幹細胞や胎生期神経前駆細胞における機能がいくつか報告されている。神経幹細胞でLsd1は、核内受容体であるTlxの標的遺伝子のプロモーターにHdac5と共に誘引され、それらの遺伝子の発現を抑制し神経幹細胞の増殖を維持している[18](ref 18)。胎生期マウス神経前駆細胞でLsd1は、Rbpjk及びCoRESTと複合体を形成しHes1プロモーターに結合している。しかしNotchシグナルが活性化されると、Notchの細胞内領域(NCID)がタンパク質切断により細胞膜から遊離し、Rbpjkに結合することで、Lsd1とRbpjkの結合を解離させる(図3)。また、Lsd1とCoRESTのノックダウンによってHes1陽性細胞や神経前駆/幹細胞マーカーであるSox2及びTbr2陽性細胞の割合が増加し、ニューロン分化を誘導するNeurog2の陽性細胞の割合が減少する。これらの結果から、Lsd1は胎生期神経前駆細胞において、Notchシグナルを抑制しニューロンの分化を促進するように働いていると考えられている[19](ref 19)。また、胎生期の網膜でもLsd1は同様の機能を発揮すると報告されている[20](ref 20)。

胎生期マウス神経前駆細胞において、Notchシグナルが不活性化の状態では、Lsd1はCoREST及びRbpjkと複合体を形成し、Hes1の発現を抑制している。Notchシグナルが活性化すると、Notchの細胞内領域(NICD)が細胞膜から遊離し、Rbpjkに結合することでRbpjkとLsd1を解離させ、Hes1の発現を促進する。Dll1/Jag1は共にNotchのリガンドである。Dll1: Delta Like Canonical Notch Ligand 1; Jag1: Jagged Canonical Notch Ligand 1.
分化したニューロンでは、選択的スプライシングにより4アミノ酸から成るexonを特異的に含んだアイソフォーム(Lsd1-E8a)の発現が増加する。Lsd1-E8aは成熟中のニューロンにおいて、ニューロン特異的エクソン(E8a)内の2番目のトレオニンがリン酸化されてCoRESTとHdac2との複合体から解離し[21](ref 21)、神経突起の分岐と伸長を促進する[21][22](ref 21, 22)。さらにこのLsd1-E8aは会合するパートナーによって、脱メチル化する標的ヒストンを変える。成熟中のニューロンでは、Lsd1-E8aはSupervillin(Svil)と相互作用することにより、H3K9me2の脱メチル化活性を得る。そして、ニューロン分化過程で発現が増加する遺伝子のプロモーターのH3K9me2の脱メチル化を誘導し、それらの遺伝子の発現を促進している[23](ref 23)。一方、Svilがほとんど発現していない成熟したニューロンでは、Lsd1-E8aはCAMP responsive element binding protein (Creb)と相互作用することにより、H4K20me2の脱メチル化活性を得て、ニューロンの活性化に反応する遺伝子の転写の開始及び伸長を誘導している(図4)。加えて、LSD1-E8aを神経系細胞特異的にノックアウトし、ニューロンでこのアイソフォームを発現しないようにしたマウス(Nestin-CRE: loxP-Lsd1(exon 8a)-loxPマウス)は、空間の学習及び記憶能力が減少する[24](ref 24)。
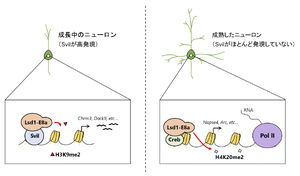
Svilが高発現している成長中のニューロンでは、Lsd-E8aはSvilと相互作用してH3K9me2の脱メチル化を誘導する。一方で、Svilがほとんど発現していない成熟したニューロンでは、Lsd-E8aはCrebと相互作用してH4K20me2の脱メチル化を誘導する。
成体マウスの全身性にLsd1を欠損させた場合、海馬や大脳皮質のニューロンに重度の変性がみられ、麻痺などの運動障害が観察された[25](ref 25)。しかし、大脳の他の神経系細胞や小脳のプルキンエニューロンには影響がみられず、さらに、肝臓の肝細胞や腎臓のネフロン細胞も細胞死などの形態的な兆候を示さなかったことから、Lsd1は海馬や大脳皮質のニューロン特異的に細胞を保護する機能を持っているのではないかと推測された[25](ref 25)。
Lsd2を欠損した母親マウスの卵母細胞ではインプリンティング異常が起こり、Lsd2欠損母親マウスゲノムを受け継いだ仔マウスは、重度の胎盤欠陥と成長障害、神経管欠損、心膜水腫など様々な胚異常を示し、胎生(E)10.5日を超えて生存できない[26]。(ref 26)
JmjCドメイン含有タンパク質ファミリー
分子機能
水酸化反応により脱メチル化を触媒する水酸化酵素である。JmjC ドメイン含有タンパク質は,補酵素として Fe(II)とアルファケトグルタル酸(α-KG)を用いて,水酸基をメチル基に導入する(図5)。この結果生成された不安定なカルビノールアミン中間体はホルムアルデヒドを放出し脱メチル化が完了する(図5)。この反応は LSD familyのように,トリメチル化リジンからは脱メチル化できないという制限は無い。
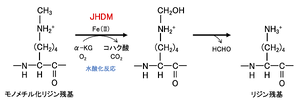
文献[15](ref 27)の図を改変。
個体での機能
Fbxl10(Kdm2b)はE8.5から神経上皮や頭蓋領域の神経堤が発生する部位に発現する。そして、E9.5では前脳、中脳、後脳、頭蓋間充織にまでその発現が広がり、E10.5では神経管や視蓋で、E14.5では大脳皮質の神経前駆細胞から成る脳室帯で強く発現するようになる[27](ref 28)。Fbxl10欠損マウスは、中脳及び後脳の神経管閉鎖不全による外脳症となり、生後すぐに死亡する。E9.5のFbxl10欠損胚の神経堤細胞とその周囲の間充織に多くのアポトーシスマーカー陽性細胞がみられたことから、神経上皮と神経堤間充織組織における過剰な細胞死が原因ではないかと考えられている。また、E14.5の大脳皮質脳室帯や網膜では、神経前駆細胞の増加がみられたことから、Fbxl10はマウスの神経前駆細胞でアポトーシス及び増殖を負に制御していると考えられている[27] (ref 28)。
Utx(Kdm6a)を神経幹細胞特異的に欠損させたマウスは、学習記憶障害を示し、海馬のニューロンの機能異常及び形態異常がみられる[28](ref 29)。
ES細胞において、各細胞種への分化に必要な遺伝子のプロモーターでは、転写促進型ヒストン修飾であるH3K4me3と転写抑制型ヒストン修飾H3K27me3が共存しており、各遺伝子は低発現状態に保たれている(bivalent state)。Jmjd3(Kdm6b)は、マウスES細胞が神経系細胞に分化する際、神経前駆/幹細胞マーカーであるNestinプロモーターのH3K4me3とH3K27me3のうち、H3K27me3を脱メチル化することが報告されている。このことから、Jmjd3はNestinプロモーターのbivalent state を解き、神経系への分化過程の適切な時期にNestinが発現するために必要であると考えられている[29](ref 30)。Jmjd3 (Kdm6b)は他にも、ニューロン新生を制御することが報告されている[30][31](ref 31, 32)。ニワトリ脊髄の胎生期神経前駆細胞では、ニューロン分化を促進するTransforming Growth Factor-β(TGFβ)シグナルの下流因子Smad3と共に、標的遺伝子のプロモーター領域のH3K27me3を脱メチル化し、ニューロン分化に重要な遺伝子の転写を活性化させ、ニューロン分化を誘導する(ref 31)。また、成体マウス大脳皮質脳室下帯 (SVZ)の神経幹細胞では、ニューロン分化関連遺伝子(Myt1, Slc32a1, and Gjb6)のプロモーター領域や、SVZ神経幹細胞のニューロン分化に重要なDlx2のエンハンサー領域のH3K27me3を脱メチル化し、ニューロン分化を誘導する[31](ref 32)。
疾患との関わり
LSDファミリー
成体マウスニューロンでLsd1が欠損したマウスの海馬や大脳皮質に重度の神経変性がみられ、記憶・学習などの認知機能が低下する[25](ref 25)。また、リン酸化タウ(pTau)の凝集体がみられるアルツハイマー病(AD)患者のニューロンでは、LSD1がこれらの凝集体と細胞質に共局在していることや[25](ref 25)、pTauの蓄積がみられるタウオパチーモデルマウスでも同様に細胞質での共局在が観察されることから[32](ref 33)、核内からの隔離によるLSD1の機能阻害がADなどのタウを介した神経変性疾患に関連しているのではないかと考えられている。
一方で、Lsd1阻害剤を投与することによって、ASDモデルマウスの症状改善[33](ref 34)やアルツハイマーモデルマウスの認知機能回復[34](ref 35)がみられるという報告もある。
JJmjCドメイン含有タンパク質ファミリー
FBXL10(KDM2B)とヒストンメチル化酵素SETD1Bの両方を含むゲノム領域である12a24.31の欠失が知的障害を引き起こし[35](ref 36)、JMJD1C(KDM3C)の複数の変異が、自閉スペクトラム症 (ASD)、レット症候群、知的障害の患者においてみられることが報告されている[36](ref 37)。
Jmjd2(Kdm4)阻害剤であるジメチルオキサリルグリシン(DMOG)を10日間腹腔内投与したマウスは、ストレスに晒されなくてもうつ様行動や不安様行動を示す[37](ref 38)。
JARID1C(KDM5C)の機能不全が起こる変異は、家族性X 連鎖精神遅滞(XLID)の原因の一つとして報告されている[38](ref 39)。Kdm5c欠損マウスでは、社会的行動の障害、記憶障害や攻撃性の増加など、XLIDで観察される異常がみられる[39](ref 40)。Kdm5c欠損マウス由来のニューロンは神経突起の分岐やスパインの形態に異常がみられ、XLID関連の変異を導入したKdm5cを神経芽細胞(Neuro2a)で過剰発現させると、同様の神経突起の発達不全がみられたことから、Kdm5cの機能不全によるニューロンの発達不全がXLID の症状の一因ではないかと考えられている[40](ref 41)。
PHF8(KDM7B)の変異もXLIDと関連があると報告されている (ref 42)。マウスを用いた解析では、Phf8(Kdm7b)を欠損させると学習記憶障害や海馬長期増強(LTP)障害を示すことが報告されている[41](ref 42)。またこれらの障害は、mTORシグナルの活性化因子であるRps6ka1遺伝子の転写開始点(TSS)におけるH4K20me1の脱メチル化がPhf8の欠損によって阻害され、Rps6ka1の発現が増加しmTORシグナルが亢進することで引き起こされる[42](ref 43)。
関連語
参考文献
- ↑
KIM, S., BENOITON, L., & PAIK, W.K. (1964).
EPSILON-ALKYLLYSINASE. PURIFICATION AND PROPERTIES OF THE ENZYME. The Journal of biological chemistry, 239, 3790-6. [PubMed:14257609] [WorldCat] - ↑
Paik, W.K., & Kim, S. (1973).
Enzymatic demethylation of calf thymus histones. Biochemical and biophysical research communications, 51(3), 781-8. [PubMed:4704060] [WorldCat] [DOI] - ↑
Paik, W.K., & Kim, S. (1974).
Epsilon-alkyllysinase. New assay method, purification, and biological significance. Archives of biochemistry and biophysics, 165(1), 369-78. [PubMed:4441079] [WorldCat] [DOI] - ↑
Chinenov, Y. (2002).
A second catalytic domain in the Elp3 histone acetyltransferases: a candidate for histone demethylase activity? Trends in biochemical sciences, 27(3), 115-7. [PubMed:11893502] [WorldCat] [DOI] - ↑
Bannister, A.J., Schneider, R., & Kouzarides, T. (2002).
Histone methylation: dynamic or static? Cell, 109(7), 801-6. [PubMed:12110177] [WorldCat] [DOI] - ↑
Shi, Y., Lan, F., Matson, C., Mulligan, P., Whetstine, J.R., Cole, P.A., ..., & Shi, Y. (2004).
Histone demethylation mediated by the nuclear amine oxidase homolog LSD1. Cell, 119(7), 941-53. [PubMed:15620353] [WorldCat] [DOI] - ↑ 7.0 7.1
Tsukada, Y., Fang, J., Erdjument-Bromage, H., Warren, M.E., Borchers, C.H., Tempst, P., & Zhang, Y. (2006).
Histone demethylation by a family of JmjC domain-containing proteins. Nature, 439(7078), 811-6. [PubMed:16362057] [WorldCat] [DOI] - ↑ 8.0 8.1 8.2
Fang, R., Chen, F., Dong, Z., Hu, D., Barbera, A.J., Clark, E.A., ..., & Shi, Y.G. (2013).
LSD2/KDM1B and its cofactor NPAC/GLYR1 endow a structural and molecular model for regulation of H3K4 demethylation. Molecular cell, 49(3), 558-70. [PubMed:23260659] [PMC] [WorldCat] [DOI] - ↑ 9.0 9.1 9.2
Klose, R.J., Kallin, E.M., & Zhang, Y. (2006).
JmjC-domain-containing proteins and histone demethylation. Nature reviews. Genetics, 7(9), 715-27. [PubMed:16983801] [WorldCat] [DOI] - ↑
Huang, J., Sengupta, R., Espejo, A.B., Lee, M.G., Dorsey, J.A., Richter, M., ..., & Berger, S.L. (2007).
p53 is regulated by the lysine demethylase LSD1. Nature, 449(7158), 105-8. [PubMed:17805299] [WorldCat] [DOI] - ↑
Kontaki, H., & Talianidis, I. (2010).
Lysine methylation regulates E2F1-induced cell death. Molecular cell, 39(1), 152-60. [PubMed:20603083] [WorldCat] [DOI] - ↑ 12.0 12.1
Wang, J., Hevi, S., Kurash, J.K., Lei, H., Gay, F., Bajko, J., ..., & Chen, T. (2009).
The lysine demethylase LSD1 (KDM1) is required for maintenance of global DNA methylation. Nature genetics, 41(1), 125-9. [PubMed:19098913] [WorldCat] [DOI] - ↑
Metzger, E., Wissmann, M., Yin, N., Müller, J.M., Schneider, R., Peters, A.H., ..., & Schüle, R. (2005).
LSD1 demethylates repressive histone marks to promote androgen-receptor-dependent transcription. Nature, 437(7057), 436-9. [PubMed:16079795] [WorldCat] [DOI] - ↑
Shi, Y.J., Matson, C., Lan, F., Iwase, S., Baba, T., & Shi, Y. (2005).
Regulation of LSD1 histone demethylase activity by its associated factors. Molecular cell, 19(6), 857-64. [PubMed:16140033] [WorldCat] [DOI] - ↑ 15.0 15.1
Tsukada, Y. (2007).
[Histone methylation and demethylation--focusing on demethylation--]. Seikagaku. The Journal of Japanese Biochemical Society, 79(7), 691-7. [PubMed:17763704] [WorldCat] - ↑ 16.0 16.1
Wang, J., Scully, K., Zhu, X., Cai, L., Zhang, J., Prefontaine, G.G., ..., & Rosenfeld, M.G. (2007).
Opposing LSD1 complexes function in developmental gene activation and repression programmes. Nature, 446(7138), 882-7. [PubMed:17392792] [WorldCat] [DOI] - ↑ 17.0 17.1
Han, X., Gui, B., Xiong, C., Zhao, L., Liang, J., Sun, L., ..., & Shang, Y. (2014).
Destabilizing LSD1 by Jade-2 promotes neurogenesis: an antibraking system in neural development. Molecular cell, 55(3), 482-94. [PubMed:25018020] [WorldCat] [DOI] - ↑
Sun, G., Alzayady, K., Stewart, R., Ye, P., Yang, S., Li, W., & Shi, Y. (2010).
Histone demethylase LSD1 regulates neural stem cell proliferation. Molecular and cellular biology, 30(8), 1997-2005. [PubMed:20123967] [PMC] [WorldCat] [DOI] - ↑
Lopez, C.I., Saud, K.E., Aguilar, R., Berndt, F.A., Cánovas, J., Montecino, M., & Kukuljan, M. (2016).
The chromatin modifying complex CoREST/LSD1 negatively regulates notch pathway during cerebral cortex development. Developmental neurobiology, 76(12), 1360-1373. [PubMed:27112428] [WorldCat] [DOI] - ↑
Popova, E.Y., Pinzon-Guzman, C., Salzberg, A.C., Zhang, S.S., & Barnstable, C.J. (2016).
LSD1-Mediated Demethylation of H3K4me2 Is Required for the Transition from Late Progenitor to Differentiated Mouse Rod Photoreceptor. Molecular neurobiology, 53(7), 4563-81. [PubMed:26298666] [PMC] [WorldCat] [DOI] - ↑ 21.0 21.1
Toffolo, E., Rusconi, F., Paganini, L., Tortorici, M., Pilotto, S., Heise, C., ..., & Battaglioli, E. (2014).
Phosphorylation of neuronal Lysine-Specific Demethylase 1LSD1/KDM1A impairs transcriptional repression by regulating interaction with CoREST and histone deacetylases HDAC1/2. Journal of neurochemistry, 128(5), 603-16. [PubMed:24111946] [WorldCat] [DOI] - ↑
Zibetti, C., Adamo, A., Binda, C., Forneris, F., Toffolo, E., Verpelli, C., ..., & Battaglioli, E. (2010).
Alternative splicing of the histone demethylase LSD1/KDM1 contributes to the modulation of neurite morphogenesis in the mammalian nervous system. The Journal of neuroscience : the official journal of the Society for Neuroscience, 30(7), 2521-32. [PubMed:20164337] [PMC] [WorldCat] [DOI] - ↑
Laurent, B., Ruitu, L., Murn, J., Hempel, K., Ferrao, R., Xiang, Y., ..., & Shi, Y. (2015).
A specific LSD1/KDM1A isoform regulates neuronal differentiation through H3K9 demethylation. Molecular cell, 57(6), 957-970. [PubMed:25684206] [PMC] [WorldCat] [DOI] - ↑
Wang, J., Telese, F., Tan, Y., Li, W., Jin, C., He, X., ..., & Rosenfeld, M.G. (2015).
LSD1n is an H4K20 demethylase regulating memory formation via transcriptional elongation control. Nature neuroscience, 18(9), 1256-64. [PubMed:26214369] [PMC] [WorldCat] [DOI] - ↑ 25.0 25.1 25.2 25.3
Christopher, M.A., Myrick, D.A., Barwick, B.G., Engstrom, A.K., Porter-Stransky, K.A., Boss, J.M., ..., & Katz, D.J. (2017).
LSD1 protects against hippocampal and cortical neurodegeneration. Nature communications, 8(1), 805. [PubMed:28993646] [PMC] [WorldCat] [DOI] - ↑
Ciccone, D.N., Su, H., Hevi, S., Gay, F., Lei, H., Bajko, J., ..., & Chen, T. (2009).
KDM1B is a histone H3K4 demethylase required to establish maternal genomic imprints. Nature, 461(7262), 415-8. [PubMed:19727073] [WorldCat] [DOI] - ↑ 27.0 27.1
Fukuda, T., Tokunaga, A., Sakamoto, R., & Yoshida, N. (2011).
Fbxl10/Kdm2b deficiency accelerates neural progenitor cell death and leads to exencephaly. Molecular and cellular neurosciences, 46(3), 614-24. [PubMed:21220025] [WorldCat] [DOI] - ↑
Tang, G.B., Zeng, Y.Q., Liu, P.P., Mi, T.W., Zhang, S.F., Dai, S.K., ..., & Liu, C.M. (2017).
The Histone H3K27 Demethylase UTX Regulates Synaptic Plasticity and Cognitive Behaviors in Mice. Frontiers in molecular neuroscience, 10, 267. [PubMed:28970783] [PMC] [WorldCat] [DOI] - ↑
Burgold, T., Spreafico, F., De Santa, F., Totaro, M.G., Prosperini, E., Natoli, G., & Testa, G. (2008).
The histone H3 lysine 27-specific demethylase Jmjd3 is required for neural commitment. PloS one, 3(8), e3034. [PubMed:18716661] [PMC] [WorldCat] [DOI] - ↑
Estarás, C., Akizu, N., García, A., Beltrán, S., de la Cruz, X., & Martínez-Balbás, M.A. (2012).
Genome-wide analysis reveals that Smad3 and JMJD3 HDM co-activate the neural developmental program. Development (Cambridge, England), 139(15), 2681-91. [PubMed:22782721] [WorldCat] [DOI] - ↑ 31.0 31.1
Park, D.H., Hong, S.J., Salinas, R.D., Liu, S.J., Sun, S.W., Sgualdino, J., ..., & Lim, D.A. (2014).
Activation of neuronal gene expression by the JMJD3 demethylase is required for postnatal and adult brain neurogenesis. Cell reports, 8(5), 1290-9. [PubMed:25176653] [PMC] [WorldCat] [DOI] - ↑
Engstrom, A.K., Walker, A.C., Moudgal, R.A., Myrick, D.A., Kyle, S.M., Bai, Y., ..., & Katz, D.J. (2020).
The inhibition of LSD1 via sequestration contributes to tau-mediated neurodegeneration. Proceedings of the National Academy of Sciences of the United States of America, 117(46), 29133-29143. [PubMed:33139560] [PMC] [WorldCat] [DOI] - ↑
Baba, R., Matsuda, S., Maeda, R., Murakami, K., Yamamoto, Y., Nakatani, A., & Kimura, H. (2022).
Investigating the Therapeutic Potential of LSD1 Enzyme Activity-Specific Inhibition by TAK-418 for Social and Memory Deficits in Rodent Disease Models. ACS chemical neuroscience, 13(3), 313-321. [PubMed:35061371] [WorldCat] [DOI] - ↑
Maes, T., Mascaró, C., Rotllant, D., Lufino, M.M.P., Estiarte, A., Guibourt, N., ..., & Buesa Arjol, C. (2020).
Modulation of KDM1A with vafidemstat rescues memory deficit and behavioral alterations. PloS one, 15(5), e0233468. [PubMed:32469975] [PMC] [WorldCat] [DOI] - ↑
Labonne, J.D., Lee, K.H., Iwase, S., Kong, I.K., Diamond, M.P., Layman, L.C., ..., & Kim, H.G. (2016).
An atypical 12q24.31 microdeletion implicates six genes including a histone demethylase KDM2B and a histone methyltransferase SETD1B in syndromic intellectual disability. Human genetics, 135(7), 757-71. [PubMed:27106595] [WorldCat] [DOI] - ↑
Sáez, M.A., Fernández-Rodríguez, J., Moutinho, C., Sanchez-Mut, J.V., Gomez, A., Vidal, E., ..., & Esteller, M. (2016).
Mutations in JMJD1C are involved in Rett syndrome and intellectual disability. Genetics in medicine : official journal of the American College of Medical Genetics, 18(4), 378-85. [PubMed:26181491] [PMC] [WorldCat] [DOI] - ↑
Maitra, S., Khandelwal, N., Kootar, S., Sant, P., Pathak, S.S., Reddy, S., ..., & Kumar, A. (2020).
Histone Lysine Demethylase JMJD2D/KDM4D and Family Members Mediate Effects of Chronic Social Defeat Stress on Mouse Hippocampal Neurogenesis and Mood Disorders. Brain sciences, 10(11). [PubMed:33182385] [PMC] [WorldCat] [DOI] - ↑
Jensen, L.R., Amende, M., Gurok, U., Moser, B., Gimmel, V., Tzschach, A., ..., & Lenzner, S. (2005).
Mutations in the JARID1C gene, which is involved in transcriptional regulation and chromatin remodeling, cause X-linked mental retardation. American journal of human genetics, 76(2), 227-36. [PubMed:15586325] [PMC] [WorldCat] [DOI] - ↑
Iwase, S., Brookes, E., Agarwal, S., Badeaux, A.I., Ito, H., Vallianatos, C.N., ..., & Shi, Y. (2016).
A Mouse Model of X-linked Intellectual Disability Associated with Impaired Removal of Histone Methylation. Cell reports, 14(5), 1000-1009. [PubMed:26804915] [PMC] [WorldCat] [DOI] - ↑
Wei, G., Deng, X., Agarwal, S., Iwase, S., Disteche, C., & Xu, J. (2016).
Patient Mutations of the Intellectual Disability Gene KDM5C Downregulate Netrin G2 and Suppress Neurite Growth in Neuro2a Cells. Journal of molecular neuroscience : MN, 60(1), 33-45. [PubMed:27421841] [PMC] [WorldCat] [DOI] - ↑
Laumonnier, F., Holbert, S., Ronce, N., Faravelli, F., Lenzner, S., Schwartz, C.E., ..., & Briault, S. (2005).
Mutations in PHF8 are associated with X linked mental retardation and cleft lip/cleft palate. Journal of medical genetics, 42(10), 780-6. [PubMed:16199551] [PMC] [WorldCat] [DOI] - ↑
Chen, X., Wang, S., Zhou, Y., Han, Y., Li, S., Xu, Q., ..., & Chen, C.D. (2018).
Phf8 histone demethylase deficiency causes cognitive impairments through the mTOR pathway. Nature communications, 9(1), 114. [PubMed:29317619] [PMC] [WorldCat] [DOI]


