Αアクチニン
歴史
アクチニンは1965年に江橋節郎、文子夫妻と丸山工作により骨格筋の粗精製アクチンより分離された最初のアクチン結合タンパク質である。当時のアミノ酸組成分析(今では古典的な各アミノ酸の含有量をスター図で示す比較法)ではアクチンと類似しているデータが得られたために、アクチニンと命名された [1]。
αアクチニン
江橋夫妻らのα-アクチニンactininはカルシウム制御因子(トロポニン)の生成過程で超沈殿(アクチンとミオシンがATP付加により形成する凝集体を吸光度として測定する)を促進する活性因子として分離された[2]。
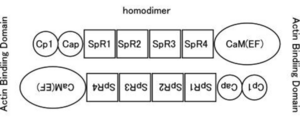
ヒトのαアクチニンにはACTN1、2、3、4の4個が見出されている。ACTN1と4のC末端カルモジュリン様ドメインのEFハンドは機能しており、Caを結合するCa制御性因子である。骨格筋型のACTN2と3のEFハンドはカルシウム結合能を失っている。細胞骨格の形成を含めて腫瘍細胞の浸潤との関連など多彩な機能が報告されている。
| 分子量 |
〜100kDa アンチパラレルに結合したホモダイマーとして存在 |
| 機能 |
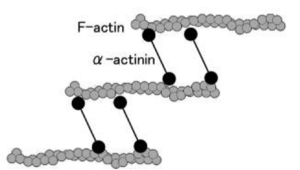
アクチン結合タンパク質 F-actin(繊維状アクチン)を架橋 |
| 分布 | Ca結合能 | 遺伝子異常 | |
| ACTN1 |
骨格筋以外の細胞(平滑筋を含む)比較的細胞膜直下に局在 いわゆる"non-muscle" α-actinin |
(+) カルシウムが結合するとアクチン結合能が低下する |
|
| ACTN2 |
骨格筋(glycolytic muscle、速筋のみ) いわゆる"muscle" α-actinin |
(ー) | |
| ACTN3 | (ー) | ||
| ACTN4 |
βアクチニン
丸山工作のβアクチニンは分子量3万程度の2個のサブユニットからなるヘテロダイマーである。当初、βアクチニンは骨格筋のZ膜側とは反対側(矢じり端<*注1>)に結合して、アクチンフィラメントの長さを一定に保つ機能が推定されていた。1981年にはProc Natl Acad Sciにβアクチニンはアルブミンであるという論文が掲載されたが、さすがにこれは誤報であった<*注2>。しかし、1987年にZ膜から反矢じり端結合タンパク質が精製され、CapZと命名された。CapZはβアクチニンに他ならなかった。βアクチニンが矢じり端に結合すると思われたのは混和タンパク質(トロポモジュリン)によるものと結論された。このためβアクチニンの名前はほぼ消滅し、現在はCapZが定着している。
CapZは骨格筋と心筋で見いだされおり、Z膜へアクチン線維を固定化している。マウスではCapZの部分欠損はProtein Kinase C系シグナル伝達が低下し、心筋肥大と生後早期死亡をもたらす[3]。
<*注1> F(線維状)アクチンには方向性があり、ミオシン頭部を結合させると矢じり構造を示す。この矢印の先端側を矢じり端(pointed end、P端、-端)、その反対側を反矢じり端(barbed end、B端、+端)という。アクチンの重合速度(線維の伸長速度)は反矢じり端のほうが早い(アクチンモノマーが結合しやすい、5~10倍)ことから、反矢じり端は+端とも表現される。骨格筋ではアクチンはZ膜に反矢じり端を埋め込むように固定され、矢じり端は自由端となっている。
<*注2> 丸山工作は反論の論文をProc Natl Acad Sci誌が掲載を認めないことに不満を唱えた。結局、反論論文はJ. Biochem[4]に掲載された。
Euアクチニンとγアクチニン
丸山工作の一派により、ウサギ骨格筋からγアクチニン[5]とニワトリ骨格筋からEuアクチニン[6]が報告されている。それぞれ1報告のみであり、クローニングもされておらず、詳細は不明である。
参考文献
- ↑
Maruyama, K. (2002).
beta-Actinin, Cap Z, connectin and titin: what's in a name? Trends in biochemical sciences, 27(5), 264-6. [PubMed:12076539] [WorldCat] [DOI] - ↑
Ebashi, S., & Ebashi, F. (1965).
Alpha-actinin, a new structural protein from striated muscle. I. Preparation and action on actomyosinàtp interaction. Journal of biochemistry, 58(1), 7-12. [PubMed:5857104] [WorldCat] [DOI] - ↑
Yang, F.H., & Pyle, W.G. (2012).
Reduced cardiac CapZ protein protects hearts against acute ischemia-reperfusion injury and enhances preconditioning. Journal of molecular and cellular cardiology, 52(3), 761-72. [PubMed:22155006] [WorldCat] [DOI] - ↑
Maruyama, K., & Kimura, S. (1981).
Muscle beta-actinin is not chicken serum albumin. Journal of biochemistry, 90(2), 563-6. [PubMed:7298603] [WorldCat] [DOI] - ↑
Kuroda, M., & Maruyama, K. (1976).
Gamma-Actinin, a new regulatory protein from rabbit skeletal muscle. I. Purification and characterization. Journal of biochemistry, 80(2), 315-22. [PubMed:1002672] [WorldCat] [DOI] - ↑
Kuroda, M., Tanaka, T., & Masaki, T. (1981).
Eu-actinin, a new structural protein of the Z-line of striated muscles. Journal of biochemistry, 89(1), 297-310. [PubMed:6783638] [WorldCat] [DOI]
(執筆者:丸山敬、太田安隆 担当編集委員:尾藤晴彦)