「アドレナリン」の版間の差分
細 (→中枢神経系) |
細編集の要約なし |
||
| (3人の利用者による、間の28版が非表示) | |||
| 1行目: | 1行目: | ||
'''「概要」''' | |||
'' | |||
アドレナリン(adrenaline)はノルエピネフリン(epinephrine, EP)とも呼ばれる。モノアミンの一種、またカテコールアミンの一種である。生体内において、神経伝達物質またはホルモンとして働く。生体内ではチロシンから合成される。受容体はアドレナリン受容体と呼ばれるファミリーであり、Gタンパク質共役7回膜貫通型である。中枢神経系では、後脳髄質にアドレナリン作動性神経細胞が存在し、そこからほぼ脳全域に投射している。<br> | |||
< | <br> '''「発見と用語」''' | ||
< | 1893年、George Oliver(イギリス)は副腎(Adrenal)に薬理学的に劇的な効果を持つ物質が含まれることを発見した<ref name="ref1">'''G Oliver, EA Schäfer''' <br> On the physiological action of extract of the suprarenal capsules <br>''J. Physiol. Lond.'':1894;16;i-iv</ref>。1897年、John Abel (アメリカ)は副腎から粗抽出物を調製、これをエピネフリンと呼んだが<ref name="ref2">''' JJ Abel''' <br> On epinephrin, the active constituent of the suprarenal capsule and its compounds <br>'' Proc. Am. Phys. Soc.'': 1898; 34; 35</ref>、これには生理活性はなかった<ref name="ref3"><pubmed> 10678871</pubmed></ref>。その後、1901年、高峰と上中は副腎から生理活性物質を精製した<ref name="ref4">''' J Takamine '''<br> The isolation of the active principle of the suprarenal gland <br>''J. Physiol. Lond.'':1901;27;30P-39P </ref>。これをParke, Davis & CoはAdrenalinという名前で販売した<ref name="ref3" />。 | ||
現在、アドレナリンとエピネフリンという呼称については、国により使用頻度が異なる。歴史的にはアドレナリンの方が正しい呼称と考えられ、欧州ではアドレナリンの方が一般的である。しかし、米国の、特に医学分野では、John Abelの影響の名残でエピネフリンの方が一般的である。日本では2006年の第十五改正日本薬局方よりアドレナリンが一般名称となった。 | |||
< | <br> | ||
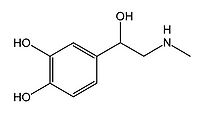
'''「構造」'''<br>カテコール基と二級アミノ基をもつ、カテコールアミン神経伝達物質の一種(図1)。また、ドーパミン、セロトニン、ヒスタミンなどとともにモノアミン系神経伝達物質のグループを形成する。 | |||
<br> | |||
[[Image:2AD fig1.jpg|200px]] | |||
<br> | |||
'''「合成」''' | |||
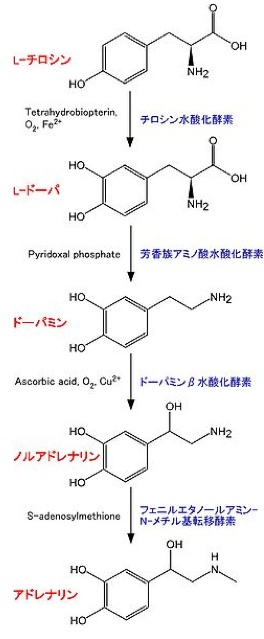
脳の一部の神経細胞、および副腎髄質中にあるクロム親和性細胞において合成される(図2)。他に、も合成されている。生合成に関わる酵素は以下の通り。 <br> | |||
== | *'''チロシン水酸化酵素 tyrosine hydroxylase (TH):'''EC 1.14.16.2。チロシンよりL-DOPA (L-3,4-dihydroxyphenylalanine)を合成する<ref name="ref5"><pubmed> 15569247 </pubmed></ref> <ref name="ref6"><pubmed> 21176768 </pubmed></ref> <ref name="ref7"><pubmed> 2575455</pubmed></ref>。反応には、Tetrahydrobiopterin, O2, Fe2+が必要。カテコールアミン合成において、律速段階の酵素であると考えられている。その活性制御は、主にタンパク質の量と、リン酸化による。全てのカテコールアミン産生細胞に存在する。 補因子であるTetrahydrobiopterinはGTPより合成される。律速酵素はGTP cyclohydrolase Iである<ref name="ref8"><pubmed> 21867484 </pubmed></ref>。 | ||
*'''芳香族アミノ酸脱炭酸酵素 aromatic L-amino acid decarboxylase (AADC):'''EC 4.1.1.28。L-DOPAよりドーパミンを合成する。他に、この酵素は5-hydroxytryptophanからセロトニン(5-hydroxytryptamine, 5-HT)を合成する反応も触媒する。Pyridoxal phosphateが必要。全てのカテコールアミン産生細胞に存在する<ref name="ref9"><pubmed> 8897471</pubmed></ref>。 | |||
*'''ドーパミンβ水酸化酵素 Dopamine β-hydroxylase:'''EC 1.14.2.1。ドーパミンよりノルアドレナリンを合成する。アスコルビン酸、O2、Cu2+が必要。ノルアドレナリン、アドレナリン産生細胞のシナプス小胞の中に存在し、シナプス小胞に取り込まれたドーパミンをノルアドレナリンに変換する<ref name="ref10"><pubmed> 6998654 </pubmed></ref>。 | |||
*'''フェニルエタノールアミン-N-メチル基転移酵素 phenylethanolamine N-methyltransferase(PNMT):'''EC 2.1.1.28。ノルアドレナリンのアミノにメチル基を付加し、アドレナリンを生合成する。メチル基のドナーとしてS-adenosylmethioneが必要。ヒトでは一つの遺伝子があり(Gene ID 5409)、転写産物は副腎髄質に多く、心臓、および脳幹にも存在する<ref name="ref11"><pubmed> 12438093 </pubmed></ref>。ノルアドレナリンからアドレナリンの生合成は、ノルアドレナリンが合成された顆粒内で起きると考えられている<ref name="ref12"><pubmed> 4615087</pubmed></ref>。 | |||
<br> | |||
[[Image:2AD fig2.jpg|300px]] | |||
<br> | |||
'''「放出、再取り込み」''' | |||
アドレナリンの前駆対であるドーパミンは小胞型モノアミントランスポーター(vesicular monoamine transporter, vMAT)によりシナプス小胞内に輸送される。vMAT1は主に副腎のクロム親和性細胞、vMAT2は神経細胞で発現している。vMATはH+との交換輸送によりモノアミンを小胞内に蓄積させる<ref name="ref13"><pubmed> 11099462 </pubmed></ref>。 アドレナリンの放出は他の神経伝達物質と同様に、神経活動依存的、カルシウム依存的なシナプス小胞のエキソサイトーシスによる。 アドレナリンの再取り込みの機構はまだよく理解されていない。アドレナリン特異的なトランスポーターは、ほ乳類では報告されていない。 | |||
<br> | |||
'''「代謝分解」''' | |||
アドレナリンの代謝分解には次の二つの酵素が重要である。 | |||
*''' | *'''モノアミン酸化酵素(monoamine oxidase, MAO):'''MAOはモノアミンのアミノ基をアルデヒド基に酸化する。MAOはミトコンドリア外膜に局在しに存在し、細胞内のノルアドレナリン(再取込みされたものを含む)の分解に関与する。ただしMAOに比べてvMAT2の方がノルアドレナリンに対する親和性がずっと高いため、シナプス小胞への取り込みの方がMAOによる分解よりも優先されると考えられる<ref name="ref14"><pubmed> 16552415</pubmed></ref>。MAOにはMAO-AとMAO-Bがあり、二つの別の遺伝子によりコードされている。MAO-AとMAO-Bはモノアミン作動性神経細胞およびグリア細胞に発現しているが、発現量は細胞の種類により異なり、また動物種によっても違いが見られる<ref name="ref14" />。マウス脳のノルアドレナリン作動性神経細胞には主にMAOAが発現している<ref name="ref15"><pubmed> 11793338 </pubmed></ref>。 | ||
*'''カテコール-o-メチル基転移酵素(catechol-o-methyltransferase, COMT):'''これはカテコール基のm-水酸基にメチル基を転移させる。腎臓や肝臓に豊富だが、カテコールアミン作動性神経細胞の投射先においても発現している。細胞外で働くと考えられている<ref name="ref16"><pubmed> 21846718 </pubmed></ref>。 | |||
脳においてアドレナリンの多くは、ノルアドレナリンと同様、MAO、アルデヒド還元酵素、およびCOMTにより3-methoxy-4-hydroxyphenylglycol(MHPG)へ代謝され、さらに3-methoxy-4-hydroxymandelic acid (VMA)となって尿中に排出される<ref name="ref17">'''D E Golan, A H Tashjian Jr, E J Armstrong, A W Armstrong'''<br> Principles of Pharmacology, Second Edition<br>''Wolters Kluwer Health (Philadelphia)'':2002</ref>。MHPGの硫酸化物も尿中に排出される<ref name="ref17" />。 | |||
<br> | |||
'''「主たる投射系と機能」''' | |||
(1) 中枢神経系 中枢神経系におけるアドレナリン作動性の神経細胞は、主に次の二つの部位にある。 | |||
C1:髄質の腹外側にありノルアドレナリン作動性神経細胞核A1に近接する。 | |||
C2:髄質の背側にありノルアドレナリン作動性神経細胞核A2に近接する。C1、C2共に視床下部に上行性投射をし、循環器系や内分泌系の調節を行う。 | |||
(2) 末梢神経系 末梢神経系の節後神経細胞は、ノルアドレナリンと共にアドレナリン作動性でもある。脊髄中の節前神経細胞よりアセチルコリン性の入力を受け、アドレナリン性の出力を内臓器官に与える。結果的に、血管の収縮、血圧の上昇、心拍数の増加、などを引き起こす。 | |||
<br> | |||
'''「受容体」''' | |||
アドレナリンはノルアドレナリンと共にアドレナリン受容体(adrenergic receptorまたはadrenoceptor)に結合し活性化する。αおよびβのサブファミリーからなる。より細かくは、α<sub>1A</sub>-α<sub>1D</sub>、α<sub>2A</sub>-α<sub>2C</sub>、β<sub>1</sub>、β<sub>2</sub>、β<sub>3</sub>、から構成されている。いずれも三量体Gタンパク質共役型の受容体である。α<sub>1</sub>はG<sub>q</sub>、α<sub>2</sub>はG<sub>i</sub>、β<sub>1</sub>-β<sub>3</sub>はG<sub>s</sub>と共役している。 末梢神経系において、アドレナリンは、低濃度ではβ<sub>1</sub>およびβ<sub>2</sub>アドレナリン受容体に作用し、高濃度ではα<sub>1</sub>を介した作用が主となる。(ノルアドレナリンはα<sub>1</sub>およびβ<sub>1</sub>アドレナリン受容体のアゴニストとして作用する。) | |||
<br> | |||
<references /> | <references /> | ||
2012年6月4日 (月) 16:20時点における版
「概要」
アドレナリン(adrenaline)はノルエピネフリン(epinephrine, EP)とも呼ばれる。モノアミンの一種、またカテコールアミンの一種である。生体内において、神経伝達物質またはホルモンとして働く。生体内ではチロシンから合成される。受容体はアドレナリン受容体と呼ばれるファミリーであり、Gタンパク質共役7回膜貫通型である。中枢神経系では、後脳髄質にアドレナリン作動性神経細胞が存在し、そこからほぼ脳全域に投射している。
「発見と用語」
1893年、George Oliver(イギリス)は副腎(Adrenal)に薬理学的に劇的な効果を持つ物質が含まれることを発見した[1]。1897年、John Abel (アメリカ)は副腎から粗抽出物を調製、これをエピネフリンと呼んだが[2]、これには生理活性はなかった[3]。その後、1901年、高峰と上中は副腎から生理活性物質を精製した[4]。これをParke, Davis & CoはAdrenalinという名前で販売した[3]。
現在、アドレナリンとエピネフリンという呼称については、国により使用頻度が異なる。歴史的にはアドレナリンの方が正しい呼称と考えられ、欧州ではアドレナリンの方が一般的である。しかし、米国の、特に医学分野では、John Abelの影響の名残でエピネフリンの方が一般的である。日本では2006年の第十五改正日本薬局方よりアドレナリンが一般名称となった。
「構造」
カテコール基と二級アミノ基をもつ、カテコールアミン神経伝達物質の一種(図1)。また、ドーパミン、セロトニン、ヒスタミンなどとともにモノアミン系神経伝達物質のグループを形成する。
「合成」
脳の一部の神経細胞、および副腎髄質中にあるクロム親和性細胞において合成される(図2)。他に、も合成されている。生合成に関わる酵素は以下の通り。
- チロシン水酸化酵素 tyrosine hydroxylase (TH):EC 1.14.16.2。チロシンよりL-DOPA (L-3,4-dihydroxyphenylalanine)を合成する[5] [6] [7]。反応には、Tetrahydrobiopterin, O2, Fe2+が必要。カテコールアミン合成において、律速段階の酵素であると考えられている。その活性制御は、主にタンパク質の量と、リン酸化による。全てのカテコールアミン産生細胞に存在する。 補因子であるTetrahydrobiopterinはGTPより合成される。律速酵素はGTP cyclohydrolase Iである[8]。
- 芳香族アミノ酸脱炭酸酵素 aromatic L-amino acid decarboxylase (AADC):EC 4.1.1.28。L-DOPAよりドーパミンを合成する。他に、この酵素は5-hydroxytryptophanからセロトニン(5-hydroxytryptamine, 5-HT)を合成する反応も触媒する。Pyridoxal phosphateが必要。全てのカテコールアミン産生細胞に存在する[9]。
- ドーパミンβ水酸化酵素 Dopamine β-hydroxylase:EC 1.14.2.1。ドーパミンよりノルアドレナリンを合成する。アスコルビン酸、O2、Cu2+が必要。ノルアドレナリン、アドレナリン産生細胞のシナプス小胞の中に存在し、シナプス小胞に取り込まれたドーパミンをノルアドレナリンに変換する[10]。
- フェニルエタノールアミン-N-メチル基転移酵素 phenylethanolamine N-methyltransferase(PNMT):EC 2.1.1.28。ノルアドレナリンのアミノにメチル基を付加し、アドレナリンを生合成する。メチル基のドナーとしてS-adenosylmethioneが必要。ヒトでは一つの遺伝子があり(Gene ID 5409)、転写産物は副腎髄質に多く、心臓、および脳幹にも存在する[11]。ノルアドレナリンからアドレナリンの生合成は、ノルアドレナリンが合成された顆粒内で起きると考えられている[12]。
「放出、再取り込み」
アドレナリンの前駆対であるドーパミンは小胞型モノアミントランスポーター(vesicular monoamine transporter, vMAT)によりシナプス小胞内に輸送される。vMAT1は主に副腎のクロム親和性細胞、vMAT2は神経細胞で発現している。vMATはH+との交換輸送によりモノアミンを小胞内に蓄積させる[13]。 アドレナリンの放出は他の神経伝達物質と同様に、神経活動依存的、カルシウム依存的なシナプス小胞のエキソサイトーシスによる。 アドレナリンの再取り込みの機構はまだよく理解されていない。アドレナリン特異的なトランスポーターは、ほ乳類では報告されていない。
「代謝分解」
アドレナリンの代謝分解には次の二つの酵素が重要である。
- モノアミン酸化酵素(monoamine oxidase, MAO):MAOはモノアミンのアミノ基をアルデヒド基に酸化する。MAOはミトコンドリア外膜に局在しに存在し、細胞内のノルアドレナリン(再取込みされたものを含む)の分解に関与する。ただしMAOに比べてvMAT2の方がノルアドレナリンに対する親和性がずっと高いため、シナプス小胞への取り込みの方がMAOによる分解よりも優先されると考えられる[14]。MAOにはMAO-AとMAO-Bがあり、二つの別の遺伝子によりコードされている。MAO-AとMAO-Bはモノアミン作動性神経細胞およびグリア細胞に発現しているが、発現量は細胞の種類により異なり、また動物種によっても違いが見られる[14]。マウス脳のノルアドレナリン作動性神経細胞には主にMAOAが発現している[15]。
- カテコール-o-メチル基転移酵素(catechol-o-methyltransferase, COMT):これはカテコール基のm-水酸基にメチル基を転移させる。腎臓や肝臓に豊富だが、カテコールアミン作動性神経細胞の投射先においても発現している。細胞外で働くと考えられている[16]。
脳においてアドレナリンの多くは、ノルアドレナリンと同様、MAO、アルデヒド還元酵素、およびCOMTにより3-methoxy-4-hydroxyphenylglycol(MHPG)へ代謝され、さらに3-methoxy-4-hydroxymandelic acid (VMA)となって尿中に排出される[17]。MHPGの硫酸化物も尿中に排出される[17]。
「主たる投射系と機能」
(1) 中枢神経系 中枢神経系におけるアドレナリン作動性の神経細胞は、主に次の二つの部位にある。
C1:髄質の腹外側にありノルアドレナリン作動性神経細胞核A1に近接する。
C2:髄質の背側にありノルアドレナリン作動性神経細胞核A2に近接する。C1、C2共に視床下部に上行性投射をし、循環器系や内分泌系の調節を行う。
(2) 末梢神経系 末梢神経系の節後神経細胞は、ノルアドレナリンと共にアドレナリン作動性でもある。脊髄中の節前神経細胞よりアセチルコリン性の入力を受け、アドレナリン性の出力を内臓器官に与える。結果的に、血管の収縮、血圧の上昇、心拍数の増加、などを引き起こす。
「受容体」
アドレナリンはノルアドレナリンと共にアドレナリン受容体(adrenergic receptorまたはadrenoceptor)に結合し活性化する。αおよびβのサブファミリーからなる。より細かくは、α1A-α1D、α2A-α2C、β1、β2、β3、から構成されている。いずれも三量体Gタンパク質共役型の受容体である。α1はGq、α2はGi、β1-β3はGsと共役している。 末梢神経系において、アドレナリンは、低濃度ではβ1およびβ2アドレナリン受容体に作用し、高濃度ではα1を介した作用が主となる。(ノルアドレナリンはα1およびβ1アドレナリン受容体のアゴニストとして作用する。)
- ↑ G Oliver, EA Schäfer
On the physiological action of extract of the suprarenal capsules
J. Physiol. Lond.:1894;16;i-iv - ↑ JJ Abel
On epinephrin, the active constituent of the suprarenal capsule and its compounds
Proc. Am. Phys. Soc.: 1898; 34; 35 - ↑ 3.0 3.1
Aronson, J.K. (2000).
"Where name and image meet"--the argument for "adrenaline". BMJ (Clinical research ed.), 320(7233), 506-9. [PubMed:10678871] [PMC] [WorldCat] [DOI] - ↑ J Takamine
The isolation of the active principle of the suprarenal gland
J. Physiol. Lond.:1901;27;30P-39P - ↑
Dunkley, P.R., Bobrovskaya, L., Graham, M.E., von Nagy-Felsobuki, E.I., & Dickson, P.W. (2004).
Tyrosine hydroxylase phosphorylation: regulation and consequences. Journal of neurochemistry, 91(5), 1025-43. [PubMed:15569247] [WorldCat] [DOI] - ↑
Daubner, S.C., Le, T., & Wang, S. (2011).
Tyrosine hydroxylase and regulation of dopamine synthesis. Archives of biochemistry and biophysics, 508(1), 1-12. [PubMed:21176768] [PMC] [WorldCat] [DOI] - ↑
Nagatsu, T. (1989).
The human tyrosine hydroxylase gene. Cellular and molecular neurobiology, 9(3), 313-21. [PubMed:2575455] [WorldCat] [DOI] - ↑
Werner, E.R., Blau, N., & Thöny, B. (2011).
Tetrahydrobiopterin: biochemistry and pathophysiology. The Biochemical journal, 438(3), 397-414. [PubMed:21867484] [WorldCat] [DOI] - ↑
Berry, M.D., Juorio, A.V., Li, X.M., & Boulton, A.A. (1996).
Aromatic L-amino acid decarboxylase: a neglected and misunderstood enzyme. Neurochemical research, 21(9), 1075-87. [PubMed:8897471] [WorldCat] [DOI] - ↑
Rush, R.A., & Geffen, L.B. (1980).
Dopamine beta-hydroxylase in health and disease. Critical reviews in clinical laboratory sciences, 12(3), 241-77. [PubMed:6998654] [WorldCat] [DOI] - ↑
Ziegler, M.G., Bao, X., Kennedy, B.P., Joyner, A., & Enns, R. (2002).
Location, development, control, and function of extraadrenal phenylethanolamine N-methyltransferase. Annals of the New York Academy of Sciences, 971, 76-82. [PubMed:12438093] [WorldCat] [DOI] - ↑
Nagatsu, I., & Kondo, Y. (1974).
Immunoelectronmicroscopic localization of phenylethanolamine-n-methyltransferase in the bovine adrenal medulla. Histochemistry, 42(4), 351-8. [PubMed:4615087] [WorldCat] [DOI] - ↑
Erickson, J.D., & Varoqui, H. (2000).
Molecular analysis of vesicular amine transporter function and targeting to secretory organelles. FASEB journal : official publication of the Federation of American Societies for Experimental Biology, 14(15), 2450-8. [PubMed:11099462] [WorldCat] [DOI] - ↑ 14.0 14.1
Youdim, M.B., Edmondson, D., & Tipton, K.F. (2006).
The therapeutic potential of monoamine oxidase inhibitors. Nature reviews. Neuroscience, 7(4), 295-309. [PubMed:16552415] [WorldCat] [DOI] - ↑
Vitalis, T., Fouquet, C., Alvarez, C., Seif, I., Price, D., Gaspar, P., & Cases, O. (2002).
Developmental expression of monoamine oxidases A and B in the central and peripheral nervous systems of the mouse. The Journal of comparative neurology, 442(4), 331-47. [PubMed:11793338] [WorldCat] [DOI] - ↑
Chen, J., Song, J., Yuan, P., Tian, Q., Ji, Y., Ren-Patterson, R., ..., & Weinberger, D.R. (2011).
Orientation and cellular distribution of membrane-bound catechol-O-methyltransferase in cortical neurons: implications for drug development. The Journal of biological chemistry, 286(40), 34752-60. [PubMed:21846718] [PMC] [WorldCat] [DOI] - ↑ 17.0 17.1 D E Golan, A H Tashjian Jr, E J Armstrong, A W Armstrong
Principles of Pharmacology, Second Edition
Wolters Kluwer Health (Philadelphia):2002