「イオンチャネル」の版間の差分
細編集の要約なし |
細 (→P2X受容体) |
||
| (2人の利用者による、間の22版が非表示) | |||
| 1行目: | 1行目: | ||
<div align="right"> | |||
<font size="+1">[http://researchmap.jp/read0132108 中條 浩一]、[http://researchmap.jp/yoshihirokubo 久保 義弘]</font><br> | |||
''自然科学研究機構 生理学研究所''<br> | |||
DOI:<selfdoi /> 原稿受付日:2012年6月5日 原稿完成日:2013年8月12日<br> | |||
担当編集委員:[http://researchmap.jp/2rikenbsi 林 康紀](独立行政法人理化学研究所 脳科学総合研究センター)<br> | |||
</div> | |||
英:ion channel 独: Ionenkanal 仏: canal ionique | 英:ion channel 独: Ionenkanal 仏: canal ionique | ||
イオンチャネルとは、[[形質膜]]あるいは[[内膜]]系に存在する、[[wikipedia:ja:|イオン]]を透過させる役割を持つ[[膜タンパク質]]である。[[生体膜]]を構成する脂質二重膜はイオンをほとんど透過しないため、イオンを膜の内外に透過させるために生体機能に必須のタンパク質であり、[[wikipedia:ja:|バクテリア]]から高等動物まで、あらゆる細胞に発現している。イオン透過路に存在する[[イオン選択性フィルター]]により、通ることのできるイオンの種類、あるいは大きさが決まっている。したがって[[カリウムチャネル]]など、透過するイオンの種類によって分類することが可能である。また[[ゲート]]によっても分類が可能で、膜電位に依存して開閉する[[電位依存性チャネル]]や、リガンドが結合することによって開く[[リガンド依存性イオンチャネル]]([[イオンチャネル型受容体]])、[[機械刺激受容チャネル]]などが存在する。神経回路の活動、[[筋収縮]]、[[感覚]]など、イオンが関わるあらゆる生理機能に深く関与している。 | {{box|text= | ||
イオンチャネルとは、[[形質膜]]あるいは[[内膜]]系に存在する、[[wikipedia:ja:イオン|イオン]]を透過させる役割を持つ[[膜タンパク質]]である。[[生体膜]]を構成する脂質二重膜はイオンをほとんど透過しないため、イオンを膜の内外に透過させるために生体機能に必須のタンパク質であり、[[wikipedia:ja:バクテリア|バクテリア]]から高等動物まで、あらゆる細胞に発現している。イオン透過路に存在する[[イオン選択性フィルター]]により、通ることのできるイオンの種類、あるいは大きさが決まっている。したがって[[カリウムチャネル]]など、透過するイオンの種類によって分類することが可能である。また[[ゲート]]によっても分類が可能で、膜電位に依存して開閉する[[電位依存性チャネル]]や、リガンドが結合することによって開く[[リガンド依存性イオンチャネル]]([[イオンチャネル型受容体]])、[[機械刺激受容チャネル]]などが存在する。神経回路の活動、[[筋収縮]]、[[感覚]]など、イオンが関わるあらゆる生理機能に深く関与している。 | |||
}} | |||
==イオンチャネルとは== | ==イオンチャネルとは== | ||
| 9行目: | 18行目: | ||
==イオンチャネル研究の歴史== | ==イオンチャネル研究の歴史== | ||
1950年代に発表された[[wikipedia: | 1950年代に発表された[[wikipedia:Alan Lloyd Hodgkin|Hodgkin]]と[[wikipedia:Andrew Huxley|Huxley]](1963年[[wikipedia:ja:ノーベル医学生理学賞|ノーベル医学生理学賞]])による一連の[[wikipedia:ja:イカ|イカ]]の[[巨大軸索]]を使った実験により、活動電位が起こる際に細胞膜のナトリウムイオン透過性が高まり、活動電位が静まる際にはカリウムイオン透過性が高まることが明らかにされた。これによりゲート、イオン選択性を有するイオンチャネルの存在が示唆された。1970年代になり、[[wikipedia:ja:エルヴィン・ネーアー|Neher]]と[[wikipedia:ja:ベルト・ザクマン|Sakmann]](1991年ノーベル医学生理学賞)によって開発された[[パッチクランプ]]法により、単一イオンチャネルの電流が初めて計測され、ガラス電極内に単離できる実体としてのイオンチャネルの存在が証明された。 | ||
1980年代に入り遺伝子クローニングの時代に入ると、[[wikipedia:ja:沼正作|沼]]、野田らによる[[ニコチン性アセチルコリン受容体]]や[[電位依存性ナトリウムチャネル]]の[[wikipedia:ja:cDNA|cDNA]]クローニング、[[wikipedia:zh:葉公杼|Jan]]らによる[[電位依存性カリウムチャネル]]のcDNAクローニングを皮切りにつぎつぎとイオンチャネルのcDNAがクローニングされていった。1988年、豊島とUnwinが[[wikipedia:ja:電子線結晶構造解析|電子線結晶構造解析]]で[[wikipedia:ja:シビレエイ|シビレエイ]]のニコチン性アセチルコリン受容体の構造を明らかにしたのが、イオンチャネルの立体構造研究のはしりである<ref><pubmed>2461515</pubmed></ref>。1998年には[[wikipedia:Roderick MacKinnon|MacKinnon]](2003年[[wikipedia:ja:ノーベル化学賞|ノーベル化学賞]])らにより、はじめてのイオンチャネルの[[wikipedia:ja:X線結晶構造解析|X線結晶構造解析]]として、[[wikipedia:ja:原核生物|原核生物]]由来のカリウムチャネルである[[KcsAチャネル]]の構造が明らかにされた<ref><pubmed>9525859</pubmed></ref>。現在までに明らかにされたイオンチャネルの結晶構造の多くは比較的分子量の小さいカリウムチャネルが中心であるが、ゲーティングやイオン透過機構など各種イオンチャネルに普遍的な機構が次々に明らかになりつつある。 | |||
==イオンチャネルの構造とファミリー== | ==イオンチャネルの構造とファミリー== | ||
| 21行目: | 30行目: | ||
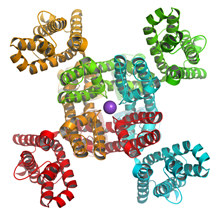
[[Image:Kchannel.jpg|300px|thumb|right|'''図2. 電位依存性カリウムチャネルαサブユニットの構造'''<br>これが4つ集まって図1のような立体構造をとる。]] | [[Image:Kchannel.jpg|300px|thumb|right|'''図2. 電位依存性カリウムチャネルαサブユニットの構造'''<br>これが4つ集まって図1のような立体構造をとる。]] | ||
電位依存性カリウムチャネルは6回膜貫通型の膜タンパク質である(図2)。四つのαサブユニットが集まって一つのイオンチャネルが構成される。六つの膜貫通セグメント(S1~S6)のうち最初の四つ(S1~S4)は[[膜電位センサー]]ドメインと呼ばれ、細胞膜内外の電位差を感じるセンサーとして機能する。特にS4セグメントには正電荷を持つアミノ酸(主に[[wikipedia:ja:|アルギニン]])が3アミノ酸おきに配置されており、この正電荷のクラスターが膜電位センサーとしての中心的な役割を果たしている。残りの二つのセグメント(S5~S6)はポアドメインと呼ばれ、四つのサブユニットが集まってイオン透過路を構成する。S5-S6の間のループは特にPループと呼ばれ、イオン選択性フィルターとしてカリウムイオンを選択的に透過させる機能を持っている。またS6セグメントは開閉のゲートとして働いていると考えられている。膜電位が脱分極すると、それを感知したS4セグメントが細胞外側に向かってスライドするような構造変化を起こす。その変化がS4-S5リンカーを通じてポアドメインに伝わり、S6セグメントのゲートが開くと考えられている。 | ''詳細は「[[カリウムチャネル]]」を参照'' | ||
電位依存性カリウムチャネルは6回膜貫通型の膜タンパク質である(図2)。四つのαサブユニットが集まって一つのイオンチャネルが構成される。六つの膜貫通セグメント(S1~S6)のうち最初の四つ(S1~S4)は[[膜電位センサー]]ドメインと呼ばれ、細胞膜内外の電位差を感じるセンサーとして機能する。特にS4セグメントには正電荷を持つアミノ酸(主に[[wikipedia:ja:アルギニン|アルギニン]])が3アミノ酸おきに配置されており、この正電荷のクラスターが膜電位センサーとしての中心的な役割を果たしている。残りの二つのセグメント(S5~S6)はポアドメインと呼ばれ、四つのサブユニットが集まってイオン透過路を構成する。S5-S6の間のループは特にPループと呼ばれ、イオン選択性フィルターとしてカリウムイオンを選択的に透過させる機能を持っている。またS6セグメントは開閉のゲートとして働いていると考えられている。膜電位が脱分極すると、それを感知したS4セグメントが細胞外側に向かってスライドするような構造変化を起こす。その変化がS4-S5リンカーを通じてポアドメインに伝わり、S6セグメントのゲートが開くと考えられている。 | |||
分子としては40種類程度の遺伝子が存在し、イオンチャネルの中でも最も大きなファミリーの一つである。Hodgkin-Huxleyの時代からもっともよく研究されているイオンチャネルファミリーの一つであり、結晶構造もすでに明らかにされている。機能を調節するための修飾サブユニット(βサブユニット)がいくつか知られている。 | 分子としては40種類程度の遺伝子が存在し、イオンチャネルの中でも最も大きなファミリーの一つである。Hodgkin-Huxleyの時代からもっともよく研究されているイオンチャネルファミリーの一つであり、結晶構造もすでに明らかにされている。機能を調節するための修飾サブユニット(βサブユニット)がいくつか知られている。 | ||
| 28行目: | 39行目: | ||
[[Image:Topology.jpg|300px|thumb|right|'''図3. さまざまなトポロジーのイオンチャネル''']] | [[Image:Topology.jpg|300px|thumb|right|'''図3. さまざまなトポロジーのイオンチャネル''']] | ||
''詳細は「[[ナトリウムチャネル]]」を参照'' | |||
電位依存性ナトリウムチャネルは上述の電依存性カリウムチャネルと似た構造を持っているが、カリウムチャネルの3つ(4つではないでしょうか?)のサブユニットが直列につながったような、24回膜貫通型のタンパク質である(図3)。それぞれドメインI~IVと呼ばれ、それぞれに膜電位センサードメインとポアドメインが含まれる。ヒトにはαサブユニットとしてNaV1.1~1.9まで9種類の遺伝子が存在し、さらに修飾サブユニットとしてβサブユニットが存在する。活動電位を起こす機能が有名で、Hodgkin-Huxleyの時代からよく研究されているチャネルファミリーの一つである。膜電位が[[脱分極]]すると、電位依存性カリウムチャネルと同様にS4セグメントが細胞外側に動くと考えられる。続いてゲートが開いてナトリウムイオンを流入させ、細胞を脱分極させる。特徴的なのは、その後すぐに不活性化という状態に入ってしまい、その後一定時間活性化しなくなることである。この不活性化は活動電位を[[軸索]]に沿って一方向に進めるために重要な性質である。[[フグ毒]]として有名なテトロドトキシン(TTX)は電位依存性ナトリウムチャネルの阻害剤である。 | |||
====電位依存性カルシウムチャネル==== | ====電位依存性カルシウムチャネル==== | ||
''詳細は「[[カルシウムチャネル]]」を参照'' | |||
電依依存性ナトリウムチャネルと同様、24回膜貫通型のタンパク質であり、さらにCa<sub>V</sub>1~3まで3種類のサブファミリーに分類される(ヒトの遺伝子としては10種類)。βサブユニット、α2δサブユニット、γサブユニットなど、複数種類の修飾サブユニットが存在する。脱分極により開き、[[カルシウム]]イオンを選択的に透過する。カルシウムイオンの生理的重要性ゆえに、神経伝達物質の放出、心筋や骨格筋の収縮、ホルモン分泌などさまざまな生理現象にとって非常に重要なイオンチャネルである。 | 電依依存性ナトリウムチャネルと同様、24回膜貫通型のタンパク質であり、さらにCa<sub>V</sub>1~3まで3種類のサブファミリーに分類される(ヒトの遺伝子としては10種類)。βサブユニット、α2δサブユニット、γサブユニットなど、複数種類の修飾サブユニットが存在する。脱分極により開き、[[カルシウム]]イオンを選択的に透過する。カルシウムイオンの生理的重要性ゆえに、神経伝達物質の放出、心筋や骨格筋の収縮、ホルモン分泌などさまざまな生理現象にとって非常に重要なイオンチャネルである。 | ||
====カルシウム活性化型カリウムチャネル==== | ====カルシウム活性化型カリウムチャネル==== | ||
''詳細は「[[カリウムチャネル]]」を参照'' | |||
細胞内のカルシウムイオン濃度に依存して活性化するカリウムチャネルである。カルシウム活性化型カリウムチャネルはシングルチャネルコンダクタンスの大きさに従って[[BK]], [[IK]], [[SK]]と分類される。基本的には電位依存性カリウムチャネルと同様の構造であるが、BKチャネルにはS1の前にS0と呼ばれる膜貫通セグメントが存在し、タンパク質のN末端が細胞外に出ている。BKチャネルのみ膜電位によっても活性化される。したがってBKチャネルは膜電位と細胞内カルシウムイオン濃度の二つのパラメータに依存して活性化するイオンチャネルということになる。BKチャネルはさらにβサブユニットによって機能の調節を受ける。 | 細胞内のカルシウムイオン濃度に依存して活性化するカリウムチャネルである。カルシウム活性化型カリウムチャネルはシングルチャネルコンダクタンスの大きさに従って[[BK]], [[IK]], [[SK]]と分類される。基本的には電位依存性カリウムチャネルと同様の構造であるが、BKチャネルにはS1の前にS0と呼ばれる膜貫通セグメントが存在し、タンパク質のN末端が細胞外に出ている。BKチャネルのみ膜電位によっても活性化される。したがってBKチャネルは膜電位と細胞内カルシウムイオン濃度の二つのパラメータに依存して活性化するイオンチャネルということになる。BKチャネルはさらにβサブユニットによって機能の調節を受ける。 | ||
==== | ====HCNチャネルとCNGチャネル==== | ||
Hyperpolarization-activated cyclic nucleotide-gated (HCN)チャネルは、細胞膜が過分極することで開く非選択的陽イオンチャネルである。電位依存性カリウムチャネルと同様に6回膜貫通型のαサブユニットが4つ集まって一つのイオンチャネルを構成する。他の電位依存性チャネルと同様脱分極によってS4セグメントが細胞外に向けて動くが、ゲートとのカップリングが他の電位依存性チャネルとは逆になっており、過分極で電位センサーが下がった位置に来るとゲートが開く仕組みになっている<ref><pubmed>12397358</pubmed></ref>。同じファミリーに属するcyclic nucleotide-gated (CNG)チャネルは、S4セグメントを持つにも関わらず電位依存性をほとんど失っているが、細胞内の[[環状ヌクレオチド]]([[cAMP]]、[[cGMP]])で活性化される。同様にHCNチャネルも環状ヌクレオチドで活性化される。 | |||
====TRPチャネル==== | ====TRPチャネル==== | ||
Transient receptor potential (TRP)チャネルは6回膜貫通型の四量体チャネルである。ナトリウム、カリウム、カルシウムを透過する非選択的陽イオンチャネルである。膜電位センサー様の構造を持つが、膜電位感受性は弱いか、または失われている。28種類ものTRP遺伝子が存在し、それぞれ細胞内外の様々なシグナル、リガンドで活性化される。いくつかは強い温度感受性を有し、[[wikipedia:ja:トウガラシ|トウガラシ]]の成分[[カプサイシン]]でも活性化される高温感受性の[[TRPV1]]や、[[wikipedia:ja:メントール|メントール]]や低温で活性化される[[TRPM8]]が有名である。 | |||
====電位依存性プロトンチャネル==== | ====電位依存性プロトンチャネル==== | ||
2006年に発見された電位依存性プロトンチャネルは、電位依存性カリウムチャネルの膜電位センサードメイン(S1~S4)のみでポアドメイン(S5~S6)を欠いたような構造の4回膜貫通型タンパク質である(図3)<ref><pubmed>16556803</pubmed></ref><ref><pubmed>16554753</pubmed></ref>。単体でプロトンを透過することができるが、二量体で機能していると考えられている。 | 2006年に発見された電位依存性プロトンチャネルは、電位依存性カリウムチャネルの膜電位センサードメイン(S1~S4)のみでポアドメイン(S5~S6)を欠いたような構造の4回膜貫通型タンパク質である(図3)<ref><pubmed>16556803</pubmed></ref><ref><pubmed>16554753</pubmed></ref>。単体でプロトンを透過することができるが、二量体で機能していると考えられている。 | ||
===内向き整流性カリウムチャネル | ===内向き整流性カリウムチャネル=== | ||
内向き[[整流性]]カリウムチャネルは2回膜貫通型のポアドメインのみからなるイオンチャネルで、4つのαサブユニットで構成される四量体イオンチャネルである(図3) | 内向き[[整流性]]カリウムチャネルは2回膜貫通型のポアドメインのみからなるイオンチャネルで、4つのαサブユニットで構成される四量体イオンチャネルである(図3)。イオンチャネルとして初めて構造が明らかになったKcsAチャネルも2回膜貫通型のカリウムチャネルである。ファミリーには古典的な内向き[[Wikipedia:ja:整流|整流]]性チャネルであるKir1, 2, 4, 5, 7と、[[GTP結合タンパク質]]で活性化されるGIRK (Kir3)、[[Wikipedia:ja:ATP|ATP]]感受性カリウムチャネルを構成するKir6に大別される。[[静止膜電位]]の維持など、神経細胞や[[Wikipedia:ja:心筋|心筋]]などで重要な役割を果たしている。Kir6は[[wikipedia:ja:膵臓|膵臓]][[wikipedia:ja:ランゲルハンス島|β細胞]]で[[wikipedia:ja:スルフォニルウレア|スルフォニル尿素]]と複合体を構成し、細胞内[[wikipedia:ja:ATP|ATP]]センサーとして[[wikipedia:ja:インシュリン|インシュリン]]の放出に重要である。Kir2をはじめとする内向き整流性カリウムチャネルは、膜電位センサーに相当するドメインを有していないが、細胞内の[[wikipedia:ja:マグネシウム|Mg<sup>2+</sup>]]や[[wikipedia:ja:スペルミン|スペルミン]]などの[[wikipedia:ja:ポリアミン|ポリアミン]]によって、細胞の内側から膜電位依存的にブロックされる。この機構により過分極時にはカリウムイオンを細胞外から細胞内に向けて流すが、脱分極時にはこれらのブロックにより細胞外へのカリウムイオンの流出を抑える。結果的に細胞の内側にカリウムイオンが流れやすい“内向き整流性”の性質を持つことになる。GIRK1(Kir3.1)とKir2.2の結晶構造がこれまでに明らかになっている<ref><pubmed>12507423</pubmed></ref><ref><pubmed>20019282</pubmed></ref><ref><pubmed>21874019</pubmed></ref>。 | ||
===Two poreチャネル | ===Two poreチャネル=== | ||
Two-poreチャネルは2回膜貫通型のイオンチャネルが2つ直列につながったような、4回膜貫通型のイオンチャネルである(図3)。2つのPループを持つことからTwo-poreチャネルと呼ばれるが、二量体で構成されるこのイオンチャネルは一つのイオン透過路を持つ。リークチャネルとも呼ばれ、静止膜電位の形成などに寄与していると考えられる。最近結晶構造も明らかになった<ref><pubmed>22282804</pubmed></ref><ref><pubmed>22282805</pubmed></ref>。 | Two-poreチャネルは2回膜貫通型のイオンチャネルが2つ直列につながったような、4回膜貫通型のイオンチャネルである(図3)。2つのPループを持つことからTwo-poreチャネルと呼ばれるが、二量体で構成されるこのイオンチャネルは一つのイオン透過路を持つ。リークチャネルとも呼ばれ、静止膜電位の形成などに寄与していると考えられる。最近結晶構造も明らかになった<ref><pubmed>22282804</pubmed></ref><ref><pubmed>22282805</pubmed></ref>。 | ||
| 55行目: | 77行目: | ||
===塩素チャネル=== | ===塩素チャネル=== | ||
[[ClCチャネル]]はクロライドイオンを通すイオンチャネルで、二量体のイオンチャネルだが、それぞれのサブユニットにイオン透過路があるので、1つのイオンチャネルに2つのポアが存在することになる。[[CFTRチャネル]]は[[cAMP]]を[[wikipedia:ja:加水分解|加水分解]]することで作動する[[塩素チャネル]]で、[[wikipedia:ja:嚢胞性線維症|嚢胞性線維症]]の原因遺伝子として有名である。構造上は[[ABCトランスポーター]]に属する。 | |||
===リガンド依存性チャネル=== | ===リガンド依存性チャネル=== | ||
| 66行目: | 88行目: | ||
====P2X受容体==== | ====P2X受容体==== | ||
P2X受容体は細胞外のATPをリガンドとして活性化されるリガンド依存性チャネルである。2回膜貫通型で、3量体で構成される。ナトリウムイオン等を透過させる非選択性陽イオンチャネルであるが、ATPで長時間活性化させるとNMDGなどの大きな陽イオンも透過させることができるようにポアサイズが大きくなるという、特異なポアの性質を持つ。 | P2X受容体は細胞外のATPをリガンドとして活性化されるリガンド依存性チャネルである。2回膜貫通型で、3量体で構成される。ナトリウムイオン等を透過させる非選択性陽イオンチャネルであるが、ATPで長時間活性化させるとNMDGなどの大きな陽イオンも透過させることができるようにポアサイズが大きくなるという、特異なポアの性質を持つ。 | ||
'' 詳細は[[P2X受容体]]のページ参照。'' | |||
===細胞内膜系イオンチャネル=== | ===細胞内膜系イオンチャネル=== | ||
| 71行目: | 95行目: | ||
[[リアノジン受容体]]はカルシウムストアとして機能する[[小胞体]]上のカルシウムチャネルである。細胞質中のカルシウムイオン濃度が上がると開き、小胞体中のカルシウムイオンを放出し、細胞内カルシウムシグナルを増幅する。筋細胞の収縮において重要な役割を果たしている。 | [[リアノジン受容体]]はカルシウムストアとして機能する[[小胞体]]上のカルシウムチャネルである。細胞質中のカルシウムイオン濃度が上がると開き、小胞体中のカルシウムイオンを放出し、細胞内カルシウムシグナルを増幅する。筋細胞の収縮において重要な役割を果たしている。 | ||
==== | ====IP<sub>3</sub>受容体==== | ||
リアノジン受容体と同様小胞体上に発現するカルシウムイオン放出チャネルである。細胞内のシグナル伝達物質の一種である[[ | リアノジン受容体と同様小胞体上に発現するカルシウムイオン放出チャネルである。細胞内のシグナル伝達物質の一種である[[イノシトール3リン酸]](IP<sub>3</sub>)によって活性化される。受精時のカルシウム動態をはじめ、生理・発生現象の様々な場面において重要な働きを担う。 | ||
====TRICチャネル==== | ====TRICチャネル==== | ||
| 99行目: | 123行目: | ||
<references /> | <references /> | ||
2015年11月28日 (土) 13:01時点における最新版
中條 浩一、久保 義弘
自然科学研究機構 生理学研究所
DOI:10.14931/bsd.1877 原稿受付日:2012年6月5日 原稿完成日:2013年8月12日
担当編集委員:林 康紀(独立行政法人理化学研究所 脳科学総合研究センター)
英:ion channel 独: Ionenkanal 仏: canal ionique
イオンチャネルとは、形質膜あるいは内膜系に存在する、イオンを透過させる役割を持つ膜タンパク質である。生体膜を構成する脂質二重膜はイオンをほとんど透過しないため、イオンを膜の内外に透過させるために生体機能に必須のタンパク質であり、バクテリアから高等動物まで、あらゆる細胞に発現している。イオン透過路に存在するイオン選択性フィルターにより、通ることのできるイオンの種類、あるいは大きさが決まっている。したがってカリウムチャネルなど、透過するイオンの種類によって分類することが可能である。またゲートによっても分類が可能で、膜電位に依存して開閉する電位依存性チャネルや、リガンドが結合することによって開くリガンド依存性イオンチャネル(イオンチャネル型受容体)、機械刺激受容チャネルなどが存在する。神経回路の活動、筋収縮、感覚など、イオンが関わるあらゆる生理機能に深く関与している。
イオンチャネルとは
イオンチャネルは、形質膜や細胞内膜系に存在する膜タンパク質である。イオンは脂質二重膜をほとんど透過しないため、細胞内外にイオンを輸送するためにイオンチャネルが必要になる。イオン透過路を有し、濃度と電位の勾配に従ってイオンを流出入させる機能を持つ。イオン透過路は通常ゲートを有し、膜電位やリガンドなどの刺激により開閉する。透過させるイオンの種類や、ゲートの種類、トポロジー(何回膜を貫通しているか)などによって分類される。神経細胞における活動電位の発生、筋収縮、神経伝達物質の放出、ホルモン等の分泌、感覚など、イオンが関わるありとあらゆる生理現象を担う重要な膜タンパク質である。
イオンチャネル研究の歴史
1950年代に発表されたHodgkinとHuxley(1963年ノーベル医学生理学賞)による一連のイカの巨大軸索を使った実験により、活動電位が起こる際に細胞膜のナトリウムイオン透過性が高まり、活動電位が静まる際にはカリウムイオン透過性が高まることが明らかにされた。これによりゲート、イオン選択性を有するイオンチャネルの存在が示唆された。1970年代になり、NeherとSakmann(1991年ノーベル医学生理学賞)によって開発されたパッチクランプ法により、単一イオンチャネルの電流が初めて計測され、ガラス電極内に単離できる実体としてのイオンチャネルの存在が証明された。
1980年代に入り遺伝子クローニングの時代に入ると、沼、野田らによるニコチン性アセチルコリン受容体や電位依存性ナトリウムチャネルのcDNAクローニング、Janらによる電位依存性カリウムチャネルのcDNAクローニングを皮切りにつぎつぎとイオンチャネルのcDNAがクローニングされていった。1988年、豊島とUnwinが電子線結晶構造解析でシビレエイのニコチン性アセチルコリン受容体の構造を明らかにしたのが、イオンチャネルの立体構造研究のはしりである[1]。1998年にはMacKinnon(2003年ノーベル化学賞)らにより、はじめてのイオンチャネルのX線結晶構造解析として、原核生物由来のカリウムチャネルであるKcsAチャネルの構造が明らかにされた[2]。現在までに明らかにされたイオンチャネルの結晶構造の多くは比較的分子量の小さいカリウムチャネルが中心であるが、ゲーティングやイオン透過機構など各種イオンチャネルに普遍的な機構が次々に明らかになりつつある。
イオンチャネルの構造とファミリー
イオンチャネルは、通すイオンの種類やリガンドの種類などによって命名・分類されている。また分子構造(トポロジー)などからも分類される。
電位依存性チャネルファミリー
電位依存性カリウムチャネル
詳細は「カリウムチャネル」を参照
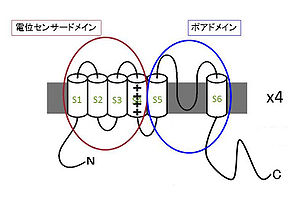
電位依存性カリウムチャネルは6回膜貫通型の膜タンパク質である(図2)。四つのαサブユニットが集まって一つのイオンチャネルが構成される。六つの膜貫通セグメント(S1~S6)のうち最初の四つ(S1~S4)は膜電位センサードメインと呼ばれ、細胞膜内外の電位差を感じるセンサーとして機能する。特にS4セグメントには正電荷を持つアミノ酸(主にアルギニン)が3アミノ酸おきに配置されており、この正電荷のクラスターが膜電位センサーとしての中心的な役割を果たしている。残りの二つのセグメント(S5~S6)はポアドメインと呼ばれ、四つのサブユニットが集まってイオン透過路を構成する。S5-S6の間のループは特にPループと呼ばれ、イオン選択性フィルターとしてカリウムイオンを選択的に透過させる機能を持っている。またS6セグメントは開閉のゲートとして働いていると考えられている。膜電位が脱分極すると、それを感知したS4セグメントが細胞外側に向かってスライドするような構造変化を起こす。その変化がS4-S5リンカーを通じてポアドメインに伝わり、S6セグメントのゲートが開くと考えられている。
分子としては40種類程度の遺伝子が存在し、イオンチャネルの中でも最も大きなファミリーの一つである。Hodgkin-Huxleyの時代からもっともよく研究されているイオンチャネルファミリーの一つであり、結晶構造もすでに明らかにされている。機能を調節するための修飾サブユニット(βサブユニット)がいくつか知られている。
電位依存性ナトリウムチャネル
詳細は「ナトリウムチャネル」を参照
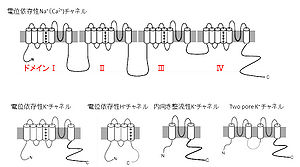
電位依存性ナトリウムチャネルは上述の電依存性カリウムチャネルと似た構造を持っているが、カリウムチャネルの3つ(4つではないでしょうか?)のサブユニットが直列につながったような、24回膜貫通型のタンパク質である(図3)。それぞれドメインI~IVと呼ばれ、それぞれに膜電位センサードメインとポアドメインが含まれる。ヒトにはαサブユニットとしてNaV1.1~1.9まで9種類の遺伝子が存在し、さらに修飾サブユニットとしてβサブユニットが存在する。活動電位を起こす機能が有名で、Hodgkin-Huxleyの時代からよく研究されているチャネルファミリーの一つである。膜電位が脱分極すると、電位依存性カリウムチャネルと同様にS4セグメントが細胞外側に動くと考えられる。続いてゲートが開いてナトリウムイオンを流入させ、細胞を脱分極させる。特徴的なのは、その後すぐに不活性化という状態に入ってしまい、その後一定時間活性化しなくなることである。この不活性化は活動電位を軸索に沿って一方向に進めるために重要な性質である。フグ毒として有名なテトロドトキシン(TTX)は電位依存性ナトリウムチャネルの阻害剤である。
電位依存性カルシウムチャネル
詳細は「カルシウムチャネル」を参照
電依依存性ナトリウムチャネルと同様、24回膜貫通型のタンパク質であり、さらにCaV1~3まで3種類のサブファミリーに分類される(ヒトの遺伝子としては10種類)。βサブユニット、α2δサブユニット、γサブユニットなど、複数種類の修飾サブユニットが存在する。脱分極により開き、カルシウムイオンを選択的に透過する。カルシウムイオンの生理的重要性ゆえに、神経伝達物質の放出、心筋や骨格筋の収縮、ホルモン分泌などさまざまな生理現象にとって非常に重要なイオンチャネルである。
カルシウム活性化型カリウムチャネル
詳細は「カリウムチャネル」を参照
細胞内のカルシウムイオン濃度に依存して活性化するカリウムチャネルである。カルシウム活性化型カリウムチャネルはシングルチャネルコンダクタンスの大きさに従ってBK, IK, SKと分類される。基本的には電位依存性カリウムチャネルと同様の構造であるが、BKチャネルにはS1の前にS0と呼ばれる膜貫通セグメントが存在し、タンパク質のN末端が細胞外に出ている。BKチャネルのみ膜電位によっても活性化される。したがってBKチャネルは膜電位と細胞内カルシウムイオン濃度の二つのパラメータに依存して活性化するイオンチャネルということになる。BKチャネルはさらにβサブユニットによって機能の調節を受ける。
HCNチャネルとCNGチャネル
Hyperpolarization-activated cyclic nucleotide-gated (HCN)チャネルは、細胞膜が過分極することで開く非選択的陽イオンチャネルである。電位依存性カリウムチャネルと同様に6回膜貫通型のαサブユニットが4つ集まって一つのイオンチャネルを構成する。他の電位依存性チャネルと同様脱分極によってS4セグメントが細胞外に向けて動くが、ゲートとのカップリングが他の電位依存性チャネルとは逆になっており、過分極で電位センサーが下がった位置に来るとゲートが開く仕組みになっている[3]。同じファミリーに属するcyclic nucleotide-gated (CNG)チャネルは、S4セグメントを持つにも関わらず電位依存性をほとんど失っているが、細胞内の環状ヌクレオチド(cAMP、cGMP)で活性化される。同様にHCNチャネルも環状ヌクレオチドで活性化される。
TRPチャネル
Transient receptor potential (TRP)チャネルは6回膜貫通型の四量体チャネルである。ナトリウム、カリウム、カルシウムを透過する非選択的陽イオンチャネルである。膜電位センサー様の構造を持つが、膜電位感受性は弱いか、または失われている。28種類ものTRP遺伝子が存在し、それぞれ細胞内外の様々なシグナル、リガンドで活性化される。いくつかは強い温度感受性を有し、トウガラシの成分カプサイシンでも活性化される高温感受性のTRPV1や、メントールや低温で活性化されるTRPM8が有名である。
電位依存性プロトンチャネル
2006年に発見された電位依存性プロトンチャネルは、電位依存性カリウムチャネルの膜電位センサードメイン(S1~S4)のみでポアドメイン(S5~S6)を欠いたような構造の4回膜貫通型タンパク質である(図3)[4][5]。単体でプロトンを透過することができるが、二量体で機能していると考えられている。
内向き整流性カリウムチャネル
内向き整流性カリウムチャネルは2回膜貫通型のポアドメインのみからなるイオンチャネルで、4つのαサブユニットで構成される四量体イオンチャネルである(図3)。イオンチャネルとして初めて構造が明らかになったKcsAチャネルも2回膜貫通型のカリウムチャネルである。ファミリーには古典的な内向き整流性チャネルであるKir1, 2, 4, 5, 7と、GTP結合タンパク質で活性化されるGIRK (Kir3)、ATP感受性カリウムチャネルを構成するKir6に大別される。静止膜電位の維持など、神経細胞や心筋などで重要な役割を果たしている。Kir6は膵臓β細胞でスルフォニル尿素と複合体を構成し、細胞内ATPセンサーとしてインシュリンの放出に重要である。Kir2をはじめとする内向き整流性カリウムチャネルは、膜電位センサーに相当するドメインを有していないが、細胞内のMg2+やスペルミンなどのポリアミンによって、細胞の内側から膜電位依存的にブロックされる。この機構により過分極時にはカリウムイオンを細胞外から細胞内に向けて流すが、脱分極時にはこれらのブロックにより細胞外へのカリウムイオンの流出を抑える。結果的に細胞の内側にカリウムイオンが流れやすい“内向き整流性”の性質を持つことになる。GIRK1(Kir3.1)とKir2.2の結晶構造がこれまでに明らかになっている[6][7][8]。
Two poreチャネル
Two-poreチャネルは2回膜貫通型のイオンチャネルが2つ直列につながったような、4回膜貫通型のイオンチャネルである(図3)。2つのPループを持つことからTwo-poreチャネルと呼ばれるが、二量体で構成されるこのイオンチャネルは一つのイオン透過路を持つ。リークチャネルとも呼ばれ、静止膜電位の形成などに寄与していると考えられる。最近結晶構造も明らかになった[9][10]。
酸感受性イオンチャネルと上皮型ナトリウムチャネル
酸感受性イオンチャネル(Acid-sensing ion channel; ASIC)は細胞外のpHが小さくなると開く非選択性の陽イオンチャネルである。上皮型ナトリウムチャネル(epithelial Na+channel; ENaC)は上皮細胞でのナトリウムイオン輸送を制御している。同じファミリーに属し、どちらも2回膜貫通型のイオンチャネルである。
塩素チャネル
ClCチャネルはクロライドイオンを通すイオンチャネルで、二量体のイオンチャネルだが、それぞれのサブユニットにイオン透過路があるので、1つのイオンチャネルに2つのポアが存在することになる。CFTRチャネルはcAMPを加水分解することで作動する塩素チャネルで、嚢胞性線維症の原因遺伝子として有名である。構造上はABCトランスポーターに属する。
リガンド依存性チャネル
Cys-loop受容体
5量体のリガンド依存性チャネルファミリーの一種である。非選択的に陽イオンを透過するニコチン型アセチルコリン受容体や[[5-HT3受容体]]、陰イオンを透過するグリシン受容体、GABA受容体(GABAA, GABAC)などが含まれる。
グルタミン酸受容体
中枢神経系の興奮性シナプスで極めて重要な働きを持つAMPA型グルタミン酸受容体、NMDA型グルタミン酸受容体、カイニン酸型グルタミン酸受容体はイオンチャネル型グルタミン酸受容体である。4量体で構成される。
P2X受容体
P2X受容体は細胞外のATPをリガンドとして活性化されるリガンド依存性チャネルである。2回膜貫通型で、3量体で構成される。ナトリウムイオン等を透過させる非選択性陽イオンチャネルであるが、ATPで長時間活性化させるとNMDGなどの大きな陽イオンも透過させることができるようにポアサイズが大きくなるという、特異なポアの性質を持つ。
詳細はP2X受容体のページ参照。
細胞内膜系イオンチャネル
リアノジン受容体
リアノジン受容体はカルシウムストアとして機能する小胞体上のカルシウムチャネルである。細胞質中のカルシウムイオン濃度が上がると開き、小胞体中のカルシウムイオンを放出し、細胞内カルシウムシグナルを増幅する。筋細胞の収縮において重要な役割を果たしている。
IP3受容体
リアノジン受容体と同様小胞体上に発現するカルシウムイオン放出チャネルである。細胞内のシグナル伝達物質の一種であるイノシトール3リン酸(IP3)によって活性化される。受精時のカルシウム動態をはじめ、生理・発生現象の様々な場面において重要な働きを担う。
TRICチャネル
上記2種のカルシウム放出チャネルによってカルシウムイオンが小胞体から放出される際、カウンターイオンとして小胞体に陽イオンが流入する必要がある。そのカウンターイオンを流入させる一過の陽イオン透過性のイオンチャネルであり、小胞体や核膜に発現している[11]。
コネキシン
細胞間にはイオンや低分子物質を透過させるギャップジャンクションとよばれる構造が存在するが、そのギャップジャンクションを構成するイオンチャネル。それぞれの細胞ではコネクソンという6量体構造として存在し、隣り合った細胞のコネクソン同士がつながることで、ギャップジャンクションが構成される。
関連項目
- Hodgkin-Huxley方程式
- イオン選択性フィルター
- イオンチャンネル型グルタミン酸受容体
- 塩素チャネル
- カリウムチャネル
- カルシウムチャネル
- ゲート
- 静止膜電位
- チャネル病
- 電位依存性チャネル
- ナトリウムチャネル
- 膜電位センサー
- リアノジン受容体
- リガンド依存性チャネル
参考文献
- ↑
Toyoshima, C., & Unwin, N. (1988).
Ion channel of acetylcholine receptor reconstructed from images of postsynaptic membranes. Nature, 336(6196), 247-50. [PubMed:2461515] [WorldCat] [DOI] - ↑
Doyle, D.A., Morais Cabral, J., Pfuetzner, R.A., Kuo, A., Gulbis, J.M., Cohen, S.L., ..., & MacKinnon, R. (1998).
The structure of the potassium channel: molecular basis of K+ conduction and selectivity. Science (New York, N.Y.), 280(5360), 69-77. [PubMed:9525859] [WorldCat] [DOI] - ↑
Männikkö, R., Elinder, F., & Larsson, H.P. (2002).
Voltage-sensing mechanism is conserved among ion channels gated by opposite voltages. Nature, 419(6909), 837-41. [PubMed:12397358] [WorldCat] [DOI] - ↑
Sasaki, M., Takagi, M., & Okamura, Y. (2006).
A voltage sensor-domain protein is a voltage-gated proton channel. Science (New York, N.Y.), 312(5773), 589-92. [PubMed:16556803] [WorldCat] [DOI] - ↑
Ramsey, I.S., Moran, M.M., Chong, J.A., & Clapham, D.E. (2006).
A voltage-gated proton-selective channel lacking the pore domain. Nature, 440(7088), 1213-6. [PubMed:16554753] [PMC] [WorldCat] [DOI] - ↑
Nishida, M., & MacKinnon, R. (2002).
Structural basis of inward rectification: cytoplasmic pore of the G protein-gated inward rectifier GIRK1 at 1.8 A resolution. Cell, 111(7), 957-65. [PubMed:12507423] [WorldCat] [DOI] - ↑
Tao, X., Avalos, J.L., Chen, J., & MacKinnon, R. (2009).
Crystal structure of the eukaryotic strong inward-rectifier K+ channel Kir2.2 at 3.1 A resolution. Science (New York, N.Y.), 326(5960), 1668-74. [PubMed:20019282] [PMC] [WorldCat] [DOI] - ↑
Hansen, S.B., Tao, X., & MacKinnon, R. (2011).
Structural basis of PIP2 activation of the classical inward rectifier K+ channel Kir2.2. Nature, 477(7365), 495-8. [PubMed:21874019] [PMC] [WorldCat] [DOI] - ↑
Miller, A.N., & Long, S.B. (2012).
Crystal structure of the human two-pore domain potassium channel K2P1. Science (New York, N.Y.), 335(6067), 432-6. [PubMed:22282804] [WorldCat] [DOI] - ↑
Brohawn, S.G., del Mármol, J., & MacKinnon, R. (2012).
Crystal structure of the human K2P TRAAK, a lipid- and mechano-sensitive K+ ion channel. Science (New York, N.Y.), 335(6067), 436-41. [PubMed:22282805] [PMC] [WorldCat] [DOI] - ↑
Yazawa, M., Ferrante, C., Feng, J., Mio, K., Ogura, T., Zhang, M., ..., & Takeshima, H. (2007).
TRIC channels are essential for Ca2+ handling in intracellular stores. Nature, 448(7149), 78-82. [PubMed:17611541] [WorldCat] [DOI]