「インフラマソーム」の版間の差分
(ページの作成:「東京都医学総合研究所 脳卒中ルネサンスプロジェクト 七田 崇 日本医科大学 微生物学免疫学教室 森田林平 英:inflamma…」) |
細編集の要約なし |
||
| 4行目: | 4行目: | ||
英:inflammasome | 英:inflammasome | ||
{{box|text= インフラマソームとは、炎症反応を惹起するための細胞内タンパク質複合体である。インフラマソームを構成するタンパク質の1つであるパターン認識受容体が、病原体の感染や組織傷害を感知して活性化されることにより、インフラマソームの活性化すなわちインフラマソーム複合体を形成するトリガーとなる。インフラマソーム複合体は最終的にカスパーゼ-1を活性化し、炎症性サイトカインIL-1β/IL-18を放出させて炎症を惹起するほか、パイロトーシスと呼ばれる細胞膜の崩壊を伴うプログラム細胞死を誘導して、神経病態に関与する。インフラマソームの活性化は免疫細胞(主にミクログリアやマクロファージ)だけでなく、神経細胞、グリア細胞においても観察されており、脳血管障害や神経変性疾患において神経炎症の促進や病態の進展への関与が示されている。}} | |||
==インフラマソームとは== | |||
脳における生理的機能や病態において炎症が重要な役割を持つ。脳内炎症には様々な分子・細胞メカニズムが機能するが、特にインフラマソームは新規の標的分子として注目されている。 | 脳における生理的機能や病態において炎症が重要な役割を持つ。脳内炎症には様々な分子・細胞メカニズムが機能するが、特にインフラマソームは新規の標的分子として注目されている。 | ||
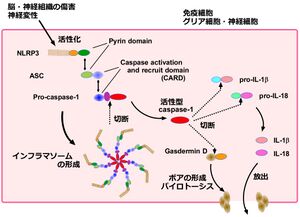
[[ファイル:Shichika Inflammasome Fig.jpg|サムネイル|図1. NLRP3インフラマソームの構造と生理機能<br>脳組織の傷害をNLRP3が感知するとASC、プロカスパーゼ1が集合して巨大な複合体(インフラマソーム)を形成することにより、プロカスパーゼ-1が切断されて活性型のcaspase-1となる。活性型caspase-1はpro-IL-1βやpro-IL-18を切断して成熟型のIL-1β、IL-18となる。一方で活性型caspase-1はGasdermin Dを切断し、N末側の断片が細胞膜にポアを形成することにより成熟型のIL-1βやIL-18が放出される。このような細胞膜の崩壊を伴うプログラム細胞死はパイロトーシスと呼称されている。]] | |||
==無菌的炎症とインフラマソームの活性化== | |||
インフラマソーム複合体は右図に示すような巨大なタンパク質複合体である(図1)。インフラマソーム複合体の形成は、その構成タンパク質の1つであるパターン認識受容体の活性化によって開始される。インフラマソームを構成するパターン認識受容体としては、nucleotide-binding domain and leucine-rich repeat-containing receptors (NLRs)やAIM2-like receptors (ALRs)が知られており、これらは病原体の感染や組織傷害によって活性化される。したがって脳・神経組織へのダメージによってもインフラマソームが活性化され、神経炎症や細胞死を誘導することにより神経病態に関与することが多数の文献によって報告されている。 | |||
細菌やウイルス、真菌などの病原体を構成する分子(リポタンパク質や糖脂質、核酸など)には、我々の生体内には存在しないものが含まれており、これらはパターン認識受容体によって認識され、マクロファージやミクログリアなどの免疫細胞を活性化し、炎症性因子の産生を誘導する<ref name=Chen2010><pubmed>21088683</pubmed></ref> 1)。一方で、組織傷害や細胞死によって細胞内の分子群や細胞外マトリックスなどが、傷害された組織中に放出されると、パターン認識受容体によって認識されて炎症を惹起することがあり、このような炎症は病原体が関与しない炎症であると考えられるため無菌的炎症として区別されている。インフラマソームの活性化も同様に、無菌的な炎症の関与が示されており、例えば組織傷害によって放出されるアデノシン3リン酸(ATP)やミトコンドリアDNA、痛風の原因となる尿酸結晶などがインフラマソームを活性化するトリガーとなりえることが知られている。実際にどのような分子によってインフラマソームが活性化されるかは、インフラマソームを構成するパターン認識受容体によって異なっている。前述したようにNLRsとALRsを含む2つのインフラマソームに大別され、NLR familyに属するNLRP1、NLRP3、NLRC4を含むものはNLR (NLRP) inflammasome、ALR familyに属するAIM2、IFI16を含むものはpyrin and HIN200 domain-containing protein (PYHIN) inflammasomeと呼称されている。それぞれのインフラマソームが活性化されるメカニズムについてはhttps://en.wikipedia.org/wiki/Inflammasomeを参照されたい。 | |||
==構成分子== | |||
以上に述べたようなパターン認識受容体の活性化が起こると、ASC (apoptosis-associated speck-like protein containing a CARD)と呼ばれるアダプタータンパク質とカスパーゼ1前駆体 (pro-カスパーゼ-1)を集合させて7量体を形成し、巨大なタンパク質複合体(インフラマソーム:図1)となる<ref name=Lamkanfi2014><pubmed>24855941</pubmed></ref> 2)。このような複合体が形成されるとプロカスパーゼ-1が自己切断され、活性化型カスパーゼ-1となる。活性化したカスパーゼ-1は、炎症性サイトカインの前駆体であるpro-IL-1βやpro-IL-18を切断することにより、活性型のIL-1βやIL-18として放出させて炎症を惹起する。さらにカスパーゼ-1は、その基質であるgasdermin D (GSDMD)と呼ばれるタンパク質を切断するが、その切断されたN末端側の断片は多量体を形成して細胞膜に挿入されることにより、大きな孔(ポア)を形成して細胞膜を破壊し、細胞の膨潤や破裂を来たす<ref name=Ding2016><pubmed>27281216</pubmed></ref> 3)。このような細胞死の形態はパイロトーシスと呼称されており、他の細胞死とは区別されている。免疫細胞においてはGSDMDを発現するため、インフラマソーム(カスパーゼ-1)の活性化によってパイロトーシスが誘導されるが、神経細胞などではGSDMDを発現しないため、カスパーゼ-1の活性化によってアポトーシスが誘導されて神経変性を引き起こすことが報告されている<ref name=Tsuchiya2019><pubmed>31064994</pubmed></ref> 4)。 | |||
== 非古典的インフラマソーム経路 == | |||
上述のインフラマソーム形成もしくは活性化システムは古典的経路と称されている(図1)。一方、細胞質内のリポ多糖類(LPS)がカスパーゼ-4, 5, 11の活性化を誘導する非古典的インフラマソーム経路も明らかにされてきた。非古典的経路では、活性化カスパーゼ-4, 5, 11がGSDMDを切断しパイロトーシスを誘導する一方で、N末端側の断片がNLRP3インフラマソームを活性化する<ref name=Rathinam2016><pubmed>27153493</pubmed></ref> 5)。本経路は敗血症の病態に関与していると考えられている。 | 上述のインフラマソーム形成もしくは活性化システムは古典的経路と称されている(図1)。一方、細胞質内のリポ多糖類(LPS)がカスパーゼ-4, 5, 11の活性化を誘導する非古典的インフラマソーム経路も明らかにされてきた。非古典的経路では、活性化カスパーゼ-4, 5, 11がGSDMDを切断しパイロトーシスを誘導する一方で、N末端側の断片がNLRP3インフラマソームを活性化する<ref name=Rathinam2016><pubmed>27153493</pubmed></ref> 5)。本経路は敗血症の病態に関与していると考えられている。 | ||
== 神経病態への関与 == | |||
インフラマソームの活性化は様々な神経疾患(脳血管障害、認知症(神経認知障害)、外傷、多発性硬化症、パーキンソン病など)において観察されており、各々の病態の進展に寄与すると考えられている。それぞれの病態におけるインフラマソームの関与についてのエビデンスは他稿において詳細にまとめられているため参照されたい<ref name=Voet2019><pubmed>31015277</pubmed></ref><ref | インフラマソームの活性化は様々な神経疾患(脳血管障害、認知症(神経認知障害)、外傷、多発性硬化症、パーキンソン病など)において観察されており、各々の病態の進展に寄与すると考えられている。それぞれの病態におけるインフラマソームの関与についてのエビデンスは他稿において詳細にまとめられているため参照されたい<ref name=Voet2019><pubmed>31015277</pubmed></ref><ref name=Heneka2018><pubmed>30206330</pubmed></ref> 6,7)。炎症自体は神経傷害を悪化させると考えられるため、インフラマソームを標的とした神経疾患の新たな治療法の確立が期待されている。 | ||
脳血管障害や外傷のような急性の神経組織傷害においては、IL-1βのような炎症性サイトカインの産生は神経炎症の惹起のために中心的な分子機転となりえる。脳血管障害や外傷(脳・脊髄損傷)における病態の進展にはNLR、PYHINインフラマソームが関与するとのエビデンスが既に蓄積している。一方でIL-1βには神経軸索を伸長させる効果があることも報告されており<ref name=Boato2011><pubmed>22200088</pubmed></ref> 8)、IL-1βに注目した場合には神経炎症の病態の理解はやや複雑となる。またIL-18は免疫学的にはIFN-産生ヘルパーT細胞(Th1)による慢性的な免疫応答を誘導する炎症性サイトカインであり、急性の神経組織傷害におけるIL-18の役割についてはまだ十分なエビデンスが蓄積していない。 | |||
神経変性疾患においては慢性的な神経炎症が、病態の進展に重要であることが注目されている。アルツハイマー病においてはインフラマソームの活性化による慢性的な炎症の持続が、病態の進展に重要な寄与を持つことが明らかにされつつある。パーキンソン病や筋萎縮性側索硬化症におけるインフラマソームの関与のエビデンスは蓄積されつつあるが、詳細の解明には今後の研究成果が必要とされている状況である。またGSDMDの活性化に伴うパイロトーシスによる神経変性疾患の病態の進展についても今後の解析が待たれる。 | 神経変性疾患においては慢性的な神経炎症が、病態の進展に重要であることが注目されている。アルツハイマー病においてはインフラマソームの活性化による慢性的な炎症の持続が、病態の進展に重要な寄与を持つことが明らかにされつつある。パーキンソン病や筋萎縮性側索硬化症におけるインフラマソームの関与のエビデンスは蓄積されつつあるが、詳細の解明には今後の研究成果が必要とされている状況である。またGSDMDの活性化に伴うパイロトーシスによる神経変性疾患の病態の進展についても今後の解析が待たれる。 | ||
==参考文献== | |||
<references /> | |||
2020年11月25日 (水) 08:17時点における版
東京都医学総合研究所 脳卒中ルネサンスプロジェクト 七田 崇 日本医科大学 微生物学免疫学教室 森田林平
英:inflammasome
インフラマソームとは、炎症反応を惹起するための細胞内タンパク質複合体である。インフラマソームを構成するタンパク質の1つであるパターン認識受容体が、病原体の感染や組織傷害を感知して活性化されることにより、インフラマソームの活性化すなわちインフラマソーム複合体を形成するトリガーとなる。インフラマソーム複合体は最終的にカスパーゼ-1を活性化し、炎症性サイトカインIL-1β/IL-18を放出させて炎症を惹起するほか、パイロトーシスと呼ばれる細胞膜の崩壊を伴うプログラム細胞死を誘導して、神経病態に関与する。インフラマソームの活性化は免疫細胞(主にミクログリアやマクロファージ)だけでなく、神経細胞、グリア細胞においても観察されており、脳血管障害や神経変性疾患において神経炎症の促進や病態の進展への関与が示されている。
インフラマソームとは
脳における生理的機能や病態において炎症が重要な役割を持つ。脳内炎症には様々な分子・細胞メカニズムが機能するが、特にインフラマソームは新規の標的分子として注目されている。
無菌的炎症とインフラマソームの活性化
インフラマソーム複合体は右図に示すような巨大なタンパク質複合体である(図1)。インフラマソーム複合体の形成は、その構成タンパク質の1つであるパターン認識受容体の活性化によって開始される。インフラマソームを構成するパターン認識受容体としては、nucleotide-binding domain and leucine-rich repeat-containing receptors (NLRs)やAIM2-like receptors (ALRs)が知られており、これらは病原体の感染や組織傷害によって活性化される。したがって脳・神経組織へのダメージによってもインフラマソームが活性化され、神経炎症や細胞死を誘導することにより神経病態に関与することが多数の文献によって報告されている。
細菌やウイルス、真菌などの病原体を構成する分子(リポタンパク質や糖脂質、核酸など)には、我々の生体内には存在しないものが含まれており、これらはパターン認識受容体によって認識され、マクロファージやミクログリアなどの免疫細胞を活性化し、炎症性因子の産生を誘導する[1] 1)。一方で、組織傷害や細胞死によって細胞内の分子群や細胞外マトリックスなどが、傷害された組織中に放出されると、パターン認識受容体によって認識されて炎症を惹起することがあり、このような炎症は病原体が関与しない炎症であると考えられるため無菌的炎症として区別されている。インフラマソームの活性化も同様に、無菌的な炎症の関与が示されており、例えば組織傷害によって放出されるアデノシン3リン酸(ATP)やミトコンドリアDNA、痛風の原因となる尿酸結晶などがインフラマソームを活性化するトリガーとなりえることが知られている。実際にどのような分子によってインフラマソームが活性化されるかは、インフラマソームを構成するパターン認識受容体によって異なっている。前述したようにNLRsとALRsを含む2つのインフラマソームに大別され、NLR familyに属するNLRP1、NLRP3、NLRC4を含むものはNLR (NLRP) inflammasome、ALR familyに属するAIM2、IFI16を含むものはpyrin and HIN200 domain-containing protein (PYHIN) inflammasomeと呼称されている。それぞれのインフラマソームが活性化されるメカニズムについてはhttps://en.wikipedia.org/wiki/Inflammasomeを参照されたい。
構成分子
以上に述べたようなパターン認識受容体の活性化が起こると、ASC (apoptosis-associated speck-like protein containing a CARD)と呼ばれるアダプタータンパク質とカスパーゼ1前駆体 (pro-カスパーゼ-1)を集合させて7量体を形成し、巨大なタンパク質複合体(インフラマソーム:図1)となる[2] 2)。このような複合体が形成されるとプロカスパーゼ-1が自己切断され、活性化型カスパーゼ-1となる。活性化したカスパーゼ-1は、炎症性サイトカインの前駆体であるpro-IL-1βやpro-IL-18を切断することにより、活性型のIL-1βやIL-18として放出させて炎症を惹起する。さらにカスパーゼ-1は、その基質であるgasdermin D (GSDMD)と呼ばれるタンパク質を切断するが、その切断されたN末端側の断片は多量体を形成して細胞膜に挿入されることにより、大きな孔(ポア)を形成して細胞膜を破壊し、細胞の膨潤や破裂を来たす[3] 3)。このような細胞死の形態はパイロトーシスと呼称されており、他の細胞死とは区別されている。免疫細胞においてはGSDMDを発現するため、インフラマソーム(カスパーゼ-1)の活性化によってパイロトーシスが誘導されるが、神経細胞などではGSDMDを発現しないため、カスパーゼ-1の活性化によってアポトーシスが誘導されて神経変性を引き起こすことが報告されている[4] 4)。
非古典的インフラマソーム経路
上述のインフラマソーム形成もしくは活性化システムは古典的経路と称されている(図1)。一方、細胞質内のリポ多糖類(LPS)がカスパーゼ-4, 5, 11の活性化を誘導する非古典的インフラマソーム経路も明らかにされてきた。非古典的経路では、活性化カスパーゼ-4, 5, 11がGSDMDを切断しパイロトーシスを誘導する一方で、N末端側の断片がNLRP3インフラマソームを活性化する[5] 5)。本経路は敗血症の病態に関与していると考えられている。
神経病態への関与
インフラマソームの活性化は様々な神経疾患(脳血管障害、認知症(神経認知障害)、外傷、多発性硬化症、パーキンソン病など)において観察されており、各々の病態の進展に寄与すると考えられている。それぞれの病態におけるインフラマソームの関与についてのエビデンスは他稿において詳細にまとめられているため参照されたい[6][7] 6,7)。炎症自体は神経傷害を悪化させると考えられるため、インフラマソームを標的とした神経疾患の新たな治療法の確立が期待されている。
脳血管障害や外傷のような急性の神経組織傷害においては、IL-1βのような炎症性サイトカインの産生は神経炎症の惹起のために中心的な分子機転となりえる。脳血管障害や外傷(脳・脊髄損傷)における病態の進展にはNLR、PYHINインフラマソームが関与するとのエビデンスが既に蓄積している。一方でIL-1βには神経軸索を伸長させる効果があることも報告されており[8] 8)、IL-1βに注目した場合には神経炎症の病態の理解はやや複雑となる。またIL-18は免疫学的にはIFN-産生ヘルパーT細胞(Th1)による慢性的な免疫応答を誘導する炎症性サイトカインであり、急性の神経組織傷害におけるIL-18の役割についてはまだ十分なエビデンスが蓄積していない。 神経変性疾患においては慢性的な神経炎症が、病態の進展に重要であることが注目されている。アルツハイマー病においてはインフラマソームの活性化による慢性的な炎症の持続が、病態の進展に重要な寄与を持つことが明らかにされつつある。パーキンソン病や筋萎縮性側索硬化症におけるインフラマソームの関与のエビデンスは蓄積されつつあるが、詳細の解明には今後の研究成果が必要とされている状況である。またGSDMDの活性化に伴うパイロトーシスによる神経変性疾患の病態の進展についても今後の解析が待たれる。
参考文献
- ↑
Chen, G.Y., & Nuñez, G. (2010).
Sterile inflammation: sensing and reacting to damage. Nature reviews. Immunology, 10(12), 826-37. [PubMed:21088683] [PMC] [WorldCat] [DOI] - ↑
Lamkanfi, M., & Dixit, V.M. (2014).
Mechanisms and functions of inflammasomes. Cell, 157(5), 1013-22. [PubMed:24855941] [WorldCat] [DOI] - ↑
Ding, J., Wang, K., Liu, W., She, Y., Sun, Q., Shi, J., ..., & Shao, F. (2016).
Pore-forming activity and structural autoinhibition of the gasdermin family. Nature, 535(7610), 111-6. [PubMed:27281216] [WorldCat] [DOI] - ↑
Tsuchiya, K., Nakajima, S., Hosojima, S., Thi Nguyen, D., Hattori, T., Manh Le, T., ..., & Suda, T. (2019).
Caspase-1 initiates apoptosis in the absence of gasdermin D. Nature communications, 10(1), 2091. [PubMed:31064994] [PMC] [WorldCat] [DOI] - ↑
Rathinam, V.A., & Fitzgerald, K.A. (2016).
Inflammasome Complexes: Emerging Mechanisms and Effector Functions. Cell, 165(4), 792-800. [PubMed:27153493] [PMC] [WorldCat] [DOI] - ↑
Voet, S., Srinivasan, S., Lamkanfi, M., & van Loo, G. (2019).
Inflammasomes in neuroinflammatory and neurodegenerative diseases. EMBO molecular medicine, 11(6). [PubMed:31015277] [PMC] [WorldCat] [DOI] - ↑
Heneka, M.T., McManus, R.M., & Latz, E. (2018).
Inflammasome signalling in brain function and neurodegenerative disease. Nature reviews. Neuroscience, 19(10), 610-621. [PubMed:30206330] [WorldCat] [DOI] - ↑
Boato, F., Hechler, D., Rosenberger, K., Lüdecke, D., Peters, E.M., Nitsch, R., & Hendrix, S. (2011).
Interleukin-1 beta and neurotrophin-3 synergistically promote neurite growth in vitro. Journal of neuroinflammation, 8, 183. [PubMed:22200088] [PMC] [WorldCat] [DOI]