「カルシウムキレート剤」の版間の差分
Junko kurahashi (トーク | 投稿記録) |
Junko kurahashi (トーク | 投稿記録) 細編集の要約なし |
||
| (2人の利用者による、間の2版が非表示) | |||
| 4行目: | 4行目: | ||
<font size="+1">[http://researchmap.jp/ttakahas 高橋 智幸]</font><br> | <font size="+1">[http://researchmap.jp/ttakahas 高橋 智幸]</font><br> | ||
''沖縄科学技術大学院大学細胞分子シナプス機能ユニット''<br> | ''沖縄科学技術大学院大学細胞分子シナプス機能ユニット''<br> | ||
DOI:<selfdoi /> 原稿受付日:2018年3月22日 原稿完成日:2018年7月30日<br> | |||
担当編集委員:[https://researchmap.jp/haruokasai 河西春郎](東京大学 医学系研究科)<br> | |||
</div> | </div> | ||
| 18行目: | 20行目: | ||
[[カルシウム]]キレート剤は、キレート剤の中でもCa<sup>2+</sup>をキレート化するものである。Ca<sup>2+</sup>と同時に他の金属イオンもキレートする非選択的なカルシウムキレート剤と、Ca<sup>2+</sup>に特異性の高い選択的なカルシウムキレート剤が存在するが、研究や実験の目的に応じてどちらも使用されるため、本項では両者ともカルシウムキレート剤として解説する。 | [[カルシウム]]キレート剤は、キレート剤の中でもCa<sup>2+</sup>をキレート化するものである。Ca<sup>2+</sup>と同時に他の金属イオンもキレートする非選択的なカルシウムキレート剤と、Ca<sup>2+</sup>に特異性の高い選択的なカルシウムキレート剤が存在するが、研究や実験の目的に応じてどちらも使用されるため、本項では両者ともカルシウムキレート剤として解説する。 | ||
以下に詳説する[[EDTA]]、[[EGTA]]、[[BAPTA]]の他、N'-(2-ヒドロキシエチル)エチレンジアミン-N,N,N'-三酢酸(HEDTA)やニトリロトリ酢酸(NTA)などもカルシウムキレート剤として用いられることがある。<br> | |||
{{chembox | {{chembox | ||
| Name = EDTA | | Name = EDTA | ||
| 55行目: | 55行目: | ||
ethylenediaminetetraacetic acid:EDTA | ethylenediaminetetraacetic acid:EDTA | ||
アミノポリカルボン酸の一種。1935年オーストリアの化学者[[ | アミノポリカルボン酸の一種。1935年オーストリアの化学者[[w:Ferdinand Münz|Ferdinand Münz]](1888-1969)によって初めて合成され<ref>'''Matteo Paolieri'''<br>Ferdinand Münz: EDTA and 40 years of inventions.<br>Bull. Hist. Chem. ACS.: 2017, 42(2);133–140</ref>、ドイツの染料会社[[wj:IG・ファルベンインドゥストリー|イーゲーファルベン]](I.G. Farben)よりTrilon Bという商品名で硬水軟化剤として発売された<ref>'''柴田村治, 永田恭一<br>'''対話でつづる錯塩化学 : その4 錯体化学の周辺<br> [https://doi.org/10.20665/kagakukyouiku.21.6_446 化学教育: 1973, 21(6);446-450]</ref>。 | ||
EDTAはCa<sup>2+</sup>とMg<sup>2+</sup>をはじめとする二価の金属イオンと特によくキレート結合するが、それ以外にAg<sup>+</sup>、Fe<sup>3+</sup>、Zr<sup>4+</sup>などの1~4価の金属イオンとも結合する広範なキレート剤である<ref name = dojin>'''同仁化学研究所<br>'''Dojindo技術情報 >プロトコル集 >[http://www.dojindo.co.jp/technical/protocol/log.pdf カタログ付録Iキレート安定度定数一覧表]</ref>。その強力なキレート能と安定性のため、現在では工業目的から食品添加物まで日常生活の多岐にわたって使用されている。 | EDTAはCa<sup>2+</sup>とMg<sup>2+</sup>をはじめとする二価の金属イオンと特によくキレート結合するが、それ以外にAg<sup>+</sup>、Fe<sup>3+</sup>、Zr<sup>4+</sup>などの1~4価の金属イオンとも結合する広範なキレート剤である<ref name = dojin>'''同仁化学研究所<br>'''Dojindo技術情報 >プロトコル集 >[http://www.dojindo.co.jp/technical/protocol/log.pdf カタログ付録Iキレート安定度定数一覧表]</ref>。その強力なキレート能と安定性のため、現在では工業目的から食品添加物まで日常生活の多岐にわたって使用されている。 | ||
生物学実験では、しばしば酵素の不活性化剤として用いられる。例えば、[[DNA]]を溶解・保存するTE(Tris-EDTA)溶液中のEDTAは、[[DNA分解酵素]]DNAaseの補因子であるMg<sup>2+</sup>をキレートしてDNAaseの活性を抑制する。また、タンパク質分解酵素の一種金属[[プロテアーゼ]]の多くはZn<sup>2+</sup>依存的であり、タンパク質精製に際してはプロテアーゼ活性抑制のためにEDTAが添加される。さらに、接着性細胞の接着はMg<sup>2+</sup>、Ca<sup>2+</sup>依存的な[[細胞接着因子]]のはたらきによるため、細胞を単離したり培養ディッシュから剥がしたりする際にもEDTAがキレート剤として使用される。 | 生物学実験では、しばしば酵素の不活性化剤として用いられる。例えば、[[DNA]]を溶解・保存するTE(Tris-EDTA)溶液中のEDTAは、[[DNA分解酵素]]DNAaseの補因子であるMg<sup>2+</sup>をキレートしてDNAaseの活性を抑制する。また、タンパク質分解酵素の一種金属[[プロテアーゼ]]の多くはZn<sup>2+</sup>依存的であり、タンパク質精製に際してはプロテアーゼ活性抑制のためにEDTAが添加される。さらに、接着性細胞の接着はMg<sup>2+</sup>、Ca<sup>2+</sup>依存的な[[細胞接着因子]]のはたらきによるため、細胞を単離したり培養ディッシュから剥がしたりする際にもEDTAがキレート剤として使用される。 | ||
{{chembox | {{chembox | ||
| 147行目: | 147行目: | ||
1,2-bis-(o-Aminophenoxy)-ethane-N,N,N',N'-tetraacetic acid:BAPTA | 1,2-bis-(o-Aminophenoxy)-ethane-N,N,N',N'-tetraacetic acid:BAPTA | ||
EGTAの誘導体として1980年に[[ | EGTAの誘導体として1980年に[[wj:ロジャー・Y・チエン|Roger Tsien]](1952-2016)によって開発された。細胞内Ca<sup>2+</sup>測定に用いる低分子[[カルシウム指示薬]]はカルシウムキレート剤がその母核化合物となっているが、EGTA(およびその誘導体のカルシウム指示薬Quin2)はそのpH依存性が問題であった。また高いpKa(>8)値に起因するCa<sup>2+</sup>との遅い結合速度も時間分解能を高める上で不都合であった。よりすぐれたカルシウム指示薬の開発にあたって彼は、EGTAで窒素原子と酸素原子をつないでいるメチレン基をベンゼン環へ置換することですべての配位子の[[PKA|pKa]]を6.5以下にし、pH7付近での性質を安定させることに成功した<ref name=Tsien><pubmed> 6770893 </pubmed></ref>('''図2''')。こうしてできたキレート剤がBAPTAであり、[[Fura2]]に続く多くの低分子カルシウム指示薬の母核化合物となった。 | ||
細胞内の生理的Ca<sup>2+</sup>濃度(0.1 nM~1 mM)では、BAPTAとCa<sup>2+</sup>は1:1で結合する<ref name=Tsien />。解離定数は220 nMでEGTAと同等であるが、結合速度定数は4.0 × 10<sup>8</sup> M<sup>-1</sup>sec<sup>-1</sup>とEGTAに比べて50~100倍速い<ref name=Naraghi />。たとえばイカの巨大[[シナプス前]]末端からの[[神経伝達物質]]放出はEGTAでは抑制されないがBAPTAで抑制されることから[[シナプス]]前末端内におけるCa<sup>2+</sup>の源([[カルシウムチャネル]])とCa<sup>2+</sup>の受容器([[シナプス小胞]]のCa<sup>2+</sup>センサー)の距離が近いことを反映していると考えられる<ref><pubmed> 1675264 </pubmed></ref>。このように、結合速度定数の異なるEGTAとBAPTAによる生理現象の抑制率を比較定量することによって、生理現象に関わる[[カルシウムドメイン]]のサイズを推定することができる<ref><pubmed> 9539117 </pubmed></ref><ref name=Nakamura><pubmed> 29563180 </pubmed></ref>。 | 細胞内の生理的Ca<sup>2+</sup>濃度(0.1 nM~1 mM)では、BAPTAとCa<sup>2+</sup>は1:1で結合する<ref name=Tsien />。解離定数は220 nMでEGTAと同等であるが、結合速度定数は4.0 × 10<sup>8</sup> M<sup>-1</sup>sec<sup>-1</sup>とEGTAに比べて50~100倍速い<ref name=Naraghi />。たとえばイカの巨大[[シナプス前]]末端からの[[神経伝達物質]]放出はEGTAでは抑制されないがBAPTAで抑制されることから[[シナプス]]前末端内におけるCa<sup>2+</sup>の源([[カルシウムチャネル]])とCa<sup>2+</sup>の受容器([[シナプス小胞]]のCa<sup>2+</sup>センサー)の距離が近いことを反映していると考えられる<ref><pubmed> 1675264 </pubmed></ref>。このように、結合速度定数の異なるEGTAとBAPTAによる生理現象の抑制率を比較定量することによって、生理現象に関わる[[カルシウムドメイン]]のサイズを推定することができる<ref><pubmed> 9539117 </pubmed></ref><ref name=Nakamura><pubmed> 29563180 </pubmed></ref>。 | ||
細胞外から投与して細胞内Ca<sup>2+</sup> | 細胞外から投与して細胞内Ca<sup>2+</sup>をキレートするときには、エステル化して細胞膜の透過性を高めたBAPTA-AMが利用される。 | ||
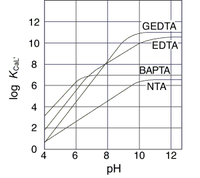
[[Image:CaChelator figure2.png|none|thumb|200px|'''図2.各種Ca<sup>2+</sup>錯体の条件定数のpH依存性'''<br>生理的pH(7)付近における曲線の傾きに着目。(株)同仁化学研究所の[http://dominoweb.dojindo.co.jp/goodsr7.nsf/View_Display/B019?OpenDocument 製品情報]より許可を得て転載]] | [[Image:CaChelator figure2.png|none|thumb|200px|'''図2.各種Ca<sup>2+</sup>錯体の条件定数のpH依存性'''<br>生理的pH(7)付近における曲線の傾きに着目。(株)同仁化学研究所の[http://dominoweb.dojindo.co.jp/goodsr7.nsf/View_Display/B019?OpenDocument 製品情報]より許可を得て転載]] | ||
2018年7月30日 (月) 15:04時点における最新版
中村 行宏
東京慈恵会医科大学薬理学講座
高橋 智幸
沖縄科学技術大学院大学細胞分子シナプス機能ユニット
DOI:10.14931/bsd.7521 原稿受付日:2018年3月22日 原稿完成日:2018年7月30日
担当編集委員:河西春郎(東京大学 医学系研究科)
英:calcium chelator 独:Calciumchelator 仏:chélateur du calcium
カルシウムキレート剤は、水溶液中でカルシウムイオン(Ca2+)へ選択的に結合して、その活性を消失させる非金属リガンド分子である。Ca2+は細胞内シグナル伝達を担う代表的なセカンドメッセンジャーであり、神経細胞の分化、突起の伸展、神経伝達物質放出、シナプス可塑性、神経細胞死などさまざまな細胞機能に関与している。細胞のカルシウム依存性機能の研究において、カルシウムキレート剤は必須のツールである。また低分子カルシウム指示薬は、カルシウムキレート剤をもとに化学合成されたものである。代表的なカルシウムキレート剤としてEGTAとBAPTAがあげられる。
キレート剤とは
キレート剤とは、溶液中で金属イオンと結合する非金属のリガンドで、リガンド分子内の複数の配位原子で1つの金属イオンと結合し、その金属イオンの活性を低下させる。金属イオンとキレート剤が反応してできた化合物をキレート錯体、またその反応をキレート化という。
キレート錯体はリガンドが金属イオンと複数の配位座で結合しているため、個々の配位結合の親和性が弱くても全体としては安定し、金属イオンが分離しにくい。キレート化した金属イオンは沈殿を生成せず溶液中に存在し続けるものの、その活性は無効化または低減される。生物学実験においては、金属イオンが不可欠な酵素反応の停止や、遊離金属イオンの濃度調節、キレート滴定法による遊離金属イオンの定量に用いられる。
カルシウムキレート剤の例
カルシウムキレート剤は、キレート剤の中でもCa2+をキレート化するものである。Ca2+と同時に他の金属イオンもキレートする非選択的なカルシウムキレート剤と、Ca2+に特異性の高い選択的なカルシウムキレート剤が存在するが、研究や実験の目的に応じてどちらも使用されるため、本項では両者ともカルシウムキレート剤として解説する。
以下に詳説するEDTA、EGTA、BAPTAの他、N'-(2-ヒドロキシエチル)エチレンジアミン-N,N,N'-三酢酸(HEDTA)やニトリロトリ酢酸(NTA)などもカルシウムキレート剤として用いられることがある。
| EDTA | |
|---|---|
| |
2,2′,2″,2‴-(Ethane-1,2-diyldinitrilo)tetraacetic acid | |
別称 N,N′-Ethane-1,2-diylbis[N-(carboxymethyl)glycine] Diaminoethane-tetraacetic acid Edetic acid Ethylenedinitrilo-tetraacetic acid | |
| Identifiers | |
| 60-00-4 | |
| ChEBI | |
| ChEMBL | ChEMBL858 |
| ChemSpider | 5826 |
| |
| Jmol-3D images | Image |
| KEGG | D00052 |
| PubChem | 6049 |
| |
| UNII | 9G34HU7RV0 |
| Properties | |
| C10H16N2O8 | |
| Molar mass | 292.244 g·mol−1 |
| Appearance | Colourless crystals |
| Density | 0.860 g cm−3 (20 °C) |
| 特記なき場合、データは常温(25 °C)・常圧(100 kPa)におけるものである。 | |
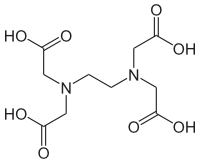
エチレンジアミン四酢酸
ethylenediaminetetraacetic acid:EDTA
アミノポリカルボン酸の一種。1935年オーストリアの化学者Ferdinand Münz(1888-1969)によって初めて合成され[1]、ドイツの染料会社イーゲーファルベン(I.G. Farben)よりTrilon Bという商品名で硬水軟化剤として発売された[2]。
EDTAはCa2+とMg2+をはじめとする二価の金属イオンと特によくキレート結合するが、それ以外にAg+、Fe3+、Zr4+などの1~4価の金属イオンとも結合する広範なキレート剤である[3]。その強力なキレート能と安定性のため、現在では工業目的から食品添加物まで日常生活の多岐にわたって使用されている。
生物学実験では、しばしば酵素の不活性化剤として用いられる。例えば、DNAを溶解・保存するTE(Tris-EDTA)溶液中のEDTAは、DNA分解酵素DNAaseの補因子であるMg2+をキレートしてDNAaseの活性を抑制する。また、タンパク質分解酵素の一種金属プロテアーゼの多くはZn2+依存的であり、タンパク質精製に際してはプロテアーゼ活性抑制のためにEDTAが添加される。さらに、接着性細胞の接着はMg2+、Ca2+依存的な細胞接着因子のはたらきによるため、細胞を単離したり培養ディッシュから剥がしたりする際にもEDTAがキレート剤として使用される。
| EGTA | |
|---|---|
| |
Ethylene glycol-bis(2-aminoethylether)-N,N,N′,N′-tetraacetic acid | |
別称 Triethylene glycol diamine tetraacetic acid | |
| Identifiers | |
| 67-42-5 | |
| ChEBI | |
| ChEMBL | ChEMBL240390 |
| ChemSpider | 5972 |
| |
| Jmol-3D images | Image |
| KEGG | D00569 |
| PubChem | 6207 |
| |
| UNII | 526U7A2651 |
| Properties | |
| C14H24N2O10 | |
| Molar mass | 380.350 g·mol−1 |
| Melting point | 241 °C (466 °F; 514 K) |
| 特記なき場合、データは常温(25 °C)・常圧(100 kPa)におけるものである。 | |
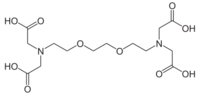
グリコールエーテルジアミン四酢酸
ethylene glycol tetraacetic acid:EGTA、GEDTA
二価および三価の金属イオンと反応し錯体を形成する。EGTAはEDTAとキレート生成定数はあまり変わらないが、金属イオンに対する特異性が異なり、二価の金属イオンではMg2+に比べ、Ca2+やCd2+に対する選択性が高い[3]。このため、Ca2+,Mg2+共存下でCa2+を選択的にキレートするにはEGTAが適しており[4]、細胞内や無細胞系でのCa2+生理機能解析に汎用される。
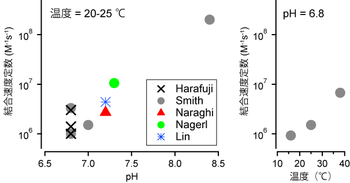
EGTAと(EDTAも)Ca2+の結合は水溶液のpHに依存する。EGTA1分子には最大4つのH+が結合できるが、生理学的pH(=7)付近では通常2つのH+が結合している。この状態でのCa2+との結合速度は、H+が結合していない状態のEGTAより100~1000倍遅い[5]。EGTAにCa2+が結合するとH+は解離する。pH依存性はpH7付近で顕著に変化し、さらにEGTAとCa2+の結合は溶液の温度とイオン強度にも影響される[6][7](図1)。EGTAの特性はこれら複数の要素に依存するため、測定法による誤差を大きくしている。例えばpH7.2における室温下でのEGTAとCa2+の解離定数は70~543 nM、結合速度定数は1.05×107~ 4.38×106 M-1s-1と報告されている[8][9][10]。
EGTAを用いてCa2+緩衝液を作製する場合、上述の種々の依存性を考慮して適切なEGTA濃度を設定しなければならない。溶液中のCa2+濃度、Mg2+濃度、EGTA濃度の総量とpH、温度、イオン強度から遊離Ca2+濃度を計算で求める方法が開発され[11]、プラットフォームが公開されている(maxchelator)。細胞外から投与して細胞内Ca2+をキレートできるよう、エステル化して細胞膜の透過性を高めたEGTA-AMも利用される。
| BAPTA | |
|---|---|
| |
1,2-bis(o-aminophenoxy)ethane-N,N,N′,N′-tetraacetic acid | |
| Identifiers | |
| 85233-19-8 | |
| ChEBI | |
| ChEMBL | ChEMBL1590868 |
| ChemSpider | 94562 |
| |
| Jmol-3D images | Image |
| PubChem | 104751 |
| |
| UNII | K22DDW77C0 |
| Properties | |
| C22H24N2O10 | |
| Molar mass | 476.438 g·mol−1 |
| Density | 1.494 g/cm3 |
| Melting point | 177–179 °C (351–354 °F; 450–452 K) |
| 特記なき場合、データは常温(25 °C)・常圧(100 kPa)におけるものである。 | |
1,2-ビス(o-アミノフェノキシド)エタン-N,N,N',N'-テトラ酢酸
1,2-bis-(o-Aminophenoxy)-ethane-N,N,N',N'-tetraacetic acid:BAPTA
EGTAの誘導体として1980年にRoger Tsien(1952-2016)によって開発された。細胞内Ca2+測定に用いる低分子カルシウム指示薬はカルシウムキレート剤がその母核化合物となっているが、EGTA(およびその誘導体のカルシウム指示薬Quin2)はそのpH依存性が問題であった。また高いpKa(>8)値に起因するCa2+との遅い結合速度も時間分解能を高める上で不都合であった。よりすぐれたカルシウム指示薬の開発にあたって彼は、EGTAで窒素原子と酸素原子をつないでいるメチレン基をベンゼン環へ置換することですべての配位子のpKaを6.5以下にし、pH7付近での性質を安定させることに成功した[12](図2)。こうしてできたキレート剤がBAPTAであり、Fura2に続く多くの低分子カルシウム指示薬の母核化合物となった。
細胞内の生理的Ca2+濃度(0.1 nM~1 mM)では、BAPTAとCa2+は1:1で結合する[12]。解離定数は220 nMでEGTAと同等であるが、結合速度定数は4.0 × 108 M-1sec-1とEGTAに比べて50~100倍速い[8]。たとえばイカの巨大シナプス前末端からの神経伝達物質放出はEGTAでは抑制されないがBAPTAで抑制されることからシナプス前末端内におけるCa2+の源(カルシウムチャネル)とCa2+の受容器(シナプス小胞のCa2+センサー)の距離が近いことを反映していると考えられる[13]。このように、結合速度定数の異なるEGTAとBAPTAによる生理現象の抑制率を比較定量することによって、生理現象に関わるカルシウムドメインのサイズを推定することができる[14][15]。
細胞外から投与して細胞内Ca2+をキレートするときには、エステル化して細胞膜の透過性を高めたBAPTA-AMが利用される。
関連項目
参考文献
- ↑ Matteo Paolieri
Ferdinand Münz: EDTA and 40 years of inventions.
Bull. Hist. Chem. ACS.: 2017, 42(2);133–140 - ↑ 柴田村治, 永田恭一
対話でつづる錯塩化学 : その4 錯体化学の周辺
化学教育: 1973, 21(6);446-450 - ↑ 3.0 3.1 同仁化学研究所
Dojindo技術情報 >プロトコル集 >カタログ付録Iキレート安定度定数一覧表 - ↑ R W Schmid, Charles Reilley
New complexon for titration of calcium in the presence of magnesium.
Analyt. Chem.: 1957, 29;264-268 - ↑ Pietro Mirti
Kinetics of ligand exchange and dissociation reactions of the calcium(II)-EGTA complex investigated by the NMR technique.
J. inorg. nucl. Chem.: 1978, 41;323-330 - ↑
Harafuji, H., & Ogawa, Y. (1980).
Re-examination of the apparent binding constant of ethylene glycol bis(beta-aminoethyl ether)-N,N,N',N'-tetraacetic acid with calcium around neutral pH. Journal of biochemistry, 87(5), 1305-12. [PubMed:6771253] [WorldCat] [DOI] - ↑
Smith, P.D., Liesegang, G.W., Berger, R.L., Czerlinski, G., & Podolsky, R.J. (1984).
A stopped-flow investigation of calcium ion binding by ethylene glycol bis(beta-aminoethyl ether)-N,N'-tetraacetic acid. Analytical biochemistry, 143(1), 188-95. [PubMed:6442108] [WorldCat] [DOI] - ↑ 8.0 8.1
Naraghi, M. (1997).
T-jump study of calcium binding kinetics of calcium chelators. Cell calcium, 22(4), 255-68. [PubMed:9481476] [WorldCat] [DOI] - ↑
Nägerl, U.V., Novo, D., Mody, I., & Vergara, J.L. (2000).
Binding kinetics of calbindin-D(28k) determined by flash photolysis of caged Ca(2+) Biophysical journal, 79(6), 3009-18. [PubMed:11106608] [PMC] [WorldCat] [DOI] - ↑
Lin, K.H., Taschenberger, H., & Neher, E. (2017).
Dynamics of volume-averaged intracellular Ca2+ in a rat CNS nerve terminal during single and repetitive voltage-clamp depolarizations. The Journal of physiology, 595(10), 3219-3236. [PubMed:27957749] [PMC] [WorldCat] [DOI] - ↑
Patton, C., Thompson, S., & Epel, D. (2004).
Some precautions in using chelators to buffer metals in biological solutions. Cell calcium, 35(5), 427-31. [PubMed:15003852] [WorldCat] [DOI] - ↑ 12.0 12.1
Tsien, R.Y. (1980).
New calcium indicators and buffers with high selectivity against magnesium and protons: design, synthesis, and properties of prototype structures. Biochemistry, 19(11), 2396-404. [PubMed:6770893] [WorldCat] [DOI] - ↑
Adler, E.M., Augustine, G.J., Duffy, S.N., & Charlton, M.P. (1991).
Alien intracellular calcium chelators attenuate neurotransmitter release at the squid giant synapse. The Journal of neuroscience : the official journal of the Society for Neuroscience, 11(6), 1496-507. [PubMed:1675264] [WorldCat] - ↑
Neher, E. (1998).
Vesicle pools and Ca2+ microdomains: new tools for understanding their roles in neurotransmitter release. Neuron, 20(3), 389-99. [PubMed:9539117] [WorldCat] [DOI] - ↑
Nakamura, Y., Reva, M., & DiGregorio, D.A. (2018).
Variations in Ca2+ Influx Can Alter Chelator-Based Estimates of Ca2+ Channel-Synaptic Vesicle Coupling Distance. The Journal of neuroscience : the official journal of the Society for Neuroscience, 38(16), 3971-3987. [PubMed:29563180] [PMC] [WorldCat] [DOI]