「カルシウム指示薬」の版間の差分
細編集の要約なし |
細編集の要約なし |
||
| 21行目: | 21行目: | ||
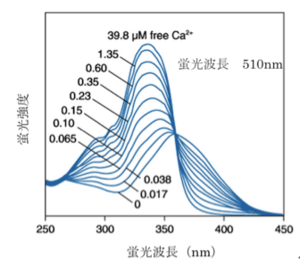
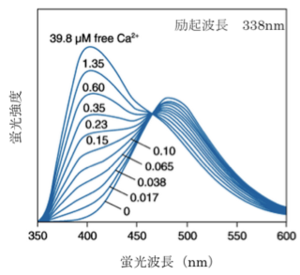
[[Image:indo-1spectra.png|thumb|'''図6.indo-1 蛍光スペクトル'''<br>ライフテクノロジーズのHPより許可を得て転載。]] | [[Image:indo-1spectra.png|thumb|'''図6.indo-1 蛍光スペクトル'''<br>ライフテクノロジーズのHPより許可を得て転載。]] | ||
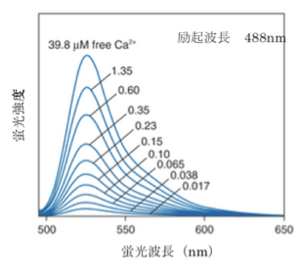
[[Image:fluo-3spectra.png|thumb|'''図7.fluo-3 蛍光スペクトル'''<br>ライフテクノロジーズのHPより許可を得て転載。]] | [[Image:fluo-3spectra.png|thumb|'''図7.fluo-3 蛍光スペクトル'''<br>ライフテクノロジーズのHPより許可を得て転載。]] | ||
[[Image:fura-2AM.png|thumb|'''図8 fura-2AM '''<br>AM体は細胞膜を透過した後細胞内のエステラーゼにより加水分解されることによりカルシウム指示薬として機能する。]] | |||
[[Image:DGAchfluo-3AM.pmg|thumb|'''図9.fluo-3AMを取りこませたマウス歯状回の神経細胞の蛍光イメージング'''<br>マウス脳スライス標本を作成しfluo-3AMを取りこませた後アセチルコリンを投与して刺激した。中井による未発表データー。]] | [[Image:DGAchfluo-3AM.pmg|thumb|'''図9.fluo-3AMを取りこませたマウス歯状回の神経細胞の蛍光イメージング'''<br>マウス脳スライス標本を作成しfluo-3AMを取りこませた後アセチルコリンを投与して刺激した。中井による未発表データー。]] | ||
2015年7月15日 (水) 09:40時点における版
中井 淳一
埼玉大学 脳末梢科学研究センター
DOI:10.14931/bsd.6177 原稿受付日:2015年7月14日 原稿完成日:2015年月日
担当編集委員:河西 春郎(東京大学 大学院医学系研究科)
英:calcium indicator 独:Calcium-Indikator 仏:Indicateur de calcium
同義語:蛍光カルシウムインジケーター、蛍光カルシウム色素、カルシウム感受性色素
カルシウム指示薬とは、主に化学合成された蛍光物質であって、細胞内のカルシウムイオン濃度を測定するために用いられる試薬のことである。細胞内のカルシウムイオンはセカンドメッセンジャーとして働いているのでその動態を知ることは重要である。カルシウム指示薬は細胞内のカルシウムイオンと結合するとその蛍光特性(蛍光強度や波長)が変化するため、蛍光測光により細胞内のカルシウムイオン濃度を測定したり、蛍光イメージングにより可視化することが可能となる。これまでにfura-2やindo-1、fluo-3、rhod-2などカルシウムに対する結合の強さや蛍光波長特性の異なる多数の蛍光カルシウム指示薬が開発されている。カルシウム指示薬はアセトキシメチル(AM)エステル化することにより細胞膜を通過し細胞内に導入することが可能で、これにより簡単に多数の細胞に短時間のうちにカルシウム指示薬を導入することができる。
マウス脳スライス標本を作成しfluo-3AMを取りこませた後アセチルコリンを投与して刺激した。中井による未発表データー。
カルシウム指示薬
カルシウム指示薬は、主に化学合成された蛍光カルシウム感受性色素を指すが、広義には、Fluo-3などの化学合成された蛍光カルシウム感受性色素以外に、aequorinなどのカルシウム感受性発光タンパク質、cameleonやG-CaMPなどの遺伝子でコードされたカルシウム感受性蛍光タンパク質(genetically encoded calcium indicator; GECI)、今はあまり使われていないarsenaso IIIやantipyrylazo IIIなどの吸光試薬が含まれる。
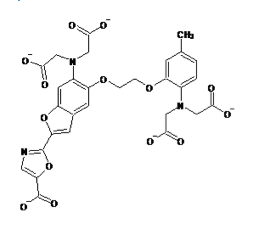
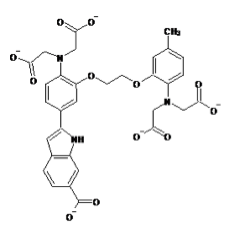
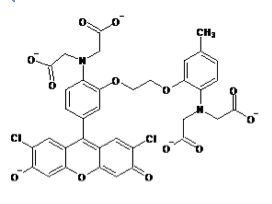
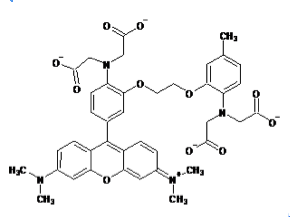
蛍光カルシウム指示薬はノーベル化学賞(2008年)を受賞したRoger Y. Tsienらによってカルシウムキレート剤であるEGTA(ethylene glycol tetraacetic acid)およびその誘導体であるBAPTA(1,2-bis-(o-Aminophenoxy)-ethane-N,N,N',N'-tetraacetic acid)をもとに開発された。quin-2は最も初期に開発された蛍光カルシウム指示薬でEGTAをもとにしている[1]。その後BAPTAをもとにしたfura-2、indo-1、fluo-3、rhod-2などの蛍光カルシウム指示薬が開発された[2] [3]。現在ではカルシウムに対する結合の強さ(カルシウムイオン解離定数)や蛍光特性(蛍光波長など)の異なる多数の指示薬が開発されている。
大きな特徴は、カルシウム指示薬はアセトキシメチル(AM)エステル化することにより細胞膜を通過し細胞内に導入することが可能である点である[4]。これにより簡単に多数の細胞にカルシウム指示薬を導入することができるようになった。
種類
現在主流となっている蛍光カルシウム指示薬はカルボキシレート基(RCOO-)を3つまたは4つ持つ色素である。fura-2、indo-1などのカルシウムイオンの結合により励起波長または蛍光波長がシフトするタイプと、fluo-3、rhod-2などのカルシウムイオンの結合により励起、蛍光波長がほとんどシフトしないタイプがある。
波長がシフトするタイプのカルシウム指示薬では2波長測定により蛍光比を取ることでカルシウム指示薬の濃度の違いや、細胞の厚みの違いによる影響をキャンセルできるため精度の高い測定が可能である。例えば、fura-2はカルシウムの結合により励起波長が大きくシフトする特徴があるので、370nMと340nMの励起波長の光を用いてそれぞれ510nm近辺の蛍光の強度を測定し、370nMで励起した際の蛍光強度を340nMで励起した際の蛍光強度で割った比を取ることがよく行われる(2波長励起1波長測光)。また、indo-1はカルシウムイオンの結合により蛍光波長が大きくシフトする特徴を持っているので、340nMの波長の光で励起し390nMと480nMの波長でそれぞれ蛍光強度を測定し、480nMでの蛍光強度を390nMでの蛍光強度で割った比を取ることがよく行われる(1波長励起2波長測光)。
fluo-3やrhod-2はカルシウムイオンの結合により波長シフトしないタイプであるので極大励起波長で励起して極大蛍光波長で測定し、蛍光強度の変化から相対的なカルシウム濃度の変化の情報を得る(1波長励起1波長測光)。このタイプの指示薬は2波長測定に比べ波長を変えて測定する必要がないため測定が簡単であるが、カルシウム指示薬の濃度の違いや、細胞の厚みの違いによる影響を受けるため測定の精度は落ちる。これらの影響を除くためには他の基準となる色素を同時に細胞に導入して蛍光比を取ることで補正する必要がある。
fura-2、fluo-3が緑色の蛍光を発するのに対してrhod-2は蛍光波長の極大が576nmと赤色蛍光を発すると言う点でユニークである。また、fura-2、indo-1、fluo-3のカルシウムイオンの結合解離定数がそれぞれ224nM、250nM、0.4μMとカルシウムイオンに強く結合するのに対して、rhod-2はカルシウムイオンの結合解離定数は0.7μMでありカルシウムイオンとの結合親和性が低い。そのため1μMを超えるような比較的高濃度のカルシウム濃度の測定に向いている。
波長がシフトするタイプのカルシウム指示薬
カルシウム指示薬 極大励起波長(nm) 極大蛍光波長(nm) 解離定数
Kd(nM) 参考文献
カルシウム有り カルシウム無し カルシウム有り カルシウム無し
fura-2 335 362 510 518 224 2
indo-1 331 349 398 482 250 2
励起・蛍光波長がほとんどシフトしないタイプのカルシウム指示薬 カルシウム指示薬 極大励起波長(nm) 極大蛍光波長(nm) 最大蛍光変化量(倍) 解離定数 Kd(μM) 参考文献 fluo-3 506 526 36-40 0.4 3 rhod-2 553 576 3.4 1.0 3
メカニズム
カルシウム指示薬はカルシウムキレート剤をもとに開発されており、カルシウムイオンを結合するカルシウムキレート部分と、蛍光を発する蛍光団の部分からなっている。カルシウムイオンがカルシウムキレート部分に結合することにより分子内の電子配置が変化しその結果、蛍光団の励起光を吸収する効率(吸光係数Extinction coefficient)や蛍光団が蛍光を出す効率(量子効率quantum efficiency)が影響を受けて、蛍光強度や波長が変化する。
細胞内への導入
AMエステル法: カルシウム指示薬は通常細胞膜を通過しないためそのままの形態で細胞に投与しても細胞内に取り込まれる事はほとんどない。細胞膜透過を可能にするためアセトキシメチル(AM)エステル化する手法が開発されている[4]。AMエステル化されたカルシウム指示薬は、カルシウムイオンと結合するカルボキシレート基がエステル化されているためカルシウムイオンと結合できない。AMエステル化されたカルシウム指示薬を細胞外液に加えると、AMエステル化されたカルシウム指示薬は細胞内に取り込まれた後、細胞が持つエステラーゼによってアセトキシメチル基が加水分解され、本来のカルシウム指示薬となり細胞内で機能する。この方法では加水分解されたカルシウム指示薬は細胞内に留まるため濃縮されることになる。例えば、AMエステル化されたカルシウム指示薬の細胞外液の濃度が1~5μMであっても、加水分解されたカルシウム指示薬の細胞内濃度は100μM以上にもなる。このようにAMエステル法を用いることによりカルシウム指示薬を簡単に多数の細胞に導入することができるようになった。
カルシウム指示薬は主に細胞質のカルシウムイオン濃度を測ることに使われるが、AMエステル化したカルシウム指示薬は細胞質とともに細胞内小器官にも透過して入っていくため小胞体やミトコンドリアなど細胞内小器官のカルシウムイオン濃度を測定する目的で使用されることがある。この場合、細胞質内のカルシウム指示薬との区別をつけるため、例えばパッチピペットによる細胞内還流やサポインで細胞膜に穴を開け細胞質のカルシウム指示薬を洗い流す処理を行う。細胞内小器官のカルシウムイオン濃度測定にはカルシウムイオンとの親和性が低いrhod-2AMやMag-fura-2AMなどが用いられる。
かつてはカルシウム指示薬を生きた動物の脳細胞に取り込ませることが難しかったが、AMエステル化したカルシウム指示薬を高濃度で脳内に投与する方法が開発され、現在では in vivoカルシウムイメージングにも利用されるようになった[5]。
細胞質にカルシウム指示薬を導入する方法として、マイクロインジェクション法、パッチクランプを用いる方法、リポソームを細胞に融合させる方法、電気穿孔法などがある。これらの方法は細胞内のエステラーゼ活性が低い細胞種で利用される。
関連項目
参考文献
- ↑
Tsien, R.Y. (1980).
New calcium indicators and buffers with high selectivity against magnesium and protons: design, synthesis, and properties of prototype structures. Biochemistry, 19(11), 2396-404. [PubMed:6770893] [WorldCat] [DOI] - ↑
Grynkiewicz, G., Poenie, M., & Tsien, R.Y. (1985).
A new generation of Ca2+ indicators with greatly improved fluorescence properties. The Journal of biological chemistry, 260(6), 3440-50. [PubMed:3838314] [WorldCat] - ↑
Minta, A., Kao, J.P., & Tsien, R.Y. (1989).
Fluorescent indicators for cytosolic calcium based on rhodamine and fluorescein chromophores. The Journal of biological chemistry, 264(14), 8171-8. [PubMed:2498308] [WorldCat] - ↑
Tsien, R.Y. (1981).
A non-disruptive technique for loading calcium buffers and indicators into cells. Nature, 290(5806), 527-8. [PubMed:7219539] [WorldCat] [DOI] - ↑
Stosiek, C., Garaschuk, O., Holthoff, K., & Konnerth, A. (2003).
In vivo two-photon calcium imaging of neuronal networks. Proceedings of the National Academy of Sciences of the United States of America, 100(12), 7319-24. [PubMed:12777621] [PMC] [WorldCat] [DOI]