「コーディン」の版間の差分
細編集の要約なし |
細編集の要約なし |
||
| (同じ利用者による、間の13版が非表示) | |||
| 2行目: | 2行目: | ||
<font size="+1">[http://researchmap.jp/read0118148 笹井 紀明]</font><br> | <font size="+1">[http://researchmap.jp/read0118148 笹井 紀明]</font><br> | ||
''奈良先端科学技術大学院大学''<br> | ''奈良先端科学技術大学院大学''<br> | ||
DOI:<selfdoi /> | DOI:<selfdoi /> 原稿受付日:2020年7月18日 原稿完成日:2020年7月29日<br> | ||
担当編集委員:[https://researchmap.jp/ | 担当編集委員:[https://researchmap.jp/hiroshikawasaki 河崎 洋志](金沢大学 医学系 脳神経医学教室)<br> | ||
</div> | </div> | ||
英語名:chordin 独:Chordin 仏:chordine | 英語名:chordin 独:Chordin 仏:chordine | ||
{{box|text= | {{box|text= コーディンは、脊椎動物の発生において形成体(オーガナイザー(organizer)、原口背唇部)に発現し、神経誘導活性を持つ分泌因子である。アフリカツメガエルで単離された後、その相同遺伝子がマウスやヒトなどでも同定され機能解析が行われた。骨形成因子 (BMP)と結合し、その機能を阻害することで機能する。さらに、コーディンに結合してその安定性を制御するたんぱく質の存在も複数知られている。}} | ||
{{infobox protein | {{infobox protein | ||
| 29行目: | 29行目: | ||
}} | }} | ||
== コーディンとは == | == コーディンとは == | ||
1924年、ドイツの生物学者[[wj:ハンス・シュペーマン|ハンス・シュペーマン]]と、[[wj:Hilde Mangold|ヒルデ・マンゴールド]]は、[[wj:イモリ|イモリ]]胚の一部分を別の胚に移植することにより、胚に[[2次軸]]([[脊索]]を含む背側[[中胚葉]])が形成されることを見出し、この部分を「[[形成体]](organizer)」と名付けた<ref>'''Spemann, H., & Mangold, H. (1924)'''<br>Über Induktion von Embryonalanlagen durch Implantation artfremder Organisatoren. Archiv für mikroskopische Anatomie und Entwicklungsmechanik 100, pp. 599–638 [https://bsd.neuroinf.jp/w/images/e/ef/Spemann-Mangold1924_Article_ÜberInduktionVonEmbryonalanlag.pdf PDF]</ref>(英訳 <ref><pubmed>11291841 </pubmed></ref>)。この部分からは[[誘導因子]](移植した組織から分泌され、移植された胚に作用する因子)が分泌されることが予想されたが、その分子実体は長年明らかにされていなかった <ref name=DeRobertis2006><pubmed>16482093</pubmed></ref><ref name=Sander2001><pubmed>11291840</pubmed></ref> 。 | |||
1990年代になって分子生物学的手法、特に遺伝子のクローニング技術が発達したことにより、微小または特定の組織に高い発現量を持つ遺伝子の単離が可能になった。この技術を利用して、カリフォルニア大学・ロサンゼルス校の[[w:Edward M. De Robertis|エドワード・デロバティス]]教授と笹井芳樹博士は、形成体に発現量が蓄積されている遺伝子単離するための[[ディファレンシャルスクリーン]]<ref group=脚注>ディファレンシャルスクリーン:特定の組織で発現する遺伝子を単離する方法の1つ。特定の(発現を期待する)組織と対照となる組織からそれぞれRNAを抽出し、さらにそこから放射性同位元素などでラベルしたcDNAを合成し、これをプローブとしてcDNAライブラリーを用いてスクリーニングを行う。発現を期待する組織で強いシグナルを発出する遺伝子が目的の遺伝子である。chdの単離では、「[[リチウム|塩化リチウム]]で処理されて全体が背側化した胚」と「紫外線照射により全体が腹側化した胚」のそれぞれからcDNAが合成され、cDNAライブラリーとハイブリダイズさせたときに「形成体」のプローブのみで強くハイブリダイズするものが網羅的に探索された。<br> 現在では[[マイクロアレイ]]や[[mRNAシーケンス法]]を用いることが多い。</ref>を行い、強い2次軸誘導活性をもつ遺伝子を単離した。この遺伝子は分泌因子をコードし、4つのシステイン繰り返し領域(cysteine-rich domain; CRD)を持つもので、コーディン (chordin (chd)と名付けられた。 | |||
コーディンを発現する背側中胚葉は、それ自体が体軸を形成する脊索へと分化するほか、それに隣接する未分化外胚葉を神経化する活性を持つ。実際に、カエルの[[アニマルキャップ]](マウスで[[エピブラスト]]に相当する部分)に作用して、細胞を直接(ほかの組織と協働することなく)神経化することが明らかになり、コーディンは[[神経誘導因子]]の1つと考えられた。コーディンとほぼ同時期に単離された[[ノギン]] <ref name=Smith1992><pubmed>1339313</pubmed></ref> 、[[フォリスタチン]]<ref name=Hemmati-Brivanlou1994><pubmed>8168135</pubmed></ref> と合わせ、3つの分泌因子が「神経誘導因子」と呼ばれることになった。 | |||
[[ファイル:Sasai Chordin Fig1.png|サムネイル|'''図1. コーディンの構造と制御'''<br>'''A.''' コーディンとSog、Chordin-likeのドメイン構造。Sog以外は分泌因子で、Sogではカルボキシル末端側が細胞外に存在する。SP; シグナルペプチド、TM; 膜貫通領域、CR; システインリッチリピートを表す。コーディンのCR1, CR3がBMP4と結合する。Chdl1, Chdl2のCR1, CR3がコーディンのCR3に最も相同性が高い。<br>'''B.''' コーディン、BMP4、Tsg、Xldの制御関係。コーディンを曲線で、BMP(これはADMPでもよい)を青色で、Tsgを赤色でそれぞれ示し、Xldがコーディンタンパク質を切断する部位を緑色で示した。Nはアミノ末端、Cはカルボキシル末端を示す。<ref name=DeRobertis2000><pubmed>11252746</pubmed></ref><ref name=Piccolo1997><pubmed>9363949</pubmed></ref> をもとに作成。]] | |||
==構造== | ==構造== | ||
コーディンは1000アミノ酸弱からなる[[wj:分泌蛋白質|分泌蛋白質]]であり、[[wj:シグナルペプチド|シグナルペプチド]]、4つの[[システイン]]リッチリピート(cysteine-rich repeat)を持つ(図1)。電子顕微鏡を用いた解析によれば、ヒトのコーディンタンパク質の3次元構造は、馬蹄形をなす<ref name=Troilo2014><pubmed> 25157165 </pubmed></ref>。 | |||
== 相同体 == | == 相同体 == | ||
===脊椎動物=== | ===脊椎動物=== | ||
コーディンの機能は主に[[アフリカツメガエル]]において研究されているが、その相同遺伝子は[[マウス]]、[[ヒト]]をはじめとするすべての[[脊椎動物]]において存在すると考えられる。 | |||
=== 無脊椎動物 === | |||
[[ショウジョウバエ]]では、[[Short gastrulation]]([[Sog]])が[[wj:細胞性胞胚|細胞性胞胚]] (blastoderm)の時期に胚の腹側に発現し、[[Decapentaplegic]]([[Dpp]])という分泌因子と拮抗して働く <ref name=Biehs1996><pubmed>8918893</pubmed></ref> 。なお、Sogは膜貫通ドメインを持ち、細胞膜にアンカーされる。またSogは細胞外ドメインにコーディン同様のシステインリッチドメインをもつタンパク質をコードし、ショウジョウバエの神経発生を促進する。一方、Dppはそれを抑制する効果があるため、Sog/Dppの関係はコーディン/BMPの関係([[コーディン#作用機構|作用機構]]を参照)に対応している。さらに、ショウジョウバエのSogをコードする[[mRNA]]をカエル胚に注入すると2次軸が形成された <ref name=Holley1995><pubmed>7617035</pubmed></ref> 。これらの事実から、ショウジョウバエSog(腹側に発現する)と脊椎動物のコーディン(背側に発現する)は[[wj:相同遺伝子|相同遺伝子]]であり、[[背腹軸]]が逆転して進化したものと考えられた<ref name=DeRobertis1996><pubmed>8598900</pubmed></ref> 。 | |||
[[Xolloid]]/[[Tolloid]] <ref name=Clark1999><pubmed>10331975</pubmed></ref>や[[Tsg]]の相同遺伝子である[[Tolloid]]や[[Twisted Gastrulation]]もショウジョウバエに存在し、脊椎動物のコーディンやBMPと同様にSogやDppと相互作用する <ref name=Yu2000><pubmed>10769238</pubmed></ref> 。 | |||
=== | === 類似遺伝子 === | ||
コーディンと類似したタンパク質をコードする遺伝子として、[[Chordin-like1]]([[CHRDL1]]; [[Ventroptin]])<ref name=Sakuta2001><pubmed>11441185</pubmed></ref> と[[Chordin-like2]]([[CHRDL2]])が単離された<ref name=Nakayama2004><pubmed>14660436</pubmed></ref> 。これらはコーディンに比べていずれも450アミノ酸程度と短いが、3つのシステインリッチリピート(cysteine-rich repeat)を含む領域を持つという意味でコーディンと構造的に類似し'''(図1)'''、いずれもBMPの[[アンタゴニスト]]として働く <ref name=Nakayama2004><pubmed>14660436</pubmed></ref><ref name=Sakuta2001><pubmed>11441185</pubmed></ref> 。 | |||
CHRDL1は[[ニワトリ]]胚では[[網膜]]の腹側に発現し、[[角膜]]から脳への[[視神経]]の投射に影響を及ぼすことが報告されている <ref name=Sakuta2001><pubmed>11441185</pubmed></ref> 。Chrdl1の[[モルフォリノ|モルフォリノアンチセンスオリゴヌクレオチド]]を注入したカエル胚では、角膜の巨大化(megalocornea)の表現型が見られ、ヒトでも同様の症状が報告されている<ref name=Pfirrmann2015><pubmed>25712132</pubmed></ref> 。 | |||
Chrdl2は[[wj:軟骨細胞|軟骨細胞]]、[[wj:生殖器官|生殖器官]]の[[wj:結合組織|結合組織]]での発現がみられている <ref name=Nakayama2004><pubmed>14660436</pubmed></ref> 。 | |||
==発現== | ==発現== | ||
アフリカツメガエルにおいては、[[wj:原腸形成期|原腸形成期]]に[[オーガナイザー|原口背唇部]](形成体)に発現が開始する。原腸形成後は、頭部中胚葉領域(プレコーダルプレート; prechordal plate)、[[脊索]](notochord)を含む背側中胚葉領域に発現し、その後、[[尾芽]](tailbud)に限局するようになる<ref name=sasai1994><pubmed>8001117</pubmed></ref>。 | |||
マウスやニワトリでは、同じく原腸形成期から[[原始原条]](anterior primitive streak)、[[結節]] (node)や[[軸中内胚葉]](axial mesendoderm)に<ref name= Streit1998><pubmed> 9425145 </pubmed></ref><ref name=Bachiller2000 />、またマウスの発生後期では、[[wj:大腿骨|大腿骨]]、[[wj:肋骨|肋骨]]、[[wj:椎骨|椎骨]]などの骨格系に発現が見られる<ref name=Scott2000><pubmed> 10767089</pubmed></ref>。 | |||
生後は、脳領域では[[海馬]]や[[小脳]]に発現が見られる<ref name=Scott2000 />ほか、[https://www.ncbi.nlm.nih.gov/gene?Db=gene&Cmd=DetailsSearch&Term=8646 NCBIのデータベース]によると、ヒトでは脳や[[腎臓]]などにRNAレベルで高発現が見られる。 | |||
==作用機構== | ==作用機構== | ||
[[ファイル:Sasai Chordin Fig2.png|サムネイル|'''図2. コーディン/BMPによる表皮・神経の遺伝子の誘導'''<br><ref name=Holley1995><pubmed>7617035</pubmed></ref><ref name=Nakayama2004><pubmed>14660436</pubmed></ref><ref name=Larrain2000><pubmed>10648240</pubmed></ref>をもとに作成。]] | |||
コーディンは[[TGFβ]]スーパーファミリーの1つである[[BMP4]]と拮抗することで機能する <ref name=Sasai1995><pubmed>7630399</pubmed></ref> 。生化学的には、コーディンとBMP4は1:2のモル比で直接結合し <ref name=Larrain2000><pubmed>10648240</pubmed></ref> 、BMP4が[[BMP受容体]]に結合するのを阻害する。コーディンとBMP4の解離定数は0.3 nmol程度と、強固な結合である <ref name=Piccolo1996><pubmed>8752213</pubmed></ref> 。なお、コーディンに直接結合する細胞膜受容体は報告されていない。 | |||
発生過程において、BMPシグナルはSmadシグナルを活性化して表皮のマーカーである[[Foxi1]] <ref name=Matsuo-Takasaki2005><pubmed>16079156</pubmed></ref> 、[[Grainyhead-like-1]]([[Grhl1]]) <ref name=Tao2005><pubmed>15705857</pubmed></ref> などの転写因子を誘導し、未分化外胚葉を表皮化する。一方、BMPシグナルが遮断されると[[Zic1]], [[Sox2]] <ref name=Mizuseki1998><pubmed>9435279</pubmed></ref> や[[XlPOU2]] <ref name=Matsuo-Takasaki1999><pubmed>10559482</pubmed></ref> などの、神経系特異的な[[転写因子]]の発現が誘導され、未分化外胚葉が神経化し、背側外胚葉領域に[[神経板]]が形成される。 | |||
「BMPシグナルを遮断する」ことがどのように神経化の遺伝子発現を誘導するのかは明らかではないが、おそらくBMPシグナルによって発現誘導される表皮化遺伝子が神経化遺伝子の発現を抑制しており、コーディンによってBMPシグナルがブロックされ、ZicやXlPOU2の遺伝子が発現するのだろうと考えられている <ref name=Lee2014><pubmed>25234468</pubmed></ref>('''図2''') 。 | |||
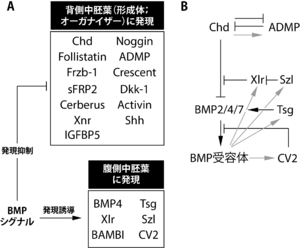
[[ファイル:Sasai Chordin Fig3.png|サムネイル|'''図3. コーディンに結合する、またはコーディンによって転写制御をうける因子群'''<br>'''A.''' 背側中胚葉(多くは原口背唇部)と腹側中胚葉に発現する遺伝子群。<br>'''B.''' それらの間に存在する制御関係。黒色の矢印はタンパク質間の相互作用を、灰色の矢印は転写制御を示す。<ref name=DeRobertis2004><pubmed>15473842</pubmed></ref><ref name=Ambrosio2008><pubmed>18694564</pubmed></ref><ref name=Plouhinec2009><pubmed>20066084</pubmed></ref> をもとに作成。]] | |||
==活性調節== | ==活性調節== | ||
コーディンを発現する形成体の大きさ、また形成体によって誘導される神経板は、体全体と比較して特定の大きさでなければならないため、コーディン遺伝子やそのタンパク質の発現量や活性は厳密に制御される。この制御を行うための因子(コーディンタンパク質を分解するものや修飾するもの)の存在が知られている。現在までに知られている制御因子の一部を'''図3'''に示した。 | |||
=== Xolloid === | === Xolloid === | ||
たとえばXolloid([[BMP1]])とその近縁遺伝子[[Xolloid-related]]([[xlr]])と呼ばれる[[メタロプロテアーゼ]]は腹側に発現し、コーディンタンパク質を分解する活性を持つ <ref name=Dale2002><pubmed>12464431</pubmed></ref><ref name=Piccolo1997><pubmed>9363949</pubmed></ref> 。この結果BMPタンパク質が解放され、BMPシグナル活性を維持する。これは、形成体が肥大化しないように調節しているメカニズムの1つである<ref name=DeRobertis2001><pubmed>11291846</pubmed></ref> 。 | |||
=== Twisted Gastrulation === | === Twisted Gastrulation === | ||
[[Twisted Gastrulation]](Tsg)と呼ばれる分泌タンパク質がBMP4と結合してTsg-BMP-コーディンの複合体を形成してBMP活性を抑制することにより、結果としてコーディンの活性を保護している <ref name=Chang2001><pubmed>11260717</pubmed></ref><ref name=DeRobertis2000><pubmed>11252746</pubmed></ref> 。ただ一方で、TsgがBMPシグナルを保護するという報告もある<ref name=Xie2005><pubmed>15604098</pubmed></ref> 。この齟齬は実験系(強制発現系による生化学的な解析と変異体解析の違い、種の違いなど)によるものと考えられる。 | |||
=== Sizzled === | === Sizzled === | ||
[[Sizzled]]([[szl]])は[[Wnt]]の受容体[[Frizzled]]の細胞外ドメインのみを持つ[[sFRP]]タイプ分泌性因子をコードするが <ref name=Lee2006><pubmed>16413488</pubmed></ref> 、これ自体は[[Wnt8]]の阻害因子としては働かず <ref name=Collavin2003><pubmed>12506010</pubmed></ref> 、Xolloidを分解して活性を阻害することにより、結果的にコーディンの活性を維持する <ref name=Lee2006><pubmed>16413488</pubmed></ref><ref name=Muraoka2006><pubmed>16518392</pubmed></ref> 。 | |||
== 生理機能 == | == 生理機能 == | ||
=== | === 未分化外胚葉細胞の神経化=== | ||
未分化外胚葉細胞の予定運命は、表皮か神経のいずれかである。このうち表皮の運命はBMPシグナルの活性化によってもたらされる。(たとえば、[[ドミナントネガティブ]]BMP受容体(dnBMPR)をカエル胚に発現させることにより、細胞を神経化することができる)<ref name=Suzuki1994><pubmed>7937936</pubmed></ref><ref name=Xu1995><pubmed>7612010</pubmed></ref> 。 | |||
コーディンが発現する原口背唇部を含む一部を胚から切り出して胚を発生させると、腹側胚は細胞塊を形成するのに対し、背側胚は、腹側を含む完全胚になる。これは、背側中胚葉に腹側中胚葉を誘導する活性が存在することを意味する。コーディンは[[ADMP]]というTGFβタイプの分泌因子の発現を誘導する。ADMPはコーディンと同じく背側中胚葉に発現するにもかかわらず、それ自体は[[ALK-2]]受容体に結合してBMPシグナルを刺激([[Smad1]]をリン酸化)し、中胚葉を腹側化する活性を持つ。また、ADMPはBMPと同様にコーディンと結合し、コーディンの活性を阻害する。このように、主に[[ネガティブフィードバック]]の様式により、コーディンを含む背側中胚葉が、胚全体の形成を制御することが示された。さらに、[[オルファクトメディンタイプ]] <ref name=Anholt2014><pubmed>25364714</pubmed></ref> の分泌因子[[ONT-1]]がコーディン、[[Xlr]]と複合体を形成してコーディンの分解を促し、背側中胚葉の大きさを制御する(肥大化しないようにする)ことが明らかになった <ref name=Inomata2008><pubmed>18775317</pubmed></ref> 。 | |||
ほかにも、[[BAMBI]]([[BMP And Activin Membrane Bound Inhibitor]])<ref name=Chen2007><pubmed>17661381</pubmed></ref> <ref name=Onichtchouk1999><pubmed>10519551</pubmed></ref> や[[CV2]]([[Crossveinless-2]])<ref name=Ikeya2006><pubmed>17035289</pubmed></ref> <ref name=Ambrosio2008><pubmed>18694564</pubmed></ref> などのようにコーディンに結合する因子が単離され、機能解析が行われている。このように、コーディンの活性を阻害するものと保護するものがコーディンと結合、あるいは転写レベルで発現して制御関係を形成することにより、背側中胚葉(特に形成体)の大きさを決定している<ref name=Plouhinec2009><pubmed>20066084</pubmed></ref> 。 | |||
また、コーディン、ノギン、フォリスタチンの3つの因子を同時に発現阻害した胚においては、神経誘導はもちろんのこと、背側組織の発生が大きく阻害された <ref name=Khokha2005><pubmed>15737935</pubmed></ref> 。 | |||
===遺伝子操作動物を用いた機能解析=== | ===遺伝子操作動物を用いた機能解析=== | ||
哺乳類におけるコーディンの役割については、特にマウスにおける遺伝子操作動物を用いた機能解析の報告が存在する <ref name=Bachiller2000><pubmed>10688202</pubmed></ref> 。 | |||
==== コーディンのノックアウトマウス ==== | |||
コーディン単独のノックアウトマウスは、[[耳胞]]の発達や[[下顎]]形成に影響が及ぶもののその表現型はマウスの系統依存的であり、いずれも生存は可能である <ref name=Bachiller2000><pubmed>10688202</pubmed></ref><ref name=Choi2009><pubmed>19247433</pubmed></ref> 。したがって、神経発生に関しては他の遺伝子(特にノギン)によって相補されることが示唆された。そこで、コーディンとノギンのダブルノックアウトマウスを作成して解析したところ、[[前方臓側内胚葉]] ([[anterior visceral endoderm]]; [[AVE]])自体の形成には異常はみられなかったが、頭部神経領域を含む頭部構造の形成が著しく阻害されることが明らかになった。このことは、(1) AVEによる頭部の発生は結節(ノード)の存在に依存していること、(2) 体幹部の発生自体はコーディンの存在には依存しないこと、を意味する。 | |||
マウスでは頭部と体幹部の発生は別の細胞集団によって制御される。頭部の発生はAVE<ref name=Stower2014><pubmed>25349454</pubmed></ref> によって誘導される一方、体幹部は結節(ノード)と原条 ([[anterior primitive streak]], APS)によって別々に誘導される。コーディン(と、それと同様の機能を持つノギン)は原条には発現するがAVEには発現しないため、AVEの発生が結節に依存するのか、独立に発生するのかは議論があった。このノックアウトマウスの解析により、AVEの機能(頭部神経を誘導する機能)が結節に依存することが明らかになった。 | |||
==== | ==== コーディン関連因子のノックアウトマウス ==== | ||
コーディンに関連する因子は、カエルでは原腸形成期や神経発生での機能がクローズアップされているが、それらの相同遺伝子の遺伝子変異マウスの表現型は、必ずしも神経発生における機能を反映していない。これは、カエルの原口背唇部と、マウスの原条・AVEの機能の違いや、相同遺伝子の重複(冗長性の獲得)・収斂などが原因として考えられる。一部の遺伝子のノックアウトの表現型を以下に記した。主に中胚葉由来の組織で、個体の形態形成に異常を生じるものが多い。 | |||
===== Tsg ===== | |||
コーディンと相互作用するタンパク質をコードする遺伝子のうち、Tsgのノックアウトマウスは出生時に死亡し、頭部形成不全、骨化不全、骨格異常など、全身性の表現型を呈する。一部のノックアウト個体は生存するが、成長不全である <ref name=Petryk2004><pubmed>15013800</pubmed></ref><ref name=Zakin2004><pubmed>14681194</pubmed></ref> 。 | |||
==== | ===== Tolloid ===== | ||
Tolloid-like-1(Tll1)のノックアウトマウスは[[心臓]]の中隔形成に異常をきたし、胚性致死となる<ref name=Clark1999><pubmed>10331975</pubmed></ref><ref name=Ge2006><pubmed>16622848</pubmed></ref> 。 | |||
===== sFRP ===== | |||
カエルや[[魚類]]のSzlに最も近いマウスの遺伝子は[[sFRP]]([[sFRP1]]-[[sFRP6|6]])と呼ばれる[[Secreted frizzled-related protein]]だが、これら6種類の遺伝子の中にszlと活性(Tsg/BMP1の活性を阻害する)がまったく同じものはない <ref name=Bijakowski2012><pubmed>22825851</pubmed></ref> 。最も構造的に近い[[sFRP2]]の単独の遺伝子変異では表現型がみられないが、sFRP1とのダブルノックアウトにより、未分節中胚葉(presomatic mesoderm)の[[細胞移動]]が起こらなくなり、胚の[[前後軸]]に沿った伸長が抑制される <ref name=Satoh2006><pubmed>16467359</pubmed></ref> 。 | |||
== | ==疾患との関連== | ||
2020年現在、ヒトにおいてコーディン遺伝子単独の変異によって引き起こされる遺伝性疾患は報告されていない。 | |||
==脚注== | ==脚注== | ||
2020年7月29日 (水) 14:18時点における最新版
笹井 紀明
奈良先端科学技術大学院大学
DOI:10.14931/bsd.9269 原稿受付日:2020年7月18日 原稿完成日:2020年7月29日
担当編集委員:河崎 洋志(金沢大学 医学系 脳神経医学教室)
英語名:chordin 独:Chordin 仏:chordine
コーディンは、脊椎動物の発生において形成体(オーガナイザー(organizer)、原口背唇部)に発現し、神経誘導活性を持つ分泌因子である。アフリカツメガエルで単離された後、その相同遺伝子がマウスやヒトなどでも同定され機能解析が行われた。骨形成因子 (BMP)と結合し、その機能を阻害することで機能する。さらに、コーディンに結合してその安定性を制御するたんぱく質の存在も複数知られている。
| chordin | |
|---|---|
| Identifiers | |
| Symbol | CHRD |
| Entrez | 8646 |
| HUGO | 1949 |
| OMIM | 603475 |
| RefSeq | NM_003741 |
| UniProt | Q9H2X0 |
| Other data | |
| Locus | Chr. 3 q27 |
コーディンとは
1924年、ドイツの生物学者ハンス・シュペーマンと、ヒルデ・マンゴールドは、イモリ胚の一部分を別の胚に移植することにより、胚に2次軸(脊索を含む背側中胚葉)が形成されることを見出し、この部分を「形成体(organizer)」と名付けた[1](英訳 [2])。この部分からは誘導因子(移植した組織から分泌され、移植された胚に作用する因子)が分泌されることが予想されたが、その分子実体は長年明らかにされていなかった [3][4] 。
1990年代になって分子生物学的手法、特に遺伝子のクローニング技術が発達したことにより、微小または特定の組織に高い発現量を持つ遺伝子の単離が可能になった。この技術を利用して、カリフォルニア大学・ロサンゼルス校のエドワード・デロバティス教授と笹井芳樹博士は、形成体に発現量が蓄積されている遺伝子単離するためのディファレンシャルスクリーン[脚注 1]を行い、強い2次軸誘導活性をもつ遺伝子を単離した。この遺伝子は分泌因子をコードし、4つのシステイン繰り返し領域(cysteine-rich domain; CRD)を持つもので、コーディン (chordin (chd)と名付けられた。
コーディンを発現する背側中胚葉は、それ自体が体軸を形成する脊索へと分化するほか、それに隣接する未分化外胚葉を神経化する活性を持つ。実際に、カエルのアニマルキャップ(マウスでエピブラストに相当する部分)に作用して、細胞を直接(ほかの組織と協働することなく)神経化することが明らかになり、コーディンは神経誘導因子の1つと考えられた。コーディンとほぼ同時期に単離されたノギン [5] 、フォリスタチン[6] と合わせ、3つの分泌因子が「神経誘導因子」と呼ばれることになった。

A. コーディンとSog、Chordin-likeのドメイン構造。Sog以外は分泌因子で、Sogではカルボキシル末端側が細胞外に存在する。SP; シグナルペプチド、TM; 膜貫通領域、CR; システインリッチリピートを表す。コーディンのCR1, CR3がBMP4と結合する。Chdl1, Chdl2のCR1, CR3がコーディンのCR3に最も相同性が高い。
B. コーディン、BMP4、Tsg、Xldの制御関係。コーディンを曲線で、BMP(これはADMPでもよい)を青色で、Tsgを赤色でそれぞれ示し、Xldがコーディンタンパク質を切断する部位を緑色で示した。Nはアミノ末端、Cはカルボキシル末端を示す。[7][8] をもとに作成。
構造
コーディンは1000アミノ酸弱からなる分泌蛋白質であり、シグナルペプチド、4つのシステインリッチリピート(cysteine-rich repeat)を持つ(図1)。電子顕微鏡を用いた解析によれば、ヒトのコーディンタンパク質の3次元構造は、馬蹄形をなす[9]。
相同体
脊椎動物
コーディンの機能は主にアフリカツメガエルにおいて研究されているが、その相同遺伝子はマウス、ヒトをはじめとするすべての脊椎動物において存在すると考えられる。
無脊椎動物
ショウジョウバエでは、Short gastrulation(Sog)が細胞性胞胚 (blastoderm)の時期に胚の腹側に発現し、Decapentaplegic(Dpp)という分泌因子と拮抗して働く [10] 。なお、Sogは膜貫通ドメインを持ち、細胞膜にアンカーされる。またSogは細胞外ドメインにコーディン同様のシステインリッチドメインをもつタンパク質をコードし、ショウジョウバエの神経発生を促進する。一方、Dppはそれを抑制する効果があるため、Sog/Dppの関係はコーディン/BMPの関係(作用機構を参照)に対応している。さらに、ショウジョウバエのSogをコードするmRNAをカエル胚に注入すると2次軸が形成された [11] 。これらの事実から、ショウジョウバエSog(腹側に発現する)と脊椎動物のコーディン(背側に発現する)は相同遺伝子であり、背腹軸が逆転して進化したものと考えられた[12] 。
Xolloid/Tolloid [13]やTsgの相同遺伝子であるTolloidやTwisted Gastrulationもショウジョウバエに存在し、脊椎動物のコーディンやBMPと同様にSogやDppと相互作用する [14] 。
類似遺伝子
コーディンと類似したタンパク質をコードする遺伝子として、Chordin-like1(CHRDL1; Ventroptin)[15] とChordin-like2(CHRDL2)が単離された[16] 。これらはコーディンに比べていずれも450アミノ酸程度と短いが、3つのシステインリッチリピート(cysteine-rich repeat)を含む領域を持つという意味でコーディンと構造的に類似し(図1)、いずれもBMPのアンタゴニストとして働く [16][15] 。
CHRDL1はニワトリ胚では網膜の腹側に発現し、角膜から脳への視神経の投射に影響を及ぼすことが報告されている [15] 。Chrdl1のモルフォリノアンチセンスオリゴヌクレオチドを注入したカエル胚では、角膜の巨大化(megalocornea)の表現型が見られ、ヒトでも同様の症状が報告されている[17] 。
Chrdl2は軟骨細胞、生殖器官の結合組織での発現がみられている [16] 。
発現
アフリカツメガエルにおいては、原腸形成期に原口背唇部(形成体)に発現が開始する。原腸形成後は、頭部中胚葉領域(プレコーダルプレート; prechordal plate)、脊索(notochord)を含む背側中胚葉領域に発現し、その後、尾芽(tailbud)に限局するようになる[18]。
マウスやニワトリでは、同じく原腸形成期から原始原条(anterior primitive streak)、結節 (node)や軸中内胚葉(axial mesendoderm)に[19][20]、またマウスの発生後期では、大腿骨、肋骨、椎骨などの骨格系に発現が見られる[21]。
生後は、脳領域では海馬や小脳に発現が見られる[21]ほか、NCBIのデータベースによると、ヒトでは脳や腎臓などにRNAレベルで高発現が見られる。
作用機構
コーディンはTGFβスーパーファミリーの1つであるBMP4と拮抗することで機能する [23] 。生化学的には、コーディンとBMP4は1:2のモル比で直接結合し [22] 、BMP4がBMP受容体に結合するのを阻害する。コーディンとBMP4の解離定数は0.3 nmol程度と、強固な結合である [24] 。なお、コーディンに直接結合する細胞膜受容体は報告されていない。
発生過程において、BMPシグナルはSmadシグナルを活性化して表皮のマーカーであるFoxi1 [25] 、Grainyhead-like-1(Grhl1) [26] などの転写因子を誘導し、未分化外胚葉を表皮化する。一方、BMPシグナルが遮断されるとZic1, Sox2 [27] やXlPOU2 [28] などの、神経系特異的な転写因子の発現が誘導され、未分化外胚葉が神経化し、背側外胚葉領域に神経板が形成される。
「BMPシグナルを遮断する」ことがどのように神経化の遺伝子発現を誘導するのかは明らかではないが、おそらくBMPシグナルによって発現誘導される表皮化遺伝子が神経化遺伝子の発現を抑制しており、コーディンによってBMPシグナルがブロックされ、ZicやXlPOU2の遺伝子が発現するのだろうと考えられている [29](図2) 。
活性調節
コーディンを発現する形成体の大きさ、また形成体によって誘導される神経板は、体全体と比較して特定の大きさでなければならないため、コーディン遺伝子やそのタンパク質の発現量や活性は厳密に制御される。この制御を行うための因子(コーディンタンパク質を分解するものや修飾するもの)の存在が知られている。現在までに知られている制御因子の一部を図3に示した。
Xolloid
たとえばXolloid(BMP1)とその近縁遺伝子Xolloid-related(xlr)と呼ばれるメタロプロテアーゼは腹側に発現し、コーディンタンパク質を分解する活性を持つ [33][8] 。この結果BMPタンパク質が解放され、BMPシグナル活性を維持する。これは、形成体が肥大化しないように調節しているメカニズムの1つである[34] 。
Twisted Gastrulation
Twisted Gastrulation(Tsg)と呼ばれる分泌タンパク質がBMP4と結合してTsg-BMP-コーディンの複合体を形成してBMP活性を抑制することにより、結果としてコーディンの活性を保護している [35][7] 。ただ一方で、TsgがBMPシグナルを保護するという報告もある[36] 。この齟齬は実験系(強制発現系による生化学的な解析と変異体解析の違い、種の違いなど)によるものと考えられる。
Sizzled
Sizzled(szl)はWntの受容体Frizzledの細胞外ドメインのみを持つsFRPタイプ分泌性因子をコードするが [37] 、これ自体はWnt8の阻害因子としては働かず [38] 、Xolloidを分解して活性を阻害することにより、結果的にコーディンの活性を維持する [37][39] 。
生理機能
未分化外胚葉細胞の神経化
未分化外胚葉細胞の予定運命は、表皮か神経のいずれかである。このうち表皮の運命はBMPシグナルの活性化によってもたらされる。(たとえば、ドミナントネガティブBMP受容体(dnBMPR)をカエル胚に発現させることにより、細胞を神経化することができる)[40][41] 。
コーディンが発現する原口背唇部を含む一部を胚から切り出して胚を発生させると、腹側胚は細胞塊を形成するのに対し、背側胚は、腹側を含む完全胚になる。これは、背側中胚葉に腹側中胚葉を誘導する活性が存在することを意味する。コーディンはADMPというTGFβタイプの分泌因子の発現を誘導する。ADMPはコーディンと同じく背側中胚葉に発現するにもかかわらず、それ自体はALK-2受容体に結合してBMPシグナルを刺激(Smad1をリン酸化)し、中胚葉を腹側化する活性を持つ。また、ADMPはBMPと同様にコーディンと結合し、コーディンの活性を阻害する。このように、主にネガティブフィードバックの様式により、コーディンを含む背側中胚葉が、胚全体の形成を制御することが示された。さらに、オルファクトメディンタイプ [42] の分泌因子ONT-1がコーディン、Xlrと複合体を形成してコーディンの分解を促し、背側中胚葉の大きさを制御する(肥大化しないようにする)ことが明らかになった [43] 。
ほかにも、BAMBI(BMP And Activin Membrane Bound Inhibitor)[44] [45] やCV2(Crossveinless-2)[46] [31] などのようにコーディンに結合する因子が単離され、機能解析が行われている。このように、コーディンの活性を阻害するものと保護するものがコーディンと結合、あるいは転写レベルで発現して制御関係を形成することにより、背側中胚葉(特に形成体)の大きさを決定している[32] 。
また、コーディン、ノギン、フォリスタチンの3つの因子を同時に発現阻害した胚においては、神経誘導はもちろんのこと、背側組織の発生が大きく阻害された [47] 。
遺伝子操作動物を用いた機能解析
哺乳類におけるコーディンの役割については、特にマウスにおける遺伝子操作動物を用いた機能解析の報告が存在する [20] 。
コーディンのノックアウトマウス
コーディン単独のノックアウトマウスは、耳胞の発達や下顎形成に影響が及ぶもののその表現型はマウスの系統依存的であり、いずれも生存は可能である [20][48] 。したがって、神経発生に関しては他の遺伝子(特にノギン)によって相補されることが示唆された。そこで、コーディンとノギンのダブルノックアウトマウスを作成して解析したところ、前方臓側内胚葉 (anterior visceral endoderm; AVE)自体の形成には異常はみられなかったが、頭部神経領域を含む頭部構造の形成が著しく阻害されることが明らかになった。このことは、(1) AVEによる頭部の発生は結節(ノード)の存在に依存していること、(2) 体幹部の発生自体はコーディンの存在には依存しないこと、を意味する。
マウスでは頭部と体幹部の発生は別の細胞集団によって制御される。頭部の発生はAVE[49] によって誘導される一方、体幹部は結節(ノード)と原条 (anterior primitive streak, APS)によって別々に誘導される。コーディン(と、それと同様の機能を持つノギン)は原条には発現するがAVEには発現しないため、AVEの発生が結節に依存するのか、独立に発生するのかは議論があった。このノックアウトマウスの解析により、AVEの機能(頭部神経を誘導する機能)が結節に依存することが明らかになった。
コーディン関連因子のノックアウトマウス
コーディンに関連する因子は、カエルでは原腸形成期や神経発生での機能がクローズアップされているが、それらの相同遺伝子の遺伝子変異マウスの表現型は、必ずしも神経発生における機能を反映していない。これは、カエルの原口背唇部と、マウスの原条・AVEの機能の違いや、相同遺伝子の重複(冗長性の獲得)・収斂などが原因として考えられる。一部の遺伝子のノックアウトの表現型を以下に記した。主に中胚葉由来の組織で、個体の形態形成に異常を生じるものが多い。
Tsg
コーディンと相互作用するタンパク質をコードする遺伝子のうち、Tsgのノックアウトマウスは出生時に死亡し、頭部形成不全、骨化不全、骨格異常など、全身性の表現型を呈する。一部のノックアウト個体は生存するが、成長不全である [50][51] 。
Tolloid
Tolloid-like-1(Tll1)のノックアウトマウスは心臓の中隔形成に異常をきたし、胚性致死となる[13][52] 。
sFRP
カエルや魚類のSzlに最も近いマウスの遺伝子はsFRP(sFRP1-6)と呼ばれるSecreted frizzled-related proteinだが、これら6種類の遺伝子の中にszlと活性(Tsg/BMP1の活性を阻害する)がまったく同じものはない [53] 。最も構造的に近いsFRP2の単独の遺伝子変異では表現型がみられないが、sFRP1とのダブルノックアウトにより、未分節中胚葉(presomatic mesoderm)の細胞移動が起こらなくなり、胚の前後軸に沿った伸長が抑制される [54] 。
疾患との関連
2020年現在、ヒトにおいてコーディン遺伝子単独の変異によって引き起こされる遺伝性疾患は報告されていない。
脚注
- ↑ ディファレンシャルスクリーン:特定の組織で発現する遺伝子を単離する方法の1つ。特定の(発現を期待する)組織と対照となる組織からそれぞれRNAを抽出し、さらにそこから放射性同位元素などでラベルしたcDNAを合成し、これをプローブとしてcDNAライブラリーを用いてスクリーニングを行う。発現を期待する組織で強いシグナルを発出する遺伝子が目的の遺伝子である。chdの単離では、「塩化リチウムで処理されて全体が背側化した胚」と「紫外線照射により全体が腹側化した胚」のそれぞれからcDNAが合成され、cDNAライブラリーとハイブリダイズさせたときに「形成体」のプローブのみで強くハイブリダイズするものが網羅的に探索された。
現在ではマイクロアレイやmRNAシーケンス法を用いることが多い。
関連項目
参考文献
- ↑ Spemann, H., & Mangold, H. (1924)
Über Induktion von Embryonalanlagen durch Implantation artfremder Organisatoren. Archiv für mikroskopische Anatomie und Entwicklungsmechanik 100, pp. 599–638 PDF - ↑
Spemann, H., & Mangold, H. (2001).
Induction of embryonic primordia by implantation of organizers from a different species. 1923. The International journal of developmental biology, 45(1), 13-38. [PubMed:11291841] [WorldCat] - ↑
De Robertis, E.M. (2006).
Spemann's organizer and self-regulation in amphibian embryos. Nature reviews. Molecular cell biology, 7(4), 296-302. [PubMed:16482093] [PMC] [WorldCat] [DOI] - ↑
Sander, K., & Faessler, P.E. (2001).
Introducing the Spemann-Mangold organizer: experiments and insights that generated a key concept in developmental biology. The International journal of developmental biology, 45(1), 1-11. [PubMed:11291840] [WorldCat] - ↑
Smith, W.C., & Harland, R.M. (1992).
Expression cloning of noggin, a new dorsalizing factor localized to the Spemann organizer in Xenopus embryos. Cell, 70(5), 829-40. [PubMed:1339313] [WorldCat] [DOI] - ↑
Hemmati-Brivanlou, A., Kelly, O.G., & Melton, D.A. (1994).
Follistatin, an antagonist of activin, is expressed in the Spemann organizer and displays direct neuralizing activity. Cell, 77(2), 283-95. [PubMed:8168135] [WorldCat] [DOI] - ↑ 7.0 7.1
De Robertis, E.M., Larraín, J., Oelgeschläger, M., & Wessely, O. (2000).
The establishment of Spemann's organizer and patterning of the vertebrate embryo. Nature reviews. Genetics, 1(3), 171-81. [PubMed:11252746] [PMC] [WorldCat] [DOI] - ↑ 8.0 8.1
Piccolo, S., Agius, E., Lu, B., Goodman, S., Dale, L., & De Robertis, E.M. (1997).
Cleavage of Chordin by Xolloid metalloprotease suggests a role for proteolytic processing in the regulation of Spemann organizer activity. Cell, 91(3), 407-16. [PubMed:9363949] [PMC] [WorldCat] [DOI] - ↑
Troilo, H., Zuk, A.V., Tunnicliffe, R.B., Wohl, A.P., Berry, R., Collins, R.F., ..., & Baldock, C. (2014).
Nanoscale structure of the BMP antagonist chordin supports cooperative BMP binding. Proceedings of the National Academy of Sciences of the United States of America, 111(36), 13063-8. [PubMed:25157165] [PMC] [WorldCat] [DOI] - ↑
Biehs, B., François, V., & Bier, E. (1996).
The Drosophila short gastrulation gene prevents Dpp from autoactivating and suppressing neurogenesis in the neuroectoderm. Genes & development, 10(22), 2922-34. [PubMed:8918893] [WorldCat] [DOI] - ↑ 11.0 11.1
Holley, S.A., Jackson, P.D., Sasai, Y., Lu, B., De Robertis, E.M., Hoffmann, F.M., & Ferguson, E.L. (1995).
A conserved system for dorsal-ventral patterning in insects and vertebrates involving sog and chordin. Nature, 376(6537), 249-53. [PubMed:7617035] [WorldCat] [DOI] - ↑
De Robertis, E.M., & Sasai, Y. (1996).
A common plan for dorsoventral patterning in Bilateria. Nature, 380(6569), 37-40. [PubMed:8598900] [WorldCat] [DOI] - ↑ 13.0 13.1
Clark, T.G., Conway, S.J., Scott, I.C., Labosky, P.A., Winnier, G., Bundy, J., ..., & Greenspan, D.S. (1999).
The mammalian Tolloid-like 1 gene, Tll1, is necessary for normal septation and positioning of the heart. Development (Cambridge, England), 126(12), 2631-42. [PubMed:10331975] [WorldCat] - ↑
Yu, K., Srinivasan, S., Shimmi, O., Biehs, B., Rashka, K.E., Kimelman, D., ..., & Bier, E. (2000).
Processing of the Drosophila Sog protein creates a novel BMP inhibitory activity. Development (Cambridge, England), 127(10), 2143-54. [PubMed:10769238] [WorldCat] - ↑ 15.0 15.1 15.2
Sakuta, H., Suzuki, R., Takahashi, H., Kato, A., Shintani, T., Iemura Si, ..., & Noda, M. (2001).
Ventroptin: a BMP-4 antagonist expressed in a double-gradient pattern in the retina. Science (New York, N.Y.), 293(5527), 111-5. [PubMed:11441185] [WorldCat] [DOI] - ↑ 16.0 16.1 16.2 16.3
Nakayama, N., Han, C.Y., Cam, L., Lee, J.I., Pretorius, J., Fisher, S., ..., & Zhang, K. (2004).
A novel chordin-like BMP inhibitor, CHL2, expressed preferentially in chondrocytes of developing cartilage and osteoarthritic joint cartilage. Development (Cambridge, England), 131(1), 229-40. [PubMed:14660436] [WorldCat] [DOI] - ↑
Pfirrmann, T., Emmerich, D., Ruokonen, P., Quandt, D., Buchen, R., Fischer-Zirnsak, B., ..., & Villavicencio-Lorini, P. (2015).
Molecular mechanism of CHRDL1-mediated X-linked megalocornea in humans and in Xenopus model. Human molecular genetics, 24(11), 3119-32. [PubMed:25712132] [WorldCat] [DOI] - ↑
Sasai, Y., Lu, B., Steinbeisser, H., Geissert, D., Gont, L.K., & De Robertis, E.M. (1994).
Xenopus chordin: a novel dorsalizing factor activated by organizer-specific homeobox genes. Cell, 79(5), 779-90. [PubMed:8001117] [PMC] [WorldCat] [DOI] - ↑
Streit, A., Lee, K.J., Woo, I., Roberts, C., Jessell, T.M., & Stern, C.D. (1998).
Chordin regulates primitive streak development and the stability of induced neural cells, but is not sufficient for neural induction in the chick embryo. Development (Cambridge, England), 125(3), 507-19. [PubMed:9425145] [WorldCat] - ↑ 20.0 20.1 20.2
Bachiller, D., Klingensmith, J., Kemp, C., Belo, J.A., Anderson, R.M., May, S.R., ..., & De Robertis, E.M. (2000).
The organizer factors Chordin and Noggin are required for mouse forebrain development. Nature, 403(6770), 658-61. [PubMed:10688202] [WorldCat] [DOI] - ↑ 21.0 21.1
Scott, I.C., Steiglitz, B.M., Clark, T.G., Pappano, W.N., & Greenspan, D.S. (2000).
Spatiotemporal expression patterns of mammalian chordin during postgastrulation embryogenesis and in postnatal brain. Developmental dynamics : an official publication of the American Association of Anatomists, 217(4), 449-56. [PubMed:10767089] [WorldCat] [DOI] - ↑ 22.0 22.1
Larraín, J., Bachiller, D., Lu, B., Agius, E., Piccolo, S., & De Robertis, E.M. (2000).
BMP-binding modules in chordin: a model for signalling regulation in the extracellular space. Development (Cambridge, England), 127(4), 821-30. [PubMed:10648240] [PMC] [WorldCat] - ↑
Sasai, Y., Lu, B., Steinbeisser, H., & De Robertis, E.M. (1995).
Regulation of neural induction by the Chd and Bmp-4 antagonistic patterning signals in Xenopus. Nature, 376(6538), 333-6. [PubMed:7630399] [WorldCat] [DOI] - ↑
Piccolo, S., Sasai, Y., Lu, B., & De Robertis, E.M. (1996).
Dorsoventral patterning in Xenopus: inhibition of ventral signals by direct binding of chordin to BMP-4. Cell, 86(4), 589-98. [PubMed:8752213] [PMC] [WorldCat] [DOI] - ↑
Matsuo-Takasaki, M., Matsumura, M., & Sasai, Y. (2005).
An essential role of Xenopus Foxi1a for ventral specification of the cephalic ectoderm during gastrulation. Development (Cambridge, England), 132(17), 3885-94. [PubMed:16079156] [WorldCat] [DOI] - ↑
Tao, J., Kuliyev, E., Wang, X., Li, X., Wilanowski, T., Jane, S.M., ..., & Cunningham, J.M. (2005).
BMP4-dependent expression of Xenopus Grainyhead-like 1 is essential for epidermal differentiation. Development (Cambridge, England), 132(5), 1021-34. [PubMed:15705857] [WorldCat] [DOI] - ↑
Mizuseki, K., Kishi, M., Matsui, M., Nakanishi, S., & Sasai, Y. (1998).
Xenopus Zic-related-1 and Sox-2, two factors induced by chordin, have distinct activities in the initiation of neural induction. Development (Cambridge, England), 125(4), 579-87. [PubMed:9435279] [WorldCat] - ↑
Matsuo-Takasaki, M., Lim, J.H., & Sato, S.M. (1999).
The POU domain gene, XlPOU 2 is an essential downstream determinant of neural induction. Mechanisms of development, 89(1-2), 75-85. [PubMed:10559482] [WorldCat] [DOI] - ↑
Lee, H.K., Lee, H.S., & Moody, S.A. (2014).
Neural transcription factors: from embryos to neural stem cells. Molecules and cells, 37(10), 705-12. [PubMed:25234468] [PMC] [WorldCat] [DOI] - ↑
De Robertis, E.M., & Kuroda, H. (2004).
Dorsal-ventral patterning and neural induction in Xenopus embryos. Annual review of cell and developmental biology, 20, 285-308. [PubMed:15473842] [PMC] [WorldCat] [DOI] - ↑ 31.0 31.1
Ambrosio, A.L., Taelman, V.F., Lee, H.X., Metzinger, C.A., Coffinier, C., & De Robertis, E.M. (2008).
Crossveinless-2 Is a BMP feedback inhibitor that binds Chordin/BMP to regulate Xenopus embryonic patterning. Developmental cell, 15(2), 248-60. [PubMed:18694564] [PMC] [WorldCat] [DOI] - ↑ 32.0 32.1
Plouhinec, J.L., & De Robertis, E.M. (2009).
Systems biology of the self-regulating morphogenetic gradient of the Xenopus gastrula. Cold Spring Harbor perspectives in biology, 1(2), a001701. [PubMed:20066084] [PMC] [WorldCat] [DOI] - ↑
Dale, L., Evans, W., & Goodman, S.A. (2002).
Xolloid-related: a novel BMP1/Tolloid-related metalloprotease is expressed during early Xenopus development. Mechanisms of development, 119(2), 177-90. [PubMed:12464431] [WorldCat] [DOI] - ↑
De Robertis, E.M., Wessely, O., Oelgeschläger, M., Brizuela, B., Pera, E., Larraín, J., ..., & Bachiller, D. (2001).
Molecular mechanisms of cell-cell signaling by the Spemann-Mangold organizer. The International journal of developmental biology, 45(1), 189-97. [PubMed:11291846] [PMC] [WorldCat] - ↑
Chang, C., Holtzman, D.A., Chau, S., Chickering, T., Woolf, E.A., Holmgren, L.M., ..., & Brivanlou, A.H. (2001).
Twisted gastrulation can function as a BMP antagonist. Nature, 410(6827), 483-7. [PubMed:11260717] [WorldCat] [DOI] - ↑
Xie, J., & Fisher, S. (2005).
Twisted gastrulation enhances BMP signaling through chordin dependent and independent mechanisms. Development (Cambridge, England), 132(2), 383-91. [PubMed:15604098] [WorldCat] [DOI] - ↑ 37.0 37.1
Lee, H.X., Ambrosio, A.L., Reversade, B., & De Robertis, E.M. (2006).
Embryonic dorsal-ventral signaling: secreted frizzled-related proteins as inhibitors of tolloid proteinases. Cell, 124(1), 147-59. [PubMed:16413488] [PMC] [WorldCat] [DOI] - ↑
Collavin, L., & Kirschner, M.W. (2003).
The secreted Frizzled-related protein Sizzled functions as a negative feedback regulator of extreme ventral mesoderm. Development (Cambridge, England), 130(4), 805-16. [PubMed:12506010] [WorldCat] [DOI] - ↑
Muraoka, O., Shimizu, T., Yabe, T., Nojima, H., Bae, Y.K., Hashimoto, H., & Hibi, M. (2006).
Sizzled controls dorso-ventral polarity by repressing cleavage of the Chordin protein. Nature cell biology, 8(4), 329-38. [PubMed:16518392] [WorldCat] [DOI] - ↑
Suzuki, A., Thies, R.S., Yamaji, N., Song, J.J., Wozney, J.M., Murakami, K., & Ueno, N. (1994).
A truncated bone morphogenetic protein receptor affects dorsal-ventral patterning in the early Xenopus embryo. Proceedings of the National Academy of Sciences of the United States of America, 91(22), 10255-9. [PubMed:7937936] [PMC] [WorldCat] [DOI] - ↑
Xu, R.H., Kim, J., Taira, M., Zhan, S., Sredni, D., & Kung, H.F. (1995).
A dominant negative bone morphogenetic protein 4 receptor causes neuralization in Xenopus ectoderm. Biochemical and biophysical research communications, 212(1), 212-9. [PubMed:7612010] [WorldCat] [DOI] - ↑
Anholt, R.R. (2014).
Olfactomedin proteins: central players in development and disease. Frontiers in cell and developmental biology, 2, 6. [PubMed:25364714] [PMC] [WorldCat] [DOI] - ↑
Inomata, H., Haraguchi, T., & Sasai, Y. (2008).
Robust stability of the embryonic axial pattern requires a secreted scaffold for chordin degradation. Cell, 134(5), 854-65. [PubMed:18775317] [WorldCat] [DOI] - ↑
Chen, J., Bush, J.O., Ovitt, C.E., Lan, Y., & Jiang, R. (2007).
The TGF-beta pseudoreceptor gene Bambi is dispensable for mouse embryonic development and postnatal survival. Genesis (New York, N.Y. : 2000), 45(8), 482-6. [PubMed:17661381] [PMC] [WorldCat] [DOI] - ↑
Onichtchouk, D., Chen, Y.G., Dosch, R., Gawantka, V., Delius, H., Massagué, J., & Niehrs, C. (1999).
Silencing of TGF-beta signalling by the pseudoreceptor BAMBI. Nature, 401(6752), 480-5. [PubMed:10519551] [WorldCat] [DOI] - ↑
Ikeya, M., Kawada, M., Kiyonari, H., Sasai, N., Nakao, K., Furuta, Y., & Sasai, Y. (2006).
Essential pro-Bmp roles of crossveinless 2 in mouse organogenesis. Development (Cambridge, England), 133(22), 4463-73. [PubMed:17035289] [WorldCat] [DOI] - ↑
Khokha, M.K., Yeh, J., Grammer, T.C., & Harland, R.M. (2005).
Depletion of three BMP antagonists from Spemann's organizer leads to a catastrophic loss of dorsal structures. Developmental cell, 8(3), 401-11. [PubMed:15737935] [WorldCat] [DOI] - ↑
Choi, M., & Klingensmith, J. (2009).
Chordin is a modifier of tbx1 for the craniofacial malformations of 22q11 deletion syndrome phenotypes in mouse. PLoS genetics, 5(2), e1000395. [PubMed:19247433] [PMC] [WorldCat] [DOI] - ↑
Stower, M.J., & Srinivas, S. (2014).
Heading forwards: anterior visceral endoderm migration in patterning the mouse embryo. Philosophical transactions of the Royal Society of London. Series B, Biological sciences, 369(1657). [PubMed:25349454] [PMC] [WorldCat] [DOI] - ↑
Petryk, A., Anderson, R.M., Jarcho, M.P., Leaf, I., Carlson, C.S., Klingensmith, J., ..., & O'Connor, M.B. (2004).
The mammalian twisted gastrulation gene functions in foregut and craniofacial development. Developmental biology, 267(2), 374-86. [PubMed:15013800] [WorldCat] [DOI] - ↑
Zakin, L., & De Robertis, E.M. (2004).
Inactivation of mouse Twisted gastrulation reveals its role in promoting Bmp4 activity during forebrain development. Development (Cambridge, England), 131(2), 413-24. [PubMed:14681194] [WorldCat] [DOI] - ↑
Ge, G., & Greenspan, D.S. (2006).
Developmental roles of the BMP1/TLD metalloproteinases. Birth defects research. Part C, Embryo today : reviews, 78(1), 47-68. [PubMed:16622848] [WorldCat] [DOI] - ↑
Bijakowski, C., Vadon-Le Goff, S., Delolme, F., Bourhis, J.M., Lécorché, P., Ruggiero, F., ..., & Moali, C. (2012).
Sizzled is unique among secreted frizzled-related proteins for its ability to specifically inhibit bone morphogenetic protein-1 (BMP-1)/tolloid-like proteinases. The Journal of biological chemistry, 287(40), 33581-93. [PubMed:22825851] [PMC] [WorldCat] [DOI] - ↑
Satoh, W., Gotoh, T., Tsunematsu, Y., Aizawa, S., & Shimono, A. (2006).
Sfrp1 and Sfrp2 regulate anteroposterior axis elongation and somite segmentation during mouse embryogenesis. Development (Cambridge, England), 133(6), 989-99. [PubMed:16467359] [WorldCat] [DOI]