「ジャンクトフィリン」の版間の差分
細 (→関連項目) |
細編集の要約なし |
||
| (3人の利用者による、間の7版が非表示) | |||
| 1行目: | 1行目: | ||
<div align="right"> | |||
<font size="+1">[http://researchmap.jp/shokakizawa 柿澤 昌]</font><br> | |||
''京都大学 大学院薬学研究科 生体分子認識学分野''<br> | |||
DOI:<selfdoi /> 原稿受付日:2013年4月8日 原稿完成日:2013年4月18日<br> | |||
担当編集委員:[http://researchmap.jp/2rikenbsi 林 康紀](独立行政法人理化学研究所 脳科学総合研究センター)<br> | |||
</div> | |||
{{PBB|geneid=56704}}{{PBB|geneid=57158}}{{PBB|geneid=57338}}{{PBB|geneid=84502}} | {{PBB|geneid=56704}}{{PBB|geneid=57158}}{{PBB|geneid=57338}}{{PBB|geneid=84502}} | ||
{{Pfam_box | {{Pfam_box | ||
| 16行目: | 23行目: | ||
英語名:junctophilin 英語略名:JP | 英語名:junctophilin 英語略名:JP | ||
{{box|text= 神経・筋などの興奮性細胞においては、細胞表層膜と小胞体膜とが近接した結合膜構造が存在し、両者の膜系に存在するチャネル分子が相互作用により共役している。ジャンクトフィリンは、その結合膜構造形成に必要な分子として単離されたタンパク質である。アミノ末端側に存在する14アミノ酸からなるMORNモチーフを介して細胞表層膜と結合する一方で、カルボキシル末端側の膜貫通セグメントにおいて小胞体膜を貫通することで、両膜を架橋し結合膜構造の形成に寄与すると考えられている。現在までに4種類のサブタイプが同定されている。JP-1は骨格筋特異的に発現が見られ、JP-2は心臓と骨格筋で発現レベルが特に高い。脳においては、JP-3およびJP-4が多くの神経細胞に重複して発現分布しており、それぞれ単独のノックアウトマウスでは際立った異常は認められないが、JP-3とJP-4の二重欠損マウスでは、個体、シナプス、神経細胞レベルでの機能阻害が報告されている。神経細胞では細胞表層膜/小胞体膜のイオンチャネル間の機能的共役効率の低下によるシナプス伝達・可塑性障害が認められる。}} | |||
== ジャンクトフィリンとは== | == ジャンクトフィリンとは== | ||
[[神経]]・[[ | [[神経]]・[[wj:筋|筋]]などの興奮性細胞においては、[[細胞表層膜]]と[[小胞体]]膜とが近接した結合膜構造が存在する<ref><pubmed>1426638</pubmed></ref>。神経細胞では[[subsurface cistern]]と呼ばれるこの構造は、[[wj:筋|骨格筋]]細胞では[[triad junction]]と呼ばれ、骨格筋における[[興奮収縮連関]]との関連に着目した研究が進められている。 | ||
骨格筋興奮収縮連関においては、細胞表層膜上の[[電位依存性カルシウムチャネル]]である[[ジヒドロピリジン受容体]]([[L型カルシウムチャネル]])と、小胞体膜上のカルシウム放出チャネルである[[リアノジン受容体]]とが蛋白質間相互作用を介して共役することで、[[脱分極]]刺激による小胞体からのカルシウム放出が引き起こされ、筋収縮が起こる<ref><pubmed>16702757</pubmed></ref>。異なる二つの膜系に存在するチャネル分子が相互作用により共役するためには、上述の結合膜構造が形成され機能的なマイクロドメインが形成される必要があると考えられる。 | 骨格筋興奮収縮連関においては、細胞表層膜上の[[電位依存性カルシウムチャネル]]である[[ジヒドロピリジン受容体]]([[L型カルシウムチャネル]])と、小胞体膜上のカルシウム放出チャネルである[[リアノジン受容体]]とが蛋白質間相互作用を介して共役することで、[[脱分極]]刺激による小胞体からのカルシウム放出が引き起こされ、筋収縮が起こる<ref><pubmed>16702757</pubmed></ref>。異なる二つの膜系に存在するチャネル分子が相互作用により共役するためには、上述の結合膜構造が形成され機能的なマイクロドメインが形成される必要があると考えられる。 | ||
ジャンクトフィリンは、興奮性細胞における結合膜構造形成に必要な分子として単離された分子量72-90kDa程度のタンパク質である<ref name="ref3"><pubmed>10949023</pubmed></ref>。最初に発見された、骨格筋で特異的に発現する1型ジャンクトフィリン([[JP-1]])に加え、相同クローニングにより2型~4型ジャンクトフィリン ([[JP-2]]~[[JP-4]]) が発見され、現在までに4種類のサブタイプが同定されている<ref name="ref4"><pubmed>14559359</pubmed></ref>。脳においては、[[JP-3]]およびJP-4が多くの神経細胞に重複して発現分布しており、それぞれ単独のノックアウトマウスでは際立った異常は認められないが、JP-3とJP-4の二重欠損マウスでは、個体、[[シナプス]]、神経細胞レベルでの機能阻害が報告されている<ref name="ref5"><pubmed>18607668</pubmed></ref>。 | |||
== 構造 == | == 構造 == | ||
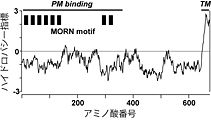
膜貫通セグメントはカルボキシル末端に1箇所のみ存在し、アミノ末端には[[ | 膜貫通セグメントはカルボキシル末端に1箇所のみ存在し、アミノ末端には[[wj:シグナル配列|シグナル配列]]が存在しない。一方、アミノ末端側には14アミノ酸よりなる[[MORNモチーフ]]と命名された繰り返し配列が8回現れる(図1)。In vitro合成mRNAを注入した[[wj:両生類|両生類]]初期胚の細胞ではJP-1の発現が細胞表層膜直下に[[wj:抗体染色|抗体染色]]法により観察されるが、部分欠損体の発現実験により、このJP-1の細胞表層膜との結合にはMORNモチーフが必要であることが示されている。したがって、MORNモチーフを介して細胞表層膜と結合する一方で、カルボキシル末端側の膜貫通セグメントにおいて小胞体膜を貫通することで、ジャンクトフィリンは両膜を架橋し、結合膜構造の形成に寄与すると考えられている(図2)<ref name="ref3" />。 | ||
<gallery widths=300px> | <gallery widths=300px> | ||
image:JP34ハイドロパシー指標.jpg|''' | image:JP34ハイドロパシー指標.jpg|'''図1.[[ウサギ]]1型ジャンクトフィリン(JP-1)のハイドロパシー指標'''<br>横軸に記されたアミノ酸番号が最も大きいカルボキシル末端側に疎水性が高い推定膜貫通領域(TM)が存在する。また、アミノ酸番号が小さいアミノ末端側には、MORNモチーフと命名された繰り返し配列が8回現れる(MORN motif)。この部分が欠損したIn vitro合成mRNAを注入した両生類初期胚の細胞では、野生型では細胞表層膜直下に局在するJP-1が細胞質内に拡散するため、この領域がJP-1と細胞表層膜との結合に必要であると考えられる(PM binding)。 | ||
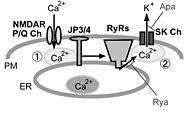
image:JP34シグナル.jpg|'''図2.中枢神経細胞における細胞表層膜/小胞体膜イオンチャネル間の共役とジャンクトフィリン'''<br>海馬CA1錐体細胞では細胞表層膜(PM)上のNMDA型グルタミン酸受容体(NMDAR)、小脳プルキンエ細胞ではP/Q型電位依存性カルシウムチャネル(P/Q Ch)を介して細胞外から流入したカルシウム(Ca<sup>2+</sup>)は、小胞体膜(ER)上に存在するリアノジン受容体(RyRs)を活性化する(①)。さらに小胞体から放出されたCa<sup>2+</sup>は、細胞表層膜に存在する小コンダクタンスCa<sup>2+</sup>依存性カリウムチャネル(SK Ch)を活性化し(②)、正電荷を持つカリウムイオン(K<sup>+</sup>)が細胞外に流出することで、膜電位変化における後過分極が生じる。野生型の海馬CA1錐体細胞や小脳プルキンエ細胞では、脱分極性の電位変化に引き続き、RyRsの阻害薬であるリアノジン(Rya)やSK Chの阻害薬であるapamin(Apa)に感受性を持つ後過分極が見られるが、脳型ジャンクトフィリン(JP3/4)二重欠損マウスでは、この様な細胞表層膜/小胞体膜のイオンチャネル間の機能的共役が阻害されるために、Rya/Apa感受性を有する後過分極が阻害されると考えられる。 | image:JP34シグナル.jpg|'''図2.中枢神経細胞における細胞表層膜/小胞体膜イオンチャネル間の共役とジャンクトフィリン'''<br>海馬CA1錐体細胞では細胞表層膜(PM)上のNMDA型グルタミン酸受容体(NMDAR)、小脳プルキンエ細胞ではP/Q型電位依存性カルシウムチャネル(P/Q Ch)を介して細胞外から流入したカルシウム(Ca<sup>2+</sup>)は、小胞体膜(ER)上に存在するリアノジン受容体(RyRs)を活性化する(①)。さらに小胞体から放出されたCa<sup>2+</sup>は、細胞表層膜に存在する小コンダクタンスCa<sup>2+</sup>依存性カリウムチャネル(SK Ch)を活性化し(②)、正電荷を持つカリウムイオン(K<sup>+</sup>)が細胞外に流出することで、膜電位変化における後過分極が生じる。野生型の海馬CA1錐体細胞や小脳プルキンエ細胞では、脱分極性の電位変化に引き続き、RyRsの阻害薬であるリアノジン(Rya)やSK Chの阻害薬であるapamin(Apa)に感受性を持つ後過分極が見られるが、脳型ジャンクトフィリン(JP3/4)二重欠損マウスでは、この様な細胞表層膜/小胞体膜のイオンチャネル間の機能的共役が阻害されるために、Rya/Apa感受性を有する後過分極が阻害されると考えられる。 | ||
</gallery> | </gallery> | ||
== サブタイプ == | == サブタイプ == | ||
現在まで、JP-1~JP-4まで、4種類のサブタイプが同定されている。[[ | 現在まで、JP-1~JP-4まで、4種類のサブタイプが同定されている。[[wj:マウス|マウス]]では、アミノ酸数は、JP-1が660、JP-2が696、JP-3が744、JP-4が628であり<ref name="ref4" />、サブタイプ間の相同性は約40%程度である<ref name="ref3" />。[[wj:ウェスタンブロット|ウェスタンブロット]]から推測される分子量は72~95kDaであり、ジャンクトフィリン分子全体的に、アミノ酸数から推測される分子量よりも大きくなる傾向があるが、その原因は解明されていない<ref name="ref4" />。MORN配列、およびカルボキシル末端側の膜貫通領域は、サブタイプ間の相同性がそれぞれ80%、50%と、相対的に高くなっている領域である。しかし、カルボキシル末端側にある膜貫通領域を除けば、MORN配列を含め、相同性の高い部分はアミノ酸番号400番台前半までの部分に集中しており<ref name="ref4" />、C末側の膜貫通領域直前の約250個のアミノ酸配列の相同性は、約6%程度と相対的に低くなっている<ref name="ref3" />。マウスジャンクトフィリンの各サブタイプにおけるアミノ酸配列の具体的な相違については、Nishi et al. 2003<ref name="ref4" />を参照されたい。 | ||
== 発現分布 == | == 発現分布 == | ||
ジャンクトフィリンは興奮性細胞において、各サブタイプの発現が見られる。JP-1は骨格筋特異的に発現が見られる。JP-2は[[ | ジャンクトフィリンは興奮性細胞において、各サブタイプの発現が見られる。JP-1は骨格筋特異的に発現が見られる。JP-2は[[wj:心臓|心臓]]と骨格筋で発現レベルが特に高いほか、[[wj:消化管|消化管]]や[[wj:気管|気管]]の[[wj:平滑筋|平滑筋]]でも発現が確認され、筋細胞全般に分布すると推測される<ref name="ref3" />。 | ||
一方、JP-3、JP-4の発現は脳に限局的であり、両者の発現部位には重複性が見られるが<ref name="ref4" />、このことは、後述のノックアウトマウアスの表現型において、JP-3、JP-4それぞれの単独ノックアウトマウスでは顕著な異常が現れないことと互いに矛盾しない。脳内におけるJP-3、JP-4の発現レベルには部位による違いが見られ、[[海馬]]の[[CA1]]~[[CA3]]領域や[[歯状回]]、[[小脳]][[顆粒細胞層]]などでは、JP-3、JP-4ともに高レベルの発現が見られる。尚、JP-3、JP-4の脳内分布に関する詳細については、Nishi et al. (2003)<ref name="ref4" />を参考にされたい。 | 一方、JP-3、JP-4の発現は脳に限局的であり、両者の発現部位には重複性が見られるが<ref name="ref4" />、このことは、後述のノックアウトマウアスの表現型において、JP-3、JP-4それぞれの単独ノックアウトマウスでは顕著な異常が現れないことと互いに矛盾しない。脳内におけるJP-3、JP-4の発現レベルには部位による違いが見られ、[[海馬]]の[[CA1]]~[[CA3]]領域や[[歯状回]]、[[小脳]][[顆粒細胞層]]などでは、JP-3、JP-4ともに高レベルの発現が見られる。尚、JP-3、JP-4の脳内分布に関する詳細については、Nishi et al. (2003)<ref name="ref4" />を参考にされたい。 | ||
尚、神経細胞内における局在に関しては、現時点では免疫組織化学的解析に使用可能な抗血清が存在しないため、JP-3、JP-4ともに不明である。 | |||
{|style="float:right; width:220px; border: 1px solid darkgray;" | {|style="float:right; width:220px; border: 1px solid darkgray;" | ||
| | | | ||
| 64行目: | 72行目: | ||
=== JP-1欠損マウス === | === JP-1欠損マウス === | ||
[[ | [[wj:母乳|母乳]]を吸うことが出来ず、出生24時間以内に死亡する新生致死性を示す。JP-1欠損骨格筋では、[[wj:電子顕微鏡|電子顕微鏡]]観察により、結合膜構造 (triad junction) の形成不全が見とめられる。また張力測定では、JP-1欠損骨格筋はほぼ正常な最大張力を示すが、刺激頻度と発生張力とのプロットが正常なものより高頻度側にシフトしている。したがって、結合膜構造の形成不全により、L型カルシウムチャネルとRyR1との機能的カップリングに不備が生じて、興奮収縮連関の効率が低下しているものと考えられる<ref><pubmed>11535622</pubmed></ref>。 | ||
=== JP-2欠損マウス === | === JP-2欠損マウス === | ||
受精後9.5日には心臓拍動の減弱が確認され、その翌日頃には心停止に至る、胎生致死が見とめられる。JP-2欠損心筋細胞では、細胞表層膜と[[ | 受精後9.5日には心臓拍動の減弱が確認され、その翌日頃には心停止に至る、胎生致死が見とめられる。JP-2欠損心筋細胞では、細胞表層膜と[[wj:筋小胞体|筋小胞体]]膜が近接した結合膜構造であるperipheral couplingの形成が極端に減少しており、このことに由来すると推測される心筋細胞内カルシウム濃度の一過的上昇([[カルシウムトランジェント]])の異常により、心不全となる<ref name="ref3" />。 | ||
=== JP-3欠損マウス、JP-4欠損マウス === | === JP-3欠損マウス、JP-4欠損マウス === | ||
| 95行目: | 103行目: | ||
== 参考文献 == | == 参考文献 == | ||
<references /> | <references /> | ||
2021年6月14日 (月) 09:20時点における最新版
柿澤 昌
京都大学 大学院薬学研究科 生体分子認識学分野
DOI:10.14931/bsd.2555 原稿受付日:2013年4月8日 原稿完成日:2013年4月18日
担当編集委員:林 康紀(独立行政法人理化学研究所 脳科学総合研究センター)
| Junctophilin 1 | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Identifiers | |||||||||||||
| Symbols | JPH1; JP-1; JP1 | ||||||||||||
| External IDs | OMIM: 605266 MGI: 1891495 HomoloGene: 10761 GeneCards: JPH1 Gene | ||||||||||||
| |||||||||||||
| RNA expression pattern | |||||||||||||
 | |||||||||||||
| More reference expression data | |||||||||||||
| Orthologs | |||||||||||||
| Species | Human | Mouse | |||||||||||
| Entrez | 56704 | 57339 | |||||||||||
| Ensembl | ENSG00000104369 | ENSMUSG00000042686 | |||||||||||
| UniProt | Q9HDC5 | Q9ET80 | |||||||||||
| RefSeq (mRNA) | NM_020647 | NM_020604 | |||||||||||
| RefSeq (protein) | NP_065698 | NP_065629 | |||||||||||
| Location (UCSC) |
Chr 8: 75.15 – 75.23 Mb |
Chr 1: 16.99 – 17.1 Mb | |||||||||||
| PubMed search | [1] | [2] | |||||||||||
| Junctophilin 2 | |||
|---|---|---|---|
| Identifiers | |||
| Symbols | JPH2; CMH17; JP-2; JP2 | ||
| External IDs | OMIM: 605267 MGI: 1891496 HomoloGene: 10714 GeneCards: JPH2 Gene | ||
| RNA expression pattern | |||
 | |||
 | |||
| More reference expression data | |||
| Orthologs | |||
| Species | Human | Mouse | |
| Entrez | 57158 | 59091 | |
| Ensembl | ENSG00000149596 | ENSMUSG00000017817 | |
| UniProt | Q9BR39 | Q9ET78 | |
| RefSeq (mRNA) | NM_020433 | NM_001205076 | |
| RefSeq (protein) | NP_065166 | NP_001192005 | |
| Location (UCSC) |
Chr 20: 42.74 – 42.82 Mb |
Chr 2: 163.34 – 163.4 Mb | |
| PubMed search | [3] | [4] | |
| Junctophilin 3 | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Identifiers | |||||||||||||
| Symbols | JPH3; CAGL237; HDL2; JP-3; JP3; TNRC22 | ||||||||||||
| External IDs | OMIM: 605268 MGI: 1891497 HomoloGene: 10762 GeneCards: JPH3 Gene | ||||||||||||
| |||||||||||||
| RNA expression pattern | |||||||||||||
 | |||||||||||||
| More reference expression data | |||||||||||||
| Orthologs | |||||||||||||
| Species | Human | Mouse | |||||||||||
| Entrez | 57338 | 57340 | |||||||||||
| Ensembl | ENSG00000154118 | ENSMUSG00000025318 | |||||||||||
| UniProt | Q8WXH2 | Q9ET77 | |||||||||||
| RefSeq (mRNA) | NM_001271604 | NM_020605 | |||||||||||
| RefSeq (protein) | NP_001258533 | NP_065630 | |||||||||||
| Location (UCSC) |
Chr 16: 87.64 – 87.73 Mb |
Chr 8: 121.73 – 121.79 Mb | |||||||||||
| PubMed search | [5] | [6] | |||||||||||
| Junctophilin 4 | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| Identifiers | |||||||||||
| Symbols | JPH4; JP4; JPHL1 | ||||||||||
| External IDs | HomoloGene: 13034 GeneCards: JPH4 Gene | ||||||||||
| |||||||||||
| Orthologs | |||||||||||
| Species | Human | Mouse | |||||||||
| Entrez | 84502 | 319984 | |||||||||
| Ensembl | ENSG00000092051 | ENSMUSG00000022208 | |||||||||
| UniProt | Q96JJ6 | Q80WT0 | |||||||||
| RefSeq (mRNA) | NM_001146028 | NM_001003829 | |||||||||
| RefSeq (protein) | NP_001139500 | NP_796023 | |||||||||
| Location (UCSC) |
Chr 14: 24.04 – 24.05 Mb |
Chr 14: 55.11 – 55.12 Mb | |||||||||
| PubMed search | [7] | [8] | |||||||||
| MORN repeat | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 Structure of histone H3 K4-specific methyltransferase SET7/9 | |||||||||
| Identifiers | |||||||||
| Symbol | MORN | ||||||||
| Pfam | PF02493 | ||||||||
| InterPro | IPR003409 | ||||||||
| SCOP | 1n6a | ||||||||
| SUPERFAMILY | 1n6a | ||||||||
| |||||||||
英語名:junctophilin 英語略名:JP
神経・筋などの興奮性細胞においては、細胞表層膜と小胞体膜とが近接した結合膜構造が存在し、両者の膜系に存在するチャネル分子が相互作用により共役している。ジャンクトフィリンは、その結合膜構造形成に必要な分子として単離されたタンパク質である。アミノ末端側に存在する14アミノ酸からなるMORNモチーフを介して細胞表層膜と結合する一方で、カルボキシル末端側の膜貫通セグメントにおいて小胞体膜を貫通することで、両膜を架橋し結合膜構造の形成に寄与すると考えられている。現在までに4種類のサブタイプが同定されている。JP-1は骨格筋特異的に発現が見られ、JP-2は心臓と骨格筋で発現レベルが特に高い。脳においては、JP-3およびJP-4が多くの神経細胞に重複して発現分布しており、それぞれ単独のノックアウトマウスでは際立った異常は認められないが、JP-3とJP-4の二重欠損マウスでは、個体、シナプス、神経細胞レベルでの機能阻害が報告されている。神経細胞では細胞表層膜/小胞体膜のイオンチャネル間の機能的共役効率の低下によるシナプス伝達・可塑性障害が認められる。
ジャンクトフィリンとは
神経・筋などの興奮性細胞においては、細胞表層膜と小胞体膜とが近接した結合膜構造が存在する[1]。神経細胞ではsubsurface cisternと呼ばれるこの構造は、骨格筋細胞ではtriad junctionと呼ばれ、骨格筋における興奮収縮連関との関連に着目した研究が進められている。
骨格筋興奮収縮連関においては、細胞表層膜上の電位依存性カルシウムチャネルであるジヒドロピリジン受容体(L型カルシウムチャネル)と、小胞体膜上のカルシウム放出チャネルであるリアノジン受容体とが蛋白質間相互作用を介して共役することで、脱分極刺激による小胞体からのカルシウム放出が引き起こされ、筋収縮が起こる[2]。異なる二つの膜系に存在するチャネル分子が相互作用により共役するためには、上述の結合膜構造が形成され機能的なマイクロドメインが形成される必要があると考えられる。
ジャンクトフィリンは、興奮性細胞における結合膜構造形成に必要な分子として単離された分子量72-90kDa程度のタンパク質である[3]。最初に発見された、骨格筋で特異的に発現する1型ジャンクトフィリン(JP-1)に加え、相同クローニングにより2型~4型ジャンクトフィリン (JP-2~JP-4) が発見され、現在までに4種類のサブタイプが同定されている[4]。脳においては、JP-3およびJP-4が多くの神経細胞に重複して発現分布しており、それぞれ単独のノックアウトマウスでは際立った異常は認められないが、JP-3とJP-4の二重欠損マウスでは、個体、シナプス、神経細胞レベルでの機能阻害が報告されている[5]。
構造
膜貫通セグメントはカルボキシル末端に1箇所のみ存在し、アミノ末端にはシグナル配列が存在しない。一方、アミノ末端側には14アミノ酸よりなるMORNモチーフと命名された繰り返し配列が8回現れる(図1)。In vitro合成mRNAを注入した両生類初期胚の細胞ではJP-1の発現が細胞表層膜直下に抗体染色法により観察されるが、部分欠損体の発現実験により、このJP-1の細胞表層膜との結合にはMORNモチーフが必要であることが示されている。したがって、MORNモチーフを介して細胞表層膜と結合する一方で、カルボキシル末端側の膜貫通セグメントにおいて小胞体膜を貫通することで、ジャンクトフィリンは両膜を架橋し、結合膜構造の形成に寄与すると考えられている(図2)[3]。
図1.ウサギ1型ジャンクトフィリン(JP-1)のハイドロパシー指標
横軸に記されたアミノ酸番号が最も大きいカルボキシル末端側に疎水性が高い推定膜貫通領域(TM)が存在する。また、アミノ酸番号が小さいアミノ末端側には、MORNモチーフと命名された繰り返し配列が8回現れる(MORN motif)。この部分が欠損したIn vitro合成mRNAを注入した両生類初期胚の細胞では、野生型では細胞表層膜直下に局在するJP-1が細胞質内に拡散するため、この領域がJP-1と細胞表層膜との結合に必要であると考えられる(PM binding)。図2.中枢神経細胞における細胞表層膜/小胞体膜イオンチャネル間の共役とジャンクトフィリン
海馬CA1錐体細胞では細胞表層膜(PM)上のNMDA型グルタミン酸受容体(NMDAR)、小脳プルキンエ細胞ではP/Q型電位依存性カルシウムチャネル(P/Q Ch)を介して細胞外から流入したカルシウム(Ca2+)は、小胞体膜(ER)上に存在するリアノジン受容体(RyRs)を活性化する(①)。さらに小胞体から放出されたCa2+は、細胞表層膜に存在する小コンダクタンスCa2+依存性カリウムチャネル(SK Ch)を活性化し(②)、正電荷を持つカリウムイオン(K+)が細胞外に流出することで、膜電位変化における後過分極が生じる。野生型の海馬CA1錐体細胞や小脳プルキンエ細胞では、脱分極性の電位変化に引き続き、RyRsの阻害薬であるリアノジン(Rya)やSK Chの阻害薬であるapamin(Apa)に感受性を持つ後過分極が見られるが、脳型ジャンクトフィリン(JP3/4)二重欠損マウスでは、この様な細胞表層膜/小胞体膜のイオンチャネル間の機能的共役が阻害されるために、Rya/Apa感受性を有する後過分極が阻害されると考えられる。
サブタイプ
現在まで、JP-1~JP-4まで、4種類のサブタイプが同定されている。マウスでは、アミノ酸数は、JP-1が660、JP-2が696、JP-3が744、JP-4が628であり[4]、サブタイプ間の相同性は約40%程度である[3]。ウェスタンブロットから推測される分子量は72~95kDaであり、ジャンクトフィリン分子全体的に、アミノ酸数から推測される分子量よりも大きくなる傾向があるが、その原因は解明されていない[4]。MORN配列、およびカルボキシル末端側の膜貫通領域は、サブタイプ間の相同性がそれぞれ80%、50%と、相対的に高くなっている領域である。しかし、カルボキシル末端側にある膜貫通領域を除けば、MORN配列を含め、相同性の高い部分はアミノ酸番号400番台前半までの部分に集中しており[4]、C末側の膜貫通領域直前の約250個のアミノ酸配列の相同性は、約6%程度と相対的に低くなっている[3]。マウスジャンクトフィリンの各サブタイプにおけるアミノ酸配列の具体的な相違については、Nishi et al. 2003[4]を参照されたい。
発現分布
ジャンクトフィリンは興奮性細胞において、各サブタイプの発現が見られる。JP-1は骨格筋特異的に発現が見られる。JP-2は心臓と骨格筋で発現レベルが特に高いほか、消化管や気管の平滑筋でも発現が確認され、筋細胞全般に分布すると推測される[3]。
一方、JP-3、JP-4の発現は脳に限局的であり、両者の発現部位には重複性が見られるが[4]、このことは、後述のノックアウトマウアスの表現型において、JP-3、JP-4それぞれの単独ノックアウトマウスでは顕著な異常が現れないことと互いに矛盾しない。脳内におけるJP-3、JP-4の発現レベルには部位による違いが見られ、海馬のCA1~CA3領域や歯状回、小脳顆粒細胞層などでは、JP-3、JP-4ともに高レベルの発現が見られる。尚、JP-3、JP-4の脳内分布に関する詳細については、Nishi et al. (2003)[4]を参考にされたい。
尚、神経細胞内における局在に関しては、現時点では免疫組織化学的解析に使用可能な抗血清が存在しないため、JP-3、JP-4ともに不明である。
| ||||||||||
| 遺伝子名はAllen Brain Atlasのin situハイブリダイゼーションデーターへリンクしている。 |
機能
ジャンクトフィリンの機能はノックアウトマウスの表現型を元に推測されている。そこで、各サブタイプのノックアウトマウス(ただし、JP-3とJP-4については、両者の二重欠損マウスについても)の表現型を記す。
JP-1欠損マウス
母乳を吸うことが出来ず、出生24時間以内に死亡する新生致死性を示す。JP-1欠損骨格筋では、電子顕微鏡観察により、結合膜構造 (triad junction) の形成不全が見とめられる。また張力測定では、JP-1欠損骨格筋はほぼ正常な最大張力を示すが、刺激頻度と発生張力とのプロットが正常なものより高頻度側にシフトしている。したがって、結合膜構造の形成不全により、L型カルシウムチャネルとRyR1との機能的カップリングに不備が生じて、興奮収縮連関の効率が低下しているものと考えられる[6]。
JP-2欠損マウス
受精後9.5日には心臓拍動の減弱が確認され、その翌日頃には心停止に至る、胎生致死が見とめられる。JP-2欠損心筋細胞では、細胞表層膜と筋小胞体膜が近接した結合膜構造であるperipheral couplingの形成が極端に減少しており、このことに由来すると推測される心筋細胞内カルシウム濃度の一過的上昇(カルシウムトランジェント)の異常により、心不全となる[3]。
JP-3欠損マウス、JP-4欠損マウス
JP-3欠損マウスでは、運動協調能の軽微な異常が見られるものの[7]、両サブタイプの単独欠損マウスでは、顕著な異常は認められない。上述の両サブタイプの発現重複性と併せて考えると、両サブタイプ間の機能補完作用が示唆される。
両サブタイプを同時に欠損するJP-3&4二重欠損マウス(JP3&4 double-knockout mouse; 以下JP-DKOマウス)は、固型飼料を用いた通常飼育条件下では、離乳時期に死亡する。しかし、ペースト状の練り餌で飼育すると、この致死性がほぼ完全に回避される。また尻尾を持ち上げた際、野生型マウスでは下肢が開くのに対し、JP-DKOマウスは下肢を結ぶしぐさ、いわゆるfoot-clasping reflexと呼ばれる応答が出現する。この異常応答は、ハンチントン舞踏病モデルマウスにも観察される異常であるが、ヒトの遺伝性疾患であるハンチントン舞踏病類似疾患(HDL2)の原因として、JP3遺伝子へのトリプレットの伸長・挿入変異が見られることが報告されている。
JP-3、JP-4の発現分布から推測されるとおり、JP-DKOマウスにおける海馬および小脳に関連した機能異常が、現在までに報告されている[5]。
海馬長期増強と記憶学習の異常
JP-DKOマウスは、Y迷路テスト、受動回避テストにおいて記憶学習の低下が見られる。これらに対応して、海馬CA3-CA1シナプスにおける長期増強(LTP)に顕著な異常が見られた。またシナプス電位応答において興奮性シナプス後電位]]に続いて現れる後過分極 (afterhyperpolarization; AHP)が、JP-DKO海馬CA1錐体細胞では欠落している。このAHPは小コンダクタンスカルシウム依存性カリウムチャネル(small-conductance Ca2+-dependent K+ channel; SK チャネル)を介するが、薬理学的な解析により、海馬CA1錐体細胞ではSKチャネルの活性化にはNMDA型グルタミン酸受容体とRyRの活性化が必要であることが示された。したがって、JP-DKO海馬CA1錐体細胞では、NMDA型グルタミン酸受容体-RyR-SKチャネル間の機能的共役が阻害されていることが推測される(図2)。さらに、JP-DKO海馬では、海馬LTPへの関与が示されているカルシウム-カルモジュリン依存性キナーゼII (CaMKII)のリン酸化に亢進が見られるが、並行して、CaMKIIの基質であるGluR1のリン酸化レベルの亢進も見られることから、JP-DKOマウス海馬におけるCaMKIIの活性化異常が示唆される[8]。
小脳機能の異常
JP-DKOでは、回転棒テストおよび小脳依存性の瞬膜反射条件付け学習において、明確な阻害が見られる。また、小脳運動学習の基盤とされる平行線維-プルキンエ細胞シナプスにおける長期抑圧(long-term depression; 小脳LTD)に関して、野生型において小脳LTDを誘導する刺激(登上線維刺激とプルキンエ細胞の脱分極との組み合わせ刺激)により、JP-DKO小脳スライスではLTPが誘導される(小脳LTDのLTP化)。登上線維刺激によりプルキンエ細胞ではcomplex spikeと言う複雑な脱分極性の電位応答が見られるが、この電位応答の脱分極相の後に続く遅い過分極応答(slow afterhyperpolarization; sAHP)が、JP-DKOプルキンエ細胞では欠損している。引き続き薬理学的な解析により、sAHPはSKチャネルを介し、プルキンエ細胞で優先的に発現するRyR1の活性化に依存することが示されたが、JP-DKOプルキンエ細胞では、SKチャネル阻害薬であるapamin、およびRyR1を阻害するリアノジンもしくはdantroleneに感受性のあるsAHPが欠損している。さらに、登上線維刺激ではNMDA型グルタミン酸受容体が活性化されず、RyR1を活性化するカルシウム流入はP/Q型カルシウムチャネルを介すると考えられることから、JP-DKOプルキンエ細胞では、P/Q型カルシウムチャネル-RyR1-SHチャネルの機能的共役が阻害されていることが示唆された(図2)。さらに野生型マウスの小脳スライス標本においても、apamin投与により小脳LTDのLTP化が見られることから、JP-DKO小脳におけるLTDのLTP化の少なくとも一つの原因として、P/Q型カルシウムチャネル-RyR1-SHチャネル間の機能的共役の阻害によるsAHPの欠損が示唆された[9][10]。
脳におけるRyRの機能については、RyR1やRyR2の遺伝子欠損マウスが、それぞれ出生致死[11]、胎生致死[12]を示すこと、さらに多くの神経細胞で複数のRyRサブタイプの発現が重複して見られることから、RyR遺伝子欠損動物を用いたアプローチでは解明が困難であった。しかし、JP-DKOマウスを用いた解析により、JP自身のチャネル間の機能的共役に関する機能的役割が明らかになっただけでなく、脳におけるRyRの機能についても知見が得られたことは特筆に値する。
関連項目
参考文献
- ↑
Flucher, B.E. (1992).
Structural analysis of muscle development: transverse tubules, sarcoplasmic reticulum, and the triad. Developmental biology, 154(2), 245-60. [PubMed:1426638] [WorldCat] [DOI] - ↑
Endo, M. (2006).
Calcium ion as a second messenger with special reference to excitation-contraction coupling. Journal of pharmacological sciences, 100(5), 519-24. [PubMed:16702757] [WorldCat] [DOI] - ↑ 3.0 3.1 3.2 3.3 3.4 3.5
Takeshima, H., Komazaki, S., Nishi, M., Iino, M., & Kangawa, K. (2000).
Junctophilins: a novel family of junctional membrane complex proteins. Molecular cell, 6(1), 11-22. [PubMed:10949023] [WorldCat] [DOI] - ↑ 4.0 4.1 4.2 4.3 4.4 4.5 4.6
Nishi, M., Sakagami, H., Komazaki, S., Kondo, H., & Takeshima, H. (2003).
Coexpression of junctophilin type 3 and type 4 in brain. Brain research. Molecular brain research, 118(1-2), 102-10. [PubMed:14559359] [WorldCat] [DOI] - ↑ 5.0 5.1
Kakizawa, S., Moriguchi, S., Ikeda, A., Iino, M., & Takeshima, H. (2008).
Functional crosstalk between cell-surface and intracellular channels mediated by junctophilins essential for neuronal functions. Cerebellum (London, England), 7(3), 385-91. [PubMed:18607668] [WorldCat] [DOI] - ↑
Ito, K., Komazaki, S., Sasamoto, K., Yoshida, M., Nishi, M., Kitamura, K., & Takeshima, H. (2001).
Deficiency of triad junction and contraction in mutant skeletal muscle lacking junctophilin type 1. The Journal of cell biology, 154(5), 1059-67. [PubMed:11535622] [PMC] [WorldCat] [DOI] - ↑
Nishi, M., Hashimoto, K., Kuriyama, K., Komazaki, S., Kano, M., Shibata, S., & Takeshima, H. (2002).
Motor discoordination in mutant mice lacking junctophilin type 3. Biochemical and biophysical research communications, 292(2), 318-24. [PubMed:11906164] [WorldCat] [DOI] - ↑
Moriguchi, S., Nishi, M., Komazaki, S., Sakagami, H., Miyazaki, T., Masumiya, H., ..., & Takeshima, H. (2006).
Functional uncoupling between Ca2+ release and afterhyperpolarization in mutant hippocampal neurons lacking junctophilins. Proceedings of the National Academy of Sciences of the United States of America, 103(28), 10811-6. [PubMed:16809425] [PMC] [WorldCat] [DOI] - ↑
Kakizawa, S., Kishimoto, Y., Hashimoto, K., Miyazaki, T., Furutani, K., Shimizu, H., ..., & Takeshima, H. (2007).
Junctophilin-mediated channel crosstalk essential for cerebellar synaptic plasticity. The EMBO journal, 26(7), 1924-33. [PubMed:17347645] [PMC] [WorldCat] [DOI] - ↑
Ikeda, A., Miyazaki, T., Kakizawa, S., Okuno, Y., Tsuchiya, S., Myomoto, A., ..., & Takeshima, H. (2007).
Abnormal features in mutant cerebellar Purkinje cells lacking junctophilins. Biochemical and biophysical research communications, 363(3), 835-9. [PubMed:17904530] [WorldCat] [DOI] - ↑
Takeshima, H., Iino, M., Takekura, H., Nishi, M., Kuno, J., Minowa, O., ..., & Noda, T. (1994).
Excitation-contraction uncoupling and muscular degeneration in mice lacking functional skeletal muscle ryanodine-receptor gene. Nature, 369(6481), 556-9. [PubMed:7515481] [WorldCat] [DOI] - ↑
Takeshima, H., Komazaki, S., Hirose, K., Nishi, M., Noda, T., & Iino, M. (1998).
Embryonic lethality and abnormal cardiac myocytes in mice lacking ryanodine receptor type 2. The EMBO journal, 17(12), 3309-16. [PubMed:9628868] [PMC] [WorldCat] [DOI]