「ステロイド」の版間の差分
Norikohorii (トーク | 投稿記録) 細編集の要約なし |
Norikohorii (トーク | 投稿記録) 細編集の要約なし |
||
| 7行目: | 7行目: | ||
== ステロイドの構造 == | == ステロイドの構造 == | ||
[[Image:Steroid structure.png|thumb|right|200px|ステロイド核の構造]] | [[Image:Steroid structure.png|thumb|right|200px|ステロイド核の構造]] ステロイド核とは、シクロペンタノペルヒドロフェナントレン核のことを指し、3つのイス型六員環と1つの五員環がつながった構造をしている<ref>{{cite journal | journal = [[Pure & Appl. Chem.]] | volume = 61 | issue = 10 | pages = 1783–1822 | year = 1989 | title = Nomenclature of Steroids (Recommendations 1989) | author = G. P. Moss | doi = 10.1351/pac198961101783}}</ref>。右図のように構造式を書いた場合、それぞれの環を左下から順にA環、B環、C環、D環と呼ぶ。一部あるいはすべての炭素が水素化され、通常はC-10とC-13にメチル基を、また多くの場合C-17にアルキル基を有する。生体物質としてのステロイドはC-3位がヒドロキシル化もしくはカルボニル化されたステロール類である。 | ||
<br> | <br> | ||
| 15行目: | 15行目: | ||
=== コレステロール === | === コレステロール === | ||
[[Image:Cholesterol.png|thumb|right|200px|コレステロールの構造]]コレステロールの分子式はC27H46Oで表わされ、ステロイド核の3位の炭素にOH基がついたステロールを基礎骨格とし、17位の炭素はアルキル化されている。その名称は、胆石からコレステロール固体を同定した際、ギリシャ語の胆汁を表すChole-、固体を表すstereos (個体)に加え、アルコールの化学命名接尾辞である- | [[Image:Cholesterol.png|thumb|right|200px|コレステロールの構造]]コレステロールの分子式はC27H46Oで表わされ、ステロイド核の3位の炭素にOH基がついたステロールを基礎骨格とし、17位の炭素はアルキル化されている。その名称は、胆石からコレステロール固体を同定した際、ギリシャ語の胆汁を表すChole-、固体を表すstereos (個体)に加え、アルコールの化学命名接尾辞である-olを付けたことに由来する。動物では、コレステールの一部は食事から摂取されるが、主に肝臓と小腸でアセチルCoAより合成され、血液を介して全身に運ばれ、ホルモンや胆汁酸、ビタミンDの原料となる。血中においてコレステロールはHDLやLDL等のリポタンパク質と複合体を形成しており、LDLは肝臓から全身にコレステロールを運ぶ役割を担い、逆にHDLは余分なコレステロールを肝臓に戻す役割を担う。また、コレステロールは、リン脂質と共に代表的な細胞膜の成分であるが、コレステロールに富む膜領域は膜の流動性が低いことが知られる。細胞膜[[マイクロドメイン]]もしくは[[ミクロドメイン]])として知られる[[カベオラ]]や[[脂質ラフト]]は、コレステロールや[[スフィンゴミエリン]]に富んでおり、タンパク質受容体の集積や[[シグナル伝達]]の場と考えられている。 | ||
=== 胆汁酸 === | === 胆汁酸 === | ||
[[Image:Cholic and deoxycholic.png|thumb|right|200px|コール酸とデオキシコール酸の構造]]胆汁酸(bile acid)とは、胆汁に含まれるステロイド誘導体の総称であり、ヒトではコール酸やデオキシコール酸がその代表である。胆汁酸は、肝臓にて[[シトクロムP450]]の作用によるコレステロールの酸化により合成される。胆汁酸は通常、グリシンやタウリンと結合して、グリココール酸(C26H43NO6)、やタウロコール酸(C26H45NO7S)等の抱合体として胆嚢に蓄積され、ビリルビンと共に胆汁として十二指腸に排出される。胆汁酸の主な役割は、脂質の乳化を促進し、食物脂肪の吸収を助けることである。 <br> | [[Image:Cholic and deoxycholic.png|thumb|right|200px|コール酸とデオキシコール酸の構造]]胆汁酸(bile acid)とは、胆汁に含まれるステロイド誘導体の総称であり、ヒトではコール酸やデオキシコール酸がその代表である。胆汁酸は、肝臓にて[[シトクロムP450]]の作用によるコレステロールの酸化により合成される。胆汁酸は通常、グリシンやタウリンと結合して、グリココール酸(C26H43NO6)、やタウロコール酸(C26H45NO7S)等の抱合体として胆嚢に蓄積され、ビリルビンと共に胆汁として十二指腸に排出される。胆汁酸の主な役割は、脂質の乳化を促進し、食物脂肪の吸収を助けることである。 | ||
<br> | |||
=== ビタミンD === | === ビタミンD === | ||
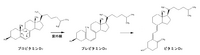
[[Image: | [[Image:provitamin to vitamin.png|thumb|right|200px|プロビタミンからビタミンDへの変換]] ビタミンDは、ステロイド核のB環が9-10位の間で開環した構造を持つ。ビタミンDは側鎖構造の違いから、D2(エルゴカルシフェロール)とD3(コレカルシフェロール)に分けられ、D2は植物に、D3は動物に多く含まれる。ビタミンDは、コレステロールが代謝を受けてプロビタミンD3(7-デヒドロコレステロール)となった後、皮膚上で紫外線によりステロイド核のB環が開きプレビタミンD3((6Z)-タカルシオール)となる。プレビタミンD3は更に、ビタミンD3(コレカルシフェロール)へと異性化する。ビタミンD自体は生理活性を持たないが、肝臓と腎臓にて3つのP450(ビタミンD25-水酸化酵素、ビタミンD1α-水酸化酵素、ビタミンD24-水酸化酵素)の働きにより活性型ビタミンD(1,25-ジヒドロキシコレカルシフェロール)へと変換され、ビタミンD受容体を介して核内の標的遺伝子の転写活性を制御することによって作用を発揮する。標的遺伝子の1つとしてカルシウム結合タンパク質であるカルビンディンが挙げられる。ビタミンD受容体は小腸、腎臓、骨組織に存在しておりカルシウム代謝と密接な関わりを持ち、腸管におけるカルシウムの吸収や腎尿細管におけるカルシウムの再吸収を促進する。活性型ビタミンDの不足は小児ではくる病、成人では骨軟化症となる。 | ||
<br> | |||
=== ステロイドホルモン === | === ステロイドホルモン === | ||
ステロイド核をもつホルモンをステロイドホルモンと呼ぶ。副腎、精巣、卵巣等の内分泌器官より分泌されるが、近年は脳でも合成されることが知られておりニューロステロイドと呼ばれている。ステロイドホルモンの特徴は、脂溶性であり分子量が低いために細胞膜を容易に通り抜けられること、また細胞質に存在するステロイドホルモン受容体に結合し、核内にて標的遺伝子の転写活性を調節することである。最近では、このような遺伝子発現を介したステロイドホルモンの作用に加え、極めて短時間のうちに作用を発揮する膜受容体の存在が推察されている。 | |||
==== ステロイドホルモンの生合成 | ==== ステロイドホルモンの生合成 ==== | ||
[[Image:Steroid synthesis.jpg|thumb|right|300px|ステロイドホルモンの生合成]] ステロイドホルモンはコレステロールから、[[シトクロムP450]]系酵素の働きによって作られる。これらの酵素は小胞体膜かミトコンドリア内膜のいずれかに局在し、以下に挙げる酵素がステロイドホルモン合成酵素として知られる。これらのうち3β-HSDと17β-HSD以外は[[シトクロムP450]]系酵素である<ref name=ステロイドホルモン>竹森重樹<br>ステロイドホルモン<br>共立出版:1998 </ref>。 | |||
[[Image:Steroid synthesis.jpg|thumb|right|300px|ステロイドホルモンの生合成]] | |||
<br> ・P450 scc:コレステロール側鎖切断酵素(cholesterole side chain cleavage) | <br> ・P450 scc:コレステロール側鎖切断酵素(cholesterole side chain cleavage) | ||
・3β-HSD: 3β-ヒドキシステロイド脱水素酵素・異性化酵素 (3β-hydroxysteroid dehydrogenase) | ・3β-HSD: 3β-ヒドキシステロイド脱水素酵素・異性化酵素 (3β-hydroxysteroid dehydrogenase) | ||
| 51行目: | 51行目: | ||
・17β-HSD: 17β-ヒドキシステロイド脱水素酵素 | ・17β-HSD: 17β-ヒドキシステロイド脱水素酵素 | ||
<br> 炭素数27のコレステロールは、P450 sccの作用により、側鎖(炭素数6)が切断されてプレグネノロン(炭素数21)となる。この過程はホルモン分泌器官の間で共通したプロセスである。副腎では、最終的には炭素数の数は変化しないが、化学構造が変化を受けた[[糖質コルチコイド]] | <br> 炭素数27のコレステロールは、P450 sccの作用により、側鎖(炭素数6)が切断されてプレグネノロン(炭素数21)となる。この過程はホルモン分泌器官の間で共通したプロセスである。副腎では、最終的には炭素数の数は変化しないが、化学構造が変化を受けた[[糖質コルチコイド]]と[[鉱質コルチコイド]]が、また精巣では炭素数が2個減少した[[アンドロゲン]](炭素数19)が、さらに卵巣では炭素数が1個減少した[[エストロゲン]](炭素数18)が生成される。 | ||
<br> | <br> | ||
== ステロイドホルモンの種類 == | == ステロイドホルモンの種類 == | ||
=== 副腎皮質ホルモン === | |||
副腎皮質ホルモンは、[[鉱質コルチコイド]]と[[糖質コルチコイド]]の2種に大別される。鉱質コルチコイドの代表はアルドステロンであり、糖質コルチコイドは主にコルチゾールやコルチコステロンである。 | |||
鉱質コルチコイド:アルドステロンは副腎皮質球状帯で合成され、腎臓の集合管に作用してナトリウムイオンの再吸収とカリウムイオンの排泄を促進する。ナトリウムイオンの再吸収によって間質液の浸透圧が上昇し水の再吸収も増加するため、体液量の調節にも重要な役割を果たす。 | |||
糖質コルチコイド:コルチゾール(コルチコステロン)は副腎皮質束状帯と網状帯にて合成され、その作用は糖代謝の調節、抗炎症作用、中枢神経系を介した情動や認知機能に対する作用、抗ストレス作用など多岐にわたる。糖代謝に関しては、糖新生を促進して血糖値を上昇させる。抗炎症作用のメカニズムとしては、リソソーム膜を安定化して、その中に含まれるタンパク質分解酵素の遊出を防ぐことにより拡大を防いでいると考えられている。また、肥満細胞によるヒスタミンの放出を防ぎ、毛細血管の透過性の上昇を抑えて局所の浮腫を軽減し、さらにプロスタグランジンの合成を制御し、高発熱作用・鎮痛作用を発揮すると考えられている。 | |||
=== 精巣ホルモン === | === 精巣ホルモン === | ||
精巣のライディッヒ細胞から分泌されるアンドロゲンは男性ホルモンとも呼ばれ、雄性化作用を持つホルモンの総称である。アンドロゲンにはテストステロンやアンドロステンジオン等が挙げられるが、その90%はテストステロンである。アンドロゲンは精子形成、輸精管・前立腺・精嚢・カウパー腺の維持、交尾等の雄の性行動、また攻撃行動等の社会行動にも関与している。 | |||
アンドロゲンと脳の性分化:アンドロゲンシャワーと呼ばれる、周生期動物の精巣から分泌される高濃度アンドロゲンの作用が脳の性分化の決定に重要な役割を担う<ref name=脳とホルモンの行動学>’’’近藤保彦、小川園子、菊水健史、山田一夫、富原一哉’’’ <br>脳とホルモンの行動学<br>''西村書店'':2010 </ref>。例えば、雄ラットの精巣を生後直後に摘出すると成熟後に雌特有の性行動を引き起こし、また出生一週間頃までの雌ラットにアンドロゲンを投与すると性成熟後も性周期は回帰せず無排卵となる。ラットの脳は生後1週間頃までは性的に未分化であり、周生期におこるアンドロゲンシャワーによって脳の雄性化と脱雌性化が起こる。このように、脳がアンドロゲンに対して高い感受性を示す時期は「脳の性分化の臨界期」と呼ばれる。 | |||
攻撃行動:テストステロンは、攻撃行動に深く関わるホルモンである。精巣を除去するとテストステロンの減少と共に攻撃行動は低下するが、テストステロンの投与により攻撃行動の回復が見られることが多くの研究で報告されている。テストステロンの作用経路は3種類存在し、テストステロンそのままの状態でアンドロゲン受容体に結合して作用する場合、5α-リダクターゼによりジヒドロテストステロンに代謝されアンドロゲン受容体に結合する場合、さらにアロマターゼによりエストラジオールに転換されてからエストロゲン受容体に結合して作用する場合である。程度の差はあるが、これら3種類の作用経路はどれも攻撃行動に関与していると考えられている。近年は、ノックアウトマウスを用いた攻撃行動解析が行われ、アロマターゼのノックアウトマウスでは、エストラジオールへの転換が起こらず血中テストステロン量が増大しているが、攻撃行動は出現しないこと<ref><pubmed>11182758</pubmed></ref>、アンドロゲン受容体やエストロゲンα受容体のノックアウトマウスでは、精巣除去前もしくは精巣除去後にテストステロンを投与してもほとんど攻撃行動を示さないことが報告されている<ref><pubmed>14747651</pubmed></ref><ref><pubmed>9037078</pubmed></ref><ref><pubmed> 9832445</pubmed></ref>。 | |||
=== 卵巣ホルモン === | |||
卵巣から分泌されている女性ホルモンは、エストラジオール、エストロン、プロゲステロンである。ヒトの場合、下垂体ホルモンのLHとFSHが周期的に分泌されて女性ホルモンの生合成が促進される。プロゲステロンは炭素数21のステロイドで、ステロイドホルモンすべての中間代謝物でもある。哺乳類では妊娠を維持し、交尾行動を抑制する。また、エストロゲンは炭素数18のステロイドホルモンでありアンドロゲンから生成される。エストロゲンはアンドロゲンのフェニル基A環の芳香化によって生成され、生物活性を持つエストロゲンは、17β-エストラジオール、エストロン、エストリオールである。内卵胞膜細胞で合成されたプロゲステロンから酵素の働きによりアンドロゲンが生成され、顆粒膜細胞内ですぐさまエストロゲンに変換される。エストロゲンは、雌の第二次性徴、水代謝、骨形成の他、交尾行動や子育て行動、母性攻撃行動等に重要な役割を果たしている。 | 卵巣から分泌されている女性ホルモンは、エストラジオール、エストロン、プロゲステロンである。ヒトの場合、下垂体ホルモンのLHとFSHが周期的に分泌されて女性ホルモンの生合成が促進される。プロゲステロンは炭素数21のステロイドで、ステロイドホルモンすべての中間代謝物でもある。哺乳類では妊娠を維持し、交尾行動を抑制する。また、エストロゲンは炭素数18のステロイドホルモンでありアンドロゲンから生成される。エストロゲンはアンドロゲンのフェニル基A環の芳香化によって生成され、生物活性を持つエストロゲンは、17β-エストラジオール、エストロン、エストリオールである。内卵胞膜細胞で合成されたプロゲステロンから酵素の働きによりアンドロゲンが生成され、顆粒膜細胞内ですぐさまエストロゲンに変換される。エストロゲンは、雌の第二次性徴、水代謝、骨形成の他、交尾行動や子育て行動、母性攻撃行動等に重要な役割を果たしている。 | ||
< | エストロゲンと性行動:多くのげっ歯類では、ロードーシスの発現は卵巣から分泌されるエストロゲンによって制御されている。通常の性周期では、ロードーシス反射はエストロゲン分泌の高まる入らん前後でのみ起こる。また卵巣を摘出しても、通常のホルモン分泌パターンを真似てエストロゲンとプロゲステロンを連続的に投与すると雌はロードーシスを示す。エストロゲン受容体にはERαとERβの2種類が存在するが、ロードーシス反射に関与しているのは主にERαだと考えられている。ERα遺伝子を損傷したαERKOマウスの雌は、エストロゲンとプロゲステロンを投与しても全くロードーシスを示さない。一方ERβ遺伝子を欠損したERβKOマウスの雌は通常の性周期を示し、発情期には野生型の雌とほぼ同等のロードーシス反応を示す<ref><pubmed>10536018</pubmed></ref><ref><pubmed>9832446</pubmed></ref> 。 | ||
ニューロステロイドとは脳で合成されるステロイドホルモンの総称である。脳は長年、末梢器官が合成・分泌するステロイドホルモンの標的器官として捉えられてきたが、1981年にフランスの内分泌学者Baulieuは、ラットの脳がコレステロールからプレグネノロンとデヒドロエピアンドロステロン(DHEA)を合成し硫酸や硫酸エステルに変換していることを見出し「ニューロステロイド」と命名した。現在では、脊椎動物のほとんどがニューロステロイドを合成していることが知られる<ref><pubmed>19505496 </pubmed></ref>。脳には、シトクロムP450sccに加え、ステロイド硫酸基転移酵素、3β-ヒドロキシステロイド脱水素酵素、5α(β)-還元酵素、17α-水酸化・開裂酵素、17β-水酸基脱水素酵素など、多くのステロイド合成酵素が存在することが証明され、脳は様々なニューロステロイドを合成していることが明らかとなった。ニューロステロイドは末梢内分泌器官を除去してもあまり変動しないことから、末梢内分泌器官とは独立したステロイド合成系を有していると考えられている。 | === ニューロステロイド === | ||
ニューロステロイドとは脳で合成されるステロイドホルモンの総称である。脳は長年、末梢器官が合成・分泌するステロイドホルモンの標的器官として捉えられてきたが、1981年にフランスの内分泌学者Baulieuは、ラットの脳がコレステロールからプレグネノロンとデヒドロエピアンドロステロン(DHEA)を合成し硫酸や硫酸エステルに変換していることを見出し「ニューロステロイド」と命名した。現在では、脊椎動物のほとんどがニューロステロイドを合成していることが知られる<ref><pubmed>19505496 </pubmed></ref>。脳には、シトクロムP450sccに加え、ステロイド硫酸基転移酵素、3β-ヒドロキシステロイド脱水素酵素、5α(β)-還元酵素、17α-水酸化・開裂酵素、17β-水酸基脱水素酵素など、多くのステロイド合成酵素が存在することが証明され、脳は様々なニューロステロイドを合成していることが明らかとなった。ニューロステロイドは末梢内分泌器官を除去してもあまり変動しないことから、末梢内分泌器官とは独立したステロイド合成系を有していると考えられている。 | |||
< | P450scc, 3β-HSDは、ニューロン、アストロサイト、オリゴデンドロサイトの全てに発現している。 | ||
<references/> | |||
2012年3月19日 (月) 15:57時点における版
英語名:steroid 独:steroide 仏:stéroïdes
ステロイドとは、分子中にステロイド核と称する骨格構造をもつ一連の有機化合物の総称である。ほとんどの動植物で生合成され、コレステロール、胆汁酸、ビタミンD、ステロイドホルモン等がその代表例である。
ステロイドの構造
ステロイド核とは、シクロペンタノペルヒドロフェナントレン核のことを指し、3つのイス型六員環と1つの五員環がつながった構造をしている[1]。右図のように構造式を書いた場合、それぞれの環を左下から順にA環、B環、C環、D環と呼ぶ。一部あるいはすべての炭素が水素化され、通常はC-10とC-13にメチル基を、また多くの場合C-17にアルキル基を有する。生体物質としてのステロイドはC-3位がヒドロキシル化もしくはカルボニル化されたステロール類である。
生体内ステロイド
コレステロール
コレステロールの分子式はC27H46Oで表わされ、ステロイド核の3位の炭素にOH基がついたステロールを基礎骨格とし、17位の炭素はアルキル化されている。その名称は、胆石からコレステロール固体を同定した際、ギリシャ語の胆汁を表すChole-、固体を表すstereos (個体)に加え、アルコールの化学命名接尾辞である-olを付けたことに由来する。動物では、コレステールの一部は食事から摂取されるが、主に肝臓と小腸でアセチルCoAより合成され、血液を介して全身に運ばれ、ホルモンや胆汁酸、ビタミンDの原料となる。血中においてコレステロールはHDLやLDL等のリポタンパク質と複合体を形成しており、LDLは肝臓から全身にコレステロールを運ぶ役割を担い、逆にHDLは余分なコレステロールを肝臓に戻す役割を担う。また、コレステロールは、リン脂質と共に代表的な細胞膜の成分であるが、コレステロールに富む膜領域は膜の流動性が低いことが知られる。細胞膜マイクロドメインもしくはミクロドメイン)として知られるカベオラや脂質ラフトは、コレステロールやスフィンゴミエリンに富んでおり、タンパク質受容体の集積やシグナル伝達の場と考えられている。
胆汁酸
胆汁酸(bile acid)とは、胆汁に含まれるステロイド誘導体の総称であり、ヒトではコール酸やデオキシコール酸がその代表である。胆汁酸は、肝臓にてシトクロムP450の作用によるコレステロールの酸化により合成される。胆汁酸は通常、グリシンやタウリンと結合して、グリココール酸(C26H43NO6)、やタウロコール酸(C26H45NO7S)等の抱合体として胆嚢に蓄積され、ビリルビンと共に胆汁として十二指腸に排出される。胆汁酸の主な役割は、脂質の乳化を促進し、食物脂肪の吸収を助けることである。
ビタミンD
ビタミンDは、ステロイド核のB環が9-10位の間で開環した構造を持つ。ビタミンDは側鎖構造の違いから、D2(エルゴカルシフェロール)とD3(コレカルシフェロール)に分けられ、D2は植物に、D3は動物に多く含まれる。ビタミンDは、コレステロールが代謝を受けてプロビタミンD3(7-デヒドロコレステロール)となった後、皮膚上で紫外線によりステロイド核のB環が開きプレビタミンD3((6Z)-タカルシオール)となる。プレビタミンD3は更に、ビタミンD3(コレカルシフェロール)へと異性化する。ビタミンD自体は生理活性を持たないが、肝臓と腎臓にて3つのP450(ビタミンD25-水酸化酵素、ビタミンD1α-水酸化酵素、ビタミンD24-水酸化酵素)の働きにより活性型ビタミンD(1,25-ジヒドロキシコレカルシフェロール)へと変換され、ビタミンD受容体を介して核内の標的遺伝子の転写活性を制御することによって作用を発揮する。標的遺伝子の1つとしてカルシウム結合タンパク質であるカルビンディンが挙げられる。ビタミンD受容体は小腸、腎臓、骨組織に存在しておりカルシウム代謝と密接な関わりを持ち、腸管におけるカルシウムの吸収や腎尿細管におけるカルシウムの再吸収を促進する。活性型ビタミンDの不足は小児ではくる病、成人では骨軟化症となる。
ステロイドホルモン
ステロイド核をもつホルモンをステロイドホルモンと呼ぶ。副腎、精巣、卵巣等の内分泌器官より分泌されるが、近年は脳でも合成されることが知られておりニューロステロイドと呼ばれている。ステロイドホルモンの特徴は、脂溶性であり分子量が低いために細胞膜を容易に通り抜けられること、また細胞質に存在するステロイドホルモン受容体に結合し、核内にて標的遺伝子の転写活性を調節することである。最近では、このような遺伝子発現を介したステロイドホルモンの作用に加え、極めて短時間のうちに作用を発揮する膜受容体の存在が推察されている。
ステロイドホルモンの生合成
ステロイドホルモンはコレステロールから、シトクロムP450系酵素の働きによって作られる。これらの酵素は小胞体膜かミトコンドリア内膜のいずれかに局在し、以下に挙げる酵素がステロイドホルモン合成酵素として知られる。これらのうち3β-HSDと17β-HSD以外はシトクロムP450系酵素である[2]。
・P450 scc:コレステロール側鎖切断酵素(cholesterole side chain cleavage)
・3β-HSD: 3β-ヒドキシステロイド脱水素酵素・異性化酵素 (3β-hydroxysteroid dehydrogenase)
・P450c17: 17α-水酸化・開裂酵素(17 α-hydoroxylase/17, 20 lyase)
・P450c21:21‐水酸化酵素(C21-hydroxylase)
・P450-11β: 11β-水酸化酵素(11β-hydroxylase)
・P450c18: アルドステロン合成酵素
・P450arom: アロマターゼ(aromatase)
・17β-HSD: 17β-ヒドキシステロイド脱水素酵素
炭素数27のコレステロールは、P450 sccの作用により、側鎖(炭素数6)が切断されてプレグネノロン(炭素数21)となる。この過程はホルモン分泌器官の間で共通したプロセスである。副腎では、最終的には炭素数の数は変化しないが、化学構造が変化を受けた糖質コルチコイドと鉱質コルチコイドが、また精巣では炭素数が2個減少したアンドロゲン(炭素数19)が、さらに卵巣では炭素数が1個減少したエストロゲン(炭素数18)が生成される。
ステロイドホルモンの種類
副腎皮質ホルモン
副腎皮質ホルモンは、鉱質コルチコイドと糖質コルチコイドの2種に大別される。鉱質コルチコイドの代表はアルドステロンであり、糖質コルチコイドは主にコルチゾールやコルチコステロンである。
鉱質コルチコイド:アルドステロンは副腎皮質球状帯で合成され、腎臓の集合管に作用してナトリウムイオンの再吸収とカリウムイオンの排泄を促進する。ナトリウムイオンの再吸収によって間質液の浸透圧が上昇し水の再吸収も増加するため、体液量の調節にも重要な役割を果たす。
糖質コルチコイド:コルチゾール(コルチコステロン)は副腎皮質束状帯と網状帯にて合成され、その作用は糖代謝の調節、抗炎症作用、中枢神経系を介した情動や認知機能に対する作用、抗ストレス作用など多岐にわたる。糖代謝に関しては、糖新生を促進して血糖値を上昇させる。抗炎症作用のメカニズムとしては、リソソーム膜を安定化して、その中に含まれるタンパク質分解酵素の遊出を防ぐことにより拡大を防いでいると考えられている。また、肥満細胞によるヒスタミンの放出を防ぎ、毛細血管の透過性の上昇を抑えて局所の浮腫を軽減し、さらにプロスタグランジンの合成を制御し、高発熱作用・鎮痛作用を発揮すると考えられている。
精巣ホルモン
精巣のライディッヒ細胞から分泌されるアンドロゲンは男性ホルモンとも呼ばれ、雄性化作用を持つホルモンの総称である。アンドロゲンにはテストステロンやアンドロステンジオン等が挙げられるが、その90%はテストステロンである。アンドロゲンは精子形成、輸精管・前立腺・精嚢・カウパー腺の維持、交尾等の雄の性行動、また攻撃行動等の社会行動にも関与している。
アンドロゲンと脳の性分化:アンドロゲンシャワーと呼ばれる、周生期動物の精巣から分泌される高濃度アンドロゲンの作用が脳の性分化の決定に重要な役割を担う[3]。例えば、雄ラットの精巣を生後直後に摘出すると成熟後に雌特有の性行動を引き起こし、また出生一週間頃までの雌ラットにアンドロゲンを投与すると性成熟後も性周期は回帰せず無排卵となる。ラットの脳は生後1週間頃までは性的に未分化であり、周生期におこるアンドロゲンシャワーによって脳の雄性化と脱雌性化が起こる。このように、脳がアンドロゲンに対して高い感受性を示す時期は「脳の性分化の臨界期」と呼ばれる。
攻撃行動:テストステロンは、攻撃行動に深く関わるホルモンである。精巣を除去するとテストステロンの減少と共に攻撃行動は低下するが、テストステロンの投与により攻撃行動の回復が見られることが多くの研究で報告されている。テストステロンの作用経路は3種類存在し、テストステロンそのままの状態でアンドロゲン受容体に結合して作用する場合、5α-リダクターゼによりジヒドロテストステロンに代謝されアンドロゲン受容体に結合する場合、さらにアロマターゼによりエストラジオールに転換されてからエストロゲン受容体に結合して作用する場合である。程度の差はあるが、これら3種類の作用経路はどれも攻撃行動に関与していると考えられている。近年は、ノックアウトマウスを用いた攻撃行動解析が行われ、アロマターゼのノックアウトマウスでは、エストラジオールへの転換が起こらず血中テストステロン量が増大しているが、攻撃行動は出現しないこと[4]、アンドロゲン受容体やエストロゲンα受容体のノックアウトマウスでは、精巣除去前もしくは精巣除去後にテストステロンを投与してもほとんど攻撃行動を示さないことが報告されている[5][6][7]。
卵巣ホルモン
卵巣から分泌されている女性ホルモンは、エストラジオール、エストロン、プロゲステロンである。ヒトの場合、下垂体ホルモンのLHとFSHが周期的に分泌されて女性ホルモンの生合成が促進される。プロゲステロンは炭素数21のステロイドで、ステロイドホルモンすべての中間代謝物でもある。哺乳類では妊娠を維持し、交尾行動を抑制する。また、エストロゲンは炭素数18のステロイドホルモンでありアンドロゲンから生成される。エストロゲンはアンドロゲンのフェニル基A環の芳香化によって生成され、生物活性を持つエストロゲンは、17β-エストラジオール、エストロン、エストリオールである。内卵胞膜細胞で合成されたプロゲステロンから酵素の働きによりアンドロゲンが生成され、顆粒膜細胞内ですぐさまエストロゲンに変換される。エストロゲンは、雌の第二次性徴、水代謝、骨形成の他、交尾行動や子育て行動、母性攻撃行動等に重要な役割を果たしている。
エストロゲンと性行動:多くのげっ歯類では、ロードーシスの発現は卵巣から分泌されるエストロゲンによって制御されている。通常の性周期では、ロードーシス反射はエストロゲン分泌の高まる入らん前後でのみ起こる。また卵巣を摘出しても、通常のホルモン分泌パターンを真似てエストロゲンとプロゲステロンを連続的に投与すると雌はロードーシスを示す。エストロゲン受容体にはERαとERβの2種類が存在するが、ロードーシス反射に関与しているのは主にERαだと考えられている。ERα遺伝子を損傷したαERKOマウスの雌は、エストロゲンとプロゲステロンを投与しても全くロードーシスを示さない。一方ERβ遺伝子を欠損したERβKOマウスの雌は通常の性周期を示し、発情期には野生型の雌とほぼ同等のロードーシス反応を示す[8][9] 。
ニューロステロイド
ニューロステロイドとは脳で合成されるステロイドホルモンの総称である。脳は長年、末梢器官が合成・分泌するステロイドホルモンの標的器官として捉えられてきたが、1981年にフランスの内分泌学者Baulieuは、ラットの脳がコレステロールからプレグネノロンとデヒドロエピアンドロステロン(DHEA)を合成し硫酸や硫酸エステルに変換していることを見出し「ニューロステロイド」と命名した。現在では、脊椎動物のほとんどがニューロステロイドを合成していることが知られる[10]。脳には、シトクロムP450sccに加え、ステロイド硫酸基転移酵素、3β-ヒドロキシステロイド脱水素酵素、5α(β)-還元酵素、17α-水酸化・開裂酵素、17β-水酸基脱水素酵素など、多くのステロイド合成酵素が存在することが証明され、脳は様々なニューロステロイドを合成していることが明らかとなった。ニューロステロイドは末梢内分泌器官を除去してもあまり変動しないことから、末梢内分泌器官とは独立したステロイド合成系を有していると考えられている。
P450scc, 3β-HSDは、ニューロン、アストロサイト、オリゴデンドロサイトの全てに発現している。
- ↑ G. P. Moss (1989). "Nomenclature of Steroids (Recommendations 1989)". Pure & Appl. Chem. 61 (10): 1783–1822. doi:10.1351/pac198961101783.
- ↑ 竹森重樹
ステロイドホルモン
共立出版:1998 - ↑ ’’’近藤保彦、小川園子、菊水健史、山田一夫、富原一哉’’’
脳とホルモンの行動学
西村書店:2010 - ↑
Toda, K., Saibara, T., Okada, T., Onishi, S., & Shizuta, Y. (2001).
A loss of aggressive behaviour and its reinstatement by oestrogen in mice lacking the aromatase gene (Cyp19). The Journal of endocrinology, 168(2), 217-20. [PubMed:11182758] [WorldCat] [DOI] - ↑
Sato, T., Matsumoto, T., Kawano, H., Watanabe, T., Uematsu, Y., Sekine, K., ..., & Kato, S. (2004).
Brain masculinization requires androgen receptor function. Proceedings of the National Academy of Sciences of the United States of America, 101(6), 1673-8. [PubMed:14747651] [PMC] [WorldCat] [DOI] - ↑
Ogawa, S., Lubahn, D.B., Korach, K.S., & Pfaff, D.W. (1997).
Behavioral effects of estrogen receptor gene disruption in male mice. Proceedings of the National Academy of Sciences of the United States of America, 94(4), 1476-81. [PubMed:9037078] [PMC] [WorldCat] [DOI] - ↑
Ogawa, S., Washburn, T.F., Taylor, J., Lubahn, D.B., Korach, K.S., & Pfaff, D.W. (1998).
Modifications of testosterone-dependent behaviors by estrogen receptor-alpha gene disruption in male mice. Endocrinology, 139(12), 5058-69. [PubMed:9832445] [WorldCat] [DOI] - ↑
Ogawa, S., Chan, J., Chester, A.E., Gustafsson, J.A., Korach, K.S., & Pfaff, D.W. (1999).
Survival of reproductive behaviors in estrogen receptor beta gene-deficient (betaERKO) male and female mice. Proceedings of the National Academy of Sciences of the United States of America, 96(22), 12887-92. [PubMed:10536018] [PMC] [WorldCat] [DOI] - ↑
Ogawa, S., Eng, V., Taylor, J., Lubahn, D.B., Korach, K.S., & Pfaff, D.W. (1998).
Roles of estrogen receptor-alpha gene expression in reproduction-related behaviors in female mice. Endocrinology, 139(12), 5070-81. [PubMed:9832446] [WorldCat] [DOI] - ↑
Do Rego, J.L., Seong, J.Y., Burel, D., Leprince, J., Luu-The, V., Tsutsui, K., ..., & Vaudry, H. (2009).
Neurosteroid biosynthesis: enzymatic pathways and neuroendocrine regulation by neurotransmitters and neuropeptides. Frontiers in neuroendocrinology, 30(3), 259-301. [PubMed:19505496] [WorldCat] [DOI]