「デルタ型グルタミン酸受容体」の版間の差分
細編集の要約なし |
細編集の要約なし |
||
| 16行目: | 16行目: | ||
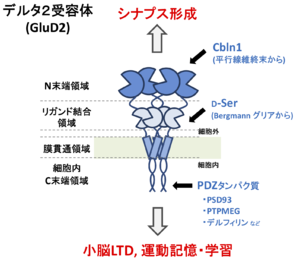
[[ファイル:Yuzaki Fig 1.png|サムネイル|'''図1. GluD2の機能領域の模式図''']] | [[ファイル:Yuzaki Fig 1.png|サムネイル|'''図1. GluD2の機能領域の模式図''']] | ||
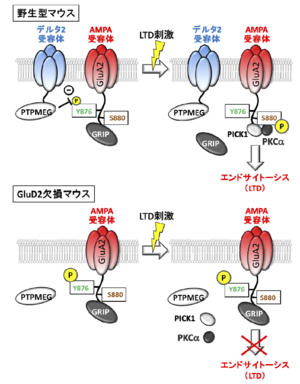
[[ファイル:Yuzaki Fig 2.png|サムネイル|'''図2. GluD2のC末端領域を介した、長期抑圧(LTD)の制御機構''']] | [[ファイル:Yuzaki Fig 2.png|サムネイル|'''図2. GluD2のC末端領域を介した、長期抑圧(LTD)の制御機構''']] | ||
デルタ型グルタミン酸受容体(GluD)はそのアミノ酸配列の相同性から、[[イオンチャネル型グルタミン酸受容体]]に分類され、[[デルタ型グルタミン酸受容体#デルタ1受容体|デルタ1受容体]]([[デルタ型グルタミン酸受容体#デルタ1受容体|GluD1]])と[[デルタ型グルタミン酸受容体#デルタ2受容体|デルタ2受容体]]([[デルタ型グルタミン酸受容体#デルタ2受容体|GluD2]])がそのメンバーである<ref name=Yuzaki2017><pubmed>28110935</pubmed></ref>。'''図1'''に示すように、GluD1とGluD2の各サブユニットがホモ4量体として主に機能する。GluD1とGluD2が同じ神経細胞においてヘテロ4量体を形成する場合があるかはよく分かっていない。他のイオンチャネル型グルタミン酸受容体と同様、機能的ドメインとして細胞外のN末端領域およびリガンド結合領域、膜貫通領域、細胞内領域に大きく分けられる。 | デルタ型グルタミン酸受容体(GluD)はそのアミノ酸配列の相同性から、[[イオンチャネル型グルタミン酸受容体]]に分類され、[[デルタ型グルタミン酸受容体#デルタ1受容体|デルタ1受容体]]([[デルタ型グルタミン酸受容体#デルタ1受容体|GluD1]])と[[デルタ型グルタミン酸受容体#デルタ2受容体|デルタ2受容体]]([[デルタ型グルタミン酸受容体#デルタ2受容体|GluD2]])がそのメンバーである<ref name=Yuzaki2017><pubmed>28110935</pubmed></ref>。'''図1'''に示すように、GluD1とGluD2の各サブユニットがホモ4量体として主に機能する。GluD1とGluD2が同じ神経細胞においてヘテロ4量体を形成する場合があるかはよく分かっていない。他のイオンチャネル型グルタミン酸受容体と同様、機能的ドメインとして細胞外のN末端領域およびリガンド結合領域、膜貫通領域、細胞内領域に大きく分けられる。 | ||
| 32行目: | 30行目: | ||
GluD2が実際にどのように機能するかは、GluD2欠損マウスのプルキンエ細胞にGluD2の各領域の変異体を導入することによる、表現型回復実験を通して明らかになった。(その詳しい経緯については、文献<ref name=Yuzaki2017><pubmed>28110935</pubmed></ref> を参照。) | GluD2が実際にどのように機能するかは、GluD2欠損マウスのプルキンエ細胞にGluD2の各領域の変異体を導入することによる、表現型回復実験を通して明らかになった。(その詳しい経緯については、文献<ref name=Yuzaki2017><pubmed>28110935</pubmed></ref> を参照。) | ||
GluD2の細胞内C末端は、[[PSD-93]]、[[PTPMEG]]、[[デルフィリン]]などの[[PDZタンパク質]] | GluD2の細胞内C末端は、[[PSD-93]]、[[PTPMEG]]、[[デルフィリン]]などの[[PDZタンパク質]]と結合する('''図1''')。この中で、PTPMEGとの結合が、そのチロシン[[脱リン酸化酵素]]活性によってLTDの誘導に重要な働きをすることが示された。 | ||
[[AMPA型グルタミン酸受容体]]の[[GluA2]]サブユニットのC末端には[[GRIP]]が結合し、定常状態ではAMPA型グルタミン酸受容体はシナプス後部の細胞膜に繋留されている。平行線維刺激によって神経活動が亢進すると、シナプス後部に存在する[[代謝型グルタミン酸受容体1型]]([[mGluR1]])が活性化される。 | [[AMPA型グルタミン酸受容体]]の[[GluA2]]サブユニットのC末端には[[GRIP]]が結合し、定常状態ではAMPA型グルタミン酸受容体はシナプス後部の細胞膜に繋留されている。平行線維刺激によって神経活動が亢進すると、シナプス後部に存在する[[代謝型グルタミン酸受容体1型]]([[mGluR1]])が活性化される。 | ||
同時に登上線維刺激あるいはプルキンエ細胞[[脱分極]]によって細胞内Ca濃度が上昇すると[[プロテインキナーゼC]]([[PKC]])が一定時間活性化される。PKCがGluA2サブユニットの[[セリン]]残基(S880)をリン酸化<ref name=Matsuda2000><pubmed>10856222</pubmed></ref> | 同時に登上線維刺激あるいはプルキンエ細胞[[脱分極]]によって細胞内Ca濃度が上昇すると[[プロテインキナーゼC]]([[PKC]])が一定時間活性化される。PKCがGluA2サブユニットの[[セリン]]残基(S880)をリン酸化<ref name=Matsuda2000><pubmed>10856222</pubmed></ref> するとGRIPが乖離し、AMPA型グルタミン酸受容体が側方拡散できるようになり、棘突起周辺に存在する特定の部位に到達するとAMPA型グルタミン酸受容体はエンドサイトーシスされる。このような平行線維と登上線維活動亢進に引き続く一連の現象の結果、シナプス後部のAMPA型グルタミン酸受容体の数が減少し、平行線維シナプス伝達が減弱することがLTDの実体である('''図2''')。 | ||
GluA2-S880の近傍には[[チロシン]]残基(Y876)が存在し、Y876がリン酸化されているとLTD誘導に必要なPKCによるS880のリン酸化が抑制される。このチロシン残基はPTPMEGの基質であるため<ref name=Kohda2013><pubmed>23431139</pubmed></ref> 、GluD2のC末端に結合したPTPMEGがシナプス後部に存在すると、GluA2-Y876が脱リン酸化状態となりはじめてLTDが誘導可能な状態となる。 | GluA2-S880の近傍には[[チロシン]]残基(Y876)が存在し、Y876がリン酸化されているとLTD誘導に必要なPKCによるS880のリン酸化が抑制される。このチロシン残基はPTPMEGの基質であるため<ref name=Kohda2013><pubmed>23431139</pubmed></ref> 、GluD2のC末端に結合したPTPMEGがシナプス後部に存在すると、GluA2-Y876が脱リン酸化状態となりはじめてLTDが誘導可能な状態となる。 | ||
このように、GluD2の機能はLTDの起き易さを制御する門番としての役割を果たすと考えられる('''図2''')。 | |||
==== N末端領域の機能―シナプス形成 ==== | ==== N末端領域の機能―シナプス形成 ==== | ||
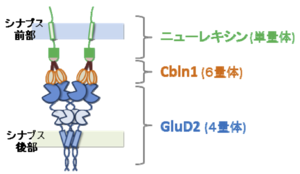
[[ファイル:Yuzaki Fig 3.png|サムネイル|'''図3. 両方向性のシナプス・オーガナイザーとして機能する、ニューレキシン-Cbln1-GluD2複合体の模式図''']] | |||
GluD2の細胞外領域は、N末端領域とリガンド結合領域から構成される('''図1''')。 | |||
GluD2のN末端領域は、平行線維-プルキンエ細胞シナプス形成に必要かつ十分である<ref name=Kakegawa2009><pubmed>19420242</pubmed></ref> 。このN末端領域には[[Cbln1]]が結合する<ref name=Matsuda2010><pubmed>20395510</pubmed></ref> 。Cbln1は[[C1q]]/[[TNF]]スーパーファミリーに属する糖タンパク質であり、小脳顆粒細胞から分泌される。また、Cbln1はシナプス前部に存在する細胞接着分子である[[ニューレキシン]]のうち、S4配列を有するスプライシング・バリアントに特異的に結合する<ref name=Uemura2010><pubmed>20537373</pubmed></ref><ref name=Matsuda2011><pubmed>21410790</pubmed></ref> | GluD2のN末端領域は、平行線維-プルキンエ細胞シナプス形成に必要かつ十分である<ref name=Kakegawa2009><pubmed>19420242</pubmed></ref> 。このN末端領域には[[Cbln1]]が結合する<ref name=Matsuda2010><pubmed>20395510</pubmed></ref> 。Cbln1は[[C1q]]/[[TNF]]スーパーファミリーに属する糖タンパク質であり、小脳顆粒細胞から分泌される。また、Cbln1はシナプス前部に存在する細胞接着分子である[[ニューレキシン]]のうち、S4配列を有するスプライシング・バリアントに特異的に結合する<ref name=Uemura2010><pubmed>20537373</pubmed></ref><ref name=Matsuda2011><pubmed>21410790</pubmed></ref> 。ニューレキシン、Cbln1、GluD2が3者コンプレックスを形成して、シナプス前部にシナプス小胞を集め、シナプス後部にGluD2やその結合タンパク質、さらにはAMPA受容体などを集積させることが明らかにされている。つまり、ニューレキシン-Cbln1-GluD2の3者コンプレックスは、両方向性のシナプス・オーガナイザーとして機能する('''図3''')。 | ||
近年の構造学的解析から、この3者コンプレックスはGluD2 : Cbln1 : ニューレキシン = 1(4量体): 2(6量体): 2(単量体)のストイキオメトリーで構成されていることが分かった<ref name=Elegheert2016><pubmed>27418511</pubmed></ref> 。 | 近年の構造学的解析から、この3者コンプレックスはGluD2 : Cbln1 : ニューレキシン = 1(4量体): 2(6量体): 2(単量体)のストイキオメトリーで構成されていることが分かった<ref name=Elegheert2016><pubmed>27418511</pubmed></ref> 。 | ||
==== リガンド結合領域の機能―D-セリンLTD ==== | ==== リガンド結合領域の機能―D-セリンLTD ==== | ||
GluD2のリガンド結合領域には[[D-セリン]]や[[グリシン]]が結合することが、構造学的研究から明らかになった。しかしD-セリン結合によってもGluD2はチャネル活性を示さない<ref name=Naur2007><pubmed>17715062</pubmed></ref> | GluD2のリガンド結合領域には[[D-セリン]]や[[グリシン]]が結合することが、構造学的研究から明らかになった。しかしD-セリン結合によってもGluD2はチャネル活性を示さない<ref name=Naur2007><pubmed>17715062</pubmed></ref> 。またこれらのリガンドと結合しないGluD2変異体('''図1''')を成熟したGluD2欠損マウスのプルキンエ細胞に発現させると、平行線維シナプスでのLTD障害とシナプス低形成をともに回復させる<ref name=Hirai2005><pubmed>15592450</pubmed></ref> 。したがって、GluD2のリガンド結合領域は少なくとも成熟後のプルキンエ細胞においてはLTDやシナプス形成には寄与しないと考えられる。 | ||
一方、D-セリンを投与すると、培養プルキンエ細胞ではAMPA受容体のエンドサイトーシスが誘導され、小脳切片では平行線維-プルキンエ細胞シナプス伝達が低下して平行線維シナプスでLTDが起きる。GluD2欠損マウスや、リガンド結合部位GluD2変異体を発現するプルキンエ細胞ではこれらの現象は起きない。[[NMDA型グルタミン酸受容体]]阻害剤は、通常の平行線維の刺激条件で引き起こされるLTDを阻害するが、D-セリン投与によって誘導されるLTDには影響しない。このように、D-セリンがGluD2のリガンド結合領域に結合することによって、新たなシナプス可塑性(D-セリンLTD)が引き起こされることが明らかとなった。D-セリンLTDにおいても、通常のLTDと同様に、GluD2のC末端領域が必要である<ref name=Kakegawa2011><pubmed>21460832</pubmed></ref> 。 | 一方、D-セリンを投与すると、培養プルキンエ細胞ではAMPA受容体のエンドサイトーシスが誘導され、小脳切片では平行線維-プルキンエ細胞シナプス伝達が低下して平行線維シナプスでLTDが起きる。GluD2欠損マウスや、リガンド結合部位GluD2変異体を発現するプルキンエ細胞ではこれらの現象は起きない。[[NMDA型グルタミン酸受容体]]阻害剤は、通常の平行線維の刺激条件で引き起こされるLTDを阻害するが、D-セリン投与によって誘導されるLTDには影響しない。このように、D-セリンがGluD2のリガンド結合領域に結合することによって、新たなシナプス可塑性(D-セリンLTD)が引き起こされることが明らかとなった。D-セリンLTDにおいても、通常のLTDと同様に、GluD2のC末端領域が必要である<ref name=Kakegawa2011><pubmed>21460832</pubmed></ref> 。 | ||
| 59行目: | 58行目: | ||
==== 膜貫通領域の機能―GluD2はチャネルとして機能するか? ==== | ==== 膜貫通領域の機能―GluD2はチャネルとして機能するか? ==== | ||
イオンチャネル型グルタミン酸受容体のチャネルポアを形成する膜貫通領域は進化的に保存されている('''図1''')。他のイオンチャネル型グルタミン酸受容体でイオン透過性を喪失させる変異を持つGluD2はLTDを回復させ<ref name=Kakegawa2007><pubmed>17702810</pubmed></ref> 、また、GluD2のN末端領域とC末端領域のみを持つ変異体は、LTDもシナプス形成も回復させる<ref name=Torashima2009><pubmed>19614753</pubmed></ref> 。従って、少なくともLTDの誘導過程においては、GluD2はイオンチャネルとして機能する必要がないと考えられる。 | |||
GluD2のチャネル活性が、mGluR1の活性化によって、時間経過の長い、[[遅いシナプス後電流]]として現れるとの報告がある<ref name=Ady2014><pubmed>24357660</pubmed></ref> 。ただ、プルキンエ細胞における遅いシナプス後電流は、非選択的カチオンチャネルである[[TRPC3]]チャネルを介することが知られている<ref name=Hartmann2008><pubmed>18701065</pubmed></ref> 。GluD2のチャネル活性として報告されたシナプス後電流もTRPC3電流を観察していた可能性があり、GluD2がイオンチャネルとして機能するか否かは、未だ結論が出ていない。 | GluD2のチャネル活性が、mGluR1の活性化によって、時間経過の長い、[[遅いシナプス後電流]]として現れるとの報告がある<ref name=Ady2014><pubmed>24357660</pubmed></ref> 。ただ、プルキンエ細胞における遅いシナプス後電流は、非選択的カチオンチャネルである[[TRPC3]]チャネルを介することが知られている<ref name=Hartmann2008><pubmed>18701065</pubmed></ref> 。GluD2のチャネル活性として報告されたシナプス後電流もTRPC3電流を観察していた可能性があり、GluD2がイオンチャネルとして機能するか否かは、未だ結論が出ていない。 | ||
2018年11月17日 (土) 08:43時点における版
掛川 渉
慶應義塾大学医学部生理学教室
幸田 和久
聖マリアンナ医科大学生理学教室
DOI:10.14931/bsd.7738 原稿受付日:2018年6月12日 原稿完成日:2018年10月14日
担当編集委員:林 康紀(京都大学大学院医学研究科システム神経薬理分野)
英語名:delta-type glutamate receptor
デルタ型グルタミン酸受容体(GluD)は、イオンチャネル型グルタミン酸受容体ファミリーに属し、GluD1とGluD2の各サブユニットがホモ4量体を形成する。GluDはアミノ酸配列からはグルタミン酸受容体に属するものの、グルタミン酸結合によっては活性化されず、内因性リガンドが不明であることから長らく孤児受容体と呼ばれていた。しかしシナプス前部から分泌されるCblnファミリー分子とグリア細胞から放出されるD-セリンがGluD2の内因性のリガンドであることが明らかになった。シナプス後部に発現するGluD2は、シナプス前部に存在するニューレキシン及びCbln1と3者コンプレックスを形成するとで、両方向性のシナプス・オーガナイザーとして機能する。GluD2の細胞内C末端はシナプス可塑性に寄与する。GluD1もGluD2同様なリガンドやシグナル伝達機構をもつと考えられている。GluD自身がイオンチャネル活性を持つかは、確定していない。近年のヒトゲノム解析研究から、GluDは精神疾患との関連が示唆されている。
構造・ファミリー分子
デルタ型グルタミン酸受容体(GluD)はそのアミノ酸配列の相同性から、イオンチャネル型グルタミン酸受容体に分類され、デルタ1受容体(GluD1)とデルタ2受容体(GluD2)がそのメンバーである[1]。図1に示すように、GluD1とGluD2の各サブユニットがホモ4量体として主に機能する。GluD1とGluD2が同じ神経細胞においてヘテロ4量体を形成する場合があるかはよく分かっていない。他のイオンチャネル型グルタミン酸受容体と同様、機能的ドメインとして細胞外のN末端領域およびリガンド結合領域、膜貫通領域、細胞内領域に大きく分けられる。
デルタ2受容体
発現
GluD2は小脳プルキンエ細胞に非常に強く発現し[2] 、とりわけその樹状突起の棘突起に局在する。小脳では、分子層介在ニューロン[3]にも発現している。またGluD2は、大脳皮質、海馬、線条体、視床、中脳、網膜など、小脳以外の多くの領域にも発現することが明らかになっている[4] 。
機能
小脳顆粒細胞の軸索は平行線維と呼ばれ、小脳プルキンエ細胞の遠位樹状突起の棘突起上においてシナプスを形成する。GluD2欠損マウスでは、平行線維-プルキンエ細胞シナプスの数が正常の60%ほどに減少し、小脳性の運動失調を呈する[5] 。神経活動が一定期間亢進すると平行線維-プルキンエ細胞シナプス伝達が長期抑圧(long-term depression; LTD)[6]されることが知られており、この現象が小脳運動学習に重要な働きをすると考えられているが、GluD2欠損マウスではLTDが障害される。
このように、GluD2は平行線維-プルキンエ細胞シナプスにおいてシナプス形成とシナプス可塑性という2つの機能を担う。
細胞内C末端領域の機能―シナプス可塑性
GluD2が実際にどのように機能するかは、GluD2欠損マウスのプルキンエ細胞にGluD2の各領域の変異体を導入することによる、表現型回復実験を通して明らかになった。(その詳しい経緯については、文献[1] を参照。)
GluD2の細胞内C末端は、PSD-93、PTPMEG、デルフィリンなどのPDZタンパク質と結合する(図1)。この中で、PTPMEGとの結合が、そのチロシン脱リン酸化酵素活性によってLTDの誘導に重要な働きをすることが示された。
AMPA型グルタミン酸受容体のGluA2サブユニットのC末端にはGRIPが結合し、定常状態ではAMPA型グルタミン酸受容体はシナプス後部の細胞膜に繋留されている。平行線維刺激によって神経活動が亢進すると、シナプス後部に存在する代謝型グルタミン酸受容体1型(mGluR1)が活性化される。
同時に登上線維刺激あるいはプルキンエ細胞脱分極によって細胞内Ca濃度が上昇するとプロテインキナーゼC(PKC)が一定時間活性化される。PKCがGluA2サブユニットのセリン残基(S880)をリン酸化[7] するとGRIPが乖離し、AMPA型グルタミン酸受容体が側方拡散できるようになり、棘突起周辺に存在する特定の部位に到達するとAMPA型グルタミン酸受容体はエンドサイトーシスされる。このような平行線維と登上線維活動亢進に引き続く一連の現象の結果、シナプス後部のAMPA型グルタミン酸受容体の数が減少し、平行線維シナプス伝達が減弱することがLTDの実体である(図2)。
GluA2-S880の近傍にはチロシン残基(Y876)が存在し、Y876がリン酸化されているとLTD誘導に必要なPKCによるS880のリン酸化が抑制される。このチロシン残基はPTPMEGの基質であるため[8] 、GluD2のC末端に結合したPTPMEGがシナプス後部に存在すると、GluA2-Y876が脱リン酸化状態となりはじめてLTDが誘導可能な状態となる。
このように、GluD2の機能はLTDの起き易さを制御する門番としての役割を果たすと考えられる(図2)。
N末端領域の機能―シナプス形成
GluD2の細胞外領域は、N末端領域とリガンド結合領域から構成される(図1)。
GluD2のN末端領域は、平行線維-プルキンエ細胞シナプス形成に必要かつ十分である[9] 。このN末端領域にはCbln1が結合する[10] 。Cbln1はC1q/TNFスーパーファミリーに属する糖タンパク質であり、小脳顆粒細胞から分泌される。また、Cbln1はシナプス前部に存在する細胞接着分子であるニューレキシンのうち、S4配列を有するスプライシング・バリアントに特異的に結合する[11][12] 。ニューレキシン、Cbln1、GluD2が3者コンプレックスを形成して、シナプス前部にシナプス小胞を集め、シナプス後部にGluD2やその結合タンパク質、さらにはAMPA受容体などを集積させることが明らかにされている。つまり、ニューレキシン-Cbln1-GluD2の3者コンプレックスは、両方向性のシナプス・オーガナイザーとして機能する(図3)。
近年の構造学的解析から、この3者コンプレックスはGluD2 : Cbln1 : ニューレキシン = 1(4量体): 2(6量体): 2(単量体)のストイキオメトリーで構成されていることが分かった[13] 。
リガンド結合領域の機能―D-セリンLTD
GluD2のリガンド結合領域にはD-セリンやグリシンが結合することが、構造学的研究から明らかになった。しかしD-セリン結合によってもGluD2はチャネル活性を示さない[14] 。またこれらのリガンドと結合しないGluD2変異体(図1)を成熟したGluD2欠損マウスのプルキンエ細胞に発現させると、平行線維シナプスでのLTD障害とシナプス低形成をともに回復させる[15] 。したがって、GluD2のリガンド結合領域は少なくとも成熟後のプルキンエ細胞においてはLTDやシナプス形成には寄与しないと考えられる。
一方、D-セリンを投与すると、培養プルキンエ細胞ではAMPA受容体のエンドサイトーシスが誘導され、小脳切片では平行線維-プルキンエ細胞シナプス伝達が低下して平行線維シナプスでLTDが起きる。GluD2欠損マウスや、リガンド結合部位GluD2変異体を発現するプルキンエ細胞ではこれらの現象は起きない。NMDA型グルタミン酸受容体阻害剤は、通常の平行線維の刺激条件で引き起こされるLTDを阻害するが、D-セリン投与によって誘導されるLTDには影響しない。このように、D-セリンがGluD2のリガンド結合領域に結合することによって、新たなシナプス可塑性(D-セリンLTD)が引き起こされることが明らかとなった。D-セリンLTDにおいても、通常のLTDと同様に、GluD2のC末端領域が必要である[16] 。
成熟後の小脳にはD-セリンはほとんど検出できないが、生後発達期には豊富に存在する。実際に生後発達期のマウスの小脳切片において、平行線維を高頻度刺激すると平行線維から放出されるグルタミン酸がspilloverし、近接するBergmannグリアのCa2+透過型AMPA受容体を活性化することによって、BergmannグリアからD-セリンが放出されることが分かった[16] 。
また生後発達期のマウスの小脳切片においては、平行線維の高頻度刺激とプルキンエ細胞の脱分極を組み合わせると、平行線維-プルキンエ細胞シナプスでD-セリンLTDが誘導される[16] 。D-セリンLTDは、幼若期の運動学習促進に重要な役割を果たしていることが示唆されている[16] 。
膜貫通領域の機能―GluD2はチャネルとして機能するか?
イオンチャネル型グルタミン酸受容体のチャネルポアを形成する膜貫通領域は進化的に保存されている(図1)。他のイオンチャネル型グルタミン酸受容体でイオン透過性を喪失させる変異を持つGluD2はLTDを回復させ[17] 、また、GluD2のN末端領域とC末端領域のみを持つ変異体は、LTDもシナプス形成も回復させる[18] 。従って、少なくともLTDの誘導過程においては、GluD2はイオンチャネルとして機能する必要がないと考えられる。
GluD2のチャネル活性が、mGluR1の活性化によって、時間経過の長い、遅いシナプス後電流として現れるとの報告がある[19] 。ただ、プルキンエ細胞における遅いシナプス後電流は、非選択的カチオンチャネルであるTRPC3チャネルを介することが知られている[20] 。GluD2のチャネル活性として報告されたシナプス後電流もTRPC3電流を観察していた可能性があり、GluD2がイオンチャネルとして機能するか否かは、未だ結論が出ていない。
小脳以外に発現するGluD2
GluD2は小脳プルキンエ細胞に圧倒的に強く発現するが、小脳の分子層介在ニューロンにも発現している[3] 。また小脳外では、大脳皮質、海馬、線条体、視床、中脳、網膜など、多くの領域に発現することが明らかになっている[4] 。Cblnファミリーには、Cbln1の他にCbln2~4が存在し、これらも脳の様々な領域に発現していることから、小脳外におけるGluD2もCbln、ニューレキシンとともに、シナプス形成とシナプス可塑性に寄与していると考えられる。
デルタ1受容体
発現
デルタ1受容体(GluD1)は成体では、大脳皮質、線条体、海馬、扁桃体中心核、小脳皮質など、多くの脳領域に発現するほか、内耳の有毛細胞に強く発現している。
機能
GluD1もCbln1(やそのファミリー分子)やニューレキシンとin vitroにて結合する。小脳では、分子層介在ニューロンの細胞体における平行線維とのシナプスにGluD1が局在する[21] 。GluD1欠損マウスでは同シナプスが減少するので、GluD2と同様、ニューレキシン-Cbln1-GluD1の3者コンプレックスがシナプス形成に寄与していると考えられる。また、GluD1欠損マウスは高周波の聴覚障害を示すほか[22] 、うつ様行動、攻撃性の亢進、社会性の障害などが見られ[23] 、以下に述べるヒトゲノム研究の成果も併せ、精神疾患との関連が示唆される。
GluD1の細胞内シグナリングについてはまだ十分分かっていない。GluD1欠損マウスでは、海馬においてmGluR5刺激によるAMPA型受容体受容体のエンドサイトーシスが障害されており、Akt-mTORシグナリングの亢進が示唆されている[24] 。また、GluD1のC末端にもGluD2と同じPDZタンパク質が結合するので、シグナリング経路を共有する可能性がある。
GluDと疾患
GluD遺伝子は、マウスではGrid、ヒトではGRIDと呼ばれる。Grid1及び2はそれぞれ第14染色体と第6染色体に、 GRID1及び2は 10q23、4q22に存在する。
GluD遺伝子の特徴は、他のイオンチャネル型グルタミン酸受容体の遺伝子に比べて、そのコーディング領域が長いことで、Grid1、GRID1では約750 kb、Grid2、GRID2は約1.5 Mbである。特に、Grid2は染色体脆弱部位に位置するため、表現型としてnull変異を呈する自然発生変異マウスhotfootが多数報告されている[25] 。
ヒトにおいてもGRID2に変異を持つ家系が相次いで報告され、患者は著しい小脳萎縮と運動失調、眼球運動障害を示すほか、知能や言語の障害も見られた[26][27][28][29] 。こうした高次の脳機能の障害が、GluD2欠損による小脳の非運動性機能の障害に起因するのか、小脳以外に発現しているGluD2の機能を反映した異常なのかは明らかではない。またヒトゲノムの解析からは、GRID1及びGRID2の一塩基多型やコピー数多型と統合失調症、双極性障害、自閉症スペクトラム障害などとの関連性が報告されている[1] 。
参考文献
- ↑ 1.0 1.1 1.2
Yuzaki, M., & Aricescu, A.R. (2017).
A GluD Coming-Of-Age Story. Trends in neurosciences, 40(3), 138-150. [PubMed:28110935] [PMC] [WorldCat] [DOI] - ↑
Lomeli, H., Sprengel, R., Laurie, D.J., Köhr, G., Herb, A., Seeburg, P.H., & Wisden, W. (1993).
The rat delta-1 and delta-2 subunits extend the excitatory amino acid receptor family. FEBS letters, 315(3), 318-22. [PubMed:8422924] [WorldCat] [DOI] - ↑ 3.0 3.1
Yamasaki, M., Miyazaki, T., Azechi, H., Abe, M., Natsume, R., Hagiwara, T., ..., & Watanabe, M. (2011).
Glutamate receptor δ2 is essential for input pathway-dependent regulation of synaptic AMPAR contents in cerebellar Purkinje cells. The Journal of neuroscience : the official journal of the Society for Neuroscience, 31(9), 3362-74. [PubMed:21368048] [PMC] [WorldCat] [DOI] - ↑ 4.0 4.1
Hepp, R., Hay, Y.A., Aguado, C., Lujan, R., Dauphinot, L., Potier, M.C., ..., & Tricoire, L. (2015).
Glutamate receptors of the delta family are widely expressed in the adult brain. Brain structure & function, 220(5), 2797-815. [PubMed:25001082] [WorldCat] [DOI] - ↑
Kashiwabuchi, N., Ikeda, K., Araki, K., Hirano, T., Shibuki, K., Takayama, C., ..., & Kang, Y. (1995).
Impairment of motor coordination, Purkinje cell synapse formation, and cerebellar long-term depression in GluR delta 2 mutant mice. Cell, 81(2), 245-52. [PubMed:7736576] [WorldCat] [DOI] - ↑
Ito, M. (2001).
Cerebellar long-term depression: characterization, signal transduction, and functional roles. Physiological reviews, 81(3), 1143-95. [PubMed:11427694] [WorldCat] [DOI] - ↑
Matsuda, S., Launey, T., Mikawa, S., & Hirai, H. (2000).
Disruption of AMPA receptor GluR2 clusters following long-term depression induction in cerebellar Purkinje neurons. The EMBO journal, 19(12), 2765-74. [PubMed:10856222] [PMC] [WorldCat] [DOI] - ↑
Kohda, K., Kakegawa, W., Matsuda, S., Yamamoto, T., Hirano, H., & Yuzaki, M. (2013).
The δ2 glutamate receptor gates long-term depression by coordinating interactions between two AMPA receptor phosphorylation sites. Proceedings of the National Academy of Sciences of the United States of America, 110(10), E948-57. [PubMed:23431139] [PMC] [WorldCat] [DOI] - ↑
Kakegawa, W., Miyazaki, T., Kohda, K., Matsuda, K., Emi, K., Motohashi, J., ..., & Yuzaki, M. (2009).
The N-terminal domain of GluD2 (GluRdelta2) recruits presynaptic terminals and regulates synaptogenesis in the cerebellum in vivo. The Journal of neuroscience : the official journal of the Society for Neuroscience, 29(18), 5738-48. [PubMed:19420242] [PMC] [WorldCat] [DOI] - ↑
Matsuda, K., Miura, E., Miyazaki, T., Kakegawa, W., Emi, K., Narumi, S., ..., & Yuzaki, M. (2010).
Cbln1 is a ligand for an orphan glutamate receptor delta2, a bidirectional synapse organizer. Science (New York, N.Y.), 328(5976), 363-8. [PubMed:20395510] [WorldCat] [DOI] - ↑
Uemura, T., Lee, S.J., Yasumura, M., Takeuchi, T., Yoshida, T., Ra, M., ..., & Mishina, M. (2010).
Trans-synaptic interaction of GluRdelta2 and Neurexin through Cbln1 mediates synapse formation in the cerebellum. Cell, 141(6), 1068-79. [PubMed:20537373] [WorldCat] [DOI] - ↑
Matsuda, K., & Yuzaki, M. (2011).
Cbln family proteins promote synapse formation by regulating distinct neurexin signaling pathways in various brain regions. The European journal of neuroscience, 33(8), 1447-61. [PubMed:21410790] [WorldCat] [DOI] - ↑
Elegheert, J., Kakegawa, W., Clay, J.E., Shanks, N.F., Behiels, E., Matsuda, K., ..., & Aricescu, A.R. (2016).
Structural basis for integration of GluD receptors within synaptic organizer complexes. Science (New York, N.Y.), 353(6296), 295-9. [PubMed:27418511] [PMC] [WorldCat] [DOI] - ↑
Naur, P., Hansen, K.B., Kristensen, A.S., Dravid, S.M., Pickering, D.S., Olsen, L., ..., & Kastrup, J.S. (2007).
Ionotropic glutamate-like receptor delta2 binds D-serine and glycine. Proceedings of the National Academy of Sciences of the United States of America, 104(35), 14116-21. [PubMed:17715062] [PMC] [WorldCat] [DOI] - ↑
Hirai, H., Miyazaki, T., Kakegawa, W., Matsuda, S., Mishina, M., Watanabe, M., & Yuzaki, M. (2005).
Rescue of abnormal phenotypes of the delta2 glutamate receptor-null mice by mutant delta2 transgenes. EMBO reports, 6(1), 90-5. [PubMed:15592450] [PMC] [WorldCat] [DOI] - ↑ 16.0 16.1 16.2 16.3
Kakegawa, W., Miyoshi, Y., Hamase, K., Matsuda, S., Matsuda, K., Kohda, K., ..., & Yuzaki, M. (2011).
D-serine regulates cerebellar LTD and motor coordination through the δ2 glutamate receptor. Nature neuroscience, 14(5), 603-11. [PubMed:21460832] [WorldCat] [DOI] - ↑
Kakegawa, W., Kohda, K., & Yuzaki, M. (2007).
The delta2 'ionotropic' glutamate receptor functions as a non-ionotropic receptor to control cerebellar synaptic plasticity. The Journal of physiology, 584(Pt 1), 89-96. [PubMed:17702810] [PMC] [WorldCat] [DOI] - ↑
Torashima, T., Iizuka, A., Horiuchi, H., Mitsumura, K., Yamasaki, M., Koyama, C., ..., & Hirai, H. (2009).
Rescue of abnormal phenotypes in delta2 glutamate receptor-deficient mice by the extracellular N-terminal and intracellular C-terminal domains of the delta2 glutamate receptor. The European journal of neuroscience, 30(3), 355-65. [PubMed:19614753] [WorldCat] [DOI] - ↑
Ady, V., Perroy, J., Tricoire, L., Piochon, C., Dadak, S., Chen, X., ..., & Levenes, C. (2014).
Type 1 metabotropic glutamate receptors (mGlu1) trigger the gating of GluD2 delta glutamate receptors. EMBO reports, 15(1), 103-9. [PubMed:24357660] [PMC] [WorldCat] [DOI] - ↑
Hartmann, J., Dragicevic, E., Adelsberger, H., Henning, H.A., Sumser, M., Abramowitz, J., ..., & Konnerth, A. (2008).
TRPC3 channels are required for synaptic transmission and motor coordination. Neuron, 59(3), 392-8. [PubMed:18701065] [PMC] [WorldCat] [DOI] - ↑
Konno, K., Matsuda, K., Nakamoto, C., Uchigashima, M., Miyazaki, T., Yamasaki, M., ..., & Watanabe, M. (2014).
Enriched expression of GluD1 in higher brain regions and its involvement in parallel fiber-interneuron synapse formation in the cerebellum. The Journal of neuroscience : the official journal of the Society for Neuroscience, 34(22), 7412-24. [PubMed:24872547] [PMC] [WorldCat] [DOI] - ↑
Gao, J., Maison, S.F., Wu, X., Hirose, K., Jones, S.M., Bayazitov, I., ..., & Zuo, J. (2007).
Orphan glutamate receptor delta1 subunit required for high-frequency hearing. Molecular and cellular biology, 27(12), 4500-12. [PubMed:17438141] [PMC] [WorldCat] [DOI] - ↑
Yadav, R., Hillman, B.G., Gupta, S.C., Suryavanshi, P., Bhatt, J.M., Pavuluri, R., ..., & Dravid, S.M. (2013).
Deletion of glutamate delta-1 receptor in mouse leads to enhanced working memory and deficit in fear conditioning. PloS one, 8(4), e60785. [PubMed:23560106] [PMC] [WorldCat] [DOI] - ↑
Suryavanshi, P.S., Gupta, S.C., Yadav, R., Kesherwani, V., Liu, J., & Dravid, S.M. (2016).
Glutamate Delta-1 Receptor Regulates Metabotropic Glutamate Receptor 5 Signaling in the Hippocampus. Molecular pharmacology, 90(2), 96-105. [PubMed:27231330] [PMC] [WorldCat] [DOI] - ↑
Wang, Y., Matsuda, S., Drews, V., Torashima, T., Meisler, M.H., & Yuzaki, M. (2003).
A hot spot for hotfoot mutations in the gene encoding the delta2 glutamate receptor. The European journal of neuroscience, 17(8), 1581-90. [PubMed:12752376] [WorldCat] [DOI] - ↑
Hills, L.B., Masri, A., Konno, K., Kakegawa, W., Lam, A.T., Lim-Melia, E., ..., & Mochida, G.H. (2013).
Deletions in GRID2 lead to a recessive syndrome of cerebellar ataxia and tonic upgaze in humans. Neurology, 81(16), 1378-86. [PubMed:24078737] [PMC] [WorldCat] [DOI] - ↑
Utine, G.E., Haliloğlu, G., Salanci, B., Çetinkaya, A., Kiper, P.Ö., Alanay, Y., ..., & Alikaşifoğlu, M. (2013).
A homozygous deletion in GRID2 causes a human phenotype with cerebellar ataxia and atrophy. Journal of child neurology, 28(7), 926-32. [PubMed:23611888] [WorldCat] [DOI] - ↑
Van Schil, K., Meire, F., Karlstetter, M., Bauwens, M., Verdin, H., Coppieters, F., ..., & De Baere, E. (2015).
Early-onset autosomal recessive cerebellar ataxia associated with retinal dystrophy: new human hotfoot phenotype caused by homozygous GRID2 deletion. Genetics in medicine : official journal of the American College of Medical Genetics, 17(4), 291-9. [PubMed:25122145] [WorldCat] [DOI] - ↑
Coutelier, M., Burglen, L., Mundwiller, E., Abada-Bendib, M., Rodriguez, D., Chantot-Bastaraud, S., ..., & Durr, A. (2015).
GRID2 mutations span from congenital to mild adult-onset cerebellar ataxia. Neurology, 84(17), 1751-9. [PubMed:25841024] [WorldCat] [DOI]