トランスジェニック動物
林 悠
独立行政法人理化学研究所 脳科学総合研究センター
DOI:10.14931/bsd.1689 原稿受付日:2012年5月22日 原稿完成日:2013年3月18日
担当編集委員:林 康紀(独立行政法人理化学研究所 脳科学総合研究センター)
英語名:transgenic animal 独:gentechnisch veränderte Tiere 仏:animal génétiquement modifié
同義語:遺伝子組換え動物、遺伝子改変動物
外部から特定の遺伝子を人為的に導入した動物。脳科学研究においては、主に以下の目的のために用いられる。
- 特定の遺伝子の破壊や過剰発現により、その遺伝子の機能を調べる。
- 特定のニューロンに機能プローブ(蛍光タンパク質、蛍光カルシウムセンサー、シナプス放出抑制因子など)を発現させて、そのニューロンの形態や活動パターン、生理的機能などを調べる。
- ヒトの遺伝性疾患と同じ突然変異の導入などにより、疾患モデルを確立する。
外来遺伝子をゲノム上のランダムな位置に挿入する場合と、ゲノム上の特定の部分に挿入する場合(標的遺伝子組換え;gene targeting)がある。後者は、特定の遺伝子を破壊するノックアウトの際に特に有用な技法となる。
トランスジェニック動物とは
定義
外部から特定の遺伝子を人為的に導入した動物をいう。通常は外来遺伝子が生殖細胞系にも導入され、次世代に受け継がれる場合を指す。ただし、外来遺伝子が一部の組織や細胞に局所的に導入され、次世代に受け継がれない場合も広義にはトランスジェニック動物に含まれ、遺伝子組換え生物の拡散などを規制するカルタヘナ法においても規制の対象となる。
なお、外来遺伝子をゲノム上のランダムな位置に挿入するか、特定の位置を狙って挿入するかで作製方法が異なっており、「トランスジェニック動物」という用語は、前者の場合のみを指すことも多い。後者、すなわち特定の位置を狙って挿入する過程は標的遺伝子組換えと呼ばれ、特定の遺伝子を破壊するノックアウトの際に特に重要となる(詳しくは標的遺伝子組換えの項目を参照)。
歴史的背景
古典的な遺伝学では、ある表現型を示す突然変異体において、どの遺伝子座に突然変異が存在するかを調べることで、遺伝子と機能の関係を調べる(順遺伝学的手法)。しかしこの方法は、突然変異の位置と表現型の相関関係のみを明らかにするという点で、真の意味での遺伝子の機能証明とは言えなかった。そこで、より直接的な遺伝子機能の証明のために、トランスジェニック動物の作製による特定遺伝子の機能亢進や機能阻害の試みがなされるようになった(逆遺伝学的手法)。
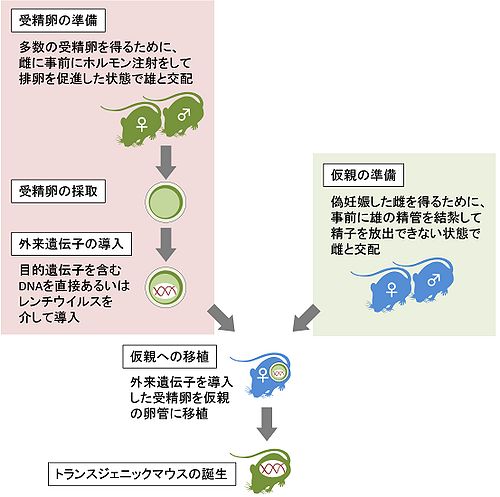
トランスジェニック動物の作製はマウスで初めて報告され、続いてショウジョウバエでも報告された。最初のトランスジェニックマウスは、1970年代にRudolf Jaenischらにより作製された[1],[2]。Jaenischらは、レトロウイルスが自身の遺伝子を宿主細胞のゲノムDNAに挿入する性質を利用し、レトロウイルス由来の遺伝子を持つトランスジェニックマウスを作製した。ただし、この方法で導入した外来遺伝子の発現量は低くかつ不均一であったため、応用の観点から有用な技術であるかは不明であった(これはおそらくマウス細胞が自己防衛のために、レトロウイルス由来の遺伝子の発現を抑制したことに因る)。その後1980年にJon Gordon、Frank Ruddleらにより、現在の主流となっているマウス受精卵前核にDNAを注入するという方法が初めて実践された[3]。この方法だと高い発現量が得られる上に、非常に大きな遺伝子も導入できる利点がある。
遺伝学の研究材料として古くから利用されてきたショウジョウバエでも、1982年にAllan Spradling、Gerald Rubinらによって外来遺伝子の導入方法が確立された [4],[5]。ショウジョウバエの場合は、トランスポゾンが自身のDNAをゲノム中に挿入する性質を利用する。
なお、マウスで初期に試されたレトロウイルスを用いた方法も、近年再び大きく注目されるようになった。レトロウイルスの中でもレンチウイルスを用いることで、外来遺伝子が発現しにくい問題が克服され、導入効率も非常に高いためである。例えば、霊長類初のトランスジェニック動物であるトランスジェニックマーモセットは、レンチウイルスを利用して作製された[6]。従って、当初の3つのアプローチ(DNAの直接注入・トランスポゾンの利用・レトロウイルスの利用)が現在でも主要なストラテジーであると言える。
また、1980年代後半には、ゲノム上の特定の遺伝子を破壊するために、従来のトランスジェニックマウス作製技術と、DNA相同組換えや胚性幹細胞(ES細胞)の培養技術などを組み合わせ、外来DNAを目的の遺伝子の途中に挿入したいわゆるノックアウトマウスが作製された。
外来遺伝子をゲノム上のランダムな位置に挿入する場合
特定の遺伝子を含むDNAを生殖細胞や受精卵などに注入すると、一定の確率でDNAはゲノム上のランダムな位置に挿入され、その細胞が生殖可能な成体へと成長した際には次世代へと受け継がれるようになる。注入するDNAは、目的の遺伝子にプロモーターやエンハンサー、イントロンやポリA付加シグナルなども加えることで、特定の組織や細胞種で効率よく発現させることが可能である。ただし実際には、導入遺伝子の発現は挿入されたゲノム上の位置の影響(位置効果;position effect)や挿入された導入遺伝子の数(コピー数;copy number)の影響も受けるため、予想した発現パターンと異なることも多い。また動物種によっては、外来遺伝子が挿入された個体と挿入されなかった個体の識別を容易にするために、何らかのマーカー遺伝子(marker gene)も同時に注入することがある。後述の標的遺伝子組換えと比べると手順の煩雑さが少なく、現在ではマウス、ショウジョウバエ、線虫、ゼブラフィッシュなどの古典的なモデル動物以外の様々な動物種でも方法が確立されている。
マウス以外の多くの動物種では、単にDNAを注入しただけではゲノム中に取り込まれる確率が非常に低い。しかしこうした動物でも、トランスポゾンやウイルスベクター、DNAエンドヌクレアーゼなどを利用することで、トランスジェニック動物の作製が可能となることがある。ここでは、マウスとその他の哺乳類動物種、ショウジョウバエ、線虫についてより詳しく紹介する。
受精卵前核へのDNAの顕微注入
マウスの場合は、受精卵前核にDNAを顕微注入する方法が一般的である(図1、図2)[7]。これにより外来遺伝子はゲノム上の一か所に、複数コピーが一列に並んだ状態で挿入される。通常トランスジェニックマウスと言うと、このようにして外来遺伝子を導入したマウスを指し、後述の標的遺伝子組換えを行ったマウス(ノックインマウス、ノックアウトマウスやFloxed mouse)と区別する(ただし、厳密には全てトランスジェニックニック動物である)。
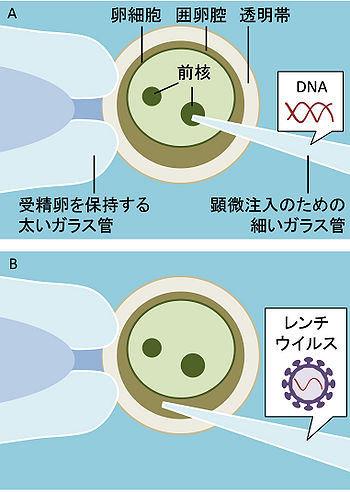
(A) 受精卵の前核へのDNAの注入による遺伝子導入(マウスで主流)
(B) レンチウイルス感染による受精卵への遺伝子導入(マウス以外の動物種で主流)
(A)だと卵細胞内のさらに前核までガラス管を挿入しなければならないのに対し、(B)では卵細胞外の空間に注入すれば良く、細胞質の不透明な動物種でも容易にできる。しかも注入した外来遺伝子がゲノム中に取り込まれる確率が高いため、少数の受精卵で済む。従って受精卵の高価な、マウス以外の動物ではこちらの方法がよく用いられる。(B)の短所としては、目的遺伝子をレンチウイルスに導入する手間がかかることや、導入できる遺伝子のサイズが限られていることなどが挙げられる。
分子生物学の研究材料としてよく用いられる線虫Caenorhabditis elegansの場合も同様に生殖細胞に直接DNAを注入する方法が主流である。注入されたDNAがゲノムに挿入されることは極めて稀だが、それでも細胞分裂の際に染色体とは独立に複製、分配される[8]。これは、線虫の染色体がセントロメアに特化した部位を要さない性質(holocentric)と関係すると考えられる[9]。
レンチウイルスを用いる方法
受精卵前核にDNAを顕微注入する、というマウスで一般的な方法は、他の哺乳類動物にも適応可能な場合が多い。しかしながらこの方法だと導入効率が悪く、通常数百個程度の受精卵が必要となり、マウス以外では非常に高価となる。さらに、多くの動物はマウスと異なり受精卵の細胞質が不透明なため、前核への正確な注入が困難となり、一層効率が下がる。そこで近年は、レトロウイルスの一種であるレンチウイルスを用いる方法が大きく注目されている(図2)。レトロウイルスは自身の遺伝子を感染した宿主細胞のゲノム中に挿入する性質がある。中でも、レンチウイルスは分裂中でない細胞にも感染しやすいことや、その遺伝子が宿主細胞によるサイレンシングを受けにくいなどの性質から、トランスジェニック動物作製に非常に有用である。外来遺伝子をDNAの状態で直接受精卵に注入する場合は卵細胞外内の前核に注入する必要がある。これにに対し、あらかじめレンチウイルスに導入してから注入する場合は、卵細胞外にある囲卵腔という空間に注入すればよく、しかも効率は遥かに高い。これまでに、マウス、ラット、ブタ、ウシなどに加え、霊長類であるコモンマーモセットでも、レンチウイルスを用いることで、効率よくトランスジェニック動物が作製できることが報告されている。
トランスポゾンを用いる方法
ショウジョウバエでは、P因子(P element)と呼ばれるトランスポゾンを利用する。このトランスポゾンは、トランスポゼースをコードする遺伝子と、トランスポゼースの認識配列からなる。導入したい遺伝子の前後に認識配列を付加し、トランスポゼースをコードする遺伝子も同時に胚に注入することで、トランスポゾンがゲノムに挿入されるのと同じ原理で目的の遺伝子が挿入される。現在では様々な脊椎動物・無脊椎動物において、各動物種への遺伝子導入に適したトランスポゾンが同定されている[10][11]。
外来遺伝子をゲノム上の特定の位置に挿入する場合
外来遺伝子をゲノム上の特定の位置に挿入することを標的遺伝子組換え;gene targetingという。トランスジェニック動物というと、前述の外来遺伝子がゲノム上のランダムな位置に挿入する場合のみを指し、標的遺伝子組換えにより作製した動物を含めないことが多い(厳密にはどちらもトランスジェニック動物であるが)。本項では標的遺伝子組換えについても簡単に紹介する(詳しくは標的遺伝子組換えの項目を参照)。
標的遺伝子組換えには、相同組換え(homologous recombination)という現象を利用する。具体的には、導入したい遺伝子の前後にゲノム上の目的部分の前後と同じDNA配列をつなぐと、稀に外来遺伝子がゲノム上の目的部分を置換する形で挿入される。これを利用し、外来遺伝子をゲノム上の特定の遺伝子の必須な部分と置換させることで、その遺伝子を破壊することができる(ノックアウト)。また、蛍光タンパク質遺伝子などを特定の細胞種に発現させたい場合に、その細胞種に発現することが知られる遺伝子の3’末端部分などに挿入することがある(ノックイン)。ノックインだと、前述のランダムな挿入と異なり位置効果の心配がなく、コピー数もコントロールでき、必要なシスエレメントも全て揃っているため、期待通りの発現パターンを得やすい。ただし、ランダムな挿入と異なり、標的遺伝子組換えの手法が確立されている動物種は非常に限られている。
胚性幹細胞を用いた方法
標的遺伝子組換えが最も一般的な技術となっているマウスでは、まず培養した胚性幹細胞(embryonic stem cell;ES cell)に外来遺伝子を導入する[7]。その中から相同組換えが確認されたES細胞を選び、発生初期の胚盤胞期胚(blastocyst-stage embryo)に注入する。すると、全身の一部の細胞が注入したES細胞に由来するキメラマウス(chimera mouse)が得られる。このキメラマウスの次世代で、全身の全ての細胞が外来遺伝子を含むマウスを得ることができる。
マウスでは上記のノックアウトやノックインに加え、特定の遺伝子の前後にloxP配列を挿入することもしばしば行われる(このようなマウスは「floxed mouse」と呼ばれる)。loxPとは、DNA組換え酵素Creが認識する34塩基からなるDNA配列である。Creは2つのloxP配列を認識すると、両者の間で高効率に相同組換えを起こす。従って特定の遺伝子の前後にloxPを挿入した場合、Cre存在下でその遺伝子は切り出されて破壊されることとなる。Floxed mouseと、特定の細胞種や時期にCreを発現するトランスジェニックマウスとを掛け合わせることで、細胞種や時期特異的な遺伝子の破壊(コンディショナルノックアウト)が可能となる。脳科学の研究においては、ニューロンを構成する因子の多くが発生過程と成体の双方で重要な役割を担い、また、様々な脳部位で発現するため、コンディショナルノックアウトは有用な技術となっている。
その他の方法
マウス以外のモデル動物でも標的遺伝子組換えの報告はあるが、マウスほど一般的な技法としては普及していない。その理由としては、外来遺伝子の相同組換えによる挿入の確率が非常に低いことに加え、それよりもはるかに起こりやすいランダムな位置への挿入との簡単な識別方法などが十分確立されていないことが挙げられる。ただし、近年のトランスポゾンやジンクフィンガーヌクレアーゼ(zinc finger nucleases;ZFNs)を利用した高効率な標的遺伝子組換え技術の開発[12][13]により、今後は様々な動物種での標的遺伝子組換えの簡易化が期待される。これらの手法は、ゲノムDNAに損傷が生じた際の修復時に、損傷部位の近傍で相同組み換えが起こりやすいことを利用する。特にジンクフィンガーヌクレアーゼは、DNA結合ドメインのデザイン次第でDNA損傷を導入する部位をある程度自由に選べることから大きく注目されている。こうした高効率な手法の確立は、マウスにおいても、従来のES細胞を利用する煩雑な方法の回避につながることが期待される。
なお現時点では、マウス以外のモデル動物の遺伝子破壊には、突然変異を誘発する化学物質(化学変異原;chemical mutagen)やトランスポゾンによりランダムに突然変異を導入した中から、目的の遺伝子が破壊された突然変異体を検索する方法がよく用いられる。化学変異原としては、エチルメタンスルフォン酸(ethyl methanesulfonate, EMS)やN‐エチル‐N‐ニトロソ尿素(N-ethyl-N-nitrosourea;ENU)やトリメチルプソラレン(trimethylpsoralen;TMP)などが用いられる。化学変異原を用いて得た突然変異体は組換え遺伝子を含まず、トランスジェニック動物ではない。
一部の細胞や組織に外来遺伝子を導入し、次世代には継承されない場合
一般的にトランスジェニック動物とは、外来遺伝子が生殖細胞系にも導入され、次世代に継承される場合を指すことが多いが、広義には特定の細胞や組織にのみ遺伝子導入した動物も含められる。成体あるいは発生の進んだ胚においてDNAを細胞外から細胞内に導入するには、ウイルスベクターや電気穿孔法(electroporation)、遺伝子銃(gene gun)などが用いられる。脳への局所的な遺伝子導入は、目的の脳部位以外の組織への導入遺伝子の影響を排除しやすいことに加えて、研究期間の短縮や動物飼育スペースの節約などの利点がある。
カルタヘナ議定書とカルタヘナ法
遺伝子組換え生物は生物多様性に悪影響を及ぼすおそれがあるとして、その移動を規制する国際協定である「カルタヘナ議定書(The Cartagena Protocol on Biosafety)」が2003年に発効した。日本では、カルタヘナ議定書に対応する国内法として、2004年に「遺伝子組換え生物等の使用等の規制による生物の多様性の確保に関する法律」(通称「カルタヘナ法」)が施行された。これに基づき、遺伝子組換え生物(living modified organism;LMO)などの輸送時には、提供元が受入れ側に情報を提供し、事前同意を得ることなどが義務づけられ、違反に対する罰則も定められている。上述のトランスジェニック動物も全てこの規制の対象となる。なお、化学変異原処理により作製した突然変異体はトランスジェニック動物には該当せず、同様の突然変異が自然に生じる可能性もなくはないので、カルタヘナ法の規制対象にはならない。
関連項目
参考文献
- ↑
Jaenisch, R., & Mintz, B. (1974).
Simian virus 40 DNA sequences in DNA of healthy adult mice derived from preimplantation blastocysts injected with viral DNA. Proceedings of the National Academy of Sciences of the United States of America, 71(4), 1250-4. [PubMed:4364530] [PMC] [WorldCat] [DOI] - ↑
Jaenisch, R. (1976).
Germ line integration and Mendelian transmission of the exogenous Moloney leukemia virus. Proceedings of the National Academy of Sciences of the United States of America, 73(4), 1260-4. [PubMed:1063407] [PMC] [WorldCat] [DOI] - ↑
Gordon, J.W., Scangos, G.A., Plotkin, D.J., Barbosa, J.A., & Ruddle, F.H. (1980).
Genetic transformation of mouse embryos by microinjection of purified DNA. Proceedings of the National Academy of Sciences of the United States of America, 77(12), 7380-4. [PubMed:6261253] [PMC] [WorldCat] [DOI] - ↑
Spradling, A.C., & Rubin, G.M. (1982).
Transposition of cloned P elements into Drosophila germ line chromosomes. Science (New York, N.Y.), 218(4570), 341-7. [PubMed:6289435] [WorldCat] [DOI] - ↑
Rubin, G.M., & Spradling, A.C. (1982).
Genetic transformation of Drosophila with transposable element vectors. Science (New York, N.Y.), 218(4570), 348-53. [PubMed:6289436] [WorldCat] [DOI] - ↑
Sasaki, E., Suemizu, H., Shimada, A., Hanazawa, K., Oiwa, R., Kamioka, M., ..., & Nomura, T. (2009).
Generation of transgenic non-human primates with germline transmission. Nature, 459(7246), 523-7. [PubMed:19478777] [WorldCat] [DOI] - ↑ 7.0 7.1 Andras Nagy, Marina Gertsenstein, Kristina Vintersten, Richard Behringer
Manipulating the mouse embryo: A Laboratory Manual 3rd Ed.
Cold Spring Harbor Laboratory Press:2003 - ↑
Stinchcomb, D.T., Shaw, J.E., Carr, S.H., & Hirsh, D. (1985).
Extrachromosomal DNA transformation of Caenorhabditis elegans. Molecular and cellular biology, 5(12), 3484-96. [PubMed:3837845] [PMC] [WorldCat] [DOI] - ↑
Yuen, K.W., Nabeshima, K., Oegema, K., & Desai, A. (2011).
Rapid de novo centromere formation occurs independently of heterochromatin protein 1 in C. elegans embryos. Current biology : CB, 21(21), 1800-7. [PubMed:22018540] [PMC] [WorldCat] [DOI] - ↑
Mátés, L., Izsvák, Z., & Ivics, Z. (2007).
Technology transfer from worms and flies to vertebrates: transposition-based genome manipulations and their future perspectives. Genome biology, 8 Suppl 1, S1. [PubMed:18047686] [PMC] [WorldCat] [DOI] - ↑
Ivics, Z., Li, M.A., Mátés, L., Boeke, J.D., Nagy, A., Bradley, A., & Izsvák, Z. (2009).
Transposon-mediated genome manipulation in vertebrates. Nature methods, 6(6), 415-22. [PubMed:19478801] [PMC] [WorldCat] [DOI] - ↑
Bibikova, M., Beumer, K., Trautman, J.K., & Carroll, D. (2003).
Enhancing gene targeting with designed zinc finger nucleases. Science (New York, N.Y.), 300(5620), 764. [PubMed:12730594] [WorldCat] [DOI] - ↑
Robert, V., & Bessereau, J.L. (2007).
Targeted engineering of the Caenorhabditis elegans genome following Mos1-triggered chromosomal breaks. The EMBO journal, 26(1), 170-83. [PubMed:17159906] [PMC] [WorldCat] [DOI]