「ドレブリン」の版間の差分
細編集の要約なし |
細編集の要約なし |
||
| 6行目: | 6行目: | ||
</div> | </div> | ||
{{box|text= | {{box|text= ドレブリンはアクチン結合タンパク質として知られ、そのアイソフォームには主にドレブリンEとドレブリンAがある。ドレブリンEは胎児期及び幼若期に主に発現し、成熟期にはドレブリンAが神経細胞特異的に発現する。ドレブリンEは突起伸展や軸索成長に影響を及ぼし、ドレブリンAはシナプス後部に集積し樹状突起スパインの形成を促進する機能がある。また、ドレブリンAはシナプス可塑性にも関与することが知られている。}} | ||
ドレブリンはアクチン結合タンパク質として知られ、そのアイソフォームには主にドレブリンEとドレブリンAがある。ドレブリンEは胎児期及び幼若期に主に発現し、成熟期にはドレブリンAが神経細胞特異的に発現する。ドレブリンEは突起伸展や軸索成長に影響を及ぼし、ドレブリンAはシナプス後部に集積し樹状突起スパインの形成を促進する機能がある。また、ドレブリンAはシナプス可塑性にも関与することが知られている。 | |||
}} | |||
== | ==ドレブリンとは== | ||
ドレブリンは[[脳]]の発達に依存して発現量が変化するタンパク質として1985年に[[ニワトリ]]脳から精製された<ref name=ref21><pubmed>3973611</pubmed></ref>[[アクチン]]結合タンパク質である。 | |||
ニワトリ胚では神経組織以外にも発現しているが、孵化後には神経組織に多量に発現しており<ref name=ref22><pubmed>3768727</pubmed></ref>、また、[[ | ニワトリ胚では神経組織以外にも発現しているが、孵化後には神経組織に多量に発現しており<ref name=ref22><pubmed>3768727</pubmed></ref>、また、[[免疫電顕]]により[[神経細胞]][[樹状突起]]に特異的に存在することが示され<ref name=ref23><pubmed>3300856</pubmed></ref>、1988年に発生過程で調節される脳タンパク(Developmentally REgulated BRain proteIN)という意味で、ドレブリン(drebrin)と命名された<ref name=ref24><pubmed>3179746</pubmed></ref>。 | ||
同年、ドレブリンcDNAの配列が決定され、その結果、ニワトリのドレブリンには幼若型の[[ドレブリンE1]]、[[ドレブリンE2]]と成熟型の[[ドレブリンA]](このアイソフォームは神経細胞特異的)の三種類のアイソフォームがあることが明らかになった<ref name=ref10><pubmed>3208110</pubmed></ref>。[[哺乳類]]においては[[ラット]]脳での研究が最初に行われ、ドレブリンは種を越えて保存されていること、また、ラットでは胎児型ドレブリンが一種類(ドレブリンE)しか存在しないことが示された<ref name=ref25>'''Shirao T, Kojima N, Nabeta Y, Obata K'''<br>Two Forms of Dγebrins, Developmentally Regulated Brain Proteins, in Rat. <br>''Proceedings of the Japan Academy'' 65:169-172. 1989</ref>。1993年には[[ヒト]]のcDNAのクローニングが報告されている<ref name=ref28><pubmed>8216329</pubmed></ref>。 | |||
==構造== | ==構造== | ||
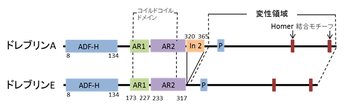
[[image:1ドレブリン.png|thumb|350px|'''図1.'''<br>ADF-H:ADFホモロジードメイン<br>AR1:アクチン結合領域1<br>AR2:アクチン結合領域2<br>In 2:In 2(ドレブリンA特異的配列)<br>P:プロリンリッチ領域]] | [[image:1ドレブリン.png|thumb|350px|'''図1.'''<br>ADF-H:ADFホモロジードメイン<br>AR1:アクチン結合領域1<br>AR2:アクチン結合領域2<br>In 2:In 2(ドレブリンA特異的配列)<br>P:プロリンリッチ領域]] | ||
ドレブリンはN末端に[[ADF]] | ドレブリンはN末端に[[コフィリン|ADF-ホモロジードメイン]]を持つ分子で、[[コフィリン]]や[[ツインフィリン]]とスーパーファミリーを作っていると考えることができる。 | ||
ドレブリンは大きく分けると、幼若型(ドレブリンE)と成熟型(ドレブリンA)の二種類に分かれる。ドレブリンのアイソフォームは単一遺伝子から[[選択的スプライシング]]により生成されるため<ref name=ref9><pubmed>8361332</pubmed></ref>、アミノ酸配列はほぼ同一であるが、ドレブリンAのみがins2配列を持つ(図1)。 | |||
= | ドレブリンが結合するタンパク質としては種々のものが報告されているが、一番の特徴はアクチン線維に結合してアクチン線維の構造を変化させることである。[[原子間力顕微鏡]]を用いた観察によると、ドレブリンの結合していないアクチン線維は36nmピッチのらせん構造を持つのに対し、ドレブリンAの結合したアクチン線維は40nmピッチのらせん構造を持つ<ref name=ref19><pubmed>21175132</pubmed></ref>。 | ||
==発現== | ==発現== | ||
| 32行目: | 29行目: | ||
===細胞内分布=== | ===細胞内分布=== | ||
ドレブリンEは移動中神経細胞の[[細胞体]]や[[軸索]]の[[成長円錐]]に多く集積している。一方、ドレブリンAは[[樹状突起スパイン]]に多く集積している。 | |||
==機能== | ==機能== | ||
アクチン結合タンパク質であるドレブリンは、F-アクチンの物理的性質を変化させることにより、他のアクチン結合タンパク質がアクチンフィラメントに結合するのを防ぐことでF- | アクチン結合タンパク質であるドレブリンは、F-アクチンの物理的性質を変化させることにより、他のアクチン結合タンパク質がアクチンフィラメントに結合するのを防ぐことでF-アクチンの安定性を変化させる。たとえば、ドレブリンは[[トロポミオシン]]のF-アクチン結合を阻害するが、[[ゲルゾリン]]のF-アクチン結合は阻害しない。したがって、ゲルゾリンはドレブリンの結合したアクチンを切断することができる<ref name=ref7><pubmed>7961990</pubmed></ref>。逆に、トロポミオシンはゲルゾリンのF-アクチン結合を阻害するので、F-アクチンの断裂はおきにくい。 | ||
また、ドレブリンはアクチン-[[ミオシン]]相互作用を抑制するので一度できた突起は退縮しにくくなる。したがって、ドレブリンがクラスターし始めた[[フィロポディア]]は退縮せずに安定した[[スパイン]]へと形態変化すると考えられる。 | |||
===神経細胞の発達=== | |||
ドレブリンEは成長円錐に多量存在し、突起伸展や軸索成長に影響を及ぼしている<ref name=ref27><pubmed>10320758</pubmed></ref> <ref name=ref16><pubmed>19222710 </pubmed></ref>。成熟に伴いドレブリンEは消失し、代わりにドレブリンAが出現する。ドレブリンAは[[シナプス]]後部に集積し、樹状突起スパインの形成を促進する(後述)。スパイン形成時にドレブリンの機能を介在するドレブリン結合タンパク質、[[スパイカー]]も同定されている<ref name=ref30><pubmed>24117785 </pubmed></ref>。 | |||
=== | ===シナプス成熟=== | ||
成熟した神経細胞の樹状突起スパインは[[シナプス後肥厚部]](Postsynaptic densities, PSDs)を含んでいるが、ドレブリンAの発現は[[PSD-95]]の集積を促進し、樹状突起スパインの形成に重要な役割を果たしていることが示されている<ref name=ref26><pubmed>12878700</pubmed></ref>。また、ドレブリンAの過剰発現によりスパイン形態が変化する<ref name=ref6><pubmed>10234022</pubmed></ref>ことが知られているが、未熟な海馬神経細胞に過剰発現させると巨大なフィロポディア様の突起が形成され、そこにはドレブリンAの集積量に相関してF-アクチンと[[PSD]]-95が集積する<ref name=ref15><pubmed>16456930</pubmed></ref>。 | |||
このことから、ドレブリンAはスパイン形成に必要な材料を集積する機能を持っているが、その量は適度でなければならないことが示唆されている。 | |||
=== | ===シナプス可塑性=== | ||
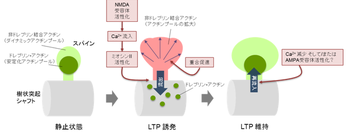
[[image:2ドレブリン.png|thumb|350px|'''図2.''']] | [[image:2ドレブリン.png|thumb|350px|'''図2.''']] | ||
ドレブリンAのスパインへの局在は神経活動依存的に変化し、[[シナプス可塑性]]に伴い一過性に樹状突起スパインから樹状突起シャフトへと移動することが分かっている。これは[[NMDA型グルタミン酸受容体]]を介した[[カルシウムイオン]]の流入により引き起こされ、加えて、[[ミオシンII]]による調整を受けていることも示唆されている<ref name=ref17><pubmed>24465547 </pubmed></ref>。この一過性の移動はスパインが形態的変化を起こすために重要な役割を果たしていると考えられている(図2)。 | |||
また、ドレブリンAは[[長期増強現象]]([[long-term potentiation]], [[LTP]])の形成に重要でありドレブリンEではその役割を補完できない、つまり、ドレブリンのアイソフォーム変換はLTPが形成されるようになるために重要であることが示唆されている<ref name=ref11><pubmed> 26970584 </pubmed></ref>。 | |||
=== | ===認知障害=== | ||
[[アルツハイマー病]] | [[アルツハイマー病]]ではシナプス機能不全が起きていると考えられているが、アルツハイマー病死後脳の[[海馬]]ではドレブリンの広範囲な消失が認められている<ref name=ref5><pubmed>8838578</pubmed></ref>。さらに、軽度のアルツハイマー病患者や[[軽度認知障害]]患者の死後脳においても海馬でドレブリンの減少が見られた<ref name=ref3><pubmed>16783169</pubmed></ref> <ref name=ref4><pubmed>22310934 </pubmed></ref>。 | ||
[[モデル動物]]を使った研究においては、ドレブリンがアルツハイマー病の発病機序に関与することも分かっており<ref name=ref2><pubmed>15339646 </pubmed></ref>、例えばドレブリンAはアルツハイマー病モデル[[動物]] | In vitro系においても、アルツハイマー病の発症に関与していると考えられる[[Aβ]]オリゴマーによりドレブリンの減少が惹起されることが確認されている<ref name=ref12><pubmed>17251419</pubmed></ref>。なお、このAβオリゴマーによるドレブリンの樹状突起スパインからの消失は、[[ヒストン脱アセチル化酵素]]を阻害すると起こらない<ref name=ref8><pubmed>25058791 </pubmed></ref>。 | ||
[[モデル動物]]を使った研究においては、ドレブリンがアルツハイマー病の発病機序に関与することも分かっており<ref name=ref2><pubmed>15339646 </pubmed></ref>、例えばドレブリンAはアルツハイマー病モデル[[動物]]において活動依存性NMDA型グルタミン酸受容体輸送に重要な役割を果たすと考えられている<ref name=ref13><pubmed>22715045 </pubmed></ref>。 | |||
またアルツハイマー病だけでなく、[[ダウン症候群]]の死後脳でもドレブリンが顕著に減少しているという報告がある<ref name=ref20><pubmed>12009525</pubmed></ref>。 | またアルツハイマー病だけでなく、[[ダウン症候群]]の死後脳でもドレブリンが顕著に減少しているという報告がある<ref name=ref20><pubmed>12009525</pubmed></ref>。 | ||
=== | ===がん細胞=== | ||
[[wj:がん|がん細胞]]は正常細胞の[[細胞間結合]]を破壊し、運動性や形態を変化させる。ドレブリンはもともとこれらの機能に関与していることから、発がん過程においてもその役割が調べられており、近年、様々ながん細胞においてドレブリンの発現が認められている。例えば、2005年には[[皮膚]]がんにおいてドレブリンの発現が認められた<ref name=ref18><pubmed>16185277 </pubmed></ref>。また興味深いことに、転移性のがん細胞にはドレブリンが異常に発現している<ref name=ref14><pubmed>24610677</pubmed></ref>。 | |||
最近では、ドレブリンが[[プログラニューリン]]を活性化し、[[膀胱がん]]を惹起することも報告されている<ref name=ref29><pubmed>25839164 </pubmed></ref>。ドレブリンが[[wj:腫瘍|腫瘍]]の発現に関与するのか等まだ不明な点は多いが、特に[[wj:ガン転移|転移]]性の腫瘍ではドレブリンの機能異常が見られることから、ドレブリンはがんのバイオマーカーとして用いることができるのかもしれない。 | |||
==関連語== | ==関連語== | ||
2016年8月17日 (水) 18:07時点における版
小金澤 紀子、白尾 智明
群馬大学大学院医学系研究科神経薬理学
DOI:10.14931/bsd.7254 原稿受付日:2016年8月15日 原稿完成日:2016年月日
担当編集委員:林 康紀(国立研究開発法人理化学研究所 脳科学総合研究センター)
ドレブリンはアクチン結合タンパク質として知られ、そのアイソフォームには主にドレブリンEとドレブリンAがある。ドレブリンEは胎児期及び幼若期に主に発現し、成熟期にはドレブリンAが神経細胞特異的に発現する。ドレブリンEは突起伸展や軸索成長に影響を及ぼし、ドレブリンAはシナプス後部に集積し樹状突起スパインの形成を促進する機能がある。また、ドレブリンAはシナプス可塑性にも関与することが知られている。
ドレブリンとは
ドレブリンは脳の発達に依存して発現量が変化するタンパク質として1985年にニワトリ脳から精製された[1]アクチン結合タンパク質である。
ニワトリ胚では神経組織以外にも発現しているが、孵化後には神経組織に多量に発現しており[2]、また、免疫電顕により神経細胞樹状突起に特異的に存在することが示され[3]、1988年に発生過程で調節される脳タンパク(Developmentally REgulated BRain proteIN)という意味で、ドレブリン(drebrin)と命名された[4]。
同年、ドレブリンcDNAの配列が決定され、その結果、ニワトリのドレブリンには幼若型のドレブリンE1、ドレブリンE2と成熟型のドレブリンA(このアイソフォームは神経細胞特異的)の三種類のアイソフォームがあることが明らかになった[5]。哺乳類においてはラット脳での研究が最初に行われ、ドレブリンは種を越えて保存されていること、また、ラットでは胎児型ドレブリンが一種類(ドレブリンE)しか存在しないことが示された[6]。1993年にはヒトのcDNAのクローニングが報告されている[7]。
構造
ドレブリンはN末端にADF-ホモロジードメインを持つ分子で、コフィリンやツインフィリンとスーパーファミリーを作っていると考えることができる。
ドレブリンは大きく分けると、幼若型(ドレブリンE)と成熟型(ドレブリンA)の二種類に分かれる。ドレブリンのアイソフォームは単一遺伝子から選択的スプライシングにより生成されるため[8]、アミノ酸配列はほぼ同一であるが、ドレブリンAのみがins2配列を持つ(図1)。
ドレブリンが結合するタンパク質としては種々のものが報告されているが、一番の特徴はアクチン線維に結合してアクチン線維の構造を変化させることである。原子間力顕微鏡を用いた観察によると、ドレブリンの結合していないアクチン線維は36nmピッチのらせん構造を持つのに対し、ドレブリンAの結合したアクチン線維は40nmピッチのらせん構造を持つ[9]。
発現
組織分布
ドレブリンEは非神経細胞にも発現しているが、すべての細胞に発現しているわけではない。一方、ドレブリンAは神経細胞特異的に発現する。げっ歯類脳においては胎児期および生後10日ほどまでは、ドレブリンEの発現が多い。ドレブリンAは海馬においては生後5日程度から見られるが、通常、生後10日ほどからその発現量が多くなる[10]。
細胞内分布
ドレブリンEは移動中神経細胞の細胞体や軸索の成長円錐に多く集積している。一方、ドレブリンAは樹状突起スパインに多く集積している。
機能
アクチン結合タンパク質であるドレブリンは、F-アクチンの物理的性質を変化させることにより、他のアクチン結合タンパク質がアクチンフィラメントに結合するのを防ぐことでF-アクチンの安定性を変化させる。たとえば、ドレブリンはトロポミオシンのF-アクチン結合を阻害するが、ゲルゾリンのF-アクチン結合は阻害しない。したがって、ゲルゾリンはドレブリンの結合したアクチンを切断することができる[11]。逆に、トロポミオシンはゲルゾリンのF-アクチン結合を阻害するので、F-アクチンの断裂はおきにくい。
また、ドレブリンはアクチン-ミオシン相互作用を抑制するので一度できた突起は退縮しにくくなる。したがって、ドレブリンがクラスターし始めたフィロポディアは退縮せずに安定したスパインへと形態変化すると考えられる。
神経細胞の発達
ドレブリンEは成長円錐に多量存在し、突起伸展や軸索成長に影響を及ぼしている[12] [13]。成熟に伴いドレブリンEは消失し、代わりにドレブリンAが出現する。ドレブリンAはシナプス後部に集積し、樹状突起スパインの形成を促進する(後述)。スパイン形成時にドレブリンの機能を介在するドレブリン結合タンパク質、スパイカーも同定されている[14]。
シナプス成熟
成熟した神経細胞の樹状突起スパインはシナプス後肥厚部(Postsynaptic densities, PSDs)を含んでいるが、ドレブリンAの発現はPSD-95の集積を促進し、樹状突起スパインの形成に重要な役割を果たしていることが示されている[15]。また、ドレブリンAの過剰発現によりスパイン形態が変化する[16]ことが知られているが、未熟な海馬神経細胞に過剰発現させると巨大なフィロポディア様の突起が形成され、そこにはドレブリンAの集積量に相関してF-アクチンとPSD-95が集積する[17]。
このことから、ドレブリンAはスパイン形成に必要な材料を集積する機能を持っているが、その量は適度でなければならないことが示唆されている。
シナプス可塑性
ドレブリンAのスパインへの局在は神経活動依存的に変化し、シナプス可塑性に伴い一過性に樹状突起スパインから樹状突起シャフトへと移動することが分かっている。これはNMDA型グルタミン酸受容体を介したカルシウムイオンの流入により引き起こされ、加えて、ミオシンIIによる調整を受けていることも示唆されている[18]。この一過性の移動はスパインが形態的変化を起こすために重要な役割を果たしていると考えられている(図2)。
また、ドレブリンAは長期増強現象(long-term potentiation, LTP)の形成に重要でありドレブリンEではその役割を補完できない、つまり、ドレブリンのアイソフォーム変換はLTPが形成されるようになるために重要であることが示唆されている[19]。
認知障害
アルツハイマー病ではシナプス機能不全が起きていると考えられているが、アルツハイマー病死後脳の海馬ではドレブリンの広範囲な消失が認められている[20]。さらに、軽度のアルツハイマー病患者や軽度認知障害患者の死後脳においても海馬でドレブリンの減少が見られた[21] [22]。
In vitro系においても、アルツハイマー病の発症に関与していると考えられるAβオリゴマーによりドレブリンの減少が惹起されることが確認されている[23]。なお、このAβオリゴマーによるドレブリンの樹状突起スパインからの消失は、ヒストン脱アセチル化酵素を阻害すると起こらない[24]。
モデル動物を使った研究においては、ドレブリンがアルツハイマー病の発病機序に関与することも分かっており[25]、例えばドレブリンAはアルツハイマー病モデル動物において活動依存性NMDA型グルタミン酸受容体輸送に重要な役割を果たすと考えられている[26]。
またアルツハイマー病だけでなく、ダウン症候群の死後脳でもドレブリンが顕著に減少しているという報告がある[27]。
がん細胞
がん細胞は正常細胞の細胞間結合を破壊し、運動性や形態を変化させる。ドレブリンはもともとこれらの機能に関与していることから、発がん過程においてもその役割が調べられており、近年、様々ながん細胞においてドレブリンの発現が認められている。例えば、2005年には皮膚がんにおいてドレブリンの発現が認められた[28]。また興味深いことに、転移性のがん細胞にはドレブリンが異常に発現している[29]。
最近では、ドレブリンがプログラニューリンを活性化し、膀胱がんを惹起することも報告されている[30]。ドレブリンが腫瘍の発現に関与するのか等まだ不明な点は多いが、特に転移性の腫瘍ではドレブリンの機能異常が見られることから、ドレブリンはがんのバイオマーカーとして用いることができるのかもしれない。
関連語
参考文献
- ↑
Shirao, T., & Obata, K. (1985).
Two acidic proteins associated with brain development in chick embryo. Journal of neurochemistry, 44(4), 1210-6. [PubMed:3973611] [WorldCat] [DOI] - ↑
Shirao, T., & Obata, K. (1986).
Immunochemical homology of 3 developmentally regulated brain proteins and their developmental change in neuronal distribution. Brain research, 394(2), 233-44. [PubMed:3768727] [WorldCat] [DOI] - ↑
Shirao, T., Inoue, H.K., Kano, Y., & Obata, K. (1987).
Localization of a developmentally regulated neuron-specific protein S54 in dendrites as revealed by immunoelectron microscopy. Brain research, 413(2), 374-8. [PubMed:3300856] [WorldCat] [DOI] - ↑
Shirao, T., Kojima, N., Kato, Y., & Obata, K. (1988).
Molecular cloning of a cDNA for the developmentally regulated brain protein, drebrin. Brain research, 464(1), 71-4. [PubMed:3179746] [WorldCat] [DOI] - ↑
Kojima, N., Kato, Y., Shirao, T., & Obata, K. (1988).
Nucleotide sequences of two embryonic drebrins, developmentally regulated brain proteins, and developmental change in their mRNAs. Brain research, 464(3), 207-15. [PubMed:3208110] [WorldCat] [DOI] - ↑ Shirao T, Kojima N, Nabeta Y, Obata K
Two Forms of Dγebrins, Developmentally Regulated Brain Proteins, in Rat.
Proceedings of the Japan Academy 65:169-172. 1989 - ↑
Toda, M., Shirao, T., Minoshima, S., Shimizu, N., Toya, S., & Uyemura, K. (1993).
Molecular cloning of cDNA encoding human drebrin E and chromosomal mapping of its gene. Biochemical and biophysical research communications, 196(1), 468-72. [PubMed:8216329] [WorldCat] [DOI] - ↑
Kojima, N., Shirao, T., & Obata, K. (1993).
Molecular cloning of a developmentally regulated brain protein, chicken drebrin A and its expression by alternative splicing of the drebrin gene. Brain research. Molecular brain research, 19(1-2), 101-14. [PubMed:8361332] [WorldCat] [DOI] - ↑
Sharma, S., Grintsevich, E.E., Phillips, M.L., Reisler, E., & Gimzewski, J.K. (2011).
Atomic force microscopy reveals drebrin induced remodeling of f-actin with subnanometer resolution. Nano letters, 11(2), 825-7. [PubMed:21175132] [PMC] [WorldCat] [DOI] - ↑
Aoki, C., Sekino, Y., Hanamura, K., Fujisawa, S., Mahadomrongkul, V., Ren, Y., & Shirao, T. (2005).
Drebrin A is a postsynaptic protein that localizes in vivo to the submembranous surface of dendritic sites forming excitatory synapses. The Journal of comparative neurology, 483(4), 383-402. [PubMed:15700273] [WorldCat] [DOI] - ↑
Ishikawa, R., Hayashi, K., Shirao, T., Xue, Y., Takagi, T., Sasaki, Y., & Kohama, K. (1994).
Drebrin, a development-associated brain protein from rat embryo, causes the dissociation of tropomyosin from actin filaments. The Journal of biological chemistry, 269(47), 29928-33. [PubMed:7961990] [WorldCat] - ↑
Toda, M., Shirao, T., & Uyemura, K. (1999).
Suppression of an actin-binding protein, drebrin, by antisense transfection attenuates neurite outgrowth in neuroblastoma B104 cells. Brain research. Developmental brain research, 114(2), 193-200. [PubMed:10320758] [WorldCat] [DOI] - ↑
Mizui, T., Kojima, N., Yamazaki, H., Katayama, M., Hanamura, K., & Shirao, T. (2009).
Drebrin E is involved in the regulation of axonal growth through actin-myosin interactions. Journal of neurochemistry, 109(2), 611-22. [PubMed:19222710] [WorldCat] [DOI] - ↑
Yamazaki, H., Kojima, N., Kato, K., Hirose, E., Iwasaki, T., Mizui, T., ..., & Shirao, T. (2014).
Spikar, a novel drebrin-binding protein, regulates the formation and stabilization of dendritic spines. Journal of neurochemistry, 128(4), 507-22. [PubMed:24117785] [WorldCat] [DOI] - ↑
Takahashi, H., Sekino, Y., Tanaka, S., Mizui, T., Kishi, S., & Shirao, T. (2003).
Drebrin-dependent actin clustering in dendritic filopodia governs synaptic targeting of postsynaptic density-95 and dendritic spine morphogenesis. The Journal of neuroscience : the official journal of the Society for Neuroscience, 23(16), 6586-95. [PubMed:12878700] [PMC] [WorldCat] - ↑
Hayashi, K., & Shirao, T. (1999).
Change in the shape of dendritic spines caused by overexpression of drebrin in cultured cortical neurons. The Journal of neuroscience : the official journal of the Society for Neuroscience, 19(10), 3918-25. [PubMed:10234022] [PMC] [WorldCat] - ↑
Mizui, T., Takahashi, H., Sekino, Y., & Shirao, T. (2005).
Overexpression of drebrin A in immature neurons induces the accumulation of F-actin and PSD-95 into dendritic filopodia, and the formation of large abnormal protrusions. Molecular and cellular neurosciences, 30(4), 630-8. [PubMed:16456930] [WorldCat] - ↑
Mizui, T., Sekino, Y., Yamazaki, H., Ishizuka, Y., Takahashi, H., Kojima, N., ..., & Shirao, T. (2014).
Myosin II ATPase activity mediates the long-term potentiation-induced exodus of stable F-actin bound by drebrin A from dendritic spines. PloS one, 9(1), e85367. [PubMed:24465547] [PMC] [WorldCat] [DOI] - ↑
Kojima, N., Yasuda, H., Hanamura, K., Ishizuka, Y., Sekino, Y., & Shirao, T. (2016).
Drebrin A regulates hippocampal LTP and hippocampus-dependent fear learning in adult mice. Neuroscience, 324, 218-26. [PubMed:26970584] [WorldCat] [DOI] - ↑
Harigaya, Y., Shoji, M., Shirao, T., & Hirai, S. (1996).
Disappearance of actin-binding protein, drebrin, from hippocampal synapses in Alzheimer's disease. Journal of neuroscience research, 43(1), 87-92. [PubMed:8838578] [WorldCat] [DOI] - ↑
Counts, S.E., Nadeem, M., Lad, S.P., Wuu, J., & Mufson, E.J. (2006).
Differential expression of synaptic proteins in the frontal and temporal cortex of elderly subjects with mild cognitive impairment. Journal of neuropathology and experimental neurology, 65(6), 592-601. [PubMed:16783169] [WorldCat] [DOI] - ↑
Counts, S.E., He, B., Nadeem, M., Wuu, J., Scheff, S.W., & Mufson, E.J. (2012).
Hippocampal drebrin loss in mild cognitive impairment. Neuro-degenerative diseases, 10(1-4), 216-9. [PubMed:22310934] [PMC] [WorldCat] [DOI] - ↑
Lacor, P.N., Buniel, M.C., Furlow, P.W., Clemente, A.S., Velasco, P.T., Wood, M., ..., & Klein, W.L. (2007).
Abeta oligomer-induced aberrations in synapse composition, shape, and density provide a molecular basis for loss of connectivity in Alzheimer's disease. The Journal of neuroscience : the official journal of the Society for Neuroscience, 27(4), 796-807. [PubMed:17251419] [PMC] [WorldCat] [DOI] - ↑
Ishizuka, Y., Shimizu, H., Takagi, E., Kato, M., Yamagata, H., Mikuni, M., & Shirao, T. (2014).
Histone deacetylase mediates the decrease in drebrin cluster density induced by amyloid beta oligomers. Neurochemistry international, 76, 114-21. [PubMed:25058791] [WorldCat] [DOI] - ↑
Calon, F., Lim, G.P., Yang, F., Morihara, T., Teter, B., Ubeda, O., ..., & Cole, G.M. (2004).
Docosahexaenoic acid protects from dendritic pathology in an Alzheimer's disease mouse model. Neuron, 43(5), 633-45. [PubMed:15339646] [PMC] [WorldCat] [DOI] - ↑
Lee, D., & Aoki, C. (2012).
Presenilin conditional double knockout mice exhibit decreases in drebrin a at hippocampal CA1 synapses. Synapse (New York, N.Y.), 66(10), 870-9. [PubMed:22715045] [PMC] [WorldCat] [DOI] - ↑
Shim, K.S., & Lubec, G. (2002).
Drebrin, a dendritic spine protein, is manifold decreased in brains of patients with Alzheimer's disease and Down syndrome. Neuroscience letters, 324(3), 209-12. [PubMed:12009525] [WorldCat] [DOI] - ↑
Peitsch, W.K., Hofmann, I., Bulkescher, J., Hergt, M., Spring, H., Bleyl, U., ..., & Franke, W.W. (2005).
Drebrin, an actin-binding, cell-type characteristic protein: induction and localization in epithelial skin tumors and cultured keratinocytes. The Journal of investigative dermatology, 125(4), 761-74. [PubMed:16185277] [WorldCat] [DOI] - ↑
Lin, Q., Tan, H.T., Lim, T.K., Khoo, A., Lim, K.H., & Chung, M.C. (2014).
iTRAQ analysis of colorectal cancer cell lines suggests Drebrin (DBN1) is overexpressed during liver metastasis. Proteomics, 14(11), 1434-43. [PubMed:24610677] [WorldCat] [DOI] - ↑
Xu, S.Q., Buraschi, S., Morcavallo, A., Genua, M., Shirao, T., Peiper, S.C., ..., & Morrione, A. (2015).
A novel role for drebrin in regulating progranulin bioactivity in bladder cancer. Oncotarget, 6(13), 10825-39. [PubMed:25839164] [PMC] [WorldCat] [DOI]