「ナノボディ」の版間の差分
細 (→イントラボディ、クロモボディ) |
細 (→抗体利用研究の再現性) |
||
| 109行目: | 109行目: | ||
近年、生命科学系の研究では、論文発表された実験結果の一部が容易に再現できないとされる問題がしばしば指摘されている。抗体の利用は、この再現性問題の重要な要因の1つであるとされる<ref><pubmed>25993940</pubmed></ref><ref><pubmed>29688318</pubmed></ref>。 | 近年、生命科学系の研究では、論文発表された実験結果の一部が容易に再現できないとされる問題がしばしば指摘されている。抗体の利用は、この再現性問題の重要な要因の1つであるとされる<ref><pubmed>25993940</pubmed></ref><ref><pubmed>29688318</pubmed></ref>。 | ||
例えば、ウサギなどからのポリクローナル抗体は、多数の異なる抗体分子を含んでいるため、免疫した動物などバッチごとの差が大きい。また、[[wj: | 例えば、ウサギなどからのポリクローナル抗体は、多数の異なる抗体分子を含んでいるため、免疫した動物などバッチごとの差が大きい。また、[[wj:モノクローナル抗体|モノクローナル抗体]]は、ハイブリドーマ細胞を増殖させることで、永遠に同じものを得ることができるはずであるが、市販抗体は予期せず販売中止になったり、ハイブリドーマ細胞は極低温で凍結維持しなくてはならず、災害や個々の研究者の都合により失われてしまうこともある。 | ||
ナノボディは、アミノ酸配列レベルで定義されるので質は同じであり、DNAという形で安価で長期保存が可能である。万一DNAが失われても、登録されたアミノ酸配列をもとにして容易に再生できるので、抗体の利用研究の再現性問題の解決法として注目されている。 | ナノボディは、アミノ酸配列レベルで定義されるので質は同じであり、DNAという形で安価で長期保存が可能である。万一DNAが失われても、登録されたアミノ酸配列をもとにして容易に再生できるので、抗体の利用研究の再現性問題の解決法として注目されている。 | ||
2018年8月26日 (日) 08:59時点における版
山形方人
Harvard University
DOI:10.14931/bsd.7719 原稿受付日:2018年8月13日 原稿完成日:2018年8月x日
担当編集委員:[1]( xx大学)
英:nanobody 独:Nanobody, Nanoantikörper 仏:nanobody 中:纳米抗体 西:nanoanticuerpo
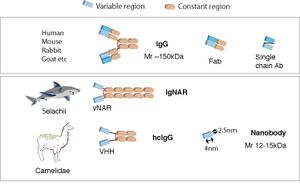
最も一般的な免疫グロブリンIgGは重鎖と軽鎖からなっているが、ラクダ科や軟骨魚は重鎖のみでできた免疫グロブリンも持っている。この重鎖抗体は可変領域のみで抗原と結合でき、この小さな単一ドメインはナノボディ(またはVHH)と呼ばれる。ナノボディは、それぞれアミノ酸配列が厳密に定義され、通常の抗体と同じように、免疫沈降法などの生化学的解析や免疫組織化学などに利用できる。また、細胞内でも抗原と結合できる細胞内抗体などとして機能的に発現させることで、神経細胞を含めたさまざまな細胞生物学的分析に利用可能である。診断や抗体医薬への応用も期待される。
単鎖抗体、重鎖抗体 、ナノボディ
ウサギ、マウスなどに見られる一般的な抗体は重鎖と軽鎖からなる複合体であり、研究、診断、治療などには、IgG、IgMなどの免疫グロブリンとその誘導体(Fab断片など)が広く用いられている(図1)。
最も一般的な抗体分子(免疫グロブリンG, IgG)は、別々の可変領域(Variable region)ドメインを持った重鎖と軽鎖からなるヘテロダイマーが1つの抗原を認識し、重鎖の定常領域(Constant region)ドメインを介したジスルフィド結合で、もう一つの同じ重鎖と軽鎖 のヘテロダイマーと一緒になって、分子量150kDaほどのY字型のヘテロテトラマーとなっている。
また目的に応じて、抗原との結合能を維持した小型抗体分子、例えばFab(1つの軽鎖および半分の重鎖)のようなプロテアーゼ切断断片や、重鎖と軽鎖の可変領域ドメインを組換えDNA技術で人工的に接続することで一本鎖の可変断片とした単鎖抗体 (single chain antibody, single chain variable fragment, scFV)がしばしば利用されてきた[1] [2]。
一方、1993年、ヒトコブラクダ(Camelus dromedarius)は、 例外的に軽鎖がない重鎖のみでできた特殊な抗体(重鎖抗体 Heavy chain antibodies )も持っていることが、Hamers-Castermanらによって報告された[3][4]。 これは、現存するラクダ科の動物(ヒトコブラクダ、フタコブラクダ(Camelus bactorianusまたはferus)、リャマ(Lama glama)/グアナコ(Lama guanicoe)、アルパカ(Vicugna pacos)/ビクーニャ(Vicugna vicugna))に共通して見られる抗体である。その後、軟骨魚類(サメ、ギンザメなど)でも類似した重鎖抗体の存在が確認された[5][6]。
サメで見られる重鎖抗体は、IgNAR (new antigen receptor)と呼ばれ、1つの可変領域のドメイン(vNARと呼ばれる)が抗原と結合することができる。
一方、ラクダ科の重鎖抗体では、その1つの可変領域ドメインはVHHと呼ばれる。他のポリペプチドの存在なしで抗原と結合する単鎖抗体であるVHHは、その分子量が通常のIgGの10分の1ほどの12-15kDaであり、nm単位の大きさであることから「ナノボディNanobody」と一般的に呼ばれている[4] [7]。
注:実際は、ベルギーのAblynx社(2018年に、フランスのバイオテクノロジー会社Sanofiの傘下となった)の商標となっている。[8]
構造
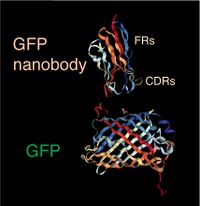
ナノボディは、通常120アミノ酸残基のポリペプチドである。基本的には、典型的な免疫グロブリンの可変領域の配列の構成と類似しており、FR1からFR4というフレームワーク領域(framework region)に挟まれて超可変領域である相補性決定領域(complementary determining region, CDR)と呼ばれる3つのCDR1-3が見られる(図2)。図3にリャマ由来のGFPナノボディの結晶構造を示す。このGFPとGFPナノボディのKd値は約1nMである[9]。
しかしながら、通常の免疫グロブリンの可変領域とは異なる特徴が見られ、それがナノボディの長所ともなっている。
第1に、通常の免疫グロブリンに比べて、FR2領域に親水性のアミノ酸残基が多く、ナノボディの水溶性の性質や安定性を高めている[10]。
第2に、 通常の免疫グロブリンの6つのCDR(重鎖3つ、軽鎖3つ)の代わりに3つのCDRのみで抗原と結合する。その結果、認識に必要な構造(パラトープ, paratope)が凸型で小さいので、通常の免疫グロブリンが入り込めないような隠れた抗原の構造(エピトープ, epitope)を認識できる可能性がある[11]。
第3に、通常の抗体より長いCDR1, CDR3ループを持つために、結合の親和性や特異性を高めることが可能となっている。これらの水溶性、構造的なコンパクトさ、そして超可変領域の配列の多様性が、通常の免疫グロブリンの可変領域と違ったナノボディの特性である。
作製
新規ナノボディ
一般的な方法としては、重鎖抗体を産生する動物を飼育し、それを抗原で免疫することで、重鎖抗体が得られる。比較的小型のリャマのほかに、アルパカ、ヒトコブラクダ、小型のネコザメ(Heterodontus francisci)などが免疫に利用されている。
次に免疫された動物から血液を採集し、その中にあるB細胞から、可変領域を含むcDNAライブラリーをM13ファージを使ったファージディスプレイライブラリーに組み込み、固定化した抗原を使ったスクリーニングすることで、cDNA配列を単離し、抗原に結合するナノボディ配列を知ることができる[12][13]。ラクダ科動物の遺伝子を組み込んだマウスも開発されているが、その利用は一般的ではないようである[14][15]。
このスクリーニングを効果的に行うための工夫が多数開発されてきている[16]。ファージディスプレイの担体の工夫、Staphylococcus carnosusのようなグラム陽性菌表面へのディスプレイ、酵母細胞表面へのディスプレイ、mRNAディスプレイ、リボソームディスプレイ、細胞内での2ハイブリッドスクリーニングなどが用いられてきている。
特に、最近、これらの方法を組み合わせることで、効率的に行う戦略が考案されている。Fridyらは、免疫動物の結合抗体を精製しその質量スペクトルの結果とファージディスプレイのハイスループットな配列決定を組み合わせる方法で、蛍光タンパク質に結合する多数のナノボディを報告した[17]。Zimmermann は、リボソームディスプレイ、ファージディスプレイ、ELISAを組み合わせることで、短期間にナノボディ配列を得る戦略を報告している[18]。また、McMahon らは、酵母ディスプレイを用いて、免疫動物を用いない合成ライブラリーをスクリーニングすることで親和性の高いナノボディ配列を得ることができることを示している[19] 。
ただ、このような非免疫ライブラリーや合成ライブラリーを用いる方法については、まだ適用例が多くなく、標準的な方法とされるものが存在しないというのが実情であろう。また、ある程度の抗原親和性を示すナノボディの配列を調整することで、親和性の成熟(affinity maturation)を行うこともできる[20] 。
将来的には人工知能などを使ったナノボディのデザインなども可能になるのかもしれない[21][22]。
通常、ナノボディは、目的別に発現ベクターにクローニングした後、哺乳類細胞だけなく、細菌、酵母、植物でも産生させることができる。哺乳類細胞では、抗体が本来機能する細胞外だけでなく、細胞内部でも発現させることが可能である(イントラボディ)。ただし、ナノボディの配列はそれぞれ異なり、ジスルフィド結合の生成が抗原との結合力あるコンフォメーションを取るために必要な場合、細胞外とは還元環境の異なる細胞内や細菌などでは活性のあるものが産生できないものもある。ナノボディの中には90℃という高温でも失活しないものもあるように[23][24]、一般に安定性は高いが、これも各ナノボディのアミノ酸配列から生じる特性による。
既知ナノボディ
ナノボディの情報を系統的に収集してきている中国の南京にある東南大学のiCAN (Institute Collection & Analysis of Nanobody)[25]には、2018年8月現在、約2400のナノボディ配列が登録されている。
1つのナノボディは、120アミノ酸(cDNAとして360bp)ほどなので、クローニングなどに利用するための配列を付加しても500bp未満の長さに収めることができる。したがって、利用したい特定ナノボディのアミノ酸配列がわかっていれば、いくつかの民間会社が提供している長鎖DNAを化学合成するサービスなどを利用することで短期間のうちにcDNA配列が入手可能である。
修飾
ナノボディだけでは 通常の抗体と違い定常領域を欠いているため、何らかの修飾が必要である。このことはナノボディが抗体のように簡便に利用できないという不便さになっているが、修飾を実験に合わせて自在に工夫できるという利点にもなっている。また、余分な構造を持たないので、バックグラウンドを低下させ、感度や精度の高い解析が可能になるという長所もある。
化学的カップリング
免疫組織化学に最もよく用いられているのは、ナノボディをタンパク質として精製後、色素分子などを化学的にカップリングするという方法である。このような試薬は既製のナノボディ試薬として市販もされている(例、ChromoTek社[26] )。最近、1次抗体を認識する「2次抗体」の活性を持つナノボディが報告されている[27] 。ナノボディの多くは、大腸菌で活性あるものを大量産生、精製することができるので、一度、配列がわかれば、動物を使用する必要がなくなる。
また、化学的なカップリングなので、カップリングする分子を変化させ工夫することで、目的に合わせて様々な標識ナノボディ(薬剤を結合した武装抗体など)を作製できる可能性がある[28] 。しかし、カップリングによるアミノ酸残基を修飾する反応により抗原結合能を失うことも想定される。この問題については、修飾するアミノ酸残基の位置を制御することで解決は可能である[29] 。
RANbody
化学的カップリング反応は、しばしばナノボディの活性を消失させるが、実験的にも条件決定など必ずしも容易ではない。この問題を克服するために開発されたプラットフォームがRANbody(Receptor-and-Nanobody)である[30]。
RANbodyは、1つのナノボディを酵素(改良型西洋ワサビペルオキシダーゼ HRP)、抗原性のあるニワトリ抗体IgYのFc断片、あるいは多重エピトープタグなどのうち1つと、組み換えDNA技術により融合させることで、検出可能にしたものである。プラスミドを293T細胞などの動物細胞に導入するだけで、培地中に放出されるので多くの生物医学系の実験室で利用できる。HRPは大腸菌の中では活性のある酵素として発現させることができない。その一つの解決策として、アスコルビン酸オキシダーゼ (APEX2)との融合タンパク質を大腸菌で発現させて用いることができるが、APEX2はHRPに比べて活性が弱い[31][32] 。
利用法
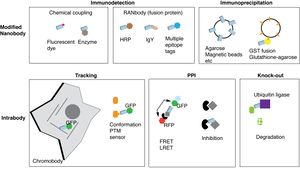
基本的には通常の「抗体」のように生化学的解析(ウェスタンブロッティング、免疫沈降法、ELISAなど)、免疫組織化学(組織染色、蛍光抗体法など)、細胞分離技術(FACSなど)に利用できる(図4)。
免疫沈降法
免疫沈降法(プルダウン pulldown)では、GFPナノボディなどをアガロースや磁気ビーズなどの担体にカップリングすることで得られた担体が市販されているので利用できる。また、多くのナノボディは大量に自家精製できるので、通常の抗体などのアフィニティクロマトグラフィ担体を作製するのと同じように利用可能である。例えば、グルタチオンS-転移酵素 (GST)などとの融合タンパク質は、グルタチン結合ゲルに容易に結合するので、免疫沈降法に有用である[33] [34] [35] 。
免疫組織化学
上述したように標識したナノボディを用いることで、細胞や組織の染色が可能である。ナノボディは小さく、通常の抗体では入り込めない箇所に結合することで、STORMやPALMなどの高解像度顕微鏡においても、アーチファクトが減少し、有用なツールになると考えられている[36] 。
イントラボディ、クロモボディ
ナノボディの特徴は、組み換えタンパク質として、細胞に強制発現させることで、細胞内で機能的に発現することができることである。この方法は、一般にイントラボディ (intrabody)(細胞内ボディ、細胞内抗体、細胞内発現抗体)と呼ばれる。
クロモボディ (chromobody)は、ナノボディをGFPなどの蛍光タンパク質と結合することで、標的分子に結合し、標的分子の染色や追跡を可能にする方法である。例えば、アクチンに対するナノボディをGFPと融合させ、それを細胞内で発現させれば、アクチンがナノボディを介してGFPで標識される(アクチンーナノボディーGFP)。この融合させる蛍光タンパク質をSTORM, PALMなどの高解像度顕微鏡に利用できる分子種とすれば、高解像度のバイオイメージングも可能である[37][38][39]。
更に、特殊な構造を認識できるナノボディを利用すれば、分子の変化を追跡することが可能になる。例えば、活性型と非活性型のβ2アドレナリン受容体のコンフォメーション を識別できるナノボディ[40] を使って、同分子の特殊なコンフォメーションを細胞内で観察ができる。
また、GFPナノボディのあるものは、GFPを2つに分割した断片と再構成したGFPを区別できる[30]。
リン酸化、アセチル化などの翻訳後修飾(post-translational modification) された抗原を認識するナノボディは、翻訳後修飾のセンサーとして利用される[41]。
分子間相互作用など
ナノボディは、分子間相互作用(Protein-protein interaction, PPI)の研究ツールとしても有用である[42][43]。このために、1つの効果的な使用法は、イントラボディとして発現させ、FRET、LRETといった分子間相互作用を検出するための方法と組み合わせたバイオイメージングである[44][45][46]。また、細胞外分子の分子間相互作用研究のツールとしても利用されている[47][48]。
また、特定の分子間相互作用を阻害するナノボディを細胞内で発現させたりすることも可能である。このような方法は、分子機能の研究において、タンパク質の数を調整するRNAiやゲノム編集による変異法とは違ったアプローチである[49] 。
ユビキチン系を利用することで、ナノボディの標的タンパク質を特異的に分解することも可能である[50]。
ナノボディー以外の組み換え結合体
免疫グロブリンに由来するナノボディ以外に、免疫グロブリン以外に見られるタンパク質のドメインを用いて、新たな組み換え結合体(Recombinant binder, Programmable protein)を作製する方法もあり、原理的にはこのような組み換え結合体はナノボディと同じ利用法が可能である[51][52] 。
細胞接着分子フィブロネクチン中の代表的なモチーフであるtype IIIリピートは、免疫グロブリンドメインと構造が類似しており、これを他の分子に結合する免疫グロブリンのように改変することが可能である。この方法は、モノボディ(monobody)と名付けられている[53]。この方法は、ナノボディと違って、ジスルフィド結合によって構造が左右されないので、細胞内での還元状態の環境でも利用できる可能性が広がる。例えば、Arnoldのグループによって開発されたFingRは、PSD-95やゲフィリンといったシナプスタンパク質を認識することができる[54] 。
免疫グロブリンを利用しない組み換え結合体には、このほかにも、アンキリンリピートを利用したDARPin(Designed ankyrin repeat proteins)などの方法がある[51]。DARPinは認識に関わる構造が凹型になりやすく、パラトープが凸型でタンパク質中に埋もれた構造を認識しやすいナノボディとは対照的である。一般にナノボディは小分子を認識するものは作製が困難であるとされており[7]、ナノボディー以外の組み換え結合体はこのようなナノボディの弱点を克服するのに有用であろう。
抗体利用研究の再現性
近年、生命科学系の研究では、論文発表された実験結果の一部が容易に再現できないとされる問題がしばしば指摘されている。抗体の利用は、この再現性問題の重要な要因の1つであるとされる[55][56]。
例えば、ウサギなどからのポリクローナル抗体は、多数の異なる抗体分子を含んでいるため、免疫した動物などバッチごとの差が大きい。また、モノクローナル抗体は、ハイブリドーマ細胞を増殖させることで、永遠に同じものを得ることができるはずであるが、市販抗体は予期せず販売中止になったり、ハイブリドーマ細胞は極低温で凍結維持しなくてはならず、災害や個々の研究者の都合により失われてしまうこともある。
ナノボディは、アミノ酸配列レベルで定義されるので質は同じであり、DNAという形で安価で長期保存が可能である。万一DNAが失われても、登録されたアミノ酸配列をもとにして容易に再生できるので、抗体の利用研究の再現性問題の解決法として注目されている。
臨床応用
従来の抗体同様に、診断や細胞分離技術への利用とともに、次世代の抗体医薬として、感染症、がん、自己免疫疾患、移植や再生医療、神経系疾患などへの適用が期待される[7][57][58]。
Ablynx社が開発した 後天性血栓性血小板減少性紫斑病を対象とした抗Von Willebrand因子ナノボディであるcaplacizumabは、既に第III相試験で良好な結果が得られている[59]。
近年、抗体医薬が世界の医薬品売上高ランキングの上位に位置していることから考えて、その実用の将来性は大きい(参考:平成26年度 特許出願技術動向調査報告書~抗体医薬)[60]。また、農業分野でもその利用が注目されている[57]。
参考文献
- ↑
Padlan, E.A. (1994).
Anatomy of the antibody molecule. Molecular immunology, 31(3), 169-217. [PubMed:8114766] [WorldCat] [DOI] - ↑
Frenzel, A., Hust, M., & Schirrmann, T. (2013).
Expression of recombinant antibodies. Frontiers in immunology, 4, 217. [PubMed:23908655] [PMC] [WorldCat] [DOI] - ↑
Hamers-Casterman, C., Atarhouch, T., Muyldermans, S., Robinson, G., Hamers, C., Songa, E.B., ..., & Hamers, R. (1993).
Naturally occurring antibodies devoid of light chains. Nature, 363(6428), 446-8. [PubMed:8502296] [WorldCat] [DOI] - ↑ 4.0 4.1
Muyldermans, S. (2013).
Nanobodies: natural single-domain antibodies. Annual review of biochemistry, 82, 775-97. [PubMed:23495938] [WorldCat] [DOI] - ↑
Greenberg, A.S., Avila, D., Hughes, M., Hughes, A., McKinney, E.C., & Flajnik, M.F. (1995).
A new antigen receptor gene family that undergoes rearrangement and extensive somatic diversification in sharks. Nature, 374(6518), 168-73. [PubMed:7877689] [WorldCat] [DOI] - ↑
Flajnik, M.F., & Kasahara, M. (2010).
Origin and evolution of the adaptive immune system: genetic events and selective pressures. Nature reviews. Genetics, 11(1), 47-59. [PubMed:19997068] [PMC] [WorldCat] [DOI] - ↑ 7.0 7.1 7.2
Arbabi-Ghahroudi, M. (2017).
Camelid Single-Domain Antibodies: Historical Perspective and Future Outlook. Frontiers in immunology, 8, 1589. [PubMed:29209322] [PMC] [WorldCat] [DOI] - ↑ http://www.ablynx.com/technology-innovation/intellectual-property/
- ↑
Kubala, M.H., Kovtun, O., Alexandrov, K., & Collins, B.M. (2010).
Structural and thermodynamic analysis of the GFP:GFP-nanobody complex. Protein science : a publication of the Protein Society, 19(12), 2389-401. [PubMed:20945358] [PMC] [WorldCat] [DOI] - ↑
Muyldermans, S., Atarhouch, T., Saldanha, J., Barbosa, J.A., & Hamers, R. (1994).
Sequence and structure of VH domain from naturally occurring camel heavy chain immunoglobulins lacking light chains. Protein engineering, 7(9), 1129-35. [PubMed:7831284] [WorldCat] [DOI] - ↑
De Genst, E., Silence, K., Decanniere, K., Conrath, K., Loris, R., Kinne, J., ..., & Wyns, L. (2006).
Molecular basis for the preferential cleft recognition by dromedary heavy-chain antibodies. Proceedings of the National Academy of Sciences of the United States of America, 103(12), 4586-91. [PubMed:16537393] [PMC] [WorldCat] [DOI] - ↑
Pardon, E., Laeremans, T., Triest, S., Rasmussen, S.G., Wohlkönig, A., Ruf, A., ..., & Steyaert, J. (2014).
A general protocol for the generation of Nanobodies for structural biology. Nature protocols, 9(3), 674-93. [PubMed:24577359] [PMC] [WorldCat] [DOI] - ↑
Flajnik, M.F., & Dooley, H. (2009).
The generation and selection of single-domain, v region libraries from nurse sharks. Methods in molecular biology (Clifton, N.J.), 562, 71-82. [PubMed:19554288] [WorldCat] [DOI] - ↑
Zou, X., Smith, J.A., Nguyen, V.K., Ren, L., Luyten, K., Muyldermans, S., & Brüggemann, M. (2005).
Expression of a dromedary heavy chain-only antibody and B cell development in the mouse. Journal of immunology (Baltimore, Md. : 1950), 175(6), 3769-79. [PubMed:16148123] [WorldCat] [DOI] - ↑
Janssens, R., Dekker, S., Hendriks, R.W., Panayotou, G., van Remoortere, A., San, J.K., ..., & Drabek, D. (2006).
Generation of heavy-chain-only antibodies in mice. Proceedings of the National Academy of Sciences of the United States of America, 103(41), 15130-5. [PubMed:17015837] [PMC] [WorldCat] [DOI] - ↑
Liu, W., Song, H., Chen, Q., Yu, J., Xian, M., Nian, R., & Feng, D. (2018).
Recent advances in the selection and identification of antigen-specific nanobodies. Molecular immunology, 96, 37-47. [PubMed:29477934] [WorldCat] [DOI] - ↑
Fridy, P.C., Li, Y., Keegan, S., Thompson, M.K., Nudelman, I., Scheid, J.F., ..., & Rout, M.P. (2014).
A robust pipeline for rapid production of versatile nanobody repertoires. Nature methods, 11(12), 1253-60. [PubMed:25362362] [PMC] [WorldCat] [DOI] - ↑
Zimmermann, I., Egloff, P., Hutter, C.A., Arnold, F.M., Stohler, P., Bocquet, N., ..., & Seeger, M.A. (2018).
Synthetic single domain antibodies for the conformational trapping of membrane proteins. eLife, 7. [PubMed:29792401] [PMC] [WorldCat] [DOI] - ↑
McMahon, C., Baier, A.S., Pascolutti, R., Wegrecki, M., Zheng, S., Ong, J.X., ..., & Kruse, A.C. (2018).
Yeast surface display platform for rapid discovery of conformationally selective nanobodies. Nature structural & molecular biology, 25(3), 289-296. [PubMed:29434346] [PMC] [WorldCat] [DOI] - ↑
Yau, K.Y., Dubuc, G., Li, S., Hirama, T., Mackenzie, C.R., Jermutus, L., ..., & Tanha, J. (2005).
Affinity maturation of a V(H)H by mutational hotspot randomization. Journal of immunological methods, 297(1-2), 213-24. [PubMed:15777944] [WorldCat] [DOI] - ↑
Liberis, E., Velickovic, P., Sormanni, P., Vendruscolo, M., & Liò, P. (2018).
Parapred: antibody paratope prediction using convolutional and recurrent neural networks. Bioinformatics (Oxford, England), 34(17), 2944-2950. [PubMed:29672675] [WorldCat] [DOI] - ↑
Chevalier, A., Silva, D.A., Rocklin, G.J., Hicks, D.R., Vergara, R., Murapa, P., ..., & Baker, D. (2017).
Massively parallel de novo protein design for targeted therapeutics. Nature, 550(7674), 74-79. [PubMed:28953867] [PMC] [WorldCat] [DOI] - ↑
van der Linden, R.H., Frenken, L.G., de Geus, B., Harmsen, M.M., Ruuls, R.C., Stok, W., ..., & Verrips, C.T. (1999).
Comparison of physical chemical properties of llama VHH antibody fragments and mouse monoclonal antibodies. Biochimica et biophysica acta, 1431(1), 37-46. [PubMed:10209277] [WorldCat] [DOI] - ↑
Akazawa-Ogawa, Y., Takashima, M., Lee, Y.H., Ikegami, T., Goto, Y., Uegaki, K., & Hagihara, Y. (2014).
Heat-induced irreversible denaturation of the camelid single domain VHH antibody is governed by chemical modifications. The Journal of biological chemistry, 289(22), 15666-79. [PubMed:24739391] [PMC] [WorldCat] [DOI] - ↑
Zuo, J., Li, J., Zhang, R., Xu, L., Chen, H., Jia, X., ..., & Xie, W. (2017).
Institute collection and analysis of Nanobodies (iCAN): a comprehensive database and analysis platform for nanobodies. BMC genomics, 18(1), 797. [PubMed:29041922] [PMC] [WorldCat] [DOI] - ↑ https://www.chromotek.com/
- ↑
Pleiner, T., Bates, M., & Görlich, D. (2018).
A toolbox of anti-mouse and anti-rabbit IgG secondary nanobodies. The Journal of cell biology, 217(3), 1143-1154. [PubMed:29263082] [PMC] [WorldCat] [DOI] - ↑
Traenkle, B., & Rothbauer, U. (2017).
Under the Microscope: Single-Domain Antibodies for Live-Cell Imaging and Super-Resolution Microscopy. Frontiers in immunology, 8, 1030. [PubMed:28883823] [PMC] [WorldCat] [DOI] - ↑
Pleiner, T., Bates, M., Trakhanov, S., Lee, C.T., Schliep, J.E., Chug, H., ..., & Görlich, D. (2015).
Nanobodies: site-specific labeling for super-resolution imaging, rapid epitope-mapping and native protein complex isolation. eLife, 4, e11349. [PubMed:26633879] [PMC] [WorldCat] [DOI] - ↑ 30.0 30.1
Yamagata, M., & Sanes, J.R. (2018).
Reporter-nanobody fusions (RANbodies) as versatile, small, sensitive immunohistochemical reagents. Proceedings of the National Academy of Sciences of the United States of America, 115(9), 2126-2131. [PubMed:29440485] [PMC] [WorldCat] [DOI] - ↑
Buser, D.P., Schleicher, K.D., Prescianotto-Baschong, C., & Spiess, M. (2018).
A versatile nanobody-based toolkit to analyze retrograde transport from the cell surface. Proceedings of the National Academy of Sciences of the United States of America, 115(27), E6227-E6236. [PubMed:29915061] [PMC] [WorldCat] [DOI] - ↑
Lam, S.S., Martell, J.D., Kamer, K.J., Deerinck, T.J., Ellisman, M.H., Mootha, V.K., & Ting, A.Y. (2015).
Directed evolution of APEX2 for electron microscopy and proximity labeling. Nature methods, 12(1), 51-4. [PubMed:25419960] [PMC] [WorldCat] [DOI] - ↑
Trinkle-Mulcahy, L., Boulon, S., Lam, Y.W., Urcia, R., Boisvert, F.M., Vandermoere, F., ..., & Lamond, A. (2008).
Identifying specific protein interaction partners using quantitative mass spectrometry and bead proteomes. The Journal of cell biology, 183(2), 223-39. [PubMed:18936248] [PMC] [WorldCat] [DOI] - ↑
Rothbauer, U., Zolghadr, K., Muyldermans, S., Schepers, A., Cardoso, M.C., & Leonhardt, H. (2008).
A versatile nanotrap for biochemical and functional studies with fluorescent fusion proteins. Molecular & cellular proteomics : MCP, 7(2), 282-9. [PubMed:17951627] [WorldCat] [DOI] - ↑
Katoh, Y., Nozaki, S., Hartanto, D., Miyano, R., & Nakayama, K. (2015).
Architectures of multisubunit complexes revealed by a visible immunoprecipitation assay using fluorescent fusion proteins. Journal of cell science, 128(12), 2351-62. [PubMed:25964651] [WorldCat] [DOI] - ↑
Szymborska, A., de Marco, A., Daigle, N., Cordes, V.C., Briggs, J.A., & Ellenberg, J. (2013).
Nuclear pore scaffold structure analyzed by super-resolution microscopy and particle averaging. Science (New York, N.Y.), 341(6146), 655-8. [PubMed:23845946] [WorldCat] [DOI] - ↑
Ries, J., Kaplan, C., Platonova, E., Eghlidi, H., & Ewers, H. (2012).
A simple, versatile method for GFP-based super-resolution microscopy via nanobodies. Nature methods, 9(6), 582-4. [PubMed:22543348] [WorldCat] [DOI] - ↑
Rothbauer, U., Zolghadr, K., Tillib, S., Nowak, D., Schermelleh, L., Gahl, A., ..., & Leonhardt, H. (2006).
Targeting and tracing antigens in live cells with fluorescent nanobodies. Nature methods, 3(11), 887-9. [PubMed:17060912] [WorldCat] [DOI] - ↑
Traenkle, B., & Rothbauer, U. (2017).
Under the Microscope: Single-Domain Antibodies for Live-Cell Imaging and Super-Resolution Microscopy. Frontiers in immunology, 8, 1030. [PubMed:28883823] [PMC] [WorldCat] [DOI] - ↑
Irannejad, R., Tomshine, J.C., Tomshine, J.R., Chevalier, M., Mahoney, J.P., Steyaert, J., ..., & von Zastrow, M. (2013).
Conformational biosensors reveal GPCR signalling from endosomes. Nature, 495(7442), 534-8. [PubMed:23515162] [PMC] [WorldCat] [DOI] - ↑
Sato, Y., Mukai, M., Ueda, J., Muraki, M., Stasevich, T.J., Horikoshi, N., ..., & Kimura, H. (2013).
Genetically encoded system to track histone modification in vivo. Scientific reports, 3, 2436. [PubMed:23942372] [PMC] [WorldCat] [DOI] - ↑
Wegner, K.D., Lindén, S., Jin, Z., Jennings, T.L., el Khoulati, R., van Bergen en Henegouwen, P.M., & Hildebrandt, N. (2014).
Nanobodies and nanocrystals: highly sensitive quantum dot-based homogeneous FRET immunoassay for serum-based EGFR detection. Small (Weinheim an der Bergstrasse, Germany), 10(4), 734-40. [PubMed:24115738] [WorldCat] [DOI] - ↑
Choi, Y., Furlon, J.M., Amos, R.B., Griswold, K.E., & Bailey-Kellogg, C. (2018).
DisruPPI: structure-based computational redesign algorithm for protein binding disruption. Bioinformatics (Oxford, England), 34(13), i245-i253. [PubMed:29949961] [PMC] [WorldCat] [DOI] - ↑
Beghein, E., & Gettemans, J. (2017).
Nanobody Technology: A Versatile Toolkit for Microscopic Imaging, Protein-Protein Interaction Analysis, and Protein Function Exploration. Frontiers in immunology, 8, 771. [PubMed:28725224] [PMC] [WorldCat] [DOI] - ↑
Drees, C., Raj, A.N., Kurre, R., Busch, K.B., Haase, M., & Piehler, J. (2016).
Engineered Upconversion Nanoparticles for Resolving Protein Interactions inside Living Cells. Angewandte Chemie (International ed. in English), 55(38), 11668-72. [PubMed:27510808] [WorldCat] [DOI] - ↑
Künzl, F., Früholz, S., Fäßler, F., Li, B., & Pimpl, P. (2016).
Receptor-mediated sorting of soluble vacuolar proteins ends at the trans-Golgi network/early endosome. Nature plants, 2, 16017. [PubMed:27249560] [WorldCat] [DOI] - ↑
Goodman, K.M., Yamagata, M., Jin, X., Mannepalli, S., Katsamba, P.S., Ahlsén, G., ..., & Shapiro, L. (2016).
Molecular basis of sidekick-mediated cell-cell adhesion and specificity. eLife, 5. [PubMed:27644106] [PMC] [WorldCat] [DOI] - ↑
Glass, D.S., & Riedel-Kruse, I.H. (2018).
A Synthetic Bacterial Cell-Cell Adhesion Toolbox for Programming Multicellular Morphologies and Patterns. Cell, 174(3), 649-658.e16. [PubMed:30033369] [WorldCat] [DOI] - ↑
Schumacher, D., Helma, J., Schneider, A.F.L., Leonhardt, H., & Hackenberger, C.P.R. (2018).
Nanobodies: Chemical Functionalization Strategies and Intracellular Applications. Angewandte Chemie (International ed. in English), 57(9), 2314-2333. [PubMed:28913971] [PMC] [WorldCat] [DOI] - ↑
Caussinus, E., Kanca, O., & Affolter, M. (2011).
Fluorescent fusion protein knockout mediated by anti-GFP nanobody. Nature structural & molecular biology, 19(1), 117-21. [PubMed:22157958] [WorldCat] [DOI] - ↑ 51.0 51.1
Helma, J., Cardoso, M.C., Muyldermans, S., & Leonhardt, H. (2015).
Nanobodies and recombinant binders in cell biology. The Journal of cell biology, 209(5), 633-44. [PubMed:26056137] [PMC] [WorldCat] [DOI] - ↑
Sha, F., Salzman, G., Gupta, A., & Koide, S. (2017).
Monobodies and other synthetic binding proteins for expanding protein science. Protein science : a publication of the Protein Society, 26(5), 910-924. [PubMed:28249355] [PMC] [WorldCat] [DOI] - ↑
Koide, A., Wojcik, J., Gilbreth, R.N., Hoey, R.J., & Koide, S. (2012).
Teaching an old scaffold new tricks: monobodies constructed using alternative surfaces of the FN3 scaffold. Journal of molecular biology, 415(2), 393-405. [PubMed:22198408] [PMC] [WorldCat] [DOI] - ↑
Gross, G.G., Junge, J.A., Mora, R.J., Kwon, H.B., Olson, C.A., Takahashi, T.T., ..., & Arnold, D.B. (2013).
Recombinant probes for visualizing endogenous synaptic proteins in living neurons. Neuron, 78(6), 971-85. [PubMed:23791193] [PMC] [WorldCat] [DOI] - ↑
Baker, M. (2015).
Reproducibility crisis: Blame it on the antibodies. Nature, 521(7552), 274-6. [PubMed:25993940] [WorldCat] [DOI] - ↑
Manuel, S.L., Johnson, B.W., Frevert, C.W., & Duncan, F.E. (2018).
Revisiting the scientific method to improve rigor and reproducibility of immunohistochemistry in reproductive science. Biology of reproduction, 99(4), 673-677. [PubMed:29688318] [PMC] [WorldCat] [DOI] - ↑ 57.0 57.1
Wang, Y., Fan, Z., Shao, L., Kong, X., Hou, X., Tian, D., ..., & Yu, L. (2016).
Nanobody-derived nanobiotechnology tool kits for diverse biomedical and biotechnology applications. International journal of nanomedicine, 11, 3287-303. [PubMed:27499623] [PMC] [WorldCat] [DOI] - ↑
Hu, Y., Liu, C., & Muyldermans, S. (2017).
Nanobody-Based Delivery Systems for Diagnosis and Targeted Tumor Therapy. Frontiers in immunology, 8, 1442. [PubMed:29163515] [PMC] [WorldCat] [DOI] - ↑ http://www.ablynx.com/rd-portfolio/overview/
- ↑ http://www3.keizaireport.com/report.php/RID/245009/