「ノルアドレナリン」の版間の差分
細編集の要約なし |
細編集の要約なし |
||
| 82行目: | 82行目: | ||
ノルアドレナリンの代謝分解には次の二つの酵素が重要である。 | ノルアドレナリンの代謝分解には次の二つの酵素が重要である。 | ||
*'''[[モノアミン酸化酵素]](monoamine oxidase, MAO)''':MAOはモノアミンのアミノ基を[[wikipedia:ja:アルデヒド|アルデヒド]]基に酸化する。MAOは[[ミトコンドリア]]外膜に局在しに存在し、細胞内のノルアドレナリン(再取込みされたものを含む)の分解に関与する。ただしMAOに比べてvMAT2の方がノルアドレナリンに対する親和性がずっと高いため、シナプス小胞への取り込みの方がMAOによる分解よりも優先されると考えられる<ref name="ref12"><pubmed> 16552415</pubmed></ref>。MAOには[[MAO-A]]と[[MAO-B]]があり、二つの別の遺伝子によりコードされている。MAO-AとMAO-Bはモノアミン作動性神経細胞および[[グリア細胞]]に発現しているが、発現量は細胞の種類により異なり、また動物種によっても違いが見られる<ref name="ref12" />。[[マウス]]脳のノルアドレナリン作動性神経細胞には主にMAO-Aが発現している<ref name="ref13"><pubmed> 11793338 </pubmed></ref>。 | *'''[[モノアミン酸化酵素]](monoamine oxidase, MAO)''':MAOはモノアミンのアミノ基を[[wikipedia:ja:アルデヒド|アルデヒド]]基に酸化する。MAOは[[ミトコンドリア]]外膜に局在しに存在し、細胞内のノルアドレナリン(再取込みされたものを含む)の分解に関与する。ただしMAOに比べてvMAT2の方がノルアドレナリンに対する親和性がずっと高いため、シナプス小胞への取り込みの方がMAOによる分解よりも優先されると考えられる<ref name="ref12"><pubmed> 16552415</pubmed></ref>。MAOには[[MAO-A]]と[[MAO-B]]があり、二つの別の遺伝子によりコードされている。MAO-AとMAO-Bはモノアミン作動性神経細胞および[[グリア細胞]]に発現しているが、発現量は細胞の種類により異なり、また動物種によっても違いが見られる<ref name="ref12" />。[[マウス]]脳のノルアドレナリン作動性神経細胞には主にMAO-Aが発現している<ref name="ref13"><pubmed> 11793338 </pubmed></ref>。 | ||
*'''[[カテコール-O-メチル基転移酵素|カテコール-''O''-メチル基転移酵素]](catechol-''O''-methyltransferase, COMT)''':これはカテコール基の[[wikipedia:ja:メタ|メタ]]位[[wikipedia:ja:水酸基|水酸基]]に[[wikipedia:ja:メチル基|メチル基]]を転移させる。[[wikipedia:ja:腎臓|腎臓]]や[[wikipedia:ja:肝臓|肝臓]]に豊富だが、カテコールアミン作動性神経細胞の投射先においても発現している。細胞外で働くと考えられている<ref name="ref14"><pubmed> 21846718 </pubmed></ref>。 | *'''[[カテコール-O-メチル基転移酵素|カテコール-''O''-メチル基転移酵素]](catechol-''O''-methyltransferase, COMT)''':これはカテコール基の[[wikipedia:ja:メタ|メタ]]位[[wikipedia:ja:水酸基|水酸基]]に[[wikipedia:ja:メチル基|メチル基]]を転移させる。[[wikipedia:ja:腎臓|腎臓]]や[[wikipedia:ja:肝臓|肝臓]]に豊富だが、カテコールアミン作動性神経細胞の投射先においても発現している。細胞外で働くと考えられている<ref name="ref14"><pubmed> 21846718 </pubmed></ref>。 | ||
| 91行目: | 91行目: | ||
ノルアドレナリンはアドレナリンと共にアドレナリン受容体(adrenergic receptorまたはadrenoceptor)に結合し活性化する。αおよびβのサブファミリーからなる(表)。より細かくは、α<sub>1A</sub>-α<sub>1D</sub>、α<sub>2A</sub>-α<sub>2C</sub>、β<sub>1</sub>-β<sub>3</sub>、から構成されている。いずれも三量体[[Gタンパク質共役型受容体]]である。α<sub>1</sub>はG<sub>q</sub>、α<sub>2</sub>はG<sub>i</sub>、β<sub>1</sub>-β<sub>3</sub>はG<sub>s</sub>と共役し、、異なるシグナル伝達を行う。Gqはphospho-lipase Cを活性化し、 inositol 1,4,5-trisphosphate (IP3) の産生からIP3受容体を介して細胞内Ca<sup>2+</sup>の上昇を引き起こす。またdiacylglicerol (DAG) の産生を介してProtein kinase Cの活性化を引き起こす。G<sub>i</sub>、G<sub>s</sub>はそれぞれadenylate cyclaseを阻害、または活性化し、cAMPの産生の増減、そしてPKA活性の増減を引き起こす。 | ノルアドレナリンはアドレナリンと共にアドレナリン受容体(adrenergic receptorまたはadrenoceptor)に結合し活性化する。αおよびβのサブファミリーからなる(表)。より細かくは、α<sub>1A</sub>-α<sub>1D</sub>、α<sub>2A</sub>-α<sub>2C</sub>、β<sub>1</sub>-β<sub>3</sub>、から構成されている。いずれも三量体[[Gタンパク質共役型受容体]]である。α<sub>1</sub>はG<sub>q</sub>、α<sub>2</sub>はG<sub>i</sub>、β<sub>1</sub>-β<sub>3</sub>はG<sub>s</sub>と共役し、、異なるシグナル伝達を行う。Gqはphospho-lipase Cを活性化し、 inositol 1,4,5-trisphosphate (IP3) の産生からIP3受容体を介して細胞内Ca<sup>2+</sup>の上昇を引き起こす。またdiacylglicerol (DAG) の産生を介してProtein kinase Cの活性化を引き起こす。G<sub>i</sub>、G<sub>s</sub>はそれぞれadenylate cyclaseを阻害、または活性化し、cAMPの産生の増減、そしてPKA活性の増減を引き起こす。 | ||
中枢神経系において、ノルアドレナリンは主にα<sub>1</sub>、α<sub>2</sub>、そしてβ<sub>1</sub>受容体を介して作用する。。海馬神経細胞において、β1受容体の活性化はCa2+依存性K+チャンネルを阻害し、afterhyperpolarizationを減少させ、結果的にシナプス入力依存的な発火を亢進させる<ref name="ref18"><pubmed> 2873241</pubmed></ref><ref name="ref19"><pubmed> 6300681</pubmed></ref>。この作用はcAMPを介している<ref name="ref20"><pubmed> 8274274</pubmed></ref>。さらに、β受容体は海馬におけるシナプス長期増強(LTP)をポジティブに調節する<ref name="ref21"><pubmed> 6311345</pubmed></ref><ref name="ref22"><pubmed> 20043991</pubmed></ref>。そのメカニズムとして、樹上突起状のA型K+チャンネルの不活性化によるbackpropagationの促進が考えられている<ref name="ref23"><pubmed> 9914302</pubmed></ref><ref name="ref24"><pubmed> 12077183</pubmed></ref>。また、SK型K+チャンネルの活性化やグルタミン酸受容体のリン酸化の可能性も指摘されている<ref name="ref25"><pubmed> 20043991</pubmed>。前頭前野では、α1、α2、そしてβ1受容体が異なる働きを示すことが示唆されている<ref name="ref26"><pubmed> 17303246</pubmed</ref> | 中枢神経系において、ノルアドレナリンは主にα<sub>1</sub>、α<sub>2</sub>、そしてβ<sub>1</sub>受容体を介して作用する。。海馬神経細胞において、β1受容体の活性化はCa2+依存性K+チャンネルを阻害し、afterhyperpolarizationを減少させ、結果的にシナプス入力依存的な発火を亢進させる<ref name="ref18"><pubmed> 2873241</pubmed></ref><ref name="ref19"><pubmed> 6300681</pubmed></ref>。この作用はcAMPを介している<ref name="ref20"><pubmed> 8274274</pubmed></ref>。さらに、β受容体は海馬におけるシナプス長期増強(LTP)をポジティブに調節する<ref name="ref21"><pubmed> 6311345</pubmed></ref><ref name="ref22"><pubmed> 20043991</pubmed></ref>。そのメカニズムとして、樹上突起状のA型K+チャンネルの不活性化によるbackpropagationの促進が考えられている<ref name="ref23"><pubmed> 9914302</pubmed></ref><ref name="ref24"><pubmed> 12077183</pubmed></ref>。また、SK型K+チャンネルの活性化やグルタミン酸受容体のリン酸化の可能性も指摘されている<ref name="ref25"><pubmed> 20043991</pubmed>。前頭前野では、α1、α2、そしてβ1受容体が異なる働きを示すことが示唆されている<ref name="ref26"><pubmed> 17303246</pubmed</ref>>。<br> | ||
<br> | <br> | ||
| 112行目: | 112行目: | ||
! style="white-space:nowrap" | [[wikipedia:Adrenergic antagonist|アンタゴニスト]] | ! style="white-space:nowrap" | [[wikipedia:Adrenergic antagonist|アンタゴニスト]] | ||
|- | |- | ||
| style="white-space:nowrap" | [[wikipedia:Α1 adrenergic receptor|α<sub>1</sub>]]:<br>[[wikipedia:Alpha-1A adrenergic receptor|A]], [[wikipedia:Alpha-1B adrenergic receptor|B]], [[wikipedia:Alpha-1D adrenergic receptor|D]]<sup>†</sup> | | style="white-space:nowrap" | [[wikipedia:Α1 adrenergic receptor|α&amp;amp;lt;sub&amp;amp;gt;1&amp;amp;lt;/sub&amp;amp;gt;]]:<br>[[wikipedia:Alpha-1A adrenergic receptor|A]], [[wikipedia:Alpha-1B adrenergic receptor|B]], [[wikipedia:Alpha-1D adrenergic receptor|D]]<sup>†</sup> | ||
| style="white-space:nowrap" | [[ノルアドレナリン]] > [[アドレナリン]] >> [[イソプレナリン]] | | style="white-space:nowrap" | [[ノルアドレナリン]] > [[アドレナリン]] >> [[イソプレナリン]] | ||
| [[wikipedia:ja:平滑筋|平滑筋]]収縮 | | [[wikipedia:ja:平滑筋|平滑筋]]収縮 | ||
| 229行目: | 229行目: | ||
== 主たる投射系 == | == 主たる投射系 == | ||
中枢神経系<br> 脳におけるノルアドレナリン作動性の神経細胞群は、主に髄質(medulla) | 中枢神経系<br> 脳におけるノルアドレナリン作動性の神経細胞群は、主に髄質(medulla)、橋(pons)に存在し、A1-A7に分けられている。 | ||
*'''A1'''、'''A2''':A1は髄質の腹外側に位置し、A2は背側に位置する。共に視床下部に上行性投射をし、ホルモン循環器系やホルモン内分泌系の調節を行う。 | *'''A1'''、'''A2''':A1は髄質の腹外側に位置し、A2は背側に位置する。共に視床下部に上行性投射をし、ホルモン循環器系やホルモン内分泌系の調節を行う。 | ||
| 237行目: | 237行目: | ||
<br> 自律神経系のうちの交感神経系では、節後神経細胞がノルアドレナリン作動性であり、脊髄中の節前神経細胞よりアセチルコリン性の入力を受け、ノルアドレナリン性の出力を内臓器官に与える。その結果、血管の収縮、血圧の上昇、心拍数の増加、などを引き起こす。 | <br> 自律神経系のうちの交感神経系では、節後神経細胞がノルアドレナリン作動性であり、脊髄中の節前神経細胞よりアセチルコリン性の入力を受け、ノルアドレナリン性の出力を内臓器官に与える。その結果、血管の収縮、血圧の上昇、心拍数の増加、などを引き起こす。 | ||
<br> | <br> [[Image:NEprojection.jpg|thumb|400px|図2 青斑核からのノルアドレナリン投射経路]] | ||
<div><br></div> | |||
== 中枢神経系におけるノルアドレナリンの機能 == | |||
1. 覚醒状態との関係<br> 青斑核は古くから覚醒状態に関係していると考えられてきた。1949年、Guiseppe MoruzziとHorace Magounは青斑核を含む脳幹部(紋様体)を刺激すると大脳皮質の脳波が様々に変化することを見いだし<ref name="ref35"><pubmed> 18421835</pubmed></ref>、この部位が脳の覚醒に関係することが示唆された。ラット青斑核神経細胞の発火頻度は、覚醒-睡眠のサイクルに応じて変化し、また継続中の行動を中断するような場合に上昇する<ref name="ref36"><pubmed> 7346592</pubmed></ref><ref name="ref37"><pubmed> 6771765</pubmed></ref>。その後の研究により、ノルアドレナリンは他の重要な機能を持つことが明らかとなってきた(下記)。 | 1. 覚醒状態との関係<br> 青斑核は古くから覚醒状態に関係していると考えられてきた。1949年、Guiseppe MoruzziとHorace Magounは青斑核を含む脳幹部(紋様体)を刺激すると大脳皮質の脳波が様々に変化することを見いだし<ref name="ref35"><pubmed> 18421835</pubmed></ref>、この部位が脳の覚醒に関係することが示唆された。ラット青斑核神経細胞の発火頻度は、覚醒-睡眠のサイクルに応じて変化し、また継続中の行動を中断するような場合に上昇する<ref name="ref36"><pubmed> 7346592</pubmed></ref><ref name="ref37"><pubmed> 6771765</pubmed></ref>。その後の研究により、ノルアドレナリンは他の重要な機能を持つことが明らかとなってきた(下記)。 | ||
2. 感覚入力の調節<br> | 2. 感覚入力の調節<br> ノルアドレナリンは、他の神経伝達物質による感覚入力の情報処理を修飾する。サルの聴覚野にノルアドレナリンを投与すると、聴覚刺激に対する応答のS/N比が亢進する、すなわち自発的活動(ノイズ)が減少するが、感覚入力依存的活動は維持される<ref name="ref38"><pubmed> 234774</pubmed></ref>。ラットの体性感覚野<ref name="ref39"><pubmed> 7349980</pubmed></ref>や海馬<ref name="ref40"><pubmed> 178411</pubmed></ref>にても同様の報告がなされている。さらに、発火の応答速度や同期性が向上することがラット体性感覚野<ref name="ref41"><pubmed> 15128405</pubmed></ref>や嗅皮質<ref name="ref42"><pubmed> 12492432</pubmed></ref>で報告されている。 | ||
3. 注意<br> | 3. 注意<br> α<sub>2</sub>アドレナリン受容体のアゴニストであるclonidineを低濃度で局所的に投与すると、軸索終末の自己受容体を介してノルアドレナリンの放出が減少する。この方法を用いて、ラットにて上行性のノルアドレナリン投射を低下させると、注意を必要とする前頭前野依存的な行動試験の成績が低下する<ref name="ref43"><pubmed> 15830223</pubmed></ref>。サルでは低濃度のclonidineにより認知機能が低下するが、高濃度では逆に認知機能が亢進し、特に老齢のサルで効果が認められた<ref name="ref44"><pubmed> 2999977</pubmed></ref><ref name="ref45"><pubmed> 17303246</pubmed></ref>。この効果は前頭前野におけるHyperpolarization-activated Cyclic Nucleotide-gated (HCN) channelsの活性化によると報告されている<ref name="ref46"><pubmed> 17448997</pubmed></ref>。ヒトにおいてもclonidineは覚醒状態に依存した効果を示し、視覚的注意に依存する作業を向上させる<ref name="ref47"><pubmed> 10600416</pubmed></ref>。 | ||
4. 記憶<br> 記憶の固定におけるノルアドレナリンの働きは、主に行動薬理学的実験により明らかになってきた。ノルアドレナリンは扁桃体や海馬において他の神経伝達物質やホルモンなどと相互作用し、長期記憶の形成を促進する<ref name="ref48"><pubmed> 18704369</pubmed></ref>。また、ノルアドレナリンはβ受容体を介して、記憶固定における遅いステージに関与していると報告されている<ref name="ref49"><pubmed> 10327234</pubmed></ref><ref name="ref50"><pubmed> 15254217</pubmed></ref>。<br>記憶の想起においてもノルアドレナリンが関与している。ラットにおいて、ノルアドレナリン放出の促進や青斑核の電気刺激により記憶の想起が促進される<ref name="ref51"><pubmed> 3345434</pubmed></ref><ref name="ref52"><pubmed> 2543356</pubmed></ref>。ドーパミンβ水酸化酵素のコンディショナル・ノックアウトマウスを用いた研究でも記憶の想起におけるノルアドレナリンの関与が示されている<ref name="ref53"><pubmed> 15066288</pubmed></ref>。<br> 心的外傷後ストレス障害(PTSD)においてもノルアドレナリンが関わると考えられる<ref name="ref54"><pubmed> 17354267</pubmed></ref>。PTSDに使用される薬剤clonidineはα2受容体のアゴニスト、prazosinはα<sub>1</sub>受容体のアンタゴニストである。PTSDの患者が、当該の出来事を想起し表出する際には、ノルアドレナリンが大量に放出される<ref name="ref54" />。β受容体が記憶の再固定(reconsolidation)に関与するとの知見から、PTSDの治療にβ受容体の阻害が試みられている<ref name="ref55"><pubmed> 16891611</pubmed></ref><ref name="ref56"><pubmed> 18410917</pubmed></ref><ref name="ref57"><pubmed> 17588604</pubmed></ref>。<br> | |||
== 抗うつ薬とノルアドレナリン == | == 抗うつ薬とノルアドレナリン == | ||
2012年9月25日 (火) 20:04時点における版
| Norepinephrine[1] | |
|---|---|
| |
| |
4-[(1R)-2-amino-1-hydroxyethyl]benzene-1,2-diol | |
別称 | |
| Identifiers | |
| (l) 51-41-2 (l) | |
| ATC code | |
| ChEBI | |
| ChEMBL | ChEMBL1437 |
| ChemSpider | 388394 |
| DrugBank | {{{value}}} |
| |
| Jmol-3D images | Image |
| KEGG | D00076 |
| PubChem | 439260 |
| |
| Properties | |
| C8H11NO3 | |
| Molar mass | 169.18 g/mol g·mol−1 |
| Density | 1.397±0.06 g/cm^3 (20 °C and 760 Torr)[2] |
| Melting point | L: 216.5–218 °C (decomp.) D/L: 191 °C (decomp.) |
| Boiling point | |
| Vapor pressure | 1.30e-8 Torr[2] |
| Acidity (pKa) | 9.57±0.10[2] |
| 特記なき場合、データは常温(25 °C)・常圧(100 kPa)におけるものである。 | |
英:noradrenaline, norepinephrine 独:Noradrenalin, Norepinephrin 仏:noradrénaline, norépinéphrine 略称:NA, NE
同義語:ノルエピネフリン
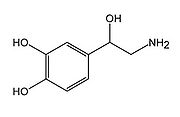
ノルアドレナリンはモノアミンの一種、またカテコールアミンの一種である。生体内において、神経伝達物質またはホルモンとして働く。生体内ではチロシンから合成される。ノルアドレナリンの受容体はアドレナリン受容体ファミリーであり、三量体Gタンパク質共役型である。末梢神経系では交感神経における神経伝達物質として重要である。中枢神経系では、橋にある青斑核にノルアドレナリン作動性神経細胞が多く存在し、そこからほぼ脳全域に投射している。中枢神経系ノルアドレナリンは覚醒-睡眠やストレスに関する働きをし、注意、記憶や学習などにも影響すると考えられている。
発見
1946年、Ulf Svante von Euler(スウェーデン)およびPeter Holtz(ドイツ)により、ノルアドレナリンがほ乳類の交感神経において神経伝達物質として働くことが示された[3] [4]。
構造
カテコール基と一級アミノ基をもつ、カテコールアミン神経伝達物質の一種。また、ドーパミン、セロトニン、ヒスタミンなどとともにモノアミン系神経伝達物質のグループを形成する。
合成
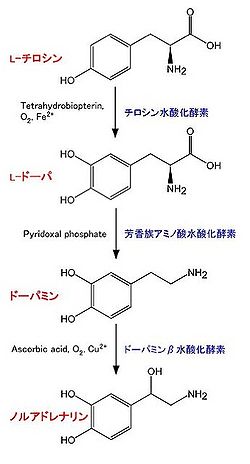
他に、副腎髄質中にあるクロム親和性細胞においても合成されている。合成に関わる酵素は以下の通り(図1)。
- チロシン水酸化酵素 (tyrosine hydroxylase, TH):EC 1.14.16.2。チロシンよりL-DOPA (L-3,4-dihydroxyphenylalanine)を合成する[5] [6] [7]。反応には、テトラヒドロビオプテリン (tetrahydrobiopterin), O2, Fe2+が必要。カテコールアミン合成において、律速段階の酵素であると考えられている。その活性制御は、主にタンパク質の量と、リン酸化による。全てのカテコールアミン産生細胞に存在する。補因子であるテトラヒドロビオプテリンはGTPより合成される。律速酵素はGTPシクロヒドラーゼI (GTP cyclohydrolase I)である[8]。
- 芳香族アミノ酸脱炭酸酵素 (aromatic L-amino acid decarboxylase, AADC):EC 4.1.1.28。L-DOPAよりドーパミンを合成する。他に、この酵素は5-ヒドロキシトリプトファン (5-hydroxytryptophan)からセロトニン(5-hydroxytryptamine, 5-HT)を合成する反応も触媒する。ピリドキサールリン酸 (pyridoxal phosphate)が必要。全てのカテコールアミン産生細胞に存在する[9]。
- ドーパミンβ水酸化酵素 (dopamine β-hydroxylase, DBH):EC 1.14.2.1。ドーパミンよりノルアドレナリンを合成する。アスコルビン酸、O2、Cu2+が必要。ノルアドレナリン、アドレナリン産生細胞のシナプス小胞の中に存在し、シナプス小胞に取り込まれたドーパミンをノルアドレナリンに変換する[10]。
放出、再取り込み
ノルアドレナリンの前駆体であるドーパミンは小胞型モノアミントランスポーター(vesicular monoamine transporter, vMAT)によりシナプス小胞内に輸送される。vMAT1は主に副腎のクロム親和性細胞、vMAT2は神経細胞で発現している。vMATはH+との交換輸送によりモノアミンを小胞内に蓄積させる[11]。
ノルアドレナリンの放出は他の神経伝達物質と同様に、神経活動依存的、カルシウム依存的なシナプス小胞のエキソサイトーシスによる。
放出された後、ノルエピネフリントランスポーター(norepinephrine transporter, NET、またはノルアドレナリントランスポーター (noradrenaline transporter, NAT))により再取り込みされる。他のカテコールアミン同様、細胞外に放出されたノルアドレナリンの量の調節は、この再取込みの寄与が高い[12]。NETはNa+/K+-ATPase依存的で、Na+/Cl-の共輸送によりノルアドレナリンを細胞内に輸送する。またNETはリン酸化により制御される[13]。
代謝分解
ノルアドレナリンの代謝分解には次の二つの酵素が重要である。
- モノアミン酸化酵素(monoamine oxidase, MAO):MAOはモノアミンのアミノ基をアルデヒド基に酸化する。MAOはミトコンドリア外膜に局在しに存在し、細胞内のノルアドレナリン(再取込みされたものを含む)の分解に関与する。ただしMAOに比べてvMAT2の方がノルアドレナリンに対する親和性がずっと高いため、シナプス小胞への取り込みの方がMAOによる分解よりも優先されると考えられる[14]。MAOにはMAO-AとMAO-Bがあり、二つの別の遺伝子によりコードされている。MAO-AとMAO-Bはモノアミン作動性神経細胞およびグリア細胞に発現しているが、発現量は細胞の種類により異なり、また動物種によっても違いが見られる[14]。マウス脳のノルアドレナリン作動性神経細胞には主にMAO-Aが発現している[15]。
- カテコール-O-メチル基転移酵素(catechol-O-methyltransferase, COMT):これはカテコール基のメタ位水酸基にメチル基を転移させる。腎臓や肝臓に豊富だが、カテコールアミン作動性神経細胞の投射先においても発現している。細胞外で働くと考えられている[16]。
脳においてノルアドレナリンの多くは、MAO、アルデヒド還元酵素、およびCOMTにより3-メトキシ-4-ヒドロキシフェニルグリコール (3-methoxy-4-hydroxyphenylglycol, MHPG)へ代謝され、さらに3-メトキシ-4-ヒドロキシマンデル酸 (3-methoxy-4-hydroxymandelic acid) (またはバニリルマンデル酸 (vanillylmandelic acid, VMA)となって尿中に排出される[17]。MHPGの硫酸化物も尿中に排出される[17]。
受容体
ノルアドレナリンはアドレナリンと共にアドレナリン受容体(adrenergic receptorまたはadrenoceptor)に結合し活性化する。αおよびβのサブファミリーからなる(表)。より細かくは、α1A-α1D、α2A-α2C、β1-β3、から構成されている。いずれも三量体Gタンパク質共役型受容体である。α1はGq、α2はGi、β1-β3はGsと共役し、、異なるシグナル伝達を行う。Gqはphospho-lipase Cを活性化し、 inositol 1,4,5-trisphosphate (IP3) の産生からIP3受容体を介して細胞内Ca2+の上昇を引き起こす。またdiacylglicerol (DAG) の産生を介してProtein kinase Cの活性化を引き起こす。Gi、Gsはそれぞれadenylate cyclaseを阻害、または活性化し、cAMPの産生の増減、そしてPKA活性の増減を引き起こす。
中枢神経系において、ノルアドレナリンは主にα1、α2、そしてβ1受容体を介して作用する。。海馬神経細胞において、β1受容体の活性化はCa2+依存性K+チャンネルを阻害し、afterhyperpolarizationを減少させ、結果的にシナプス入力依存的な発火を亢進させる[18][19]。この作用はcAMPを介している[20]。さらに、β受容体は海馬におけるシナプス長期増強(LTP)をポジティブに調節する[21][22]。そのメカニズムとして、樹上突起状のA型K+チャンネルの不活性化によるbackpropagationの促進が考えられている[23][24]。また、SK型K+チャンネルの活性化やグルタミン酸受容体のリン酸化の可能性も指摘されている引用エラー: <ref> タグに対応する </ref> タグが不足しています>。
末梢神経系において、ノルアドレナリンはα1およびβ1アドレナリン受容体のアゴニストとして作用する。(アドレナリンは、低濃度ではβ1およびβ2アドレナリン受容体に作用し、高濃度ではα1を介した作用が主となる。)
心筋において、β1受容体はGsを介してadenylate cyclaseの活性化、cAMPの産生、PKAの活性化が引き起こす。さらに、cyclic nucleotideがhyperpolarization-activated cyclic nucleotide gated (HCN) channelに直接結合し、チャンネル活性を亢進し、心筋の興奮性を高める[25][26]。また、PKAによりL型電位依存性カルシウムチャンネルや、筋小胞体リアノジン受容体がリン酸化されて活性化し、細胞内のカルシウム濃度が上昇、結果的に心筋の興奮性を亢進する。この時A-kinase anchoring protein (AKAP)が受容体とPKAの相互作用を手助けする[27][28]。また、内向き整流性カリウムチャンネルの一種であるslowly activated K channels (IKs) もPKAのリン酸化を受け、活性化する[27])。これにより、心拍数が増加した時でも、心臓の拡張期の時間が適切に調節されると考えられる。アドレナリンによるα2受容体の活性化は、Giを介して上記β1受容体と逆の効果がある。
平滑筋において、ノルアドレナリンα1受容体の活性化は、Gqを介してphospholipaseの活性化、inositol 1,4,5-trisphosphate (IP3)とdiacylglycerolの産生、IP3受容体の活性化による細胞内カルシウムストアからのカルシウム放出、myosin-light chain kinaseの活性化、そして結果的に筋収縮を引き起こす[17] [29]。
逆に、アドレナリンによるβ2受容体の活性化は、Gsを介してPKAの活性化、MLCKのリン酸化による抑制の結果、筋弛緩をもたらすと考えられる[17][30]。
α2アドレナリン受容体はノルアドレナリン軸索終末に存在し(自己受容体またはオートレセプター)、ノルアドレナリンの放出を抑制する[31]。
| 受容体 | アゴニスト選択性 | 主な作用 | 細胞内シグナル | アゴニスト | アンタゴニスト |
|---|---|---|---|---|---|
| α&amp;lt;sub&amp;gt;1&amp;lt;/sub&amp;gt;: A, B, D† |
ノルアドレナリン > アドレナリン >> イソプレナリン | 平滑筋収縮 | Gq: ホスホリパーゼC (PLC) 活性化によりイノシトール3リン酸とジアシルグリセロール、細胞内カルシウムの上昇 |
(α1アゴニスト) |
|
| α2: A, B, C |
アドレナリン ≥ ノルアドレナリン >> イソプレナリン | 自己受容体活性化による神経伝達物質放出減少 心筋弛緩、血小板活性化 |
Gi: アデニル酸シクラーゼ抑制, cAMP減少 |
(α2アゴニスト) |
|
| β1 | イソプレナリン > アドレナリン = ノルアドレナリン | 心筋収縮 | Gs: アデニル酸シクラーゼ活性化、cAMP上昇 |
(β1アゴニスト) |
|
| β2 | イソプレナリン > アドレナリン >> ノルアドレナリン | 平滑筋弛緩 | Gs: アデニル酸シクラーゼ活性化、cAMP上昇 (Giと共役することもある) |
(β2アゴニスト) |
|
| β3 | イソプレナリン = ノルアドレナリン > アドレナリン | 脂肪代謝亢進、膀胱排尿筋弛緩 | Gs: アデニル酸シクラーゼ活性化、cAMP上昇 |
表 アドレナリン性受容体 Wikipedia項目Adrenergic Receptorから翻訳、修正の上転載。 †α1C受容体と呼ばれる物は、存在しない。
主たる投射系
中枢神経系
脳におけるノルアドレナリン作動性の神経細胞群は、主に髄質(medulla)、橋(pons)に存在し、A1-A7に分けられている。
- A1、A2:A1は髄質の腹外側に位置し、A2は背側に位置する。共に視床下部に上行性投射をし、ホルモン循環器系やホルモン内分泌系の調節を行う。
- A5、A7:橋の腹外側に位置し、脊髄へ投射し、自律神経反射や、痛覚の調節を行う。
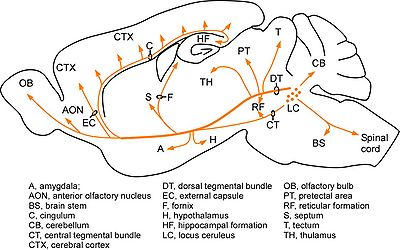
- A6:青斑核(locus ceruleus)と呼ばれる。橋の背側に位置し、最も主要なノルアドレナリン作動性神経細胞の核である。青斑核からは、大脳皮質、視床、視床下部、小脳、中脳、脊髄、など脳のほぼ全域にわたって投射している(図2:Moore and Bloom, 1979[32]より許可を得て改変)。
自律神経系のうちの交感神経系では、節後神経細胞がノルアドレナリン作動性であり、脊髄中の節前神経細胞よりアセチルコリン性の入力を受け、ノルアドレナリン性の出力を内臓器官に与える。その結果、血管の収縮、血圧の上昇、心拍数の増加、などを引き起こす。
中枢神経系におけるノルアドレナリンの機能
1. 覚醒状態との関係
青斑核は古くから覚醒状態に関係していると考えられてきた。1949年、Guiseppe MoruzziとHorace Magounは青斑核を含む脳幹部(紋様体)を刺激すると大脳皮質の脳波が様々に変化することを見いだし[33]、この部位が脳の覚醒に関係することが示唆された。ラット青斑核神経細胞の発火頻度は、覚醒-睡眠のサイクルに応じて変化し、また継続中の行動を中断するような場合に上昇する[34][35]。その後の研究により、ノルアドレナリンは他の重要な機能を持つことが明らかとなってきた(下記)。
2. 感覚入力の調節
ノルアドレナリンは、他の神経伝達物質による感覚入力の情報処理を修飾する。サルの聴覚野にノルアドレナリンを投与すると、聴覚刺激に対する応答のS/N比が亢進する、すなわち自発的活動(ノイズ)が減少するが、感覚入力依存的活動は維持される[36]。ラットの体性感覚野[37]や海馬[38]にても同様の報告がなされている。さらに、発火の応答速度や同期性が向上することがラット体性感覚野[39]や嗅皮質[40]で報告されている。
3. 注意
α2アドレナリン受容体のアゴニストであるclonidineを低濃度で局所的に投与すると、軸索終末の自己受容体を介してノルアドレナリンの放出が減少する。この方法を用いて、ラットにて上行性のノルアドレナリン投射を低下させると、注意を必要とする前頭前野依存的な行動試験の成績が低下する[41]。サルでは低濃度のclonidineにより認知機能が低下するが、高濃度では逆に認知機能が亢進し、特に老齢のサルで効果が認められた[42][43]。この効果は前頭前野におけるHyperpolarization-activated Cyclic Nucleotide-gated (HCN) channelsの活性化によると報告されている[44]。ヒトにおいてもclonidineは覚醒状態に依存した効果を示し、視覚的注意に依存する作業を向上させる[45]。
4. 記憶
記憶の固定におけるノルアドレナリンの働きは、主に行動薬理学的実験により明らかになってきた。ノルアドレナリンは扁桃体や海馬において他の神経伝達物質やホルモンなどと相互作用し、長期記憶の形成を促進する[46]。また、ノルアドレナリンはβ受容体を介して、記憶固定における遅いステージに関与していると報告されている[47][48]。
記憶の想起においてもノルアドレナリンが関与している。ラットにおいて、ノルアドレナリン放出の促進や青斑核の電気刺激により記憶の想起が促進される[49][50]。ドーパミンβ水酸化酵素のコンディショナル・ノックアウトマウスを用いた研究でも記憶の想起におけるノルアドレナリンの関与が示されている[51]。
心的外傷後ストレス障害(PTSD)においてもノルアドレナリンが関わると考えられる[52]。PTSDに使用される薬剤clonidineはα2受容体のアゴニスト、prazosinはα1受容体のアンタゴニストである。PTSDの患者が、当該の出来事を想起し表出する際には、ノルアドレナリンが大量に放出される[52]。β受容体が記憶の再固定(reconsolidation)に関与するとの知見から、PTSDの治療にβ受容体の阻害が試みられている[53][54][55]。
抗うつ薬とノルアドレナリン
気分障害の治療に使われる薬のうち、歴史的に古いMAO阻害剤、三環系抗うつ薬はセロトニン系だけでなくノルアドレナリン系を刺激する。近年使用頻度が増えている薬に選択的セロトニン再取り込み阻害剤(SSRI)あるが、これはノルアドレナリン系には作用しない。さらに、セロトニン・ノルエピネフリン再取り込み阻害剤(SNRI)も開発され、これはその名の通り、セロトニン系とノルエピネフリン系の両方を選択的に刺激する。
こうした薬の作用から、うつ状態の原因がセロトニンやノルアドレナリンなどのモノアミンの減少によるのではないかというモノアミン仮説が生まれた。しかし、これらの薬の治療効果が現れるのは、モノアミン神経伝達が亢進されるよりもずっと遅いことから、この仮説よりももっと複雑なことが起きていると考えられている[56] [57]。
関連項目
参考文献
- ↑ Merck Index, 11th Edition, 6612.
- ↑ 2.0 2.1 2.2 2.3 2.4 "51-41-2". SciFinder. SciFinder. Retrieved 14 November 2011.
- ↑ U S von Euler
A Specific Sympathomimetic Ergone in Adrenergic Nerve Fibres (Sympathin) and its Relations to Adrenaline and Nor-Adrenaline
Acta Physiol., Scand. :1946, 12; 73–97 - ↑ P Holtz
Über die sympathicomimetische Wirksamkeit von Gehirnextrakten.
Acta Physiol., Scand. : 1950, 20; 354–362 - ↑
Dunkley, P.R., Bobrovskaya, L., Graham, M.E., von Nagy-Felsobuki, E.I., & Dickson, P.W. (2004).
Tyrosine hydroxylase phosphorylation: regulation and consequences. Journal of neurochemistry, 91(5), 1025-43. [PubMed:15569247] [WorldCat] [DOI] - ↑
Daubner, S.C., Le, T., & Wang, S. (2011).
Tyrosine hydroxylase and regulation of dopamine synthesis. Archives of biochemistry and biophysics, 508(1), 1-12. [PubMed:21176768] [PMC] [WorldCat] [DOI] - ↑
Nagatsu, T. (1989).
The human tyrosine hydroxylase gene. Cellular and molecular neurobiology, 9(3), 313-21. [PubMed:2575455] [WorldCat] [DOI] - ↑
Thöny, B., Auerbach, G., & Blau, N. (2000).
Tetrahydrobiopterin biosynthesis, regeneration and functions. The Biochemical journal, 347 Pt 1, 1-16. [PubMed:10727395] [PMC] [WorldCat] - ↑
Berry, M.D., Juorio, A.V., Li, X.M., & Boulton, A.A. (1996).
Aromatic L-amino acid decarboxylase: a neglected and misunderstood enzyme. Neurochemical research, 21(9), 1075-87. [PubMed:8897471] [WorldCat] [DOI] - ↑
Rush, R.A., & Geffen, L.B. (1980).
Dopamine beta-hydroxylase in health and disease. Critical reviews in clinical laboratory sciences, 12(3), 241-77. [PubMed:6998654] [WorldCat] [DOI] - ↑
Erickson, J.D., & Varoqui, H. (2000).
Molecular analysis of vesicular amine transporter function and targeting to secretory organelles. FASEB journal : official publication of the Federation of American Societies for Experimental Biology, 14(15), 2450-8. [PubMed:11099462] [WorldCat] [DOI] - ↑
Xu, F., Gainetdinov, R.R., Wetsel, W.C., Jones, S.R., Bohn, L.M., Miller, G.W., ..., & Caron, M.G. (2000).
Mice lacking the norepinephrine transporter are supersensitive to psychostimulants. Nature neuroscience, 3(5), 465-71. [PubMed:10769386] [WorldCat] [DOI] - ↑
Mandela, P., & Ordway, G.A. (2006).
The norepinephrine transporter and its regulation. Journal of neurochemistry, 97(2), 310-33. [PubMed:16539676] [WorldCat] [DOI] - ↑ 14.0 14.1
Youdim, M.B., Edmondson, D., & Tipton, K.F. (2006).
The therapeutic potential of monoamine oxidase inhibitors. Nature reviews. Neuroscience, 7(4), 295-309. [PubMed:16552415] [WorldCat] [DOI] - ↑
Vitalis, T., Fouquet, C., Alvarez, C., Seif, I., Price, D., Gaspar, P., & Cases, O. (2002).
Developmental expression of monoamine oxidases A and B in the central and peripheral nervous systems of the mouse. The Journal of comparative neurology, 442(4), 331-47. [PubMed:11793338] [WorldCat] [DOI] - ↑
Chen, J., Song, J., Yuan, P., Tian, Q., Ji, Y., Ren-Patterson, R., ..., & Weinberger, D.R. (2011).
Orientation and cellular distribution of membrane-bound catechol-O-methyltransferase in cortical neurons: implications for drug development. The Journal of biological chemistry, 286(40), 34752-60. [PubMed:21846718] [PMC] [WorldCat] [DOI] - ↑ 17.0 17.1 17.2 17.3 D E Golan, A H Tashjian Jr, E J Armstrong, A W Armstrong
Principles of Pharmacology, Second Edition
Wolters Kluwer Health (Philadelphia):2002 - ↑
Madison, D.V., & Nicoll, R.A. (1986).
Actions of noradrenaline recorded intracellularly in rat hippocampal CA1 pyramidal neurones, in vitro. The Journal of physiology, 372, 221-44. [PubMed:2873241] [PMC] [WorldCat] [DOI] - ↑
Haas, H.L., & Konnerth, A. (1983).
Histamine and noradrenaline decrease calcium-activated potassium conductance in hippocampal pyramidal cells. Nature, 302(5907), 432-4. [PubMed:6300681] [WorldCat] [DOI] - ↑
Pedarzani, P., & Storm, J.F. (1993).
PKA mediates the effects of monoamine transmitters on the K+ current underlying the slow spike frequency adaptation in hippocampal neurons. Neuron, 11(6), 1023-35. [PubMed:8274274] [WorldCat] [DOI] - ↑
Neuman, R.S., & Harley, C.W. (1983).
Long-lasting potentiation of the dentate gyrus population spike by norepinephrine. Brain research, 273(1), 162-5. [PubMed:6311345] [WorldCat] [DOI] - ↑
O'Dell, T.J., Connor, S.A., Gelinas, J.N., & Nguyen, P.V. (2010).
Viagra for your synapses: Enhancement of hippocampal long-term potentiation by activation of beta-adrenergic receptors. Cellular signalling, 22(5), 728-36. [PubMed:20043991] [PMC] [WorldCat] [DOI] - ↑
Hoffman, D.A., & Johnston, D. (1999).
Neuromodulation of dendritic action potentials. Journal of neurophysiology, 81(1), 408-11. [PubMed:9914302] [WorldCat] [DOI] - ↑
Yuan, L.L., Adams, J.P., Swank, M., Sweatt, J.D., & Johnston, D. (2002).
Protein kinase modulation of dendritic K+ channels in hippocampus involves a mitogen-activated protein kinase pathway. The Journal of neuroscience : the official journal of the Society for Neuroscience, 22(12), 4860-8. [PubMed:12077183] [PMC] [WorldCat] - ↑
Sampson, K.J., & Kass, R.S. (2010).
Molecular mechanisms of adrenergic stimulation in the heart. Heart rhythm, 7(8), 1151-3. [PubMed:20156590] [PMC] [WorldCat] [DOI] - ↑
Wahl-Schott, C., & Biel, M. (2009).
HCN channels: structure, cellular regulation and physiological function. Cellular and molecular life sciences : CMLS, 66(3), 470-94. [PubMed:18953682] [WorldCat] [DOI] - ↑ 27.0 27.1
Sampson, K.J., & Kass, R.S. (2010).
Molecular mechanisms of adrenergic stimulation in the heart. Heart rhythm, 7(8), 1151-3. [PubMed:20156590] [PMC] [WorldCat] [DOI] - ↑
Gray, P.C., Scott, J.D., & Catterall, W.A. (1998).
Regulation of ion channels by cAMP-dependent protein kinase and A-kinase anchoring proteins. Current opinion in neurobiology, 8(3), 330-4. [PubMed:9687361] [WorldCat] [DOI] - ↑
Kamm, K.E., & Stull, J.T. (2001).
Dedicated myosin light chain kinases with diverse cellular functions. The Journal of biological chemistry, 276(7), 4527-30. [PubMed:11096123] [WorldCat] [DOI] - ↑
Conti, M.A., & Adelstein, R.S. (1981).
The relationship between calmodulin binding and phosphorylation of smooth muscle myosin kinase by the catalytic subunit of 3':5' cAMP-dependent protein kinase. The Journal of biological chemistry, 256(7), 3178-81. [PubMed:6259152] [WorldCat] - ↑
Starke, K. (2001).
Presynaptic autoreceptors in the third decade: focus on alpha2-adrenoceptors. Journal of neurochemistry, 78(4), 685-93. [PubMed:11520889] [WorldCat] [DOI] - ↑
Moore, R.Y., & Bloom, F.E. (1978).
Central catecholamine neuron systems: anatomy and physiology of the dopamine systems. Annual review of neuroscience, 1, 129-69. [PubMed:756202] [WorldCat] [DOI] - ↑
Moruzzi, G., & Magoun, H.W. (1949).
Brain stem reticular formation and activation of the EEG. Electroencephalography and clinical neurophysiology, 1(4), 455-73. [PubMed:18421835] [WorldCat] - ↑
Aston-Jones, G., & Bloom, F.E. (1981).
Activity of norepinephrine-containing locus coeruleus neurons in behaving rats anticipates fluctuations in the sleep-waking cycle. The Journal of neuroscience : the official journal of the Society for Neuroscience, 1(8), 876-86. [PubMed:7346592] [WorldCat] - ↑
Foote, S.L., Aston-Jones, G., & Bloom, F.E. (1980).
Impulse activity of locus coeruleus neurons in awake rats and monkeys is a function of sensory stimulation and arousal. Proceedings of the National Academy of Sciences of the United States of America, 77(5), 3033-7. [PubMed:6771765] [PMC] [WorldCat] [DOI] - ↑
Foote, S.L., Freedman, R., & Oliver, A.P. (1975).
Effects of putative neurotransmitters on neuronal activity in monkey auditory cortex. Brain research, 86(2), 229-42. [PubMed:234774] [WorldCat] [DOI] - ↑
Waterhouse, B.D., & Woodward, D.J. (1980).
Interaction of norepinephrine with cerebrocortical activity evoked by stimulation of somatosensory afferent pathways in the rat. Experimental neurology, 67(1), 11-34. [PubMed:7349980] [WorldCat] [DOI] - ↑
Segal, M., & Bloom, F.E. (1976).
The action of norepinephrine in the rat hippocampus. IV. The effects of locus coeruleus stimulation on evoked hippocampal unit activity. Brain research, 107(3), 513-25. [PubMed:178411] [WorldCat] [DOI] - ↑
Lecas, J.C. (2004).
Locus coeruleus activation shortens synaptic drive while decreasing spike latency and jitter in sensorimotor cortex. Implications for neuronal integration. The European journal of neuroscience, 19(9), 2519-30. [PubMed:15128405] [WorldCat] [DOI] - ↑
Bouret, S., & Sara, S.J. (2002).
Locus coeruleus activation modulates firing rate and temporal organization of odour-induced single-cell responses in rat piriform cortex. The European journal of neuroscience, 16(12), 2371-82. [PubMed:12492432] [WorldCat] [DOI] - ↑
Mair, R.D., Zhang, Y., Bailey, K.R., Toupin, M.M., & Mair, R.G. (2005).
Effects of clonidine in the locus coeruleus on prefrontal- and hippocampal-dependent measures of attention and memory in the rat. Psychopharmacology, 181(2), 280-8. [PubMed:15830223] [WorldCat] [DOI] - ↑
Arnsten, A.F., & Goldman-Rakic, P.S. (1985).
Alpha 2-adrenergic mechanisms in prefrontal cortex associated with cognitive decline in aged nonhuman primates. Science (New York, N.Y.), 230(4731), 1273-6. [PubMed:2999977] [WorldCat] [DOI] - ↑
Ramos, B.P., & Arnsten, A.F. (2007).
Adrenergic pharmacology and cognition: focus on the prefrontal cortex. Pharmacology & therapeutics, 113(3), 523-36. [PubMed:17303246] [PMC] [WorldCat] [DOI] - ↑
Wang, M., Ramos, B.P., Paspalas, C.D., Shu, Y., Simen, A., Duque, A., ..., & Arnsten, A.F. (2007).
Alpha2A-adrenoceptors strengthen working memory networks by inhibiting cAMP-HCN channel signaling in prefrontal cortex. Cell, 129(2), 397-410. [PubMed:17448997] [WorldCat] [DOI] - ↑
Coull, J.T., Büchel, C., Friston, K.J., & Frith, C.D. (1999).
Noradrenergically mediated plasticity in a human attentional neuronal network. NeuroImage, 10(6), 705-15. [PubMed:10600416] [WorldCat] [DOI] - ↑
McGaugh, J.L., & Roozendaal, B. (2009).
Drug enhancement of memory consolidation: historical perspective and neurobiological implications. Psychopharmacology, 202(1-3), 3-14. [PubMed:18704369] [WorldCat] [DOI] - ↑
Sara, S.J., Roullet, P., & Przybyslawski, J. (1999).
Consolidation of memory for odor-reward association: beta-adrenergic receptor involvement in the late phase. Learning & memory (Cold Spring Harbor, N.Y.), 6(2), 88-96. [PubMed:10327234] [PMC] [WorldCat] - ↑
Tronel, S., Feenstra, M.G., & Sara, S.J. (2004).
Noradrenergic action in prefrontal cortex in the late stage of memory consolidation. Learning & memory (Cold Spring Harbor, N.Y.), 11(4), 453-8. [PubMed:15254217] [PMC] [WorldCat] [DOI] - ↑
Sara, S.J., & Devauges, V. (1988).
Priming stimulation of locus coeruleus facilitates memory retrieval in the rat. Brain research, 438(1-2), 299-303. [PubMed:3345434] [WorldCat] [DOI] - ↑
Sara, S.J., & Devauges, V. (1989).
Idazoxan, an alpha-2 antagonist, facilitates memory retrieval in the rat. Behavioral and neural biology, 51(3), 401-11. [PubMed:2543356] [WorldCat] [DOI] - ↑
Murchison, C.F., Zhang, X.Y., Zhang, W.P., Ouyang, M., Lee, A., & Thomas, S.A. (2004).
A distinct role for norepinephrine in memory retrieval. Cell, 117(1), 131-43. [PubMed:15066288] [WorldCat] [DOI] - ↑ 52.0 52.1
Strawn, J.R., & Geracioti, T.D. (2008).
Noradrenergic dysfunction and the psychopharmacology of posttraumatic stress disorder. Depression and anxiety, 25(3), 260-71. [PubMed:17354267] [WorldCat] [DOI] - ↑
Debiec, J., & LeDoux, J.E. (2006).
Noradrenergic signaling in the amygdala contributes to the reconsolidation of fear memory: treatment implications for PTSD. Annals of the New York Academy of Sciences, 1071, 521-4. [PubMed:16891611] [WorldCat] [DOI] - ↑
Diergaarde, L., Schoffelmeer, A.N., & De Vries, T.J. (2008).
Pharmacological manipulation of memory reconsolidation: towards a novel treatment of pathogenic memories. European journal of pharmacology, 585(2-3), 453-7. [PubMed:18410917] [WorldCat] [DOI] - ↑
Brunet, A., Orr, S.P., Tremblay, J., Robertson, K., Nader, K., & Pitman, R.K. (2008).
Effect of post-retrieval propranolol on psychophysiologic responding during subsequent script-driven traumatic imagery in post-traumatic stress disorder. Journal of psychiatric research, 42(6), 503-6. [PubMed:17588604] [WorldCat] [DOI] - ↑ E R Kandel, J H Schwartz, T M Jessell
Principles of Neural Science, Fourth Edition
Mc Graw Hill (New York):2000 - ↑ N R Carlson
Physiology of Behavior, Tenth Edition
Pearson Education (Boston):2009
(執筆者:徳岡宏文、一瀬宏 担当編集者:林 康紀)