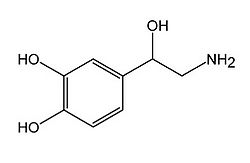
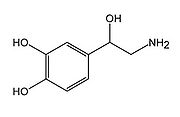
ノルアドレナリン
| Norepinephrine[1] | |
|---|---|
| |
| |
4-[(1R)-2-amino-1-hydroxyethyl]benzene-1,2-diol | |
別称 | |
| Identifiers | |
| (l) 51-41-2 (l) | |
| ATC code | |
| ChEBI | |
| ChEMBL | ChEMBL1437 |
| ChemSpider | 388394 |
| DrugBank | {{{value}}} |
| |
| Jmol-3D images | Image |
| KEGG | D00076 |
| PubChem | 439260 |
| |
| Properties | |
| C8H11NO3 | |
| Molar mass | 169.18 g/mol g·mol−1 |
| Density | 1.397±0.06 g/cm^3 (20 °C and 760 Torr)[2] |
| Melting point | L: 216.5–218 °C (decomp.) D/L: 191 °C (decomp.) |
| Boiling point | |
| Vapor pressure | 1.30e-8 Torr[2] |
| Acidity (pKa) | 9.57±0.10[2] |
| 特記なき場合、データは常温(25 °C)・常圧(100 kPa)におけるものである。 | |
英:noradrenaline, norepinephrine 独:Noradrenalin, Norepinephrin 仏:noradrénaline, norépinéphrine 略称:NA, NE 同義語:ノルエピネフリン
ノルアドレナリンはモノアミンの一種、またカテコールアミンの一種である。生体内において、神経伝達物質またはホルモンとして働く。生体内ではチロシンから合成される。ノルアドレナリンの受容体はアドレナリン受容体ファミリーであり、三量体Gタンパク質共役型である。末梢神経系では交感神経における神経伝達物質として重要である。中枢神経系では、橋にある青斑核にノルアドレナリン作動性神経細胞が多く存在し、そこからほぼ脳全域に投射している。中枢神経系ノルアドレナリンは覚醒-睡眠やストレスに関する働きをし、注意、記憶や学習などにも影響すると考えられている。
発見
1946年、Ulf Svante von Euler(スウェーデン)およびPeter Holtz(ドイツ)により、ノルアドレナリンがほ乳類の交感神経において神経伝達物質として働くことが示された[3] [4]。
構造
カテコール基と一級アミノ基をもつ、カテコールアミン神経伝達物質の一種。また、ドーパミン、セロトニン、ヒスタミンなどとともにモノアミン系神経伝達物質のグループを形成する。
合成
他に、副腎髄質中にあるクロム親和性細胞においても合成されている。合成に関わる酵素は以下の通り。
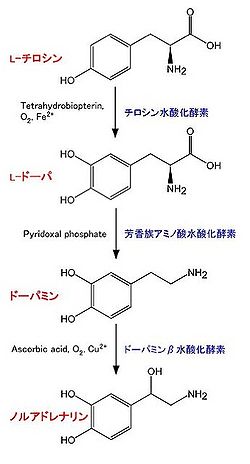
- チロシン水酸化酵素 (tyrosine hydroxylase, TH):EC 1.14.16.2。チロシンよりL-DOPA (L-3,4-dihydroxyphenylalanine)を合成する[5] [6] [7]。反応には、テトラヒドロビオプテリン (tetrahydrobiopterin), O2, Fe2+が必要。カテコールアミン合成において、律速段階の酵素であると考えられている。その活性制御は、主にタンパク質の量と、リン酸化による。全てのカテコールアミン産生細胞に存在する。補因子であるテトラヒドロビオプテリンはGTPより合成される。律速酵素はGTPシクロヒドラーゼI (GTP cyclohydrolase I)である[8]。
- 芳香族アミノ酸脱炭酸酵素 (aromatic L-amino acid decarboxylase, AADC):EC 4.1.1.28。L-DOPAよりドーパミンを合成する。他に、この酵素は5-ヒドロキシトリプトファン (5-hydroxytryptophan)からセロトニン(5-hydroxytryptamine, 5-HT)を合成する反応も触媒する。ピリドキサールリン酸 (pyridoxal phosphate)が必要。全てのカテコールアミン産生細胞に存在する[9]。
- ドーパミンβ水酸化酵素 (dopamine β-hydroxylase, DBH):EC 1.14.2.1。ドーパミンよりノルアドレナリンを合成する。アスコルビン酸、O2、Cu2+が必要。ノルアドレナリン、アドレナリン産生細胞のシナプス小胞の中に存在し、シナプス小胞に取り込まれたドーパミンをノルアドレナリンに変換する[10]。
放出、再取り込み
ノルアドレナリンの前駆体であるドーパミンは小胞型モノアミントランスポーター(vesicular monoamine transporter, vMAT)によりシナプス小胞内に輸送される。vMAT1は主に副腎のクロム親和性細胞、vMAT2は神経細胞で発現している。vMATはH+との交換輸送によりモノアミンを小胞内に蓄積させる[11]。
ノルアドレナリンの放出は他の神経伝達物質と同様に、神経活動依存的、カルシウム依存的なシナプス小胞のエキソサイトーシスによる。
放出された後、ノルエピネフリントランスポーター(norepinephrine transporter, NET、またはノルアドレナリントランスポーター (noradrenaline transporter, NAT))により再取り込みされる。他のカテコールアミン同様、細胞外に放出されたノルアドレナリンの量の調節は、この再取込みの寄与が高い[12]。NETはNa+/K+-ATPase依存的で、Na+/Cl-の共輸送によりノルアドレナリンを細胞内に輸送する。またNETはリン酸化により制御される[13]。
代謝分解
ノルアドレナリンの代謝分解には次の二つの酵素が重要である。
- モノアミン酸化酵素(monoamine oxidase, MAO):MAOはモノアミンのアミノ基をアルデヒド基に酸化する。MAOはミトコンドリア外膜に局在しに存在し、細胞内のノルアドレナリン(再取込みされたものを含む)の分解に関与する。ただしMAOに比べてvMAT2の方がノルアドレナリンに対する親和性がずっと高いため、シナプス小胞への取り込みの方がMAOによる分解よりも優先されると考えられる[14]。MAOにはMAO-AとMAO-Bがあり、二つの別の遺伝子によりコードされている。MAO-AとMAO-Bはモノアミン作動性神経細胞およびグリア細胞に発現しているが、発現量は細胞の種類により異なり、また動物種によっても違いが見られる[14]。マウス脳のノルアドレナリン作動性神経細胞には主にMAO-Aが発現している[15]。。
- カテコール-O-メチル基転移酵素(catechol-O-methyltransferase, COMT):これはカテコール基のメタ位水酸基にメチル基を転移させる。腎臓や肝臓に豊富だが、カテコールアミン作動性神経細胞の投射先においても発現している。細胞外で働くと考えられている[16]。
脳においてノルアドレナリンの多くは、MAO、アルデヒド還元酵素、およびCOMTにより3-メトキシ-4-ヒドロキシフェニルグリコール (3-methoxy-4-hydroxyphenylglycol, MHPG)へ代謝され、さらに3-メトキシ-4-ヒドロキシマンデル酸 (3-methoxy-4-hydroxymandelic acid) (またはバニリルマンデル酸 (vanillylmandelic acid, VMA)となって尿中に排出される[17]。MHPGの硫酸化物も尿中に排出される[17]。
主たる投射系と機能
中枢神経系
脳におけるノルアドレナリン作動性の神経細胞群は、主に髄質(延髄でしょうか?)、橋に存在し、A1-A7に分けられている。
- A1、A2:A1は髄質の腹外側に位置し、A2は背側に位置する。共に視床下部に上行性投射をし、ホルモン循環器系やホルモン内分泌系の調節を行う。
- A5、A7:橋の腹外側に位置し、脊髄へ投射し、自律神経反射や、痛覚の調節を行う。
- A6:青斑核(locus ceruleus)と呼ばれる。橋の背側に位置し、最も主要なノルアドレナリン作動性神経細胞の核である。青斑核からは、大脳皮質、視床、視床下部、小脳、中脳、脊髄、など脳のほぼ全域にわたって投射している。青斑核のノルアドレナリン作動性神経細胞は覚醒状態や不意な環境変化への応答性に関係している[18]。例えば、ラット青斑核神経細胞の発火頻度は、覚醒-睡眠のサイクルに応じて変化し、また継続中の行動を中断するような場合に上昇する[19]。さらに近年、ノルアドレナリンの注意、記憶、学習への関与、またシナプス可塑性への関与が報告されている[18] [20]。これらのことから、ノルアドレナリンの働きは、動物が環境の変化に適応する際に、注意や認知のシフト、そして行動の適応化を早めることであると提唱されている[18]。
自律神経系
自律神経系のうちの交感神経系では、節後神経細胞がノルアドレナリン作動性であり、脊髄中の節前神経細胞よりアセチルコリン性の入力を受け、ノルアドレナリン性の出力を内臓器官に与える。その結果、血管の収縮、血圧の上昇、心拍数の増加、などを引き起こす。
受容体
ノルアドレナリンはアドレナリンと共にアドレナリン受容体(adrenergic receptorまたはadrenoceptor)に結合し活性化する。αおよびβのサブファミリーからなる。より細かくは、α1A-α1D、α2A-α2C、β1-β3、から構成されている。いずれも三量体Gタンパク質共役型の受容体である。α1はGq、α2はGi、β1-β3はGsと共役している。
中枢神経系において、ノルアドレナリンは主にα1、α2、そしてβ1受容体を介して作用し、それぞれに異なる影響を与える。さらにノルアドレナリンの働きは、標的細胞における他の入力にも依存するので、複雑である。
末梢神経系において、ノルアドレナリンはα1およびβ1アドレナリン受容体のアゴニストとして作用する。(アドレナリンは、低濃度ではβ1およびβ2アドレナリン受容体に作用し、高濃度ではα1を介した作用が主となる。)
α2アドレナリン受容体はノルアドレナリン軸索終末に存在し(自己受容体またはオートレセプター)、ノルアドレナリンの放出を抑制する[21]。
| 受容体 | アゴニスト選択性 | 主な作用 | 細胞内シグナル | アゴニスト | アンタゴニスト |
|---|---|---|---|---|---|
| α1: A, B, D† |
ノルアドレナリン > アドレナリン >> イソプレナリン | 平滑筋収縮 | Gq: ホスホリパーゼ C (PLC) 活性化によりイノシトール3リン酸とジアシルグリセロール、細胞内カルシウムの上昇 |
(α1アゴニスト) |
|
| α2: A, B, C |
アドレナリン ≥ ノルアドレナリン >> イソプレナリン | 自己受容体活性化による神経伝達物質放出減少 心筋弛緩、血小板活性化 |
Gi: アデニル酸シクラーゼ抑制, cAMP減少 |
(α2アゴニスト) |
|
| β1 | イソプレナリン > アドレナリン = ノルアドレナリン | 心筋収縮 | Gs: アデニル酸シクラーゼ活性化、cAMP上昇 |
(β1アゴニスト) |
|
| β2 | イソプレナリン > アドレナリン >> ノルアドレナリン | 平滑筋弛緩 | Gs: アデニル酸シクラーゼ活性化、cAMP上昇 (Giと共役することもある) |
(β2アゴニスト) |
|
| β3 | イソプレナリン = ノルアドレナリン > アドレナリン | 脂肪代謝亢進、膀胱排尿筋弛緩 | Gs: アデニル酸シクラーゼ活性化、cAMP上昇 |
Wikipedia項目Adrenergic Receptorから翻訳、加筆の上転載。
†α1C受容体と呼ばれる物は、存在しない。
抗うつ薬とノルアドレナリン
気分障害の治療に使われる薬のうち、歴史的に古いMAO阻害剤、三環系抗うつ薬はセロトニン系だけでなくノルアドレナリン系を刺激する。近年使用頻度が増えている薬に選択的セロトニン再取り込み阻害剤(SSRI)あるが、これはノルアドレナリン系には作用しない。さらに、セロトニン・ノルエピネフリン再取り込み阻害剤(SNRI)も開発され、これはその名の通り、セロトニン系とノルエピネフリン系の両方を選択的に刺激する。
こうした薬の作用から、うつ状態の原因がセロトニンやノルアドレナリンなどのモノアミンの減少によるのではないかというモノアミン仮説が生まれた。しかし、これらの薬の治療効果が現れるのは、モノアミン神経伝達が亢進されるよりもずっと遅いことから、この仮説よりももっと複雑なことが起きていると考えられている[22] [23]。
参考文献
- ↑ Merck Index, 11th Edition, 6612.
- ↑ 2.0 2.1 2.2 2.3 2.4 "51-41-2". SciFinder. SciFinder. Retrieved 14 November 2011.
- ↑ U S von Euler
A Specific Sympathomimetic Ergone in Adrenergic Nerve Fibres (Sympathin) and its Relations to Adrenaline and Nor-Adrenaline
Acta Physiol., Scand. :1946, 12; 73–97 - ↑ P Holtz
Über die sympathicomimetische Wirksamkeit von Gehirnextrakten.
Acta Physiol., Scand. : 1950, 20; 354–362 - ↑
Dunkley, P.R., Bobrovskaya, L., Graham, M.E., von Nagy-Felsobuki, E.I., & Dickson, P.W. (2004).
Tyrosine hydroxylase phosphorylation: regulation and consequences. Journal of neurochemistry, 91(5), 1025-43. [PubMed:15569247] [WorldCat] [DOI] - ↑
Daubner, S.C., Le, T., & Wang, S. (2011).
Tyrosine hydroxylase and regulation of dopamine synthesis. Archives of biochemistry and biophysics, 508(1), 1-12. [PubMed:21176768] [PMC] [WorldCat] [DOI] - ↑
Nagatsu, T. (1989).
The human tyrosine hydroxylase gene. Cellular and molecular neurobiology, 9(3), 313-21. [PubMed:2575455] [WorldCat] [DOI] - ↑
Thöny, B., Auerbach, G., & Blau, N. (2000).
Tetrahydrobiopterin biosynthesis, regeneration and functions. The Biochemical journal, 347 Pt 1, 1-16. [PubMed:10727395] [PMC] [WorldCat] - ↑
Berry, M.D., Juorio, A.V., Li, X.M., & Boulton, A.A. (1996).
Aromatic L-amino acid decarboxylase: a neglected and misunderstood enzyme. Neurochemical research, 21(9), 1075-87. [PubMed:8897471] [WorldCat] [DOI] - ↑
Rush, R.A., & Geffen, L.B. (1980).
Dopamine beta-hydroxylase in health and disease. Critical reviews in clinical laboratory sciences, 12(3), 241-77. [PubMed:6998654] [WorldCat] [DOI] - ↑
Erickson, J.D., & Varoqui, H. (2000).
Molecular analysis of vesicular amine transporter function and targeting to secretory organelles. FASEB journal : official publication of the Federation of American Societies for Experimental Biology, 14(15), 2450-8. [PubMed:11099462] [WorldCat] [DOI] - ↑
Xu, F., Gainetdinov, R.R., Wetsel, W.C., Jones, S.R., Bohn, L.M., Miller, G.W., ..., & Caron, M.G. (2000).
Mice lacking the norepinephrine transporter are supersensitive to psychostimulants. Nature neuroscience, 3(5), 465-71. [PubMed:10769386] [WorldCat] [DOI] - ↑
Mandela, P., & Ordway, G.A. (2006).
The norepinephrine transporter and its regulation. Journal of neurochemistry, 97(2), 310-33. [PubMed:16539676] [WorldCat] [DOI] - ↑ 14.0 14.1
Youdim, M.B., Edmondson, D., & Tipton, K.F. (2006).
The therapeutic potential of monoamine oxidase inhibitors. Nature reviews. Neuroscience, 7(4), 295-309. [PubMed:16552415] [WorldCat] [DOI] - ↑
Vitalis, T., Fouquet, C., Alvarez, C., Seif, I., Price, D., Gaspar, P., & Cases, O. (2002).
Developmental expression of monoamine oxidases A and B in the central and peripheral nervous systems of the mouse. The Journal of comparative neurology, 442(4), 331-47. [PubMed:11793338] [WorldCat] [DOI] - ↑
Chen, J., Song, J., Yuan, P., Tian, Q., Ji, Y., Ren-Patterson, R., ..., & Weinberger, D.R. (2011).
Orientation and cellular distribution of membrane-bound catechol-O-methyltransferase in cortical neurons: implications for drug development. The Journal of biological chemistry, 286(40), 34752-60. [PubMed:21846718] [PMC] [WorldCat] [DOI] - ↑ 17.0 17.1 D E Golan, A H Tashjian Jr, E J Armstrong, A W Armstrong
Principles of Pharmacology, Second Edition
Wolters Kluwer Health (Philadelphia):2002 - ↑ 18.0 18.1 18.2
Sara, S.J. (2009).
The locus coeruleus and noradrenergic modulation of cognition. Nature reviews. Neuroscience, 10(3), 211-23. [PubMed:19190638] [WorldCat] [DOI] - ↑
Aston-Jones, G., & Bloom, F.E. (1981).
Activity of norepinephrine-containing locus coeruleus neurons in behaving rats anticipates fluctuations in the sleep-waking cycle. The Journal of neuroscience : the official journal of the Society for Neuroscience, 1(8), 876-86. [PubMed:7346592] [WorldCat] - ↑
Tully, K., & Bolshakov, V.Y. (2010).
Emotional enhancement of memory: how norepinephrine enables synaptic plasticity. Molecular brain, 3, 15. [PubMed:20465834] [PMC] [WorldCat] [DOI] - ↑
Starke, K. (2001).
Presynaptic autoreceptors in the third decade: focus on alpha2-adrenoceptors. Journal of neurochemistry, 78(4), 685-93. [PubMed:11520889] [WorldCat] [DOI] - ↑ E R Kandel, J H Schwartz, T M Jessell
Principles of Neural Science, Fourth Edition
Mc Graw Hill (New York):2000 - ↑ N R Carlson
Physiology of Behavior, Tenth Edition
Pearson Education (Boston):2009
(執筆者:徳岡宏文、一瀬宏 担当編集者:林 康紀)