「バレル皮質」の版間の差分
Junko kurahashi (トーク | 投稿記録) 細 (→機能) |
Junko kurahashi (トーク | 投稿記録) 細 (→形態学的特徴) |
||
| 14行目: | 14行目: | ||
== 形態学的特徴 == | == 形態学的特徴 == | ||
[[ニッスル染色]]などの通常の組織学的手法や様々な組織化学的手法(チトクローム酸化酵素cytochrome oxidase、コハク酸脱水素酵素succinate dehydrogenase)によって、可視化することができる。細胞密度が高いバレルにはヒゲからの入力を担う[[軸索]]が視床の後腹側核から束を作った状態で大脳皮質IV層にターミナルする。その周りに主に[[有棘星状細胞]] (spiny stellate 細胞)が取り囲むように集まり、筒状のバレルカラム内 (hollow)で視床軸索とできるだけ多く[[シナプス]]結合できるように、バレルカラム内に向けて[[樹状突起]]を伸ばすような方向性を持つ(図)。隣あったバレルカラムの間には小さなスペースがあり、セプタと呼ばれる。セプタには主に[[尖端樹状突起]] (apical dendrite)を持つ[[錐体細胞]]が配置されており、視床の後腹側核の軸索とはシナプス結合しない。バレル皮質内にはさらに尖端樹状突起の発達が乏しいStar pyramidal cellが存在し、それぞれの細胞数はspiny stellate: 58%, star pyramidal cells (25%), pyramidal cells (17%)の割合で分布している<ref><pubmed>15054049</pubmed></ref>。 | [[ニッスル染色]]などの通常の組織学的手法や様々な組織化学的手法(チトクローム酸化酵素cytochrome oxidase、コハク酸脱水素酵素succinate dehydrogenase)によって、可視化することができる。細胞密度が高いバレルにはヒゲからの入力を担う[[軸索]]が視床の後腹側核から束を作った状態で大脳皮質IV層にターミナルする。その周りに主に[[有棘星状細胞]] (spiny stellate 細胞)が取り囲むように集まり、筒状のバレルカラム内 (hollow)で視床軸索とできるだけ多く[[シナプス]]結合できるように、バレルカラム内に向けて[[樹状突起]]を伸ばすような方向性を持つ(図)。隣あったバレルカラムの間には小さなスペースがあり、セプタと呼ばれる。セプタには主に[[尖端樹状突起]] (apical dendrite)を持つ[[錐体細胞]]が配置されており、視床の後腹側核の軸索とはシナプス結合しない。バレル皮質内にはさらに尖端樹状突起の発達が乏しいStar pyramidal cellが存在し、それぞれの細胞数はspiny stellate: 58%, star pyramidal cells (25%), pyramidal cells (17%)の割合で分布している<ref><pubmed>15054049</pubmed></ref>。 | ||
[[ファイル:ShimogoriFig2.png|200px|サムネイル| '''図2. バレル皮質(4層)でのSpiny stellate, Star pyramid, Pyramidal neuronの分布''' <br>Spiny stellate, Star pyramid neuronは主にVentro basal thalamus か投射される視床軸索が集まるHollowに、Pyramidal neuron はhollowの間のSeptaに分布する。Hollow内のSpiny stellate, Star pyramid neuronはbasal dendriteをHollow側に向けるような形態を持つ。]] | |||
==神経回路== | ==神経回路== | ||
2018年3月1日 (木) 22:25時点における版
下郡智美
独立行政法人理化学研究所 脳科学総合研究センター
DOI:10.14931/bsd.7504 原稿受付日:2018年2月5日 原稿完成日:年月日
担当編集委員:藤田 一郎(大阪大学 大学院生命機能研究科)
英語名:barrel cortex
バレル皮質とは
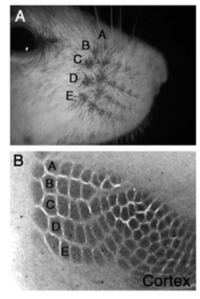
ラットやマウスなどの齧歯類の顔面に生える太いヒゲからの体性感覚入力は、三叉神経の神経節細胞>三叉神経核>視床の腹後内側核>大脳皮質第一次体性感覚野(第IV層)に到達し、情報を処理する。個々のヒゲの入力は脳内で混在しないように顔のヒゲの分布パターンを維持したまま大脳皮質体性感覚野のIV層に入力し、1本1本のヒゲからの入力を処理するバレル(樽構造、barrel)と呼ばれるモジュール構造を持つ。バレルは細胞密度が高くなっていることなどから簡単な組織学的染色で可視化することができ、顔面のヒゲの分布と同じバレルのパターン(トポグラフィー)が体性感覚野に分布したものをバレル皮質 (barrel cortex)と呼ぶ。(図1)
形態学的特徴
ニッスル染色などの通常の組織学的手法や様々な組織化学的手法(チトクローム酸化酵素cytochrome oxidase、コハク酸脱水素酵素succinate dehydrogenase)によって、可視化することができる。細胞密度が高いバレルにはヒゲからの入力を担う軸索が視床の後腹側核から束を作った状態で大脳皮質IV層にターミナルする。その周りに主に有棘星状細胞 (spiny stellate 細胞)が取り囲むように集まり、筒状のバレルカラム内 (hollow)で視床軸索とできるだけ多くシナプス結合できるように、バレルカラム内に向けて樹状突起を伸ばすような方向性を持つ(図)。隣あったバレルカラムの間には小さなスペースがあり、セプタと呼ばれる。セプタには主に尖端樹状突起 (apical dendrite)を持つ錐体細胞が配置されており、視床の後腹側核の軸索とはシナプス結合しない。バレル皮質内にはさらに尖端樹状突起の発達が乏しいStar pyramidal cellが存在し、それぞれの細胞数はspiny stellate: 58%, star pyramidal cells (25%), pyramidal cells (17%)の割合で分布している[1]。
神経回路
第IV層
視床の腹後内側核 (ventroposterior medial nucleus: VPMdm)からの投射は主にhollow内の有棘星状細胞とシナプス結合する。一方、視床後核群(posterior nucleus: POm)の主な投射先は第I層と第V層であるにもかかわらず、セプタの錐体細胞ともシナプス結合している事が報告されている [2]。第IV層の有棘星状細胞は真上のII/III層の神経細胞と接続し、異なるバレルからの投射が一箇所に混在する事は少ない [3]。第IV層同士の接続は非常に稀であり、仮に接続がある場合でも近傍の細胞同士に限られている。
II/III層
IV層の真上にあるII/III層の神経細胞からの投射は、第IV層のバレルカラムを避けセプタ領域に特異的に軸索を伸ばしてセプタにおいてシナプスを作っていることから、セプタ内に入力する感覚情報とセプタがつかさどる特殊感覚情報とを統合している可能性が示唆する。II/III層の神経細胞からの軸索を特異的に可視化することによって、バレル皮質を通常の染色と逆に浮かび上がらせるように見えるこの投射パターンはバレルネットと命名されている[4]。
機能
齧歯類の多くはヒゲを使って物体識別を行い、物体同士の隙間などもヒゲを利用して間隔識別を行うことが知られている。この間隔識別能はgap crossing testと呼ばれるテストで測定することができるが、バレル構造を正常に形成できなかった個体は間隔識別能力が下がる[5]。このことから、バレル構造を持つことによって触覚機能の精度を高めているものと考えられている。
バレル皮質はラット、マウス、ハムスター、チンチラ、モルモット、リス、ヤマアラシなどで確認されているが、カピパラには存在しない[6] 。
発生、可塑性
胎児期または生後直後、バレル皮質は形成されておらずマウスで生後2日から5日の間に形成される。視床軸索がそれぞれのhollow内に収束する形でターミナルを形成し、その周りに大脳皮質の細胞が集まってバレル構造ができる。
このバレル形成には、ヒゲの刺激による神経活動が必要であり、生後ヒゲを抜いたり、毛根を焼き切るなどしてヒゲからの入力を遮断するとバレル構造が形成されない[7] [8]。バレル構造の形成には臨界期があり、生後7日目以降はヒゲからの入力が遮断されても一度形成されたバレル構造は維持されたままとなる。
バレルの形成には神経活動が必要であること、は大脳皮質の興奮性ニューロンに限定してNMDA型グルタミン酸受容体のNR1サブユニットを欠損するノックアウトマウスや [9]、代謝型グルタミン酸受容体mGluR5のノックアウトマウスにおいてもバレルの形成が不全になる[10] 。さらにグルタミン酸受容体の下流に位置するタンパク質としてNeuroD2がバレル形成に必要であること [11]、およびmGluR5の下流に位置する因子としてホスホリパーゼCβ1のノックアウトマウスはバレルの形成不全を起こすことが報告されている [12]。
視床軸索側からバレルを形成する要素として、視軸軸索のAC1 (Ca2+/calmodulin-activated type-I adenylyl cyclase)がAMPA受容体のトラフィッキングをコントロールすることによって、視床—大脳皮質細胞のシナプス結合の強化に必要であることが報告されている[13] [14]。
バレルの形成に関わっている他の因子としては神経伝達物質であるセロトニンも重要であることが報告されている。まずセロトニン分解酵素であるモノアミン酸化酵素Aのノックアウトマウスでバレルの形成不全になる [15]。さらに、セロトニンを細胞に取り込むセロトニン輸送体のノックアウトマウスにおいてもバレルの形成が阻害されていたことから、大脳皮質でセロトニンの濃度が上昇するとバレルの形成が阻害されることが推測された [16]。
このことを裏付けるように、モノアミン酸化酵素Aのノックアウトマウスとセロトニン1B受容体のノックアウトマウスとを掛け合わせることにより,バレルの形成の異常は軽減されることも報告されている [17]。以上のように、Nisslなどの染色で可視化できる細胞密度の違いによる“バレル構造“は視床軸索からの入力と大脳皮質細胞の神経活動のバランス、さらには細胞外セロトニン濃度の調節が必要である[18]。
バレル構造の形成には細胞が有棘星状細胞hollowを取り囲むように集まることとともに、有棘星状細胞の樹状突起がhollowに向けて伸長する必要がある。この樹状突起の形態変化に特異的に関わる因子が有棘星状細胞に発現しておりBtbd3、Sema7Aなどが報告されている[19] [20]。
参考文献
- ↑
Staiger, J.F., Flagmeyer, I., Schubert, D., Zilles, K., Kötter, R., & Luhmann, H.J. (2004).
Functional diversity of layer IV spiny neurons in rat somatosensory cortex: quantitative morphology of electrophysiologically characterized and biocytin labeled cells. Cerebral cortex (New York, N.Y. : 1991), 14(6), 690-701. [PubMed:15054049] [WorldCat] [DOI] - ↑
Lu, S.M., & Lin, R.C. (1993).
Thalamic afferents of the rat barrel cortex: a light- and electron-microscopic study using Phaseolus vulgaris leucoagglutinin as an anterograde tracer. Somatosensory & motor research, 10(1), 1-16. [PubMed:8484292] [WorldCat] - ↑
Feldmeyer, D., Lübke, J., Silver, R.A., & Sakmann, B. (2002).
Synaptic connections between layer 4 spiny neurone-layer 2/3 pyramidal cell pairs in juvenile rat barrel cortex: physiology and anatomy of interlaminar signalling within a cortical column. The Journal of physiology, 538(Pt 3), 803-22. [PubMed:11826166] [PMC] [WorldCat] [DOI] - ↑
Sehara, K., Toda, T., Iwai, L., Wakimoto, M., Tanno, K., Matsubayashi, Y., & Kawasaki, H. (2010).
Whisker-related axonal patterns and plasticity of layer 2/3 neurons in the mouse barrel cortex. The Journal of neuroscience : the official journal of the Society for Neuroscience, 30(8), 3082-92. [PubMed:20181605] [PMC] [WorldCat] [DOI] - ↑
Chu, Y.F., Yen, C.T., & Lee, L.J. (2013).
Neonatal whisker clipping alters behavior, neuronal structure and neural activity in adult rats. Behavioural brain research, 238, 124-33. [PubMed:23098795] [WorldCat] [DOI] - ↑ Kevin Fox
Barrel Cortex
Cambridge University Press:2008 - ↑
Harris, R.M., & Woolsey, T.A. (1979).
Morphology of golgi-impregnated neurons in mouse cortical barrels following vibrissae damage at different post-natal ages. Brain research, 161(1), 143-9. [PubMed:758965] [WorldCat] [DOI] - ↑
Harris, R.M., & Woolsey, T.A. (1981).
Dendritic plasticity in mouse barrel cortex following postnatal vibrissa follicle damage. The Journal of comparative neurology, 196(3), 357-76. [PubMed:7217362] [WorldCat] [DOI] - ↑
Iwasato, T., Erzurumlu, R.S., Huerta, P.T., Chen, D.F., Sasaoka, T., Ulupinar, E., & Tonegawa, S. (1997).
NMDA receptor-dependent refinement of somatotopic maps. Neuron, 19(6), 1201-10. [PubMed:9427244] [WorldCat] [DOI] - ↑
Ballester-Rosado, C.J., Albright, M.J., Wu, C.S., Liao, C.C., Zhu, J., Xu, J., ..., & Lu, H.C. (2010).
mGluR5 in cortical excitatory neurons exerts both cell-autonomous and -nonautonomous influences on cortical somatosensory circuit formation. The Journal of neuroscience : the official journal of the Society for Neuroscience, 30(50), 16896-909. [PubMed:21159961] [PMC] [WorldCat] [DOI] - ↑
Ince-Dunn, G., Hall, B.J., Hu, S.C., Ripley, B., Huganir, R.L., Olson, J.M., ..., & Ghosh, A. (2006).
Regulation of thalamocortical patterning and synaptic maturation by NeuroD2. Neuron, 49(5), 683-95. [PubMed:16504944] [WorldCat] [DOI] - ↑
Hannan, A.J., Blakemore, C., Katsnelson, A., Vitalis, T., Huber, K.M., Bear, M., ..., & Kind, P.C. (2001).
PLC-beta1, activated via mGluRs, mediates activity-dependent differentiation in cerebral cortex. Nature neuroscience, 4(3), 282-8. [PubMed:11224545] [WorldCat] [DOI] - ↑
Lu, H.C., She, W.C., Plas, D.T., Neumann, P.E., Janz, R., & Crair, M.C. (2003).
Adenylyl cyclase I regulates AMPA receptor trafficking during mouse cortical 'barrel' map development. Nature neuroscience, 6(9), 939-47. [PubMed:12897788] [WorldCat] [DOI] - ↑
Suzuki, A., Lee, L.J., Hayashi, Y., Muglia, L., Itohara, S., Erzurumlu, R.S., & Iwasato, T. (2015).
Thalamic adenylyl cyclase 1 is required for barrel formation in the somatosensory cortex. Neuroscience, 290, 518-29. [PubMed:25644422] [PMC] [WorldCat] [DOI] - ↑
Cases, O., Vitalis, T., Seif, I., De Maeyer, E., Sotelo, C., & Gaspar, P. (1996).
Lack of barrels in the somatosensory cortex of monoamine oxidase A-deficient mice: role of a serotonin excess during the critical period. Neuron, 16(2), 297-307. [PubMed:8789945] [WorldCat] [DOI] - ↑
Cases, O., Lebrand, C., Giros, B., Vitalis, T., De Maeyer, E., Caron, M.G., ..., & Seif, I. (1998).
Plasma membrane transporters of serotonin, dopamine, and norepinephrine mediate serotonin accumulation in atypical locations in the developing brain of monoamine oxidase A knock-outs. The Journal of neuroscience : the official journal of the Society for Neuroscience, 18(17), 6914-27. [PubMed:9712661] [PMC] [WorldCat] - ↑
Rebsam, A., Seif, I., & Gaspar, P. (2002).
Refinement of thalamocortical arbors and emergence of barrel domains in the primary somatosensory cortex: a study of normal and monoamine oxidase a knock-out mice. The Journal of neuroscience : the official journal of the Society for Neuroscience, 22(19), 8541-52. [PubMed:12351728] [PMC] [WorldCat] - ↑
Erzurumlu, R.S., & Kind, P.C. (2001).
Neural activity: sculptor of 'barrels' in the neocortex. Trends in neurosciences, 24(10), 589-95. [PubMed:11576673] [PMC] [WorldCat] [DOI] - ↑
Carcea, I., Patil, S.B., Robison, A.J., Mesias, R., Huntsman, M.M., Froemke, R.C., ..., & Benson, D.L. (2014).
Maturation of cortical circuits requires Semaphorin 7A. Proceedings of the National Academy of Sciences of the United States of America, 111(38), 13978-83. [PubMed:25201975] [PMC] [WorldCat] [DOI] - ↑
Matsui, A., Tran, M., Yoshida, A.C., Kikuchi, S.S., U, M., Ogawa, M., & Shimogori, T. (2013).
BTBD3 controls dendrite orientation toward active axons in mammalian neocortex. Science (New York, N.Y.), 342(6162), 1114-8. [PubMed:24179155] [WorldCat] [DOI]