「バレル皮質」の版間の差分
Junko kurahashi (トーク | 投稿記録) 細 (→形態学的特徴) |
Junko kurahashi (トーク | 投稿記録) 細編集の要約なし |
||
| (2人の利用者による、間の20版が非表示) | |||
| 2行目: | 2行目: | ||
<font size="+1">下郡智美</font><br> | <font size="+1">下郡智美</font><br> | ||
''独立行政法人理化学研究所 脳科学総合研究センター''<br> | ''独立行政法人理化学研究所 脳科学総合研究センター''<br> | ||
DOI:<selfdoi /> | DOI:<selfdoi /> 原稿受付日:2018年2月5日 原稿完成日:2018年5月11日<br> | ||
担当編集委員:[http://researchmap.jp/ichirofujita 藤田 一郎](大阪大学 大学院生命機能研究科)<br> | 担当編集委員:[http://researchmap.jp/ichirofujita 藤田 一郎](大阪大学 大学院生命機能研究科)<br> | ||
</div> | </div> | ||
{{box|text= | {{box|text= バレル皮質とは齧歯類大脳皮質第一次体性感覚野の一領域であり、1本1本のヒゲ(洞毛)からの入力を処理するバレルと呼ばれる単位構造(モジュール構造)を持つ。バレルは顔面のヒゲ(洞毛)の分布と同じ空間パターンを持って分布する。バレルにはヒゲからの入力を担う軸索が視床の後腹側核から束を作った状態でIV層に終止し、その周りに主に有棘星状細胞が取り囲むように集まり、筒状のバレル内で視床軸索とできるだけ多くシナプス結合できるように、樹状突起を伸ばす。バレルの形成にはヒゲの刺激による神経活動が必要であり、生後ヒゲを抜いたり、毛根を焼き切るなどしてヒゲからの入力を遮断するとバレルが形成されないことから、可塑性のモデルとして用いられる。}} | ||
英語名:barrel cortex 独:Barrel Cortex 仏:cortex à tonneaux | 英語名:barrel cortex 独:Barrel Cortex 仏:cortex à tonneaux | ||
==バレル皮質とは== | ==バレル皮質とは== | ||
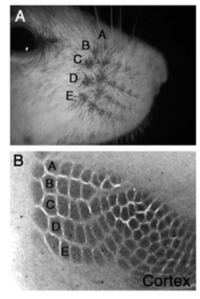
[[ファイル:ShimogoriFig1.png|200px|サムネイル| '''図1. バレル皮質''' <br>'''A.'''マウスの鼻口部の写真。ヒゲの並び方は統一されており、A-E列と名前が付けられている。<br>'''B.''' バレル皮質をチトクロームオキシダーゼ染色により可視化したもの。鼻口部でのヒゲの並びに対応したパターンが見られる。]] | |||
[[ | [[ラット]]や[[マウス]]などの[[齧歯類]]の顔面に生える太いヒゲからの[[体性感覚]]入力は、[[三叉神経]]の[[神経節]]細胞>[[三叉神経核]]>[[視床]]の[[腹後内側核]]>視床の腹後内側核を経て大脳皮質第一次体性感覚野の第IV層に到達する。個々のヒゲの入力は脳内で混在しないように顔のヒゲの分布パターンを維持したまま大脳皮質体性感覚野の第IV層に入力し、1本1本のヒゲ([[洞毛]])からの入力を処理するバレル(樽構造、barrel)と呼ばれる単位構造(モジュール構造)を持つ。バレルは細胞密度が高いことなどから簡単な組織学的染色で可視化することができ、顔面のヒゲの分布と同じ空間パターンでバレルが体性感覚野内に分布している領域をバレル皮質 (barrel cortex)と呼ぶ。('''図1''') | ||
== 形態学的特徴 == | == 形態学的特徴 == | ||
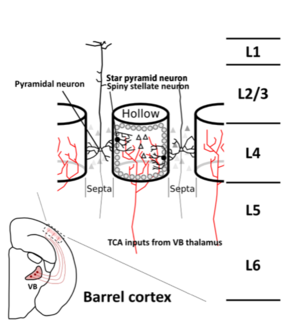
[[ファイル:ShimogoriFig2.png|300px|サムネイル| '''図2. バレル皮質(第4層)でのSpiny stellate, Star pyramid, Pyramidal neuronの分布''' <br>Spiny stellate, Star pyramid neuronは主にVentro basal thalamus か投射される視床軸索が集まるホローに、Pyramidal neuron はホローの間のセプタに分布する。ホロー内のSpiny stellate, Star pyramid neuronは基底樹状突起をホロー側に向けるような形態を持つ。]] | |||
[[ニッスル染色]]などの通常の組織学的手法や様々な組織化学的手法([[チトクローム酸化酵素]] (cytochrome oxidase))、[[コハク酸脱水素酵素]](succinate dehydrogenase)によって、可視化することができる。細胞密度が高いバレルにはヒゲからの入力を担う[[軸索]]が視床の後腹側核から束を作った状態で大脳皮質IV層に終止する。その周りに[[有棘星状細胞]] (spiny stellate 細胞)が主に取り囲むように集まり、視床軸索とできるだけ多くシナプス結合ができるように、バレル内部(hollow, ホロー)に向けて樹状突起を伸ばす。('''図2''')。 | |||
隣あったバレルの間には小さなスペースがあり、セプタと呼ばれる。セプタには[[尖端樹状突起]] (apical dendrite)を持つ[[錐体細胞]]が主に存在し、視床の後腹側核由来の軸索とはシナプス結合しない。 | |||
バレル皮質内にはさらに尖端樹状突起の発達が乏しい星状錐体細胞が存在し、有棘星状細胞: 58%, 星状錐体細胞 (25%), 錐体細胞 (17%)の割合で分布している<ref><pubmed>15054049</pubmed></ref>。 | |||
==神経回路== | ==神経回路== | ||
=== 第IV層 === | === 第IV層 === | ||
視床の腹後内側核 (ventroposterior medial nucleus: VPMdm) | 視床の腹後内側核 (ventroposterior medial nucleus: VPMdm)からの投射は主にホロー内の有棘星状細胞とシナプス結合する。一方、[[視床後核群]](posterior nucleus: POm)の主な投射先は第I層と第V層であり、セプタの錐体細胞ともシナプス結合している <ref><pubmed>8484292 </pubmed></ref>。第IV層の有棘星状細胞は真上の第II/III層の神経細胞と接続し、異なるバレルからの投射が一箇所に混在する事は少ない <ref><pubmed>11826166</pubmed></ref>。異なるバレル内の第IV層同士の接続は非常に稀であり、仮に接続がある場合でも近傍の細胞同士に限られている。 | ||
=== | ===第II/III層=== | ||
第II/III層から第IV層への投射はバレル内部(ホロー)を避けて、セプタにおいてのみシナプスを作っていることから、セプタ内に入力する感覚情報とセプタがつかさどる体性感覚以外の感覚情報とを統合している可能性が示唆する。第II/III層の神経細胞からの軸索を特異的に可視化することによって、バレル皮質を通常の染色と逆に浮かび上がらせるように見えるこの投射パターンはバレルネットと命名されている<ref><pubmed>20181605</pubmed></ref>。 | |||
==機能== | ==機能== | ||
齧歯類の多くはヒゲを使って物体識別を行い、物体同士の隙間などもヒゲを利用して間隔識別を行う。この間隔識別能は[[gap crossing test]]と呼ばれるテストで測定することができるが、バレル構造を正常に形成できなかった個体は間隔識別能力が下がる<ref><pubmed>23098795</pubmed></ref>。このことから、バレル構造を持つことによって[[触覚]]機能の精度を高めているものと考えられている。 | |||
バレル皮質は[[ラット]]、[[マウス]]、[[ハムスター]]、[[wj:チンチラ|チンチラ]]、[[wj:モルモット|モルモット]]、[[wj:リス|リス]]、[[wj:ヤマアラシ|ヤマアラシ]]などで確認されているが、[[wj:カピバラ|カピバラ]]には存在しない<ref>'''Kevin Fox'''<br>Barrel Cortex<br>''Cambridge University Press'':2008, ISBN 9780521852173</ref> 。 | |||
==発生、可塑性== | ==発生、可塑性== | ||
胎児期または生後直後、バレル皮質は形成されておらずマウスでは生後2日から5日の間に形成される。視床軸索がそれぞれのホロー内に収束する形で軸索終末を形成し、その周りに大脳皮質の細胞が集まってバレルができる。 | |||
このバレルの形成には、ヒゲの刺激による神経活動が必要であり、出生直後にヒゲを抜いたり、毛根を焼き切るなどしてヒゲからの入力を遮断するとバレルが形成されない<ref><pubmed>758965</pubmed></ref> <ref><pubmed>7217362</pubmed></ref>。バレルの形成には[[臨界期]]があり、生後7日目以降はヒゲからの入力が遮断されても一度形成されたバレルは維持されたままとなる。 | |||
バレルの形成には神経活動が必要であることから大脳皮質の[[興奮性]]ニューロンに限定して[[NMDA型グルタミン酸受容体]]の[[NR1]]サブユニットを欠損する[[ノックアウトマウス]]や <ref><pubmed>9427244</pubmed></ref>、[[代謝型グルタミン酸受容体]][[mGluR5]]のノックアウトマウスにおいてもバレルの形成が不全になる<ref><pubmed> 21159961</pubmed></ref> 。さらにグルタミン酸受容体によって発現がコントロールされるタンパク質として[[NeuroD2]]がバレル形成に必要であること <ref><pubmed>16504944</pubmed></ref>、およびmGluR5の下流に位置する因子として[[ホスホリパーゼCβ1]]のノックアウトマウスはバレルの形成不全を起こす <ref><pubmed>11224545</pubmed></ref>。 | |||
視床軸索側からバレルを形成する要素として、視軸軸索の[[CA2+|CA<sup>2+</sup>]]/calmodulin-activated type-I adenylyl cyclase(AC1 )が[[AMPA型グルタミン酸受容体]]の細胞内輸送を制御することによって、視床—大脳皮質細胞のシナプス結合の強化に必要である<ref><pubmed> 12897788</pubmed></ref> <ref><pubmed>25644422</pubmed></ref>。 | |||
バレルの形成に関わる他の因子として神経伝達物質である[[セロトニン]]も重要であることが報告されている。まずセロトニン分解酵素である[[モノアミン酸化酵素A]]のノックアウトマウスでバレルの形成不全になる <ref><pubmed>8789945</pubmed></ref>。さらに、セロトニンを細胞に取り込むセロトニン輸送体のノックアウトマウスにおいてもバレルの形成が阻害されていたことから、大脳皮質でセロトニンの濃度が上昇するとバレルの形成が阻害されることが推測された <ref><pubmed> 9712661</pubmed></ref>。このことを裏付けるように、[[モノアミン]]酸化酵素Aのノックアウトマウスと[[セロトニン1B受容体]]のノックアウトマウスとを掛け合わせることにより,バレルの形成の異常は軽減される <ref><pubmed>12351728</pubmed></ref>。 | |||
以上のように、ニッスル染色で可視化できる細胞密度の違いによる“バレル“は視床軸索からの入力と大脳皮質細胞の神経活動の[[バランス]]、さらには細胞外セロトニン濃度の調節が必要である<ref><pubmed>11576673</pubmed></ref>。 | |||
バレルの形成には細胞が有棘星状細胞ホローを取り囲むように集まることとともに、有棘星状細胞の樹状突起がホローに向けて伸長する必要がある。この樹状突起の形態変化に特異的に関わる因子として有棘星状細胞に発現している[[Btbd3]]、[[Sema7A]]などがある<ref><pubmed>25201975</pubmed></ref> <ref><pubmed>24179155</pubmed></ref>。 | |||
==参考文献== | ==参考文献== | ||
<references /> | <references /> | ||
2018年5月11日 (金) 12:12時点における最新版
下郡智美
独立行政法人理化学研究所 脳科学総合研究センター
DOI:10.14931/bsd.7504 原稿受付日:2018年2月5日 原稿完成日:2018年5月11日
担当編集委員:藤田 一郎(大阪大学 大学院生命機能研究科)
バレル皮質とは齧歯類大脳皮質第一次体性感覚野の一領域であり、1本1本のヒゲ(洞毛)からの入力を処理するバレルと呼ばれる単位構造(モジュール構造)を持つ。バレルは顔面のヒゲ(洞毛)の分布と同じ空間パターンを持って分布する。バレルにはヒゲからの入力を担う軸索が視床の後腹側核から束を作った状態でIV層に終止し、その周りに主に有棘星状細胞が取り囲むように集まり、筒状のバレル内で視床軸索とできるだけ多くシナプス結合できるように、樹状突起を伸ばす。バレルの形成にはヒゲの刺激による神経活動が必要であり、生後ヒゲを抜いたり、毛根を焼き切るなどしてヒゲからの入力を遮断するとバレルが形成されないことから、可塑性のモデルとして用いられる。
英語名:barrel cortex 独:Barrel Cortex 仏:cortex à tonneaux
バレル皮質とは
ラットやマウスなどの齧歯類の顔面に生える太いヒゲからの体性感覚入力は、三叉神経の神経節細胞>三叉神経核>視床の腹後内側核>視床の腹後内側核を経て大脳皮質第一次体性感覚野の第IV層に到達する。個々のヒゲの入力は脳内で混在しないように顔のヒゲの分布パターンを維持したまま大脳皮質体性感覚野の第IV層に入力し、1本1本のヒゲ(洞毛)からの入力を処理するバレル(樽構造、barrel)と呼ばれる単位構造(モジュール構造)を持つ。バレルは細胞密度が高いことなどから簡単な組織学的染色で可視化することができ、顔面のヒゲの分布と同じ空間パターンでバレルが体性感覚野内に分布している領域をバレル皮質 (barrel cortex)と呼ぶ。(図1)
形態学的特徴
ニッスル染色などの通常の組織学的手法や様々な組織化学的手法(チトクローム酸化酵素 (cytochrome oxidase))、コハク酸脱水素酵素(succinate dehydrogenase)によって、可視化することができる。細胞密度が高いバレルにはヒゲからの入力を担う軸索が視床の後腹側核から束を作った状態で大脳皮質IV層に終止する。その周りに有棘星状細胞 (spiny stellate 細胞)が主に取り囲むように集まり、視床軸索とできるだけ多くシナプス結合ができるように、バレル内部(hollow, ホロー)に向けて樹状突起を伸ばす。(図2)。
隣あったバレルの間には小さなスペースがあり、セプタと呼ばれる。セプタには尖端樹状突起 (apical dendrite)を持つ錐体細胞が主に存在し、視床の後腹側核由来の軸索とはシナプス結合しない。
バレル皮質内にはさらに尖端樹状突起の発達が乏しい星状錐体細胞が存在し、有棘星状細胞: 58%, 星状錐体細胞 (25%), 錐体細胞 (17%)の割合で分布している[1]。
神経回路
第IV層
視床の腹後内側核 (ventroposterior medial nucleus: VPMdm)からの投射は主にホロー内の有棘星状細胞とシナプス結合する。一方、視床後核群(posterior nucleus: POm)の主な投射先は第I層と第V層であり、セプタの錐体細胞ともシナプス結合している [2]。第IV層の有棘星状細胞は真上の第II/III層の神経細胞と接続し、異なるバレルからの投射が一箇所に混在する事は少ない [3]。異なるバレル内の第IV層同士の接続は非常に稀であり、仮に接続がある場合でも近傍の細胞同士に限られている。
第II/III層
第II/III層から第IV層への投射はバレル内部(ホロー)を避けて、セプタにおいてのみシナプスを作っていることから、セプタ内に入力する感覚情報とセプタがつかさどる体性感覚以外の感覚情報とを統合している可能性が示唆する。第II/III層の神経細胞からの軸索を特異的に可視化することによって、バレル皮質を通常の染色と逆に浮かび上がらせるように見えるこの投射パターンはバレルネットと命名されている[4]。
機能
齧歯類の多くはヒゲを使って物体識別を行い、物体同士の隙間などもヒゲを利用して間隔識別を行う。この間隔識別能はgap crossing testと呼ばれるテストで測定することができるが、バレル構造を正常に形成できなかった個体は間隔識別能力が下がる[5]。このことから、バレル構造を持つことによって触覚機能の精度を高めているものと考えられている。
バレル皮質はラット、マウス、ハムスター、チンチラ、モルモット、リス、ヤマアラシなどで確認されているが、カピバラには存在しない[6] 。
発生、可塑性
胎児期または生後直後、バレル皮質は形成されておらずマウスでは生後2日から5日の間に形成される。視床軸索がそれぞれのホロー内に収束する形で軸索終末を形成し、その周りに大脳皮質の細胞が集まってバレルができる。
このバレルの形成には、ヒゲの刺激による神経活動が必要であり、出生直後にヒゲを抜いたり、毛根を焼き切るなどしてヒゲからの入力を遮断するとバレルが形成されない[7] [8]。バレルの形成には臨界期があり、生後7日目以降はヒゲからの入力が遮断されても一度形成されたバレルは維持されたままとなる。
バレルの形成には神経活動が必要であることから大脳皮質の興奮性ニューロンに限定してNMDA型グルタミン酸受容体のNR1サブユニットを欠損するノックアウトマウスや [9]、代謝型グルタミン酸受容体mGluR5のノックアウトマウスにおいてもバレルの形成が不全になる[10] 。さらにグルタミン酸受容体によって発現がコントロールされるタンパク質としてNeuroD2がバレル形成に必要であること [11]、およびmGluR5の下流に位置する因子としてホスホリパーゼCβ1のノックアウトマウスはバレルの形成不全を起こす [12]。
視床軸索側からバレルを形成する要素として、視軸軸索のCA2+/calmodulin-activated type-I adenylyl cyclase(AC1 )がAMPA型グルタミン酸受容体の細胞内輸送を制御することによって、視床—大脳皮質細胞のシナプス結合の強化に必要である[13] [14]。
バレルの形成に関わる他の因子として神経伝達物質であるセロトニンも重要であることが報告されている。まずセロトニン分解酵素であるモノアミン酸化酵素Aのノックアウトマウスでバレルの形成不全になる [15]。さらに、セロトニンを細胞に取り込むセロトニン輸送体のノックアウトマウスにおいてもバレルの形成が阻害されていたことから、大脳皮質でセロトニンの濃度が上昇するとバレルの形成が阻害されることが推測された [16]。このことを裏付けるように、モノアミン酸化酵素Aのノックアウトマウスとセロトニン1B受容体のノックアウトマウスとを掛け合わせることにより,バレルの形成の異常は軽減される [17]。 以上のように、ニッスル染色で可視化できる細胞密度の違いによる“バレル“は視床軸索からの入力と大脳皮質細胞の神経活動のバランス、さらには細胞外セロトニン濃度の調節が必要である[18]。
バレルの形成には細胞が有棘星状細胞ホローを取り囲むように集まることとともに、有棘星状細胞の樹状突起がホローに向けて伸長する必要がある。この樹状突起の形態変化に特異的に関わる因子として有棘星状細胞に発現しているBtbd3、Sema7Aなどがある[19] [20]。
参考文献
- ↑
Staiger, J.F., Flagmeyer, I., Schubert, D., Zilles, K., Kötter, R., & Luhmann, H.J. (2004).
Functional diversity of layer IV spiny neurons in rat somatosensory cortex: quantitative morphology of electrophysiologically characterized and biocytin labeled cells. Cerebral cortex (New York, N.Y. : 1991), 14(6), 690-701. [PubMed:15054049] [WorldCat] [DOI] - ↑
Lu, S.M., & Lin, R.C. (1993).
Thalamic afferents of the rat barrel cortex: a light- and electron-microscopic study using Phaseolus vulgaris leucoagglutinin as an anterograde tracer. Somatosensory & motor research, 10(1), 1-16. [PubMed:8484292] [WorldCat] - ↑
Feldmeyer, D., Lübke, J., Silver, R.A., & Sakmann, B. (2002).
Synaptic connections between layer 4 spiny neurone-layer 2/3 pyramidal cell pairs in juvenile rat barrel cortex: physiology and anatomy of interlaminar signalling within a cortical column. The Journal of physiology, 538(Pt 3), 803-22. [PubMed:11826166] [PMC] [WorldCat] [DOI] - ↑
Sehara, K., Toda, T., Iwai, L., Wakimoto, M., Tanno, K., Matsubayashi, Y., & Kawasaki, H. (2010).
Whisker-related axonal patterns and plasticity of layer 2/3 neurons in the mouse barrel cortex. The Journal of neuroscience : the official journal of the Society for Neuroscience, 30(8), 3082-92. [PubMed:20181605] [PMC] [WorldCat] [DOI] - ↑
Chu, Y.F., Yen, C.T., & Lee, L.J. (2013).
Neonatal whisker clipping alters behavior, neuronal structure and neural activity in adult rats. Behavioural brain research, 238, 124-33. [PubMed:23098795] [WorldCat] [DOI] - ↑ Kevin Fox
Barrel Cortex
Cambridge University Press:2008, ISBN 9780521852173 - ↑
Harris, R.M., & Woolsey, T.A. (1979).
Morphology of golgi-impregnated neurons in mouse cortical barrels following vibrissae damage at different post-natal ages. Brain research, 161(1), 143-9. [PubMed:758965] [WorldCat] [DOI] - ↑
Harris, R.M., & Woolsey, T.A. (1981).
Dendritic plasticity in mouse barrel cortex following postnatal vibrissa follicle damage. The Journal of comparative neurology, 196(3), 357-76. [PubMed:7217362] [WorldCat] [DOI] - ↑
Iwasato, T., Erzurumlu, R.S., Huerta, P.T., Chen, D.F., Sasaoka, T., Ulupinar, E., & Tonegawa, S. (1997).
NMDA receptor-dependent refinement of somatotopic maps. Neuron, 19(6), 1201-10. [PubMed:9427244] [WorldCat] [DOI] - ↑
Ballester-Rosado, C.J., Albright, M.J., Wu, C.S., Liao, C.C., Zhu, J., Xu, J., ..., & Lu, H.C. (2010).
mGluR5 in cortical excitatory neurons exerts both cell-autonomous and -nonautonomous influences on cortical somatosensory circuit formation. The Journal of neuroscience : the official journal of the Society for Neuroscience, 30(50), 16896-909. [PubMed:21159961] [PMC] [WorldCat] [DOI] - ↑
Ince-Dunn, G., Hall, B.J., Hu, S.C., Ripley, B., Huganir, R.L., Olson, J.M., ..., & Ghosh, A. (2006).
Regulation of thalamocortical patterning and synaptic maturation by NeuroD2. Neuron, 49(5), 683-95. [PubMed:16504944] [WorldCat] [DOI] - ↑
Hannan, A.J., Blakemore, C., Katsnelson, A., Vitalis, T., Huber, K.M., Bear, M., ..., & Kind, P.C. (2001).
PLC-beta1, activated via mGluRs, mediates activity-dependent differentiation in cerebral cortex. Nature neuroscience, 4(3), 282-8. [PubMed:11224545] [WorldCat] [DOI] - ↑
Lu, H.C., She, W.C., Plas, D.T., Neumann, P.E., Janz, R., & Crair, M.C. (2003).
Adenylyl cyclase I regulates AMPA receptor trafficking during mouse cortical 'barrel' map development. Nature neuroscience, 6(9), 939-47. [PubMed:12897788] [WorldCat] [DOI] - ↑
Suzuki, A., Lee, L.J., Hayashi, Y., Muglia, L., Itohara, S., Erzurumlu, R.S., & Iwasato, T. (2015).
Thalamic adenylyl cyclase 1 is required for barrel formation in the somatosensory cortex. Neuroscience, 290, 518-29. [PubMed:25644422] [PMC] [WorldCat] [DOI] - ↑
Cases, O., Vitalis, T., Seif, I., De Maeyer, E., Sotelo, C., & Gaspar, P. (1996).
Lack of barrels in the somatosensory cortex of monoamine oxidase A-deficient mice: role of a serotonin excess during the critical period. Neuron, 16(2), 297-307. [PubMed:8789945] [WorldCat] [DOI] - ↑
Cases, O., Lebrand, C., Giros, B., Vitalis, T., De Maeyer, E., Caron, M.G., ..., & Seif, I. (1998).
Plasma membrane transporters of serotonin, dopamine, and norepinephrine mediate serotonin accumulation in atypical locations in the developing brain of monoamine oxidase A knock-outs. The Journal of neuroscience : the official journal of the Society for Neuroscience, 18(17), 6914-27. [PubMed:9712661] [PMC] [WorldCat] - ↑
Rebsam, A., Seif, I., & Gaspar, P. (2002).
Refinement of thalamocortical arbors and emergence of barrel domains in the primary somatosensory cortex: a study of normal and monoamine oxidase a knock-out mice. The Journal of neuroscience : the official journal of the Society for Neuroscience, 22(19), 8541-52. [PubMed:12351728] [PMC] [WorldCat] - ↑
Erzurumlu, R.S., & Kind, P.C. (2001).
Neural activity: sculptor of 'barrels' in the neocortex. Trends in neurosciences, 24(10), 589-95. [PubMed:11576673] [PMC] [WorldCat] [DOI] - ↑
Carcea, I., Patil, S.B., Robison, A.J., Mesias, R., Huntsman, M.M., Froemke, R.C., ..., & Benson, D.L. (2014).
Maturation of cortical circuits requires Semaphorin 7A. Proceedings of the National Academy of Sciences of the United States of America, 111(38), 13978-83. [PubMed:25201975] [PMC] [WorldCat] [DOI] - ↑
Matsui, A., Tran, M., Yoshida, A.C., Kikuchi, S.S., U, M., Ogawa, M., & Shimogori, T. (2013).
BTBD3 controls dendrite orientation toward active axons in mammalian neocortex. Science (New York, N.Y.), 342(6162), 1114-8. [PubMed:24179155] [WorldCat] [DOI]