「フェロモン受容体」の版間の差分
Junko kurahashi (トーク | 投稿記録) 細 (→遺伝子の特徴と受容体の構造) |
Junko kurahashi (トーク | 投稿記録) 細 (→発見の経緯) |
||
| 78行目: | 78行目: | ||
=== 嗅覚受容体 === | === 嗅覚受容体 === | ||
==== 発見の経緯 ==== | ==== 発見の経緯 ==== | ||
1980年代、視覚における光の受容体が[[ロドプシン]]であるということが明らかになったが、嗅覚における匂い分子の受容体は同定されておらず、生物がどのようにして多様な匂いを感知して識別しているのかは不明であった。一方で嗅覚受容体遺伝子が同定される以前から、匂い情報は鼻腔の[[嗅上皮]]にある[[嗅神経細胞]]で受け取られ、その情報が[[嗅球]]へと伝達されてそこからさらに高次中枢へと信号が送られていくことはわかっていた。また嗅神経細胞において、匂い刺激が入るとGタンパク質を介したシグナル伝達が動くことも実験的に明らかになっていた。[[wj:リンダ・バック|Buck]]と[[wj:リチャード・アクセル|Axel]]は、これらの知見と匂いの多様性から、1) 嗅上皮に特異的に発現している、2)嗅覚受容体(OR)はGPCRである、3)多重遺伝子ファミリーを形成している、と仮定して、[[縮重プライマー]]を利用した[[PCR]]法を導入することによって1991年にOR候補遺伝子のクローニングに成功した<ref><pubmed>1840504</pubmed></ref>37。その後、[[ウイルスベクター]]を用いてORを嗅神経細胞に発現させる再構成実験がされ、ORが実際に匂い分子を受容してシグナルを伝えることが証明された<ref><pubmed>9422698</pubmed></ref><ref><pubmed>10097159</pubmed></ref>38, | 1980年代、視覚における光の受容体が[[ロドプシン]]であるということが明らかになったが、嗅覚における匂い分子の受容体は同定されておらず、生物がどのようにして多様な匂いを感知して識別しているのかは不明であった。一方で嗅覚受容体遺伝子が同定される以前から、匂い情報は鼻腔の[[嗅上皮]]にある[[嗅神経細胞]]で受け取られ、その情報が[[嗅球]]へと伝達されてそこからさらに高次中枢へと信号が送られていくことはわかっていた。また嗅神経細胞において、匂い刺激が入るとGタンパク質を介したシグナル伝達が動くことも実験的に明らかになっていた。[[wj:リンダ・バック|Buck]]と[[wj:リチャード・アクセル|Axel]]は、これらの知見と匂いの多様性から、1) 嗅上皮に特異的に発現している、2)嗅覚受容体(OR)はGPCRである、3)多重遺伝子ファミリーを形成している、と仮定して、[[縮重プライマー]]を利用した[[wj:PCR|PCR]]法を導入することによって1991年にOR候補遺伝子のクローニングに成功した<ref><pubmed>1840504</pubmed></ref>37。その後、[[ウイルスベクター]]を用いてORを嗅神経細胞に発現させる再構成実験がされ、ORが実際に匂い分子を受容してシグナルを伝えることが証明された<ref><pubmed>9422698</pubmed></ref><ref><pubmed>10097159</pubmed></ref>38,39。 | ||
BuckとAxelはOR遺伝子発見の功績によって2004年に[[wj:ノーベル生理医学賞|ノーベル生理医学賞]]を受賞した。 | |||
==== 遺伝子の特徴と受容体の構造 ==== | ==== 遺伝子の特徴と受容体の構造 ==== | ||
2018年7月30日 (月) 14:32時点における版
板倉拓海、東原和成
東京大学大学院農学生命科学研究科
DOI:10.14931/bsd.598 原稿受付日:年月日 原稿完成日:
担当編集委員:林 康紀(独立行政法人理化学研究所 脳科学総合研究センター)
英語名:pheromone receptor 同義語:鋤鼻受容体
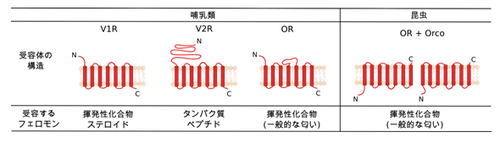
フェロモンとは、「ある個体から分泌され同種他個体において何らかの行動や生理作用を引き起こす化学物質」のことであると定義される。フェロモン受容体は、これらのフェロモン分子を受容するタンパク質である[1]1。哺乳類では一般的にフェロモンは鼻腔下部に存在する鋤鼻神経に発現する鋤鼻受容体(Vomeronasal receptor : VR)によって受容される。VRには1型と2型(V1RとV2R)の2種類が存在する。また一部の揮発性のフェロモンは、嗅神経細胞に発現する嗅覚受容体(OR)によって受容される。V1R、V2R、ORは、全て7回膜貫通型のGタンパク質共役型受容体(GPCR)である。昆虫においては、嗅覚受容体の一部がフェロモンの受容に特化してフェロモン受容体として機能すると報告されている。昆虫のフェロモン受容体は哺乳類のフェロモン受容体とは異なり、7回膜貫通型のリガンド作動性陽イオンチャネルであり、ヘテロ複合体で機能していると考えられている[1]1
哺乳類
陸棲の脊椎動物の多くは、主嗅覚系と鋤鼻系(副嗅覚系)という2つの嗅覚システムを有している(図1、2)2[2]。鋤鼻系の機能に関しては、げっ歯類において鋤鼻器を切除するとオスの攻撃行動や性行動に異常をきたすことから、フェロモンを受容する役割を持つとされていた3[3]。一方、主嗅覚系では一般的な匂いが受容されていると考えられていた。しかし最近では主嗅覚系でも揮発性のフェロモンを受容していることが示唆されている[4][5][6]4–6。
本項では主に哺乳類のモデル生物であるマウスにおけるフェロモン受容体(鋤鼻受容体:V1R・V2R、嗅覚受容体:OR)について概説する。
鋤鼻神経細胞にはV1RとV2Rという2種類の鋤鼻受容体が発現している(図1)。V1Rは低分子のフェロモンを、V2Rはタンパク質あるいはペプチド性のフェロモンなどを主に受容する。主嗅覚系において嗅神経細胞に発現するORは、一般的な匂い分子に加え、揮発性のフェロモンも受容する。
鋤鼻受容体 V1R
発見の経緯
嗅覚受容体遺伝子候補同定から4年後の1995年に、DulacとAxelは、ラットの鋤鼻神経からフェロモン受容体遺伝子候補(後にV1Rと呼ばれる鋤鼻受容体)のクローニングに成功した7[7]。最初は鋤鼻器に発現する嗅覚受容体相同遺伝子の単離を試みたが失敗に終わった。次に戦略を変更し、鋤鼻器特異的に発現する受容体を、単一の鋤鼻神経からディファレンシャルスクリーニング法によってスクリーニングしたところ、V1R遺伝子群が得られた。
V1Rは有力なフェロモン受容体候補であったが、in vitroでの機能的発現が困難であったためフェロモン受容機能はなかなか実証されなかった。2000年にZufallらのグループは、マウス鋤鼻上皮の上層に局在する鋤鼻神経細胞が複数種類の揮発性フェロモンに電気的応答をすることを示し、V1Rの関与が示唆された[8]8。そして2002年にマウス尿中に含まれる揮発性フェロモンである2-heptanoneがV1R遺伝子フェミリーの一つであるV1R2bによって特異的に受容されることが示され、V1R遺伝子がフェロモン受容体をコードしていることが証明された9[9]。
遺伝子の特徴と受容体の構造
V1Rは7回膜貫通型Gタンパク質共役型受容体(GPCR)である。
V1R遺伝子はマウスにおいて191個から成る多重遺伝子ファミリーを形成していて、配列中にイントロンを含まない7,10[7][10]。鋤鼻上皮において上層側の鋤鼻神経細胞には1つの細胞につき1種類のV1Rがモノアレルに発現している[11]11。マウスとラットという比較的近縁な種間でもV1R遺伝子のレパートリーが大きく異なることから、V1Rの進化は比較的早く、種特異的なフェロモン受容を可能にしていることが予想される[12]12。V1RはN末端の細胞外領域が比較的短く、ORと同じクラスAのGPCRに属するが、V1R遺伝子とOR遺伝子の間のホモロジーはほとんどない。
シグナル伝達
V1Rを介したフェロモンの受容メカニズムとして、以下のようなシグナル伝達機構が考えられている2[2]。
フェロモン分子がV1Rに結合するとGαi2を含む三量体Gタンパク質が活性化される。それに伴い遊離したGβ2γ2サブユニットがホスホリパーゼCβ2(PLCβ2)を活性化する。PLCβ2はホスファチジルイノシトール二リン酸を加水分解してジアシルグリセロール(DAG)とイノシトール三リン酸(PI3)を産生する。
この下流として2種類のシグナル伝達機構が考えられている。1つ目はDAGがTRPC2チャネルに結合することでチャネルが開口してNa+やCa2+が細胞内に流入して脱分極が引き起される経路である[13]13。もう一つはDAGがDAGリパーゼによって加水分解されアラキドン酸が産生し、アラキドン酸がCa2+感受性チャネルに結合することでCa2+が細胞内に流入することで脱分極が引き起こされる経路である[14][15]14,15。このような細胞内シグナル伝達を経て、V1Rが受け取ったフェロモン情報は電気信号へと変換される。 V1Rを発現する鋤鼻神経細胞は一次中枢である副嗅球の口吻側に投射しており、副嗅球でシナプスを介して二次神経に信号が伝わる。二次神経は、扁桃体内側核や分界上床核へと軸索を伸ばし、その後、視床下部などの高次脳領域へ情報が伝達されていく[16]16。
機能
V1Rは低分子の揮発性フェロモンや、ステロイドなどの不揮発性フェロモンを受容する。
揮発性フェロモン受容の例として、オスとメス両方のマウスの尿中に含まれる2-ヘプタノンはV1Rb2によって受容され、メスの発情期を延長させる[9]9。
ステロイド受容の例として、発情期のメスマウスの尿中に含まれるエストロゲン硫化物は、V1rj2とV1rj3に受容される[17]17。エストロゲン硫化物を塗った卵巣除去メスに対しては、オスはマウント行動を示さない。一方、非発情期のメス尿とエストロゲン硫化物を同時に塗った場合は、オスのマウントが促進される。これらのことから、オスはメス特異的なシグナルと発情状態を示すシグナルを同時に受容した場合に性行動が促進されることが示唆される[17]17。
Puntaらは、2つのV1Rクレードを含む16種類のV1R遺伝子群を欠損させたマウスを作製したところ、このマウスでは母親の攻撃行動やオスの性行動が消失することを見出した。これらの行動を引き起こすのに必要なフェロモン受容体が、欠損した16種のV1R遺伝子群に含まれていると考えられる[18]18。
Isogaiらは、マウスにおいて、初期応答遺伝子Egr1を鋤鼻神経活動の指標とし、同種および他種生物由来の様々な刺激に対する鋤鼻神経応答プロファイルを作成した。その結果、V1Rは同種だけでなく異種生物由来のシグナル(カイロモン)も受容することが示されている[19]19。
鋤鼻受容体 V2R
発見の経緯
1995年に発見されたV1Rは鋤鼻上皮の上層に局在し、Gαi2タンパク質と共役していた。そこで鋤鼻上皮の下層に発現するGαoタンパク質と共役する受容体の存在が示唆され、新たなフェロモン受容体遺伝子の探索がなされた。V1R遺伝子発見から2年後の1997年に3つのグループが、ほぼ同時に新たなフェロモン受容体遺伝子候補(後にV2Rと呼ばれる鋤鼻受容体遺伝子)のクローニングに成功した[20][21][22]20–22。
V2Rのフェロモン受容機能の実証は、オスマウスの涙に含まれるペプチド性フェロモンである眼窩外涙腺由来ペプチドESP1がV2Rp5という単一のV2Rのみに特異的に受容され、受容したメスマウスのオス受け入れ行動(ロードシス反射)が促進されるという研究によってなされた[23][24]23,24。
遺伝子の特徴と受容体の構造
V2Rは7回膜貫通型のGPCRである(図1)。マウスはゲノム上に121個のV2R遺伝子を有する[25]25。またV2RはV1Rと異なり配列中にイントロンを含む[20][21][22]20–22。
1つの鋤鼻神経細胞には各鋤鼻神経特異的なV2Rが1種類と、広く発現するV2R2の2つが発現している[26]26。また、主要組織適合遺伝子複合体(MHC)、β2-ミクログロブリンと共発現していることから、V2Rはこれらの因子と複合体を形成して機能している可能性が示唆されている[27][28]27,28。V2RはN末端の細胞外領域が比較的大きいクラスCのGPCRに属し、V1R遺伝子やOR遺伝子とのホモロジーがなく、代謝型グルタミン酸受容体遺伝子や甘味受容体遺伝子、うま味受容体遺伝子とのホモロジーを有する。
シグナル伝達
V2Rを介したシグナル伝達機構は未だ明らかになっていないが、V2Rを発現する鋤鼻神経細胞にはGタンパク質のGαo、Gβ2、Gγ8やPLCβ2やTRPC2などが発現していることが明らかになっている。また、TRPC2遺伝子欠損マウスでは全てのV2Rリガンドに対する応答がなくなるのではなく、一部のV2Rリガンドに対しては応答が変化しないことが報告されている[24][29][30]24,29,30。これらのことからV2Rのシグナル伝達は、V1Rと同様に2種類存在し、PLCβ2-TRPC2経路と、DAG分解によって生じたアラキドン酸がCa2+感受性チャネルを開口させてCa2+流入を生じさせる経路であると考えられている2。
V2Rを発現する鋤鼻神経細胞は副嗅球の尾側に投射し、V1Rと同様に副嗅球でシナプスを介して扁桃体内側核や分界上床核へと情報が伝達され、その後、視床下部などの高次中枢へと情報が伝達されていく[16]16。
機能
V2Rはタンパク質あるいはペプチド性のフェロモンを受容する。現在マウスにおいて、V2Rとフェロモンの対応づけがなされているのは、Touharaらのグループが報告したV2Rp5とオスマウスが分泌する眼窩外涙腺由来ペプチドESP1のみである。ESP1はオスの涙中に分泌される7 kDaのペプチド性のフェロモンであり、V2Rp5のみによって受容される。ESP1の情報は脳内で性的二型に処理され、メスとオスで異なる効果をもたらす。ESP1はメスにおいてオス受け入れ行動(ロードシス反射)を促進し、オスでは攻撃行動を亢進する[24][31][32]24,31,32。
さらにESP1は流産を引き起こすブルース効果にも関与することが報告されている[33]33。
他にもV2Rによって受容されるフェロモンは数例報告されているが、それらの受容体は同定されていない[29][34][35]29,34,35。またV2RもV1Rと同様に他種由来の化学シグナルを受容する[19]19。例えば天敵であるネコの唾液由来のタンパク質を受容すると忌避行動が生じることが報告されている[36]36。
嗅覚受容体
発見の経緯
1980年代、視覚における光の受容体がロドプシンであるということが明らかになったが、嗅覚における匂い分子の受容体は同定されておらず、生物がどのようにして多様な匂いを感知して識別しているのかは不明であった。一方で嗅覚受容体遺伝子が同定される以前から、匂い情報は鼻腔の嗅上皮にある嗅神経細胞で受け取られ、その情報が嗅球へと伝達されてそこからさらに高次中枢へと信号が送られていくことはわかっていた。また嗅神経細胞において、匂い刺激が入るとGタンパク質を介したシグナル伝達が動くことも実験的に明らかになっていた。BuckとAxelは、これらの知見と匂いの多様性から、1) 嗅上皮に特異的に発現している、2)嗅覚受容体(OR)はGPCRである、3)多重遺伝子ファミリーを形成している、と仮定して、縮重プライマーを利用したPCR法を導入することによって1991年にOR候補遺伝子のクローニングに成功した[37]37。その後、ウイルスベクターを用いてORを嗅神経細胞に発現させる再構成実験がされ、ORが実際に匂い分子を受容してシグナルを伝えることが証明された[38][39]38,39。
BuckとAxelはOR遺伝子発見の功績によって2004年にノーベル生理医学賞を受賞した。
遺伝子の特徴と受容体の構造
ORは7回膜貫通型のGPCRである。ORは哺乳類の中で最大の多重遺伝子ファミリーを形成していて、マウスは1035個、ヒトは396個のOR遺伝子を有する[40]40。OR遺伝子発現に関しては、1つの嗅神経細胞には1種類のOR遺伝子が発現する「1神経1受容体ルール」とモノアレルの発現制御が特徴的である[41]41。ORはN末端の細胞外領域が比較的短いクラスAのGPCRに属する。ORの結晶構造は解かれていないが、アミノ酸の部位特異的変異を導入したORのリガンド結合能を評価した実験から、3、5、6番目のヘリックスに位置するアミノ酸残基がリガンド結合に重要であることが報告されている[42][43]42,43。
シグナル伝達
ORは嗅神経細胞においてGsタイプに属するGαolfと共役する。そのシグナル伝達様式は以下の通りになる。匂い刺激を受けてORによって活性化されたGαolfがアデニル酸シクラーゼを活性化し、ATPをcAMPに変換する。cAMPの濃度上昇により環状ヌクレオチド作動性チャネルが開口してNa+、Ca2+が細胞内に流入し、さらにCa2+活性化型Cl-チャネルが開口することで細胞膜が脱分極すると考えられている。このような細胞内シグナル伝達を経て、ORが受け取った匂い分子の化学情報が電気信号に変換される[2]2。嗅神経細胞は軸索を主嗅覚系の一次中枢である嗅球へと投射し、シナプスを介してさらに高次へと信号が伝わっていく。
機能
以前はフェロモン受容体といえばV1RおよびV2Rとされていて、ORは一般的な匂いのみを受容するものとされていた。しかし現在はORの一部も揮発性フェロモンを受容していることが示唆されている。例えば、オスマウスの包皮腺由来の不飽和アルコールであるZ5-14:OHはメスに対して誘引効果を持つフェロモンでありOlfr288によって受容される[5]5。また、オスマウスの尿中に含まれる(methylthio)methanethiol(MTMT)も同様にしてメスに対して誘引効果を持ちMOR244-3によって受容される[6][44]6,44。
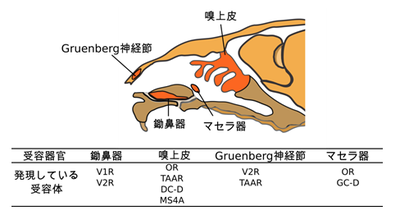
その他のフェロモン受容体候補と発現部位
マウスの嗅上皮にはOR以外のフェロモン受容システムが存在する。嗅上皮に発現するTrace amine-associated receptor(TAAR)は揮発性のアミンを受容し、フェロモン受容の機能が報告されている。TAAR5は尿中に含まれるトリメチルアミンを受容し、誘引行動に関与することが報告されている[45]45。また、嗅上皮の窪みに位置する嗅神経細胞は、嗅球の尾側に存在するネックレス糸球体へと投射する特殊な特徴をもつ。このネックレス嗅神経細胞はGPCRのシグナル伝達に関与する分子が発現しておらず、化学受容体としてグアニルサイクレースD(GC-D)とMS4Aファミリーが発現している。GC-Dは一回膜貫通型タンパク質であり、全てのネックレス嗅神経細胞に発現していて、二酸化炭素や二硫化炭素、ペプチドホルモンを受容することが報告されている[46][47][48]46–48。MS4Aファミリーは4回膜貫通型タンパク質であり、1つのネックレス嗅神経細胞に複数種が発現していて、それぞれのタンパク質が脂肪酸やフェロモンを特異的に感知していることが示唆されている[49]49。
これまでに説明してきた嗅上皮や鋤鼻器以外の嗅覚システムとして、鼻の先端に位置するGruenberg神経節と、鋤鼻器官の後方に位置するマセラ器がある。Grueneberg神経節は1種のV2R(V2r83)、TAAR群を発現していて、軸索をネックレス糸球体へと伸ばしている[50][51][52]50–52。Grueneberg神経節の細胞は、マウス尿中に含まれるアラームフェロモンに対して応答し、さらにGrueneberg神経節の切除によってアラームフェロモンによる忌避反応は消失する[53][54]53,54。これらの知見からGrueneberg神経節はアラームフェロモンの受容に関与していると考えられている。マセラ器には少数のORとGC-Dが発現している[55][56]55,56。マセラ器の嗅神経細胞の半数に発現するORであるSR1(MOR256-3)は他のORと比べ、匂い選択性が非常に低い。マセラ器はこのような選択性の低いORを持つことによって、外界の匂い変化を瞬時に察知するといった役割を果たすことが考えられている[57]57。
昆虫におけるフェロモン受容体
生物における初のフェロモンの分子実体の解明は約半世紀前に遡る。ブテナントがカイコガのメスから放たれるオス誘引因子であるボンビコールを単離した時に、「フェロモン」という用語が生まれた[58]58。昆虫のフェロモンは異性を誘引する性フェロモンの他にも、アリの道しるべフェロモンや警報フェロモンなども同定されている。昆虫ではフェロモン成分の同定が進んできた一方で、フェロモン受容の分子基盤が解明され始めたのはつい最近のことであり、2004年に昆虫におけるフェロモン受容は、一部の嗅覚受容体(OR)がその機能を果たすことがわかった[59][60]59,60。ここでは主に昆虫のフェロモン受容体としてのORについて概説する。
発見の経緯
昆虫の嗅覚受容体の発見
哺乳類のORが7回膜貫通型GPCRであることを受け、昆虫におけるORもGPCRであると予測され、遺伝子の探索がなされた。1999年にショウジョウバエの触角に特異的に発現するタンパク質のうち、7回膜貫通構造を予測するアルゴリズムを用いた解析や、ディファレンシャルスクリーニングによって嗅覚受容体遺伝子が同定された[61][62][63]61–63。その後、昆虫においても哺乳類と同様に、匂い分子と受容体は多対多の関係で認識していることなどが報告され、一般的な匂いの受容機構は明らかになった[64]64。
フェロモン受容体として機能するORの発見
昆虫のORが発見され、一般的な匂いの受容機構が明らかになりつつあった一方で、高感度と特異性が重要であるフェロモン受容体は未知であった。SakuraiらはカイコガBombyx moriの性フェロモンであるボンビコールに着目して昆虫におけるフェロモン受容の分子基盤の解明に迫った。ボンビコールはメスのカイコガから放たれ、オスに対して強い誘引と性行動促進を引き起こす性フェロモンである[58]58。2004年にSakuraiらは、ボンビコールがオスの触角に対して特異的に電気的応答を誘発することから、ディファレンシャルスクリーニング法によってオスの触角特異的に発現するBmOr1をボンビコールの受容体として同定した[59]59。アフリカツメガエル卵母細胞やメスの触角にBmOr1を発現させると、ボンビコールに対して電気的応答を示すことから、BmOr1がフェロモン受容体であることが証明された。
遺伝子の特徴と構造
昆虫ORは7回膜貫通型のタンパク質であるが、GPCRである脊椎動物のORとは膜トポロジーが異なり、N末端を細胞内側にとる構造をもつ[65][66]65,66。昆虫の嗅神経細胞は基本的に1細胞に1種類のOR遺伝子が発現している[67]67。一方、ORのうち昆虫間で広く保存されているOrco(Olfactory receptor co-receptor)遺伝子は、ほぼ全ての嗅神経細胞に発現し、ORの共役因子としての機能を果たす[68]68。嗅神経は一細胞あたりOrcoと他1種のOR遺伝子を発現している。
シグナル伝達
昆虫のORは、リガンドを結合するORと、共役因子であるOrcoがヘテロ複合体を形成し、リガンド作動性イオンチャネルとして機能している[69][70]69,70。ORに匂い分子が結合することで、ORとOrcoから形成されるポアが開口し、陽イオンが細胞内に流入することで活動電位が生じる。2012年にNakagwaらは点変異を導入したBmOr1とBmOrcoを解析し、OrとOrcoの複合体がポア構造を形成するために必要なアミノ酸部位を同定した[71]71。
一方で、Gタンパク質を介したシグナル伝達の可能性も報告されている。古くからガにおいてはORのシグナル伝達へのホスホリパーゼCβ2(PLCβ2)やGαqなどのタンパク質の関与が報告されてきた[72]72。昆虫のORがリガンド作動性イオンチャネルであることが報告された後にも、ショウジョウバエやタバコスズメガにおけるORのシグナル伝達ではPLCβ2やプロテインキナーゼC(PKC)が関与している例が報告されている[72][73][74]72–74。WicherらはGαsによるアデニル酸シクラーゼの活性化と、それに伴うcAMP濃度の上昇がORのシグナル伝達に関与することを報告している[70][75]70,75。以上の知見から、昆虫ORの細胞内シグナル伝達には、複数の機構が存在しているのではないかと考えられている。現在のところ、リガンド作動性イオンチャネルとしてのシグナル伝達が直接的な速い応答を引き起こし、Gタンパク質を介したシグナル伝達は遅いが好感度な応答を引き起こすのに関与していると考えられている[76]76。
上記のような細胞内シグナル伝達を経てフェロモンの情報は電気信号へと変換される。嗅神経細胞は軸索を一次中枢である触角葉へと投射し、糸球体構造を形成する[77][78][79]77–79。特に鱗翅目昆虫では特徴的な糸球体構造を有しており、フェロモン情報を処理する糸球体は大糸球体と呼ばれ、一般的な匂い情報を処理する常糸球体とは解剖学的に異なる[79]79。触角葉で処理されたフェロモン情報は、投射神経によりキノコ体と全大脳側部といった高次領域へと伝達される[78][80]78,80。
機能
ガ類ではメスが放出する性フェロモンが種特異的な配偶認識において重要な機能を果たす[81]81。ガにおけるフェロモン受容の特異性は、種固有の単一物質あるいは複数物質の組み合わせによって決定されている。単一物質がフェロモンとして機能する例として、カイコガのメスから放たれるボンビコールはBmOr1 に受容されオスを誘引する[59]59。アフリカツメガル卵母細胞においてBmOr1とBmOr2(BmOrco)を共発現させた場合、ボンビコールへの応答閾値が30 nMという高感度の応答閾値でボンビコールを感知することが示された[82]82。また、オスが放つボンビカールはBmOr3によって受容され、誘引効果や性行動を抑制する。BmOr1とBmOr3は異なる嗅覚神経細胞に相互排他的に発現し、それぞれが特異的にフェロモンを受容していることが示されている[82]82。 一方、複数物質の組み合わせおよび成分比がフェロモン受容の種特異性を担保する例として、アワノメイガ属(Ostrinia属)のメスが放つフェロモンがある。アワノメイガ属では6種のメスフェロモンが報告されているが、その成分と成分比は種によって異なる。Ostrinia属のアズキノメイガでは、(E)-11-テトラデセニルアセテートと(Z)-11-テトラデセニルアセテートが誘引性の性フェロモンとして機能し、その効果は(Z)-9-テトラデセニルアセテートによって抑制される。オスの触角に発現するOscaOr3は上記の3種類の物質に対して応答するが、OscaOr4は3種のうち(E)-11-テトラデセニルアセテートに特に強い応答を示し、かつ(Z)-9-テトラデセニルアセテートにより応答が抑制される応答特異性をもつ[83]83。
ガ以外の昆虫でのフェロモン受容の例として、キイロショウジョウバエのフェロモンである11-cis-vaccenyl acetate (cVA)はOr67dによって受容される。cVAはオスから放出され、オス間の攻撃行動や集合、性行動抑制などに関与している[84][85]84,85。一方、メスにおいては性行動を促進する効果をもつ[86][87]86,87。
関連項目
参考文献
- ↑ 1.0 1.1
Touhara, K., & Vosshall, L.B. (2009).
Sensing odorants and pheromones with chemosensory receptors. Annual review of physiology, 71, 307-32. [PubMed:19575682] [WorldCat] [DOI] - ↑ 2.0 2.1 2.2
Munger, S.D., Leinders-Zufall, T., & Zufall, F. (2009).
Subsystem organization of the mammalian sense of smell. Annual review of physiology, 71, 115-40. [PubMed:18808328] [WorldCat] [DOI] - ↑
Halpern, M. (1987).
The organization and function of the vomeronasal system. Annual review of neuroscience, 10, 325-62. [PubMed:3032065] [WorldCat] [DOI] - ↑
Zufall, F., & Leinders-Zufall, T. (2007).
Mammalian pheromone sensing. Current opinion in neurobiology, 17(4), 483-9. [PubMed:17709238] [WorldCat] [DOI] - ↑ 5.0 5.1
Yoshikawa, K., Nakagawa, H., Mori, N., Watanabe, H., & Touhara, K. (2013).
An unsaturated aliphatic alcohol as a natural ligand for a mouse odorant receptor. Nature chemical biology, 9(3), 160-2. [PubMed:23314914] [WorldCat] [DOI] - ↑ 6.0 6.1
Lin, D.Y., Zhang, S.Z., Block, E., & Katz, L.C. (2005).
Encoding social signals in the mouse main olfactory bulb. Nature, 434(7032), 470-7. [PubMed:15724148] [WorldCat] [DOI] - ↑ 7.0 7.1
Dulac, C., & Axel, R. (1995).
A novel family of genes encoding putative pheromone receptors in mammals. Cell, 83(2), 195-206. [PubMed:7585937] [WorldCat] [DOI] - ↑
Leinders-Zufall, T., Lane, A.P., Puche, A.C., Ma, W., Novotny, M.V., Shipley, M.T., & Zufall, F. (2000).
Ultrasensitive pheromone detection by mammalian vomeronasal neurons. Nature, 405(6788), 792-6. [PubMed:10866200] [WorldCat] [DOI] - ↑ 9.0 9.1
Boschat, C., Pélofi, C., Randin, O., Roppolo, D., Lüscher, C., Broillet, M.C., & Rodriguez, I. (2002).
Pheromone detection mediated by a V1r vomeronasal receptor. Nature neuroscience, 5(12), 1261-2. [PubMed:12436115] [WorldCat] [DOI] - ↑
Young, J.M., Massa, H.F., Hsu, L., & Trask, B.J. (2010).
Extreme variability among mammalian V1R gene families. Genome research, 20(1), 10-8. [PubMed:19952141] [PMC] [WorldCat] [DOI] - ↑
Roppolo, D., Vollery, S., Kan, C.D., Lüscher, C., Broillet, M.C., & Rodriguez, I. (2007).
Gene cluster lock after pheromone receptor gene choice. The EMBO journal, 26(14), 3423-30. [PubMed:17611603] [PMC] [WorldCat] [DOI] - ↑
Grus, W.E., Shi, P., Zhang, Y.P., & Zhang, J. (2005).
Dramatic variation of the vomeronasal pheromone receptor gene repertoire among five orders of placental and marsupial mammals. Proceedings of the National Academy of Sciences of the United States of America, 102(16), 5767-72. [PubMed:15790682] [PMC] [WorldCat] [DOI] - ↑
Lucas, P., Ukhanov, K., Leinders-Zufall, T., & Zufall, F. (2003).
A diacylglycerol-gated cation channel in vomeronasal neuron dendrites is impaired in TRPC2 mutant mice: mechanism of pheromone transduction. Neuron, 40(3), 551-61. [PubMed:14642279] [WorldCat] [DOI] - ↑
Spehr, M., Hatt, H., & Wetzel, C.H. (2002).
Arachidonic acid plays a role in rat vomeronasal signal transduction. The Journal of neuroscience : the official journal of the Society for Neuroscience, 22(19), 8429-37. [PubMed:12351717] [PMC] [WorldCat] - ↑
Zhang, P., Yang, C., & Delay, R.J. (2010).
Odors activate dual pathways, a TRPC2 and a AA-dependent pathway, in mouse vomeronasal neurons. American journal of physiology. Cell physiology, 298(5), C1253-64. [PubMed:20147653] [PMC] [WorldCat] [DOI] - ↑ 16.0 16.1
Dulac, C., & Wagner, S. (2006).
Genetic analysis of brain circuits underlying pheromone signaling. Annual review of genetics, 40, 449-67. [PubMed:16953793] [WorldCat] [DOI] - ↑ 17.0 17.1
Haga-Yamanaka, S., Ma, L., He, J., Qiu, Q., Lavis, L.D., Looger, L.L., & Yu, C.R. (2014).
Integrated action of pheromone signals in promoting courtship behavior in male mice. eLife, 3, e03025. [PubMed:25073926] [PMC] [WorldCat] [DOI] - ↑
Del Punta, K., Leinders-Zufall, T., Rodriguez, I., Jukam, D., Wysocki, C.J., Ogawa, S., ..., & Mombaerts, P. (2002).
Deficient pheromone responses in mice lacking a cluster of vomeronasal receptor genes. Nature, 419(6902), 70-4. [PubMed:12214233] [WorldCat] [DOI] - ↑ 19.0 19.1
Isogai, Y., Si, S., Pont-Lezica, L., Tan, T., Kapoor, V., Murthy, V.N., & Dulac, C. (2011).
Molecular organization of vomeronasal chemoreception. Nature, 478(7368), 241-5. [PubMed:21937988] [PMC] [WorldCat] [DOI] - ↑ 20.0 20.1
Herrada, G., & Dulac, C. (1997).
A novel family of putative pheromone receptors in mammals with a topographically organized and sexually dimorphic distribution. Cell, 90(4), 763-73. [PubMed:9288755] [WorldCat] [DOI] - ↑ 21.0 21.1
Ryba, N.J., & Tirindelli, R. (1997).
A new multigene family of putative pheromone receptors. Neuron, 19(2), 371-9. [PubMed:9292726] [WorldCat] [DOI] - ↑ 22.0 22.1
Matsunami, H., & Buck, L.B. (1997).
A multigene family encoding a diverse array of putative pheromone receptors in mammals. Cell, 90(4), 775-84. [PubMed:9288756] [WorldCat] [DOI] - ↑
Kimoto, H., Haga, S., Sato, K., & Touhara, K. (2005).
Sex-specific peptides from exocrine glands stimulate mouse vomeronasal sensory neurons. Nature, 437(7060), 898-901. [PubMed:16208374] [WorldCat] [DOI] - ↑ 24.0 24.1 24.2
Haga, S., Hattori, T., Sato, T., Sato, K., Matsuda, S., Kobayakawa, R., ..., & Touhara, K. (2010).
The male mouse pheromone ESP1 enhances female sexual receptive behaviour through a specific vomeronasal receptor. Nature, 466(7302), 118-22. [PubMed:20596023] [WorldCat] [DOI] - ↑
Young, J.M., & Trask, B.J. (2007).
V2R gene families degenerated in primates, dog and cow, but expanded in opossum. Trends in genetics : TIG, 23(5), 212-5. [PubMed:17382427] [WorldCat] [DOI] - ↑
Martini, S., Silvotti, L., Shirazi, A., Ryba, N.J., & Tirindelli, R. (2001).
Co-expression of putative pheromone receptors in the sensory neurons of the vomeronasal organ. The Journal of neuroscience : the official journal of the Society for Neuroscience, 21(3), 843-8. [PubMed:11157070] [PMC] [WorldCat] - ↑
Ishii, T., Hirota, J., & Mombaerts, P. (2003).
Combinatorial coexpression of neural and immune multigene families in mouse vomeronasal sensory neurons. Current biology : CB, 13(5), 394-400. [PubMed:12620187] [WorldCat] [DOI] - ↑
Loconto, J., Papes, F., Chang, E., Stowers, L., Jones, E.P., Takada, T., ..., & Dulac, C. (2003).
Functional expression of murine V2R pheromone receptors involves selective association with the M10 and M1 families of MHC class Ib molecules. Cell, 112(5), 607-18. [PubMed:12628182] [WorldCat] [DOI] - ↑ 29.0 29.1
Chamero, P., Marton, T.F., Logan, D.W., Flanagan, K., Cruz, J.R., Saghatelian, A., ..., & Stowers, L. (2007).
Identification of protein pheromones that promote aggressive behaviour. Nature, 450(7171), 899-902. [PubMed:18064011] [WorldCat] [DOI] - ↑
Kelliher, K.R., Spehr, M., Li, X.H., Zufall, F., & Leinders-Zufall, T. (2006).
Pheromonal recognition memory induced by TRPC2-independent vomeronasal sensing. The European journal of neuroscience, 23(12), 3385-90. [PubMed:16820028] [WorldCat] [DOI] - ↑
Hattori, T., Osakada, T., Matsumoto, A., Matsuo, N., Haga-Yamanaka, S., Nishida, T., ..., & Kikusui, T. (2016).
Self-Exposure to the Male Pheromone ESP1 Enhances Male Aggressiveness in Mice. Current biology : CB, 26(9), 1229-34. [PubMed:27151664] [WorldCat] [DOI] - ↑
Ishii, K.K., Osakada, T., Mori, H., Miyasaka, N., Yoshihara, Y., Miyamichi, K., & Touhara, K. (2017).
A Labeled-Line Neural Circuit for Pheromone-Mediated Sexual Behaviors in Mice. Neuron, 95(1), 123-137.e8. [PubMed:28648498] [WorldCat] [DOI] - ↑
Hattori, T., Osakada, T., Masaoka, T., Ooyama, R., Horio, N., Mogi, K., ..., & Kikusui, T. (2017).
Exocrine Gland-Secreting Peptide 1 Is a Key Chemosensory Signal Responsible for the Bruce Effect in Mice. Current biology : CB, 27(20), 3197-3201.e3. [PubMed:29033330] [WorldCat] [DOI] - ↑
Kaur, A.W., Ackels, T., Kuo, T.H., Cichy, A., Dey, S., Hays, C., ..., & Stowers, L. (2014).
Murine pheromone proteins constitute a context-dependent combinatorial code governing multiple social behaviors. Cell, 157(3), 676-88. [PubMed:24766811] [PMC] [WorldCat] [DOI] - ↑
Ferrero, D.M., Moeller, L.M., Osakada, T., Horio, N., Li, Q., Roy, D.S., ..., & Liberles, S.D. (2013).
A juvenile mouse pheromone inhibits sexual behaviour through the vomeronasal system. Nature, 502(7471), 368-71. [PubMed:24089208] [PMC] [WorldCat] [DOI] - ↑
Papes, F., Logan, D.W., & Stowers, L. (2010).
The vomeronasal organ mediates interspecies defensive behaviors through detection of protein pheromone homologs. Cell, 141(4), 692-703. [PubMed:20478258] [PMC] [WorldCat] [DOI] - ↑
Buck, L., & Axel, R. (1991).
A novel multigene family may encode odorant receptors: a molecular basis for odor recognition. Cell, 65(1), 175-87. [PubMed:1840504] [WorldCat] [DOI] - ↑
Zhao, H., Ivic, L., Otaki, J.M., Hashimoto, M., Mikoshiba, K., & Firestein, S. (1998).
Functional expression of a mammalian odorant receptor. Science (New York, N.Y.), 279(5348), 237-42. [PubMed:9422698] [WorldCat] [DOI] - ↑
Touhara, K., Sengoku, S., Inaki, K., Tsuboi, A., Hirono, J., Sato, T., ..., & Haga, T. (1999).
Functional identification and reconstitution of an odorant receptor in single olfactory neurons. Proceedings of the National Academy of Sciences of the United States of America, 96(7), 4040-5. [PubMed:10097159] [PMC] [WorldCat] [DOI] - ↑
Niimura, Y. (2012).
Olfactory receptor multigene family in vertebrates: from the viewpoint of evolutionary genomics. Current genomics, 13(2), 103-14. [PubMed:23024602] [PMC] [WorldCat] [DOI] - ↑
Mori, K., & Sakano, H. (2011).
How is the olfactory map formed and interpreted in the mammalian brain? Annual review of neuroscience, 34, 467-99. [PubMed:21469960] [WorldCat] [DOI] - ↑
Katada, S., Hirokawa, T., Oka, Y., Suwa, M., & Touhara, K. (2005).
Structural basis for a broad but selective ligand spectrum of a mouse olfactory receptor: mapping the odorant-binding site. The Journal of neuroscience : the official journal of the Society for Neuroscience, 25(7), 1806-15. [PubMed:15716417] [PMC] [WorldCat] [DOI] - ↑
Abaffy, T., Malhotra, A., & Luetje, C.W. (2007).
The molecular basis for ligand specificity in a mouse olfactory receptor: a network of functionally important residues. The Journal of biological chemistry, 282(2), 1216-24. [PubMed:17114180] [WorldCat] [DOI] - ↑
Duan, X., Block, E., Li, Z., Connelly, T., Zhang, J., Huang, Z., ..., & Zhuang, H. (2012).
Crucial role of copper in detection of metal-coordinating odorants. Proceedings of the National Academy of Sciences of the United States of America, 109(9), 3492-7. [PubMed:22328155] [PMC] [WorldCat] [DOI] - ↑
Li, Q., Korzan, W.J., Ferrero, D.M., Chang, R.B., Roy, D.S., Buchi, M., ..., & Liberles, S.D. (2013).
Synchronous evolution of an odor biosynthesis pathway and behavioral response. Current biology : CB, 23(1), 11-20. [PubMed:23177478] [PMC] [WorldCat] [DOI] - ↑
Hu, J., Zhong, C., Ding, C., Chi, Q., Walz, A., Mombaerts, P., ..., & Luo, M. (2007).
Detection of near-atmospheric concentrations of CO2 by an olfactory subsystem in the mouse. Science (New York, N.Y.), 317(5840), 953-7. [PubMed:17702944] [WorldCat] [DOI] - ↑
Munger, S.D., Leinders-Zufall, T., McDougall, L.M., Cockerham, R.E., Schmid, A., Wandernoth, P., ..., & Kelliher, K.R. (2010).
An olfactory subsystem that detects carbon disulfide and mediates food-related social learning. Current biology : CB, 20(16), 1438-44. [PubMed:20637621] [PMC] [WorldCat] [DOI] - ↑
Leinders-Zufall, T., Cockerham, R.E., Michalakis, S., Biel, M., Garbers, D.L., Reed, R.R., ..., & Munger, S.D. (2007).
Contribution of the receptor guanylyl cyclase GC-D to chemosensory function in the olfactory epithelium. Proceedings of the National Academy of Sciences of the United States of America, 104(36), 14507-12. [PubMed:17724338] [PMC] [WorldCat] [DOI] - ↑
Greer, P.L., Bear, D.M., Lassance, J.M., Bloom, M.L., Tsukahara, T., Pashkovski, S.L., ..., & Datta, S.R. (2016).
A Family of non-GPCR Chemosensors Defines an Alternative Logic for Mammalian Olfaction. Cell, 165(7), 1734-1748. [PubMed:27238024] [PMC] [WorldCat] [DOI] - ↑
Fleischer, J., Schwarzenbacher, K., Besser, S., Hass, N., & Breer, H. (2006).
Olfactory receptors and signalling elements in the Grueneberg ganglion. Journal of neurochemistry, 98(2), 543-54. [PubMed:16805845] [WorldCat] [DOI] - ↑
Fleischer, J., Schwarzenbacher, K., & Breer, H. (2007).
Expression of trace amine-associated receptors in the Grueneberg ganglion. Chemical senses, 32(6), 623-31. [PubMed:17556730] [WorldCat] [DOI] - ↑
Storan, M.J., & Key, B. (2006).
Septal organ of Grüneberg is part of the olfactory system. The Journal of comparative neurology, 494(5), 834-44. [PubMed:16374816] [WorldCat] [DOI] - ↑
Brechbühl, J., Klaey, M., & Broillet, M.C. (2008).
Grueneberg ganglion cells mediate alarm pheromone detection in mice. Science (New York, N.Y.), 321(5892), 1092-5. [PubMed:18719286] [WorldCat] [DOI] - ↑
Brechbühl, J., Moine, F., Klaey, M., Nenniger-Tosato, M., Hurni, N., Sporkert, F., ..., & Broillet, M.C. (2013).
Mouse alarm pheromone shares structural similarity with predator scents. Proceedings of the National Academy of Sciences of the United States of America, 110(12), 4762-7. [PubMed:23487748] [PMC] [WorldCat] [DOI] - ↑
Tian, H., & Ma, M. (2004).
Molecular organization of the olfactory septal organ. The Journal of neuroscience : the official journal of the Society for Neuroscience, 24(38), 8383-90. [PubMed:15385621] [PMC] [WorldCat] [DOI] - ↑
Ma, M., Grosmaitre, X., Iwema, C.L., Baker, H., Greer, C.A., & Shepherd, G.M. (2003).
Olfactory signal transduction in the mouse septal organ. The Journal of neuroscience : the official journal of the Society for Neuroscience, 23(1), 317-24. [PubMed:12514230] [PMC] [WorldCat] - ↑
Grosmaitre, X., Fuss, S.H., Lee, A.C., Adipietro, K.A., Matsunami, H., Mombaerts, P., & Ma, M. (2009).
SR1, a mouse odorant receptor with an unusually broad response profile. The Journal of neuroscience : the official journal of the Society for Neuroscience, 29(46), 14545-52. [PubMed:19923288] [PMC] [WorldCat] [DOI] - ↑ 58.0 58.1 Butenandt A, Beckmann R, Hecker E
Über den Sexuallockstoff des Seidenspinners, I: Der biologische Test und die Isolierung des reinen Sexuallockstoffes Bombykol.
Hoppe Seylers Z Physiol Chem.: 1961,324(1);71-83. - ↑ 59.0 59.1 59.2
Sakurai, T., Nakagawa, T., Mitsuno, H., Mori, H., Endo, Y., Tanoue, S., ..., & Nishioka, T. (2004).
Identification and functional characterization of a sex pheromone receptor in the silkmoth Bombyx mori. Proceedings of the National Academy of Sciences of the United States of America, 101(47), 16653-8. [PubMed:15545611] [PMC] [WorldCat] [DOI] - ↑
Leal, W.S. (2013).
Odorant reception in insects: roles of receptors, binding proteins, and degrading enzymes. Annual review of entomology, 58, 373-91. [PubMed:23020622] [WorldCat] [DOI] - ↑
Gao, Q., & Chess, A. (1999).
Identification of candidate Drosophila olfactory receptors from genomic DNA sequence. Genomics, 60(1), 31-9. [PubMed:10458908] [WorldCat] [DOI] - ↑
Clyne, P.J., Warr, C.G., Freeman, M.R., Lessing, D., Kim, J., & Carlson, J.R. (1999).
A novel family of divergent seven-transmembrane proteins: candidate odorant receptors in Drosophila. Neuron, 22(2), 327-38. [PubMed:10069338] [WorldCat] [DOI] - ↑
Vosshall, L.B., Amrein, H., Morozov, P.S., Rzhetsky, A., & Axel, R. (1999).
A spatial map of olfactory receptor expression in the Drosophila antenna. Cell, 96(5), 725-36. [PubMed:10089887] [WorldCat] [DOI] - ↑
Hallem, E.A., & Carlson, J.R. (2006).
Coding of odors by a receptor repertoire. Cell, 125(1), 143-60. [PubMed:16615896] [WorldCat] [DOI] - ↑
Benton, R., Sachse, S., Michnick, S.W., & Vosshall, L.B. (2006).
Atypical membrane topology and heteromeric function of Drosophila odorant receptors in vivo. PLoS biology, 4(2), e20. [PubMed:16402857] [PMC] [WorldCat] [DOI] - ↑
Hopf, T.A., Morinaga, S., Ihara, S., Touhara, K., Marks, D.S., & Benton, R. (2015).
Amino acid coevolution reveals three-dimensional structure and functional domains of insect odorant receptors. Nature communications, 6, 6077. [PubMed:25584517] [PMC] [WorldCat] [DOI] - ↑
Couto, A., Alenius, M., & Dickson, B.J. (2005).
Molecular, anatomical, and functional organization of the Drosophila olfactory system. Current biology : CB, 15(17), 1535-47. [PubMed:16139208] [WorldCat] [DOI] - ↑
Larsson, M.C., Domingos, A.I., Jones, W.D., Chiappe, M.E., Amrein, H., & Vosshall, L.B. (2004).
Or83b encodes a broadly expressed odorant receptor essential for Drosophila olfaction. Neuron, 43(5), 703-14. [PubMed:15339651] [WorldCat] [DOI] - ↑
Sato, K., Pellegrino, M., Nakagawa, T., Nakagawa, T., Vosshall, L.B., & Touhara, K. (2008).
Insect olfactory receptors are heteromeric ligand-gated ion channels. Nature, 452(7190), 1002-6. [PubMed:18408712] [WorldCat] [DOI] - ↑ 70.0 70.1
Wicher, D., Schäfer, R., Bauernfeind, R., Stensmyr, M.C., Heller, R., Heinemann, S.H., & Hansson, B.S. (2008).
Drosophila odorant receptors are both ligand-gated and cyclic-nucleotide-activated cation channels. Nature, 452(7190), 1007-11. [PubMed:18408711] [WorldCat] [DOI] - ↑
Nakagawa, T., Pellegrino, M., Sato, K., Vosshall, L.B., & Touhara, K. (2012).
Amino acid residues contributing to function of the heteromeric insect olfactory receptor complex. PloS one, 7(3), e32372. [PubMed:22403649] [PMC] [WorldCat] [DOI] - ↑ 72.0 72.1
Stengl, M. (2010).
Pheromone transduction in moths. Frontiers in cellular neuroscience, 4, 133. [PubMed:21228914] [PMC] [WorldCat] [DOI] - ↑
Wicher, D., Morinaga, S., Halty-deLeon, L., Funk, N., Hansson, B., Touhara, K., & Stengl, M. (2017).
Identification and characterization of the bombykal receptor in the hawkmoth Manduca sexta. The Journal of experimental biology, 220(Pt 10), 1781-1786. [PubMed:28254882] [WorldCat] [DOI] - ↑
Sargsyan, V., Getahun, M.N., Llanos, S.L., Olsson, S.B., Hansson, B.S., & Wicher, D. (2011).
Phosphorylation via PKC Regulates the Function of the Drosophila Odorant Co-Receptor. Frontiers in cellular neuroscience, 5, 5. [PubMed:21720521] [PMC] [WorldCat] [DOI] - ↑
Miazzi, F., Hansson, B.S., & Wicher, D. (2016).
Odor-induced cAMP production in Drosophila melanogaster olfactory sensory neurons. The Journal of experimental biology, 219(Pt 12), 1798-803. [PubMed:27045092] [WorldCat] [DOI] - ↑
Nakagawa, T., & Vosshall, L.B. (2009).
Controversy and consensus: noncanonical signaling mechanisms in the insect olfactory system. Current opinion in neurobiology, 19(3), 284-92. [PubMed:19660933] [PMC] [WorldCat] [DOI] - ↑
Ramdya, P., & Benton, R. (2010).
Evolving olfactory systems on the fly. Trends in genetics : TIG, 26(7), 307-16. [PubMed:20537755] [WorldCat] [DOI] - ↑ 78.0 78.1
Kohl, J., Huoviala, P., & Jefferis, G.S. (2015).
Pheromone processing in Drosophila. Current opinion in neurobiology, 34, 149-57. [PubMed:26143522] [PMC] [WorldCat] [DOI] - ↑ 79.0 79.1
Hansson, B.S., Ljungberg, H., Hallberg, E., & Löfstedt, C. (1992).
Functional specialization of olfactory glomeruli in a moth. Science (New York, N.Y.), 256(5061), 1313-5. [PubMed:1598574] [WorldCat] [DOI] - ↑
Seki, Y., Aonuma, H., & Kanzaki, R. (2005).
Pheromone processing center in the protocerebrum of Bombyx mori revealed by nitric oxide-induced anti-cGMP immunocytochemistry. The Journal of comparative neurology, 481(4), 340-51. [PubMed:15593336] [WorldCat] [DOI] - ↑
Zhang, J., Walker, W.B., & Wang, G. (2015).
Pheromone reception in moths: from molecules to behaviors. Progress in molecular biology and translational science, 130, 109-28. [PubMed:25623339] [WorldCat] [DOI] - ↑ 82.0 82.1
Nakagawa, T., Sakurai, T., Nishioka, T., & Touhara, K. (2005).
Insect sex-pheromone signals mediated by specific combinations of olfactory receptors. Science (New York, N.Y.), 307(5715), 1638-42. [PubMed:15692016] [WorldCat] [DOI] - ↑
Miura, N., Nakagawa, T., Touhara, K., & Ishikawa, Y. (2010).
Broadly and narrowly tuned odorant receptors are involved in female sex pheromone reception in Ostrinia moths. Insect biochemistry and molecular biology, 40(1), 64-73. [PubMed:20044000] [WorldCat] [DOI] - ↑
Wang, L., & Anderson, D.J. (2010).
Identification of an aggression-promoting pheromone and its receptor neurons in Drosophila. Nature, 463(7278), 227-31. [PubMed:19966787] [PMC] [WorldCat] [DOI] - ↑
Xu, P., Atkinson, R., Jones, D.N., & Smith, D.P. (2005).
Drosophila OBP LUSH is required for activity of pheromone-sensitive neurons. Neuron, 45(2), 193-200. [PubMed:15664171] [WorldCat] [DOI] - ↑
Kurtovic, A., Widmer, A., & Dickson, B.J. (2007).
A single class of olfactory neurons mediates behavioural responses to a Drosophila sex pheromone. Nature, 446(7135), 542-6. [PubMed:17392786] [WorldCat] [DOI] - ↑
Ejima, A., Smith, B.P., Lucas, C., van der Goes van Naters, W., Miller, C.J., Carlson, J.R., ..., & Griffith, L.C. (2007).
Generalization of courtship learning in Drosophila is mediated by cis-vaccenyl acetate. Current biology : CB, 17(7), 599-605. [PubMed:17363250] [PMC] [WorldCat] [DOI]