「マイクロカラム」の版間の差分
Junko kurahashi (トーク | 投稿記録) 細編集の要約なし |
細 (→構造) |
||
| (同じ利用者による、間の9版が非表示) | |||
| 2行目: | 2行目: | ||
<font size="+1">[https://researchmap.jp/hosoya 細谷俊彦]</font><br> | <font size="+1">[https://researchmap.jp/hosoya 細谷俊彦]</font><br> | ||
''理化学研究所脳神経科学研究センター 局所神経回路研究チーム''<br> | ''理化学研究所脳神経科学研究センター 局所神経回路研究チーム''<br> | ||
DOI:<selfdoi /> | DOI:<selfdoi /> 原稿受付日:2018年9月29日 原稿完成日:2018年10月15日<br> | ||
担当編集委員:[https://researchmap.jp/masahikowatanabeo 渡辺 雅彦] (北海道大学大学院医学研究院 解剖学分野 解剖発生学教室)<br> | 担当編集委員:[https://researchmap.jp/masahikowatanabeo 渡辺 雅彦] (北海道大学大学院医学研究院 解剖学分野 解剖発生学教室)<br> | ||
</div> | </div> | ||
英語名:microcolumn | |||
{{box|text= 大脳皮質第5層では、主要なタイプの神経細胞が細胞タイプ特異的な細い柱状のクラスター(マイクロカラム)を形成している。マイクロカラムは皮質に沿って六方格子状に並び、様々な皮質領野に共通に存在する。個々のマイクロカラムの細胞は特異的な神経回路を持ち類似した神経活動を示す。これらは第5層の回路がマイクロカラムを単位とした繰り返し構造をもつことを示し、多数のマイクロカラムによる並列処理が多様な皮質機能を担う可能性を示唆する。}} | {{box|text= 大脳皮質第5層では、主要なタイプの神経細胞が細胞タイプ特異的な細い柱状のクラスター(マイクロカラム)を形成している。マイクロカラムは皮質に沿って六方格子状に並び、様々な皮質領野に共通に存在する。個々のマイクロカラムの細胞は特異的な神経回路を持ち類似した神経活動を示す。これらは第5層の回路がマイクロカラムを単位とした繰り返し構造をもつことを示し、多数のマイクロカラムによる並列処理が多様な皮質機能を担う可能性を示唆する。}} | ||
== 歴史 == | == 歴史 == | ||
[[大脳皮質]]の回路は様々なタイプの[[興奮性神経細胞]]と[[抑制性神経細胞]]から形成されている。古くから、少数の神経細胞が基本的な単位回路を形成し、これが多数繰り返されている可能性が提唱されていた<ref>'''Lorente de Nó R.'''<br>Architectonics and structure of the cerebral cortex.<br>''Physiology of the Nervous System. Oxford University Press, 291-327'':1938 [https://bsd.neuroinf.jp/wiki/ファイル:Lorente_De_No_1938.pdf PDF] </ref><ref><pubmed> 9153131 </pubmed></ref>。単位回路の候補としてさまざまな仮説が提案されたが、その構造や機能については議論が続いておりコンセンサスは確立していなかった<ref><pubmed>20640245</pubmed></ref><ref><pubmed>15365664 </pubmed></ref><ref name=Horton2005><pubmed> 15937015 </pubmed></ref><ref><pubmed>18715998 </pubmed></ref><ref><pubmed>25359953</pubmed></ref><ref><pubmed>29905901 </pubmed></ref> | [[ファイル:Hosoya new Fig1.jpg|300px|サムネイル|'''図1. 細胞タイプ特異的な第5層マイクロカラム'''<br>生後6日のマウス視覚野。(マゼンタ) TOTO3 により全ての細胞の核が可視化されている。(緑) id2 mRNA染色による皮質下投射細胞(SCPN)の細胞体の可視化。左と右は同一視野。<br>(左)核染色のみでは構造は見られない。<br>(右)SCPNはマイクロカラムを形成し、他の種類の細胞に挟まれている。<br>文献<ref name=Maruoka2011/>より。]] | ||
[[ファイル:Hosoya new Fig2.jpg|サムネイル|'''図2. マイクロカラムの3次元構造'''<br>'''A''':成体マウスの脳橋への逆行性蛍光色素注入によりに皮質下投射細胞(SCPN)が可視化されている。マイクロカラム構造が見られる。<br>'''B''':SCPNマイクロカラムを上面から見た図。六方格子状の配置が見られる。縦軸が前後方向。青点は推定されたマイクロカラム中心。色付きの線は推定された格子構造。<br>'''C''':模式図。SCPNマイクロカラムとCPNマイクロカラムは互い違いに並ぶ。パルブアルブミン(PV)細胞とソマトスタチン(SOM)細胞はSCPNマイクロカラムと並んで配置するが、CPNマイクロカラムとは並ばない。<br>文献<ref name=Maruoka2017/>より。]] | |||
[[ファイル:Hosoya new Fig3.jpg|サムネイル|'''図3. マイクロカラムの回路と機能'''<br> | |||
'''A''': 同一マイクロカラム内の皮質下投射細胞(SCPN)は同じ細胞からのシナプス入力(青)を受ける傾向があり、同期した活動を示す(赤)。 | |||
'''B, C''': 同一マイクロカラム内のSCPNは方位選択性(B)および眼優位性(C)が似ている。<br>文献<ref name=Maruoka2017/>より。]] | |||
[[ファイル:Hosoya new Fig4.jpg|サムネイル|'''図4. マイクロカラムの発生'''<br> | |||
'''A''':個々のマイクロカラムは発生上近縁でない細胞から形成される。<br> | |||
'''B''': 幼若期にマイクロカラムは細胞タイプ特異的なギャップ結合を持つ。<br> | |||
'''C''': ギャップ結合は成体になるまでに失われる。<br>文献<ref name=Maruoka2011/><ref name=Maruoka2017/>より。]] | |||
[[大脳皮質]]の回路は様々なタイプの[[興奮性神経細胞]]と[[抑制性神経細胞]]から形成されている。古くから、少数の神経細胞が基本的な単位回路を形成し、これが多数繰り返されている可能性が提唱されていた<ref>'''Lorente de Nó R.'''<br>Architectonics and structure of the cerebral cortex.<br>''Physiology of the Nervous System. Oxford University Press, 291-327'':1938 [https://bsd.neuroinf.jp/wiki/ファイル:Lorente_De_No_1938.pdf PDF] </ref><ref><pubmed> 9153131 </pubmed></ref>。単位回路の候補としてさまざまな仮説が提案されたが、その構造や機能については議論が続いておりコンセンサスは確立していなかった<ref><pubmed>20640245</pubmed></ref><ref><pubmed>15365664 </pubmed></ref><ref name=Horton2005><pubmed> 15937015 </pubmed></ref><ref><pubmed>18715998 </pubmed></ref><ref><pubmed>25359953</pubmed></ref><ref><pubmed>29905901 </pubmed></ref>。ネコやサルの視覚野でみられる[[眼優位性カラム]]や[[方位選択性カラム]]などは特定の皮質領野のみに限られその回路・機能とも不明な点が多く、大脳皮質の普遍的な単位回路ではないと考えられている<ref name=Horton2005/>。 | |||
== 構造 == | == 構造 == | ||
大脳皮質第5層の二種類の主要な興奮性細胞のうちの一種は[[皮質下投射細胞]](subcortical projection neurons, SCPNs)と呼ばれ、[[脊髄]]、[[上丘]]、[[橋]]などへ長い[[軸索]]を伸ばし大脳皮質からの主要な出力経路を形成する<ref name=Greig2013><pubmed>24105342</pubmed></ref>。皮質下投射細胞は広範な皮質領野に存在しており、例えば[[運動野]]の皮質下投射細胞は[[上位運動ニューロン]]として[[皮質脊髄路]]を形成している。 | 大脳皮質第5層の二種類の主要な興奮性細胞のうちの一種は[[皮質下投射細胞]](subcortical projection neurons, SCPNs)と呼ばれ、[[脊髄]]、[[上丘]]、[[橋]]などへ長い[[軸索]]を伸ばし大脳皮質からの主要な出力経路を形成する<ref name=Greig2013><pubmed>24105342</pubmed></ref>。皮質下投射細胞は広範な皮質領野に存在しており、例えば[[運動野]]の皮質下投射細胞は[[上位運動ニューロン]]として[[皮質脊髄路]]を形成している。 | ||
皮質下投射細胞は幅1–2細胞、高さ数細胞程度の細長いクラスター(SCPNマイクロカラム)を形成する<ref name=Maruoka2011><pubmed>22171052 </pubmed></ref><ref name=Kwan2012><pubmed>22579290 </pubmed></ref><ref name=Maruoka2017><pubmed> 29097542 </pubmed></ref>('''図1''')。皮質に沿って多数の皮質下投射細胞マイクロカラムが周期的に配置し、ハニカム状の六方格子配列をとっている<ref name=Maruoka2017/>。このような皮質下投射細胞マイクロカラムはマウスの[[視覚野]]、[[体性感覚野]]、運動野<ref name=Maruoka2011/><ref name=Maruoka2017/>や[[wj:ヒト|ヒト]][[ | 皮質下投射細胞は幅1–2細胞、高さ数細胞程度の細長いクラスター(SCPNマイクロカラム)を形成する<ref name=Maruoka2011><pubmed>22171052 </pubmed></ref><ref name=Kwan2012><pubmed>22579290 </pubmed></ref><ref name=Maruoka2017><pubmed> 29097542 </pubmed></ref>('''図1, 2A''')。皮質に沿って多数の皮質下投射細胞マイクロカラムが周期的に配置し、ハニカム状の六方格子配列をとっている<ref name=Maruoka2017/>('''図2B''')。このような皮質下投射細胞マイクロカラムはマウスの[[視覚野]]、[[体性感覚野]]、運動野<ref name=Maruoka2011/><ref name=Maruoka2017/>や[[wj:ヒト|ヒト]][[運動性言語野]]<ref name=Kwan2012/>で共通にみられ、いずれもよく似た構造を持つ。 | ||
第5層のもう一種の興奮性細胞である皮質投射細胞(cortical projection neuron, CPNs)は、同側や対側の大脳皮質に軸索を投射し中継経路を形成している<ref name=Greig2013/>。これらの皮質投射細胞もマイクロカラム(CPNマイクロカラム)を形成し、SCPNマイクロカラムと互い違いに並んでいる(''' | 第5層のもう一種の興奮性細胞である皮質投射細胞(cortical projection neuron, CPNs)は、同側や対側の大脳皮質に軸索を投射し中継経路を形成している<ref name=Greig2013/>。これらの皮質投射細胞もマイクロカラム(CPNマイクロカラム)を形成し、SCPNマイクロカラムと互い違いに並んでいる<ref name=Maruoka2017/>('''図2C''')。 | ||
第5層にはさらに[[パルブアルブミン]]発現細胞(PV細胞)および[[ソマトスタチン]]発現細胞(SOM細胞)の2種の主要な抑制性細胞があり<ref><pubmed>23303934 </pubmed></ref> | 第5層にはさらに[[パルブアルブミン]]発現細胞(PV細胞)および[[ソマトスタチン]]発現細胞(SOM細胞)の2種の主要な抑制性細胞があり<ref><pubmed>23303934 </pubmed></ref>近傍の皮質細胞を抑制している。この2種の抑制性細胞のいずれもSCPNマイクロカラムに含まれるように配置しているが、CPNマイクロカラムとはほぼ無関係に配置している<ref name=Maruoka2017/>('''図2C''')。 | ||
従って、第5層においてはすべての主要な細胞タイプが、細胞タイプ特異的なマイクロカラムとその格子構造に組織化されている。 | 従って、第5層においてはすべての主要な細胞タイプが、細胞タイプ特異的なマイクロカラムとその格子構造に組織化されている。 | ||
== 回路と神経活動 == | == 回路と神経活動 == | ||
[[マウス]]脳内[[Ca2+イメージング|Ca<sup>2+</sup>イメージング]]によって、同一のマイクロカラムに含まれる細胞は同期した神経活動を示し、活動の時間パターンが似ていることが明らかとなった<ref name=Maruoka2017/>。この同期活動は、視覚野、体性感覚野、運動野のSCPNマイクロカラムで共通にみられた。 | [[マウス]]脳内[[Ca2+イメージング|Ca<sup>2+</sup>イメージング]]によって、同一のマイクロカラムに含まれる細胞は同期した神経活動を示し、活動の時間パターンが似ていることが明らかとなった<ref name=Maruoka2017/>('''図3A''')。この同期活動は、視覚野、体性感覚野、運動野のSCPNマイクロカラムで共通にみられた。 | ||
[[第一次視覚野]]の細胞は特定の傾き(方位)をもった線分に選択的に応答し([[方位選択性]])、また左右の眼への選択性([[眼優位性]])がさまざまに異なることが知られている。マウス第一次視覚野における解析により、同一マイクロカラム内の細胞は方位選択性と眼優位性のいずれもが似ていることが明らかとなった<ref name=Maruoka2011/><ref name=Maruoka2017/>。 | [[第一次視覚野]]の細胞は特定の傾き(方位)をもった線分に選択的に応答し([[方位選択性]])、また左右の眼への選択性([[眼優位性]])がさまざまに異なることが知られている。マウス第一次視覚野における解析により、同一マイクロカラム内の細胞は方位選択性と眼優位性のいずれもが似ていることが明らかとなった<ref name=Maruoka2011/><ref name=Maruoka2017/>('''図3B,C''')。 | ||
また、電気生理学的な解析から、同じマイクロカラムに含まれる神経細胞は同一の神経細胞からのシナプス入力を受けていることが示唆され<ref name=Maruoka2017/>、この入力が同期活動や刺激選択性の類似をもたらしている可能性が示された。以上より、個々のマイクロカラムはそれぞれ特定の情報を処理し、幅広い脳領野の共通な機能単位として動作していることが示唆された。 | また、電気生理学的な解析から、同じマイクロカラムに含まれる神経細胞は同一の神経細胞からのシナプス入力を受けていることが示唆され<ref name=Maruoka2017/>('''図3A''')、この入力が同期活動や刺激選択性の類似をもたらしている可能性が示された。以上より、個々のマイクロカラムはそれぞれ特定の情報を処理し、幅広い脳領野の共通な機能単位として動作していることが示唆された。 | ||
== 発生 == | == 発生 == | ||
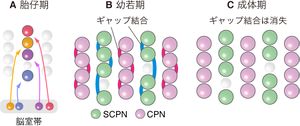
大脳皮質の発生においては、興奮性細胞は皮質の脳室側で[[放射状グリア]]の不等分裂によって産み出され、脳表の方向へ放射状に移動し最終的な位置に配置する。この際、同一あるいは発生上近縁の放射状グリアから産み出された興奮性神経細胞(発生上近縁な興奮性神経細胞)は柱状に並ぶ傾向がある。一方、個々のマイクロカラムを構成する細胞は発生上近縁ではないことが示されている<ref name=Maruoka2011/> | 大脳皮質の発生においては、興奮性細胞は皮質の脳室側で[[放射状グリア]]の不等分裂によって産み出され、脳表の方向へ放射状に移動し最終的な位置に配置する。この際、同一あるいは発生上近縁の放射状グリアから産み出された興奮性神経細胞(発生上近縁な興奮性神経細胞)は柱状に並ぶ傾向がある。一方、個々のマイクロカラムを構成する細胞は発生上近縁ではないことが示されている<ref name=Maruoka2011/>ため('''図4A''')、発生上近縁な細胞が並ぶというモデルではマイクロカラムの形成は説明できないと考えられる。 | ||
マイクロカラムはマウスでは遅くとも生後6–7日には観察される。この時期にはまだ[[化学シナプス]]は皮質内には少ない。一方、この時期に、近傍にある皮質下投射細胞と皮質下投射細胞の間および皮質投射細胞と皮質投射細胞の間はそれぞれ50%以上の確率で[[ギャップ結合]]により結合している<ref name=Maruoka2017/>。このギャップ結合は縦に並んだ細胞で高い強度を示し、同一マイクロカラム内の細胞を強く結合していることが示唆されている。一方、皮質下投射細胞と皮質投射細胞の間にはギャップ結合はほとんど見られない<ref name=Maruoka2017/>。皮質下投射細胞間、皮質投射細胞間のいずれのギャップ結合も皮質回路が概ね完成する生後14日頃までには完全に消失する<ref name=Maruoka2017/>。 | マイクロカラムはマウスでは遅くとも生後6–7日には観察される。この時期にはまだ[[化学シナプス]]は皮質内には少ない。一方、この時期に、近傍にある皮質下投射細胞と皮質下投射細胞の間および皮質投射細胞と皮質投射細胞の間はそれぞれ50%以上の確率で[[ギャップ結合]]により結合している<ref name=Maruoka2017/>('''図4B''')。このギャップ結合は縦に並んだ細胞で高い強度を示し、同一マイクロカラム内の細胞を強く結合していることが示唆されている。一方、皮質下投射細胞と皮質投射細胞の間にはギャップ結合はほとんど見られない<ref name=Maruoka2017/>。皮質下投射細胞間、皮質投射細胞間のいずれのギャップ結合も皮質回路が概ね完成する生後14日頃までには完全に消失する<ref name=Maruoka2017/>('''図4C''')。 | ||
以上より、マイクロカラムは発生上近縁でない細胞が配置することにより形成され、一時的にギャップ結合で結合することが明らかとなった。このギャップ結合は皮質回路が形成される時期に存在するため、マイクロカラム特異的な神経回路の形成を誘導している可能性がある。 | 以上より、マイクロカラムは発生上近縁でない細胞が配置することにより形成され、一時的にギャップ結合で結合することが明らかとなった。このギャップ結合は皮質回路が形成される時期に存在するため、マイクロカラム特異的な神経回路の形成を誘導している可能性がある。 | ||
| 46行目: | 53行目: | ||
マイクロカラムは発生上近縁でない細胞から形成されている<ref name=Maruoka2011/>。一方、発生上近縁な興奮性細胞は、マイクロカラムでギャップ結合が見られる時期より早い時期に一過的にギャップ結合を持つことが知られている<ref name=Yu2012><pubmed>22678291 </pubmed></ref>。発生上近縁な興奮性細胞は後に相互にシナプス結合し類似した視覚応答特性を示す<ref name=Yu2012/><ref><pubmed>22794261 </pubmed></ref><ref><pubmed>22678292</pubmed></ref>。従って、発生上近縁でない細胞からなるマイクロカラムと、発生上近縁な細胞からなる回路の両方が存在し異なる機能を担っている可能性がある。 | マイクロカラムは発生上近縁でない細胞から形成されている<ref name=Maruoka2011/>。一方、発生上近縁な興奮性細胞は、マイクロカラムでギャップ結合が見られる時期より早い時期に一過的にギャップ結合を持つことが知られている<ref name=Yu2012><pubmed>22678291 </pubmed></ref>。発生上近縁な興奮性細胞は後に相互にシナプス結合し類似した視覚応答特性を示す<ref name=Yu2012/><ref><pubmed>22794261 </pubmed></ref><ref><pubmed>22678292</pubmed></ref>。従って、発生上近縁でない細胞からなるマイクロカラムと、発生上近縁な細胞からなる回路の両方が存在し異なる機能を担っている可能性がある。 | ||
[[ネコ]]や[[サル]] | [[ネコ]]や[[サル]]の視覚野には眼優位性あるいは方位選択性の類似した細胞からなるカラム状のクラスターが存在し、それぞれ眼優位性カラムおよび方位選択性カラムと呼ばれている。眼優位性カラムの幅は細胞数十個分ほどでありマイクロカラムよりはるかに大きい。また、隣り合った方位選択性カラムが応答する刺激方位は似ているが、隣り合ったマイクロカラムが応答する刺激方位は似ていない。この違いは、ネコやサルでは方位選択性や眼優位性の似たマイクロカラムが近傍に並ぶことによって眼優位性カラムや方位選択性カラムが形成されていれば説明できる。実際、方位選択性カラムが六方格子状の周期構造を持つことが示唆されている<ref><pubmed>21623365 </pubmed></ref>。 | ||
== 参考文献 == | == 参考文献 == | ||
<references/> | <references/> | ||
2018年11月9日 (金) 00:27時点における最新版
細谷俊彦
理化学研究所脳神経科学研究センター 局所神経回路研究チーム
DOI:10.14931/bsd.7730 原稿受付日:2018年9月29日 原稿完成日:2018年10月15日
担当編集委員:渡辺 雅彦 (北海道大学大学院医学研究院 解剖学分野 解剖発生学教室)
英語名:microcolumn
大脳皮質第5層では、主要なタイプの神経細胞が細胞タイプ特異的な細い柱状のクラスター(マイクロカラム)を形成している。マイクロカラムは皮質に沿って六方格子状に並び、様々な皮質領野に共通に存在する。個々のマイクロカラムの細胞は特異的な神経回路を持ち類似した神経活動を示す。これらは第5層の回路がマイクロカラムを単位とした繰り返し構造をもつことを示し、多数のマイクロカラムによる並列処理が多様な皮質機能を担う可能性を示唆する。
歴史
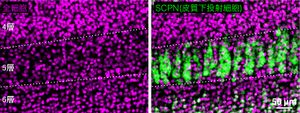
生後6日のマウス視覚野。(マゼンタ) TOTO3 により全ての細胞の核が可視化されている。(緑) id2 mRNA染色による皮質下投射細胞(SCPN)の細胞体の可視化。左と右は同一視野。
(左)核染色のみでは構造は見られない。
(右)SCPNはマイクロカラムを形成し、他の種類の細胞に挟まれている。
文献[1]より。
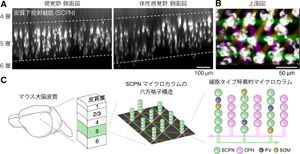
A:成体マウスの脳橋への逆行性蛍光色素注入によりに皮質下投射細胞(SCPN)が可視化されている。マイクロカラム構造が見られる。
B:SCPNマイクロカラムを上面から見た図。六方格子状の配置が見られる。縦軸が前後方向。青点は推定されたマイクロカラム中心。色付きの線は推定された格子構造。
C:模式図。SCPNマイクロカラムとCPNマイクロカラムは互い違いに並ぶ。パルブアルブミン(PV)細胞とソマトスタチン(SOM)細胞はSCPNマイクロカラムと並んで配置するが、CPNマイクロカラムとは並ばない。
文献[2]より。
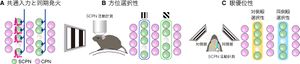
A: 同一マイクロカラム内の皮質下投射細胞(SCPN)は同じ細胞からのシナプス入力(青)を受ける傾向があり、同期した活動を示す(赤)。 B, C: 同一マイクロカラム内のSCPNは方位選択性(B)および眼優位性(C)が似ている。
文献[2]より。
大脳皮質の回路は様々なタイプの興奮性神経細胞と抑制性神経細胞から形成されている。古くから、少数の神経細胞が基本的な単位回路を形成し、これが多数繰り返されている可能性が提唱されていた[3][4]。単位回路の候補としてさまざまな仮説が提案されたが、その構造や機能については議論が続いておりコンセンサスは確立していなかった[5][6][7][8][9][10]。ネコやサルの視覚野でみられる眼優位性カラムや方位選択性カラムなどは特定の皮質領野のみに限られその回路・機能とも不明な点が多く、大脳皮質の普遍的な単位回路ではないと考えられている[7]。
構造
大脳皮質第5層の二種類の主要な興奮性細胞のうちの一種は皮質下投射細胞(subcortical projection neurons, SCPNs)と呼ばれ、脊髄、上丘、橋などへ長い軸索を伸ばし大脳皮質からの主要な出力経路を形成する[11]。皮質下投射細胞は広範な皮質領野に存在しており、例えば運動野の皮質下投射細胞は上位運動ニューロンとして皮質脊髄路を形成している。
皮質下投射細胞は幅1–2細胞、高さ数細胞程度の細長いクラスター(SCPNマイクロカラム)を形成する[1][12][2](図1, 2A)。皮質に沿って多数の皮質下投射細胞マイクロカラムが周期的に配置し、ハニカム状の六方格子配列をとっている[2](図2B)。このような皮質下投射細胞マイクロカラムはマウスの視覚野、体性感覚野、運動野[1][2]やヒト運動性言語野[12]で共通にみられ、いずれもよく似た構造を持つ。
第5層のもう一種の興奮性細胞である皮質投射細胞(cortical projection neuron, CPNs)は、同側や対側の大脳皮質に軸索を投射し中継経路を形成している[11]。これらの皮質投射細胞もマイクロカラム(CPNマイクロカラム)を形成し、SCPNマイクロカラムと互い違いに並んでいる[2](図2C)。
第5層にはさらにパルブアルブミン発現細胞(PV細胞)およびソマトスタチン発現細胞(SOM細胞)の2種の主要な抑制性細胞があり[13]近傍の皮質細胞を抑制している。この2種の抑制性細胞のいずれもSCPNマイクロカラムに含まれるように配置しているが、CPNマイクロカラムとはほぼ無関係に配置している[2](図2C)。
従って、第5層においてはすべての主要な細胞タイプが、細胞タイプ特異的なマイクロカラムとその格子構造に組織化されている。
回路と神経活動
マウス脳内Ca2+イメージングによって、同一のマイクロカラムに含まれる細胞は同期した神経活動を示し、活動の時間パターンが似ていることが明らかとなった[2](図3A)。この同期活動は、視覚野、体性感覚野、運動野のSCPNマイクロカラムで共通にみられた。
第一次視覚野の細胞は特定の傾き(方位)をもった線分に選択的に応答し(方位選択性)、また左右の眼への選択性(眼優位性)がさまざまに異なることが知られている。マウス第一次視覚野における解析により、同一マイクロカラム内の細胞は方位選択性と眼優位性のいずれもが似ていることが明らかとなった[1][2](図3B,C)。
また、電気生理学的な解析から、同じマイクロカラムに含まれる神経細胞は同一の神経細胞からのシナプス入力を受けていることが示唆され[2](図3A)、この入力が同期活動や刺激選択性の類似をもたらしている可能性が示された。以上より、個々のマイクロカラムはそれぞれ特定の情報を処理し、幅広い脳領野の共通な機能単位として動作していることが示唆された。
発生
大脳皮質の発生においては、興奮性細胞は皮質の脳室側で放射状グリアの不等分裂によって産み出され、脳表の方向へ放射状に移動し最終的な位置に配置する。この際、同一あるいは発生上近縁の放射状グリアから産み出された興奮性神経細胞(発生上近縁な興奮性神経細胞)は柱状に並ぶ傾向がある。一方、個々のマイクロカラムを構成する細胞は発生上近縁ではないことが示されている[1]ため(図4A)、発生上近縁な細胞が並ぶというモデルではマイクロカラムの形成は説明できないと考えられる。
マイクロカラムはマウスでは遅くとも生後6–7日には観察される。この時期にはまだ化学シナプスは皮質内には少ない。一方、この時期に、近傍にある皮質下投射細胞と皮質下投射細胞の間および皮質投射細胞と皮質投射細胞の間はそれぞれ50%以上の確率でギャップ結合により結合している[2](図4B)。このギャップ結合は縦に並んだ細胞で高い強度を示し、同一マイクロカラム内の細胞を強く結合していることが示唆されている。一方、皮質下投射細胞と皮質投射細胞の間にはギャップ結合はほとんど見られない[2]。皮質下投射細胞間、皮質投射細胞間のいずれのギャップ結合も皮質回路が概ね完成する生後14日頃までには完全に消失する[2](図4C)。
以上より、マイクロカラムは発生上近縁でない細胞が配置することにより形成され、一時的にギャップ結合で結合することが明らかとなった。このギャップ結合は皮質回路が形成される時期に存在するため、マイクロカラム特異的な神経回路の形成を誘導している可能性がある。
機能
以上の結果は、大脳皮質の広い領域において第5層はマイクロカラムが繰り返した構造を持つことを示している。個々のマイクロカラムは要素的な情報処理を担う機能モジュールであると考えられ、多数のマイクロカラムによる並列処理が第5層の情報処理を担っていることが示唆される。この回路構造はさまざまな異なる皮質領野に存在するため、感覚処理、運動制御、言語処理などの多様な大脳機能に共通な情報処理を行っている可能性がある。
他の構造との関連
大脳皮質の発生において、マイクロカラムに似た細いカラム状のクラスターがギャップ結合を形成している可能性を示唆する報告が1990年代にあった[14][15]。第5層におけるこのクラスターがマイクロカラムと一致している可能性がある。ギャップ結合で結合したクラスターは第5層以外の皮質層にも観察されているため、これらの層にもマイクロカラムに類似した構造が存在する可能性がある。
マイクロカラムは発生上近縁でない細胞から形成されている[1]。一方、発生上近縁な興奮性細胞は、マイクロカラムでギャップ結合が見られる時期より早い時期に一過的にギャップ結合を持つことが知られている[16]。発生上近縁な興奮性細胞は後に相互にシナプス結合し類似した視覚応答特性を示す[16][17][18]。従って、発生上近縁でない細胞からなるマイクロカラムと、発生上近縁な細胞からなる回路の両方が存在し異なる機能を担っている可能性がある。
ネコやサルの視覚野には眼優位性あるいは方位選択性の類似した細胞からなるカラム状のクラスターが存在し、それぞれ眼優位性カラムおよび方位選択性カラムと呼ばれている。眼優位性カラムの幅は細胞数十個分ほどでありマイクロカラムよりはるかに大きい。また、隣り合った方位選択性カラムが応答する刺激方位は似ているが、隣り合ったマイクロカラムが応答する刺激方位は似ていない。この違いは、ネコやサルでは方位選択性や眼優位性の似たマイクロカラムが近傍に並ぶことによって眼優位性カラムや方位選択性カラムが形成されていれば説明できる。実際、方位選択性カラムが六方格子状の周期構造を持つことが示唆されている[19]。
参考文献
- ↑ 1.0 1.1 1.2 1.3 1.4 1.5 1.6
Maruoka, H., Kubota, K., Kurokawa, R., Tsuruno, S., & Hosoya, T. (2011).
Periodic organization of a major subtype of pyramidal neurons in neocortical layer V. The Journal of neuroscience : the official journal of the Society for Neuroscience, 31(50), 18522-42. [PubMed:22171052] [PMC] [WorldCat] [DOI] - ↑ 2.00 2.01 2.02 2.03 2.04 2.05 2.06 2.07 2.08 2.09 2.10 2.11 2.12 2.13
Maruoka, H., Nakagawa, N., Tsuruno, S., Sakai, S., Yoneda, T., & Hosoya, T. (2017).
Lattice system of functionally distinct cell types in the neocortex. Science (New York, N.Y.), 358(6363), 610-615. [PubMed:29097542] [WorldCat] [DOI] - ↑ Lorente de Nó R.
Architectonics and structure of the cerebral cortex.
Physiology of the Nervous System. Oxford University Press, 291-327:1938 PDF - ↑
Mountcastle, V.B. (1997).
The columnar organization of the neocortex. Brain : a journal of neurology, 120 ( Pt 4), 701-22. [PubMed:9153131] [WorldCat] [DOI] - ↑
da Costa, N.M., & Martin, K.A. (2010).
Whose Cortical Column Would that Be? Frontiers in neuroanatomy, 4, 16. [PubMed:20640245] [PMC] [WorldCat] [DOI] - ↑
Rockland, K.S., & Ichinohe, N. (2004).
Some thoughts on cortical minicolumns. Experimental brain research, 158(3), 265-77. [PubMed:15365664] [WorldCat] [DOI] - ↑ 7.0 7.1
Horton, J.C., & Adams, D.L. (2005).
The cortical column: a structure without a function. Philosophical transactions of the Royal Society of London. Series B, Biological sciences, 360(1456), 837-62. [PubMed:15937015] [PMC] [WorldCat] [DOI] - ↑
Rakic, P. (2008).
Confusing cortical columns. Proceedings of the National Academy of Sciences of the United States of America, 105(34), 12099-100. [PubMed:18715998] [PMC] [WorldCat] [DOI] - ↑
Marcus, G., Marblestone, A., & Dean, T. (2014).
Neuroscience. The atoms of neural computation. Science (New York, N.Y.), 346(6209), 551-2. [PubMed:25359953] [WorldCat] [DOI] - ↑
Plebe, A. (2018).
The search of "canonical" explanations for the cerebral cortex. History and philosophy of the life sciences, 40(3), 40. [PubMed:29905901] [WorldCat] [DOI] - ↑ 11.0 11.1
Greig, L.C., Woodworth, M.B., Galazo, M.J., Padmanabhan, H., & Macklis, J.D. (2013).
Molecular logic of neocortical projection neuron specification, development and diversity. Nature reviews. Neuroscience, 14(11), 755-69. [PubMed:24105342] [PMC] [WorldCat] [DOI] - ↑ 12.0 12.1
Kwan, K.Y., Lam, M.M., Johnson, M.B., Dube, U., Shim, S., Rašin, M.R., ..., & Sestan, N. (2012).
Species-dependent posttranscriptional regulation of NOS1 by FMRP in the developing cerebral cortex. Cell, 149(4), 899-911. [PubMed:22579290] [PMC] [WorldCat] [DOI] - ↑
Hioki, H., Okamoto, S., Konno, M., Kameda, H., Sohn, J., Kuramoto, E., ..., & Kaneko, T. (2013).
Cell type-specific inhibitory inputs to dendritic and somatic compartments of parvalbumin-expressing neocortical interneuron. The Journal of neuroscience : the official journal of the Society for Neuroscience, 33(2), 544-55. [PubMed:23303934] [PMC] [WorldCat] [DOI] - ↑
Yuste, R., Peinado, A., & Katz, L.C. (1992).
Neuronal domains in developing neocortex. Science (New York, N.Y.), 257(5070), 665-9. [PubMed:1496379] [WorldCat] [DOI] - ↑
Peinado, A., Yuste, R., & Katz, L.C. (1993).
Extensive dye coupling between rat neocortical neurons during the period of circuit formation. Neuron, 10(1), 103-14. [PubMed:8427699] [WorldCat] [DOI] - ↑ 16.0 16.1
Yu, Y.C., He, S., Chen, S., Fu, Y., Brown, K.N., Yao, X.H., ..., & Shi, S.H. (2012).
Preferential electrical coupling regulates neocortical lineage-dependent microcircuit assembly. Nature, 486(7401), 113-7. [PubMed:22678291] [PMC] [WorldCat] [DOI] - ↑
Ohtsuki, G., Nishiyama, M., Yoshida, T., Murakami, T., Histed, M., Lois, C., & Ohki, K. (2012).
Similarity of visual selectivity among clonally related neurons in visual cortex. Neuron, 75(1), 65-72. [PubMed:22794261] [WorldCat] [DOI] - ↑
Li, Y., Lu, H., Cheng, P.L., Ge, S., Xu, H., Shi, S.H., & Dan, Y. (2012).
Clonally related visual cortical neurons show similar stimulus feature selectivity. Nature, 486(7401), 118-21. [PubMed:22678292] [PMC] [WorldCat] [DOI] - ↑
Paik, S.B., & Ringach, D.L. (2011).
Retinal origin of orientation maps in visual cortex. Nature neuroscience, 14(7), 919-25. [PubMed:21623365] [PMC] [WorldCat] [DOI]