ラメリポディア
秋山 博紀、上口 裕之
独立行政法人理化学研究所 脳科学総合研究センター
DOI:10.14931/bsd.1322 原稿受付日:2012年5月9日 原稿完成日:2012年5月16日
担当編集委員:村上 富士夫(大阪大学 大学院生命機能研究科)
英:lamellipodium(単); lamellipodia(複)
同義語:葉状仮足
ラメリポディアは、主に移動運動中の細胞周辺縁にみられる、薄い膜状の構造である。網目構造をとったアクチンフィラメントを含んでおり、このアクチンフィラメントの動態に依存して、伸長・退縮を繰り返す非常に動的な構造である。神経細胞では、移動細胞の先導突起先端部や、神経突起突出時の細胞体周辺、および成長円錐などにみられる。この他、移動中のグリア細胞や白血球、線維芽細胞の先導端にもみることができる。
構造と動態
ラメリポディアは分枝したアクチンフィラメントによって形成される網目構造によって支えられており、網目は細胞周辺部側でより密になっている。アクチンフィラメントのプラス端(重合端、反矢じり端、barbed-end)が細胞周辺部を向いており、また、網目構造全体は求心性に移動している(アクチン後方移動)[1][2]。このため、ラメリポディアの伸長・退縮は、網目構造の構築スピードとアクチン後方移動スピードとのバランスによって決定される。網目構造の構築スピードは、アクチンの重合・脱重合、分枝・脱分枝に、また、アクチン後方移動スピードは、ミオシンによりアクチン線維が求心性に引っ張られる力と、アクチン線維が形質膜によって押し戻される力に依存する[2][3][4][5]。
重合と分枝形成
アクチンの重合は、単量体アクチンの濃度が高くなるほど促進され、また、プラス端にキャッピングタンパク質が結合することによってフィラメントの伸長が抑制されることが、in vitroの実験から明らかになっている[1]。(詳細はアクチンおよびマイクロフィラメントの項参照)細胞においても、ラメリポディアの伸長が単量体アクチンの濃度が高い場合に促進されることが報告されている[6]。おもしろいことに、キャッピングタンパク質のノックダウンは、ラメリポディアの形成を阻害する[7]。キャッピングタンパク質の機能として、1)アクチンフィラメントの伸長促進(キャッピングタンパク質が結合しないフィラメントに対して、単量体アクチンの量が相対的に増すことにより、重合が促進される)、2)新規フィラメントの形成促進、のふたつのモデルが提唱されている[8][9]。
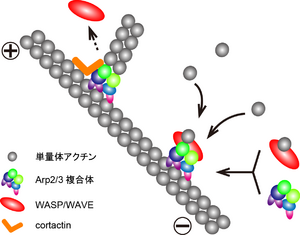
アクチンフィラメントの枝分かれの起始部には、新規フィラメントを伸長させるための重合核となる、Arp (actin-related protein) 2/3複合体が存在している。7つのサブユニットから構成されるArp2/3複合体の、Arp2およびArp3サブユニットは 単量体アクチンと非常によく似た構造をしており、これに単量体アクチンひとつを結合させた三量体が重合のための核となる。この三量体形成に重要な役割を果たすのが、WASP(Wiskott-Aldrich syndrome protein)、N-WASP(neuronal-WASP)、WAVE(WASP family verprolin-homologous protein)などのWASP/WAVEファミリータンパク質である。V(verprolin-homologyあるいはWASP-homology-2)ドメインが単量体アクチンと結合し、C(コフィリン-homologyあるいはcentral)およびA(acidic)ドメインがArp2/3複合体に結合することで、重合核が形成される[1]。
Arp2/3複合体は既存フィラメントの側面、あるいはプラス端に結合し、既存フィラメントに対しておよそ70度の角度で新規フィラメントを伸長させる[1][10]。Arp2/3複合体をノックダウンすると、線維芽細胞でラメリポディアの形成が阻害される[11]。しかし、神経細胞成長円錐では、CAドメイン過剰発現によるArp2/3複合体の機能阻害は、ラメリポディア形成に影響を与えないという報告もある[12]。コータクチンは、アクチンフィラメントとArp2サブユニットに結合し、分枝構造を安定化させることでラメリポディアの維持に寄与する[13][14]。また、Arp2との結合がVCAドメインと競合するため、コータクチンはWASP/WAVEのリサイクリングを促進すると考えられる[15]。(図1)
脱重合と脱分枝
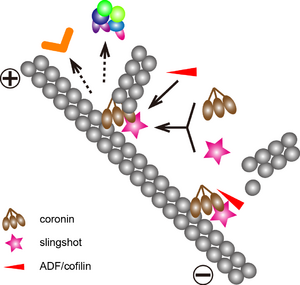
アクチンフィラメントは、ADF/コフィリンやゲルゾリンなどによって切断され、マイナス端(脱重合端、矢じり端、pointed-end)から脱重合が起こる。フィラメントに組み込まれたアクチンは、ATP型からADP型となることが知られているが、これらのフィラメント切断分子はADP型アクチンとの親和性が高いため、プラス端から離れた部位で切断が起こりやすいと考えられる[16]。また、コフィリンがアクチンフィラメントに結合することによって、そのフィラメントに結合していたArp2/3複合体が解離し、脱分枝が起こるという報告もある[17]。コロニンはコータクチンとArp2サブユニットとの結合を競合的に阻害し、Arp2/3複合体のアクチンフィラメントからの解離を促す。Arp2/3複合体解離後、コロニンが代わって分枝起始部に存在し、分枝構造が不安定化する。さらに、コロニンは、ADF/コフィリンを脱リン酸化し活性化するスリングショットとの結合ドメインを有しているため、コロニン結合部位でフィラメントが切断され、結果として脱分枝が起こる[10][18]。また、アクチン同様、Arp2サブユニットも重合開始に伴ってATP型からADP型に変換される[19]。ATP加水分解活性を失うと、分枝形成の効率は変わらないものの、分枝構造の安定化がみられることから、ADP型のArp2を認識する何らかの分子、あるいはリン酸基を失うことによる構造変化によって、脱分枝が促進されると考えられる[20]。(図2)
アクチン後方移動
アクチンの網目構造は、ラメリポディア後方に存在するミオシンによって定常的に細胞中心部へ向かって引っ張られており、ミオシンを阻害するとラメリポディアが伸長する[2]。加えて、アクチンフィラメントの伸長によって先端部形質膜を押す際に発生する、形質膜によって押し戻される力も後方移動に寄与している[2][3][4][5]。また、アクチンフィラメントはクラッチ分子を介して細胞外と連結するため、後方移動のスピードは連結構造の状態によっても変化する[21][22]。
トレッドミル
単一のアクチンフィラメントでは、プラス端で重合が、マイナス端で脱重合がそれぞれ起こる、トレッドミルと呼ばれる現象が見られる。ラメリポディアにおいても先端部でアクチンフィラメントの重合・分枝形成が起こり、後方で脱重合・脱分枝が起こるため、網目構造全体としてトレッドミル状態にある。単量体アクチンやArp2/3複合体、コータクチンなどは、ラメリポディア先端部付近に多く存在しており、先端部から遠ざかるにつれてその量は減少する[4][6][23]。さらに、WAVEは先端部に集積している[24]。また、コロニンは、ラメリポディア先端部からやや細胞中心側に離れた位置に多く存在している[10][19]。ADF/コフィリンはラメリポディア内に均一に存在するが、ADP型アクチンに結合することや、スリングショット スリングショットの局在がコロニンによって規定されることから、ADF/コフィリンによる脱重合は、ラメリポディアの先端付近では起こりづらいと考えられる[18][23]。このような分子の局在によって、網目構造全体がトレッドミル状態となると考えられる。また、ラメリポディア先端部での盛んな重合・分枝形成を維持するために、後方部でフィラメントの切断、脱分枝および脱重合の結果フィラメントから解離した単量体アクチンやWASP/WAVEなどは、細胞周辺部へと向かう細胞質の流れにのって運ばれ、先端部でリサイクルされる。この細胞質の流れは、ミオシンによるアクチン網目構造の後方移動に依存して生み出される[25]。
機能
ラメリポディアは細胞移動や突起伸長に寄与すると考えられるが、ラメリポディアの形成を阻害しても、細胞移動や突起伸長が完全に抑制されることはない。しかしながら、ラメリポディアの形成阻害によって、創傷治癒機能が著しく低下することや、軸索ガイダンス因子に対する応答性が失われることから、走化性に重要な働きをもつと考えられる[11][26]。 実際、多くの化学遊走物質(軸索ガイダンス因子など)の下流で、ラメリポディア動態を制御する分子が活性化することが報告されている。
制御
上述の通り、ラメリポディア動態は、アクチンフィラメントの重合・脱重合、分枝・脱分枝、アクチン後方移動によって決定される。このため、ラメリポディア動態の制御は、これらの要因に関与する分子の活性調節を介して行われる。
単量体アクチン
成長円錐では、誘引性軸索ガイダンス因子の下流でアクチンの翻訳が亢進されることが報告されている[27][28]。成長円錐片側での単量体アクチン量の増加は、ラメリポディア形成を促進し、結果として進路転換が起こると考えられる。
ADF/コフィリン
ADF/コフィリンのアクチンフィラメントの切断・脱重合活性は、LIMキナーゼ(LIMK)によるリン酸化により抑制され、スリングショットによる脱リン酸化により活性化される[29][30][31][32]。LIMKは、Rhoファミリー低分子GTP結合タンパク質のRhoやRacによって活性化される[33][34][35]。また、スリングショットはアクチンフィラメントへの結合により活性化し、14-3-3との結合は、スリングショットのアクチンへの結合を阻害する[32][36]。ADF/コフィリンの活性化は、ラメリポディア伸長に対して正負両面の影響を及ぼす。アクチンフィラメントの切断は網目構造を破壊するが、キャッピングタンパク質がプラス端に結合したフィラメントでは、切断によりプラス端が露出し、フィラメントが伸長できる状態になる。また、切断・脱重合による単量体アクチンのリサイクルは、先端部での重合を促進する[37][38]。実際、軸索ガイダンス因子によるADF/コフィリンの活性化は、成長円錐の誘引・反発のどちらの誘発要因にもなり得る[39][40]。このような違いは、ラメリポディア動態を適正に制御するためのADF/コフィリン活性の度合いが、細胞内環境に依存して変わるためではないかと推測されている[38]。
WASP/WAVE
WASP/WAVEは、Cdc42やRac、および、ホスファチジルイノシトール-4,5-二リン酸、ホスファチジルイノシトール-3,4,5-三リン酸との結合による構造変化の結果、VCAドメインが単量体アクチン、Arp2/3複合体と結合可能になり、活性化状態となる。また、srcキナーゼによるリン酸化によっても活性化される[41]。線維芽細胞では、誘引因子曝露によって先導端付近でホスファチジルイノシトール-3,4,5-三リン酸が産生される。これにより、WAVEが先導端に局在し、ラメリポディアが伸長する[42]。成長円錐においても、誘引性因子によるCdc42およびRacの活性化を介した、N-WASP依存的なラメリポディアの伸長がみられる[43]。また、WASP/WAVEの関与は明らかではないが、反発性因子によるCdc42の活性抑制により、ラメリポディアが退縮することが報告されている[44]。
コータクチン
コータクチンは、extracellular regulated kinases (ERK) 1/2によるセリン残基のリン酸化により活性化され、このセリン残基の非リン酸化変異体では、ラメリポディアが不安定化する[45]。srcキナーゼによるチロシン残基のリン酸化は、コータクチンの活性を抑制する[46]。反発性因子による成長円錐の崩壊に、このsrcキナーゼ依存的なコータクチンリン酸化の関与を示唆する報告がある[47]。
コロニン
コロニンのArp2/3複合体への結合は、プロテインキナーゼC (PKC) によるリン酸化によって抑制される[48]。また、同部位は、スリングショットによる脱リン酸化制御も受ける[18]。コロニンはスリングショットのアクチンへの結合を媒介するため、コロニンの制御によって、ADF/コフィリンの活性が調節される。実際、コロニンのノックダウンによって、細胞内のリン酸化コフィリン量が増加する[18]。
ミオシン
ミオシンは、ミオシン軽鎖キナーゼ (MLCK)やRho-associated coiled coil containing kinase (ROCK)などによるミオシン軽鎖のリン酸化によって活性化する。ROCKは、プロテインフォスファターゼ 1を不活化することによっても、ミオシン軽鎖のリン酸化に寄与する[49]。反発性因子による成長円錐の崩壊と軸索の退縮が、MLCKおよびROCKを介したミオシンの活性化に依存するという報告がなされている[50][51][52]。
関連項目
引用文献
- ↑ 1.0 1.1 1.2 1.3
Bugyi, B., & Carlier, M.F. (2010).
Control of actin filament treadmilling in cell motility. Annual review of biophysics, 39, 449-70. [PubMed:20192778] [WorldCat] [DOI] - ↑ 2.0 2.1 2.2 2.3
Medeiros, N.A., Burnette, D.T., & Forscher, P. (2006).
Myosin II functions in actin-bundle turnover in neuronal growth cones. Nature cell biology, 8(3), 215-26. [PubMed:16501565] [WorldCat] [DOI] - ↑ 3.0 3.1
Mogilner, A., & Oster, G. (2003).
Polymer motors: pushing out the front and pulling up the back. Current biology : CB, 13(18), R721-33. [PubMed:13678614] [WorldCat] [DOI] - ↑ 4.0 4.1 4.2
Van Goor, D., Hyland, C., Schaefer, A.W., & Forscher, P. (2012).
The role of actin turnover in retrograde actin network flow in neuronal growth cones. PloS one, 7(2), e30959. [PubMed:22359556] [PMC] [WorldCat] [DOI] - ↑ 5.0 5.1
Craig, E.M., Van Goor, D., Forscher, P., & Mogilner, A. (2012).
Membrane tension, myosin force, and actin turnover maintain actin treadmill in the nerve growth cone. Biophysical journal, 102(7), 1503-13. [PubMed:22500750] [PMC] [WorldCat] [DOI] - ↑ 6.0 6.1
Kiuchi, T., Nagai, T., Ohashi, K., & Mizuno, K. (2011).
Measurements of spatiotemporal changes in G-actin concentration reveal its effect on stimulus-induced actin assembly and lamellipodium extension. The Journal of cell biology, 193(2), 365-80. [PubMed:21502360] [PMC] [WorldCat] [DOI] - ↑
Mejillano, M.R., Kojima, S., Applewhite, D.A., Gertler, F.B., Svitkina, T.M., & Borisy, G.G. (2004).
Lamellipodial versus filopodial mode of the actin nanomachinery: pivotal role of the filament barbed end. Cell, 118(3), 363-73. [PubMed:15294161] [WorldCat] [DOI] - ↑
Carlier, M.F., & Pantaloni, D. (1997).
Control of actin dynamics in cell motility. Journal of molecular biology, 269(4), 459-67. [PubMed:9217250] [WorldCat] [DOI] - ↑
Akin, O., & Mullins, R.D. (2008).
Capping protein increases the rate of actin-based motility by promoting filament nucleation by the Arp2/3 complex. Cell, 133(5), 841-51. [PubMed:18510928] [PMC] [WorldCat] [DOI] - ↑ 10.0 10.1 10.2
Cai, L., Makhov, A.M., Schafer, D.A., & Bear, J.E. (2008).
Coronin 1B antagonizes cortactin and remodels Arp2/3-containing actin branches in lamellipodia. Cell, 134(5), 828-42. [PubMed:18775315] [PMC] [WorldCat] [DOI] - ↑ 11.0 11.1
Suraneni, P., Rubinstein, B., Unruh, J.R., Durnin, M., Hanein, D., & Li, R. (2012).
The Arp2/3 complex is required for lamellipodia extension and directional fibroblast cell migration. The Journal of cell biology, 197(2), 239-51. [PubMed:22492726] [PMC] [WorldCat] [DOI] - ↑
Strasser, G.A., Rahim, N.A., VanderWaal, K.E., Gertler, F.B., & Lanier, L.M. (2004).
Arp2/3 is a negative regulator of growth cone translocation. Neuron, 43(1), 81-94. [PubMed:15233919] [WorldCat] [DOI] - ↑
Weaver, A.M., Heuser, J.E., Karginov, A.V., Lee, W.L., Parsons, J.T., & Cooper, J.A. (2002).
Interaction of cortactin and N-WASp with Arp2/3 complex. Current biology : CB, 12(15), 1270-8. [PubMed:12176354] [WorldCat] [DOI] - ↑
Bryce, N.S., Clark, E.S., Leysath, J.L., Currie, J.D., Webb, D.J., & Weaver, A.M. (2005).
Cortactin promotes cell motility by enhancing lamellipodial persistence. Current biology : CB, 15(14), 1276-85. [PubMed:16051170] [WorldCat] [DOI] - ↑
Uruno, T., Liu, J., Li, Y., Smith, N., & Zhan, X. (2003).
Sequential interaction of actin-related proteins 2 and 3 (Arp2/3) complex with neural Wiscott-Aldrich syndrome protein (N-WASP) and cortactin during branched actin filament network formation. The Journal of biological chemistry, 278(28), 26086-93. [PubMed:12732638] [WorldCat] [DOI] - ↑
dos Remedios, C.G., Chhabra, D., Kekic, M., Dedova, I.V., Tsubakihara, M., Berry, D.A., & Nosworthy, N.J. (2003).
Actin binding proteins: regulation of cytoskeletal microfilaments. Physiological reviews, 83(2), 433-73. [PubMed:12663865] [WorldCat] [DOI] - ↑
Chan, C., Beltzner, C.C., & Pollard, T.D. (2009).
Cofilin dissociates Arp2/3 complex and branches from actin filaments. Current biology : CB, 19(7), 537-45. [PubMed:19362000] [PMC] [WorldCat] [DOI] - ↑ 18.0 18.1 18.2 18.3
Cai, L., Marshall, T.W., Uetrecht, A.C., Schafer, D.A., & Bear, J.E. (2007).
Coronin 1B coordinates Arp2/3 complex and cofilin activities at the leading edge. Cell, 128(5), 915-29. [PubMed:17350576] [PMC] [WorldCat] [DOI] - ↑ 19.0 19.1
Dayel, M.J., & Mullins, R.D. (2004).
Activation of Arp2/3 complex: addition of the first subunit of the new filament by a WASP protein triggers rapid ATP hydrolysis on Arp2. PLoS biology, 2(4), E91. [PubMed:15094799] [PMC] [WorldCat] [DOI] - ↑
Martin, A.C., Welch, M.D., & Drubin, D.G. (2006).
Arp2/3 ATP hydrolysis-catalysed branch dissociation is critical for endocytic force generation. Nature cell biology, 8(8), 826-33. [PubMed:16862144] [WorldCat] [DOI] - ↑
Suter, D.M., & Forscher, P. (2001).
Transmission of growth cone traction force through apCAM-cytoskeletal linkages is regulated by Src family tyrosine kinase activity. The Journal of cell biology, 155(3), 427-38. [PubMed:11673478] [PMC] [WorldCat] [DOI] - ↑
Gardel, M.L., Sabass, B., Ji, L., Danuser, G., Schwarz, U.S., & Waterman, C.M. (2008).
Traction stress in focal adhesions correlates biphasically with actin retrograde flow speed. The Journal of cell biology, 183(6), 999-1005. [PubMed:19075110] [PMC] [WorldCat] [DOI] - ↑ 23.0 23.1
Lai, F.P., Szczodrak, M., Block, J., Faix, J., Breitsprecher, D., Mannherz, H.G., ..., & Rottner, K. (2008).
Arp2/3 complex interactions and actin network turnover in lamellipodia. The EMBO journal, 27(7), 982-92. [PubMed:18309290] [PMC] [WorldCat] [DOI] - ↑
Nakagawa, H., Miki, H., Ito, M., Ohashi, K., Takenawa, T., & Miyamoto, S. (2001).
N-WASP, WAVE and Mena play different roles in the organization of actin cytoskeleton in lamellipodia. Journal of cell science, 114(Pt 8), 1555-65. [PubMed:11282031] [WorldCat] - ↑
Keren, K., Yam, P.T., Kinkhabwala, A., Mogilner, A., & Theriot, J.A. (2009).
Intracellular fluid flow in rapidly moving cells. Nature cell biology, 11(10), 1219-24. [PubMed:19767741] [PMC] [WorldCat] [DOI] - ↑
Dent, E.W., Gupton, S.L., & Gertler, F.B. (2011).
The growth cone cytoskeleton in axon outgrowth and guidance. Cold Spring Harbor perspectives in biology, 3(3). [PubMed:21106647] [PMC] [WorldCat] [DOI] - ↑
Yao, J., Sasaki, Y., Wen, Z., Bassell, G.J., & Zheng, J.Q. (2006).
An essential role for beta-actin mRNA localization and translation in Ca2+-dependent growth cone guidance. Nature neuroscience, 9(10), 1265-73. [PubMed:16980965] [WorldCat] [DOI] - ↑
Leung, K.M., van Horck, F.P., Lin, A.C., Allison, R., Standart, N., & Holt, C.E. (2006).
Asymmetrical beta-actin mRNA translation in growth cones mediates attractive turning to netrin-1. Nature neuroscience, 9(10), 1247-56. [PubMed:16980963] [PMC] [WorldCat] [DOI] - ↑
Yang, N., Higuchi, O., Ohashi, K., Nagata, K., Wada, A., Kangawa, K., ..., & Mizuno, K. (1998).
Cofilin phosphorylation by LIM-kinase 1 and its role in Rac-mediated actin reorganization. Nature, 393(6687), 809-12. [PubMed:9655398] [WorldCat] [DOI] - ↑
Niwa, R., Nagata-Ohashi, K., Takeichi, M., Mizuno, K., & Uemura, T. (2002).
Control of actin reorganization by Slingshot, a family of phosphatases that dephosphorylate ADF/cofilin. Cell, 108(2), 233-46. [PubMed:11832213] [WorldCat] [DOI] - ↑
Agnew, B.J., Minamide, L.S., & Bamburg, J.R. (1995).
Reactivation of phosphorylated actin depolymerizing factor and identification of the regulatory site. The Journal of biological chemistry, 270(29), 17582-7. [PubMed:7615564] [WorldCat] [DOI] - ↑ 32.0 32.1
Bernstein, B.W., & Bamburg, J.R. (2010).
ADF/cofilin: a functional node in cell biology. Trends in cell biology, 20(4), 187-95. [PubMed:20133134] [PMC] [WorldCat] [DOI] - ↑
Edwards, D.C., Sanders, L.C., Bokoch, G.M., & Gill, G.N. (1999).
Activation of LIM-kinase by Pak1 couples Rac/Cdc42 GTPase signalling to actin cytoskeletal dynamics. Nature cell biology, 1(5), 253-9. [PubMed:10559936] [WorldCat] [DOI] - ↑
Maekawa, M., Ishizaki, T., Boku, S., Watanabe, N., Fujita, A., Iwamatsu, A., ..., & Narumiya, S. (1999).
Signaling from Rho to the actin cytoskeleton through protein kinases ROCK and LIM-kinase. Science (New York, N.Y.), 285(5429), 895-8. [PubMed:10436159] [WorldCat] [DOI] - ↑
Ohashi, K., Nagata, K., Maekawa, M., Ishizaki, T., Narumiya, S., & Mizuno, K. (2000).
Rho-associated kinase ROCK activates LIM-kinase 1 by phosphorylation at threonine 508 within the activation loop. The Journal of biological chemistry, 275(5), 3577-82. [PubMed:10652353] [WorldCat] [DOI] - ↑
Eiseler, T., Döppler, H., Yan, I.K., Kitatani, K., Mizuno, K., & Storz, P. (2009).
Protein kinase D1 regulates cofilin-mediated F-actin reorganization and cell motility through slingshot. Nature cell biology, 11(5), 545-56. [PubMed:19329994] [PMC] [WorldCat] [DOI] - ↑
Le Clainche, C., & Carlier, M.F. (2008).
Regulation of actin assembly associated with protrusion and adhesion in cell migration. Physiological reviews, 88(2), 489-513. [PubMed:18391171] [WorldCat] [DOI] - ↑ 38.0 38.1
Vitriol, E.A., & Zheng, J.Q. (2012).
Growth cone travel in space and time: the cellular ensemble of cytoskeleton, adhesion, and membrane. Neuron, 73(6), 1068-81. [PubMed:22445336] [PMC] [WorldCat] [DOI] - ↑
Wen, Z., Han, L., Bamburg, J.R., Shim, S., Ming, G.L., & Zheng, J.Q. (2007).
BMP gradients steer nerve growth cones by a balancing act of LIM kinase and Slingshot phosphatase on ADF/cofilin. The Journal of cell biology, 178(1), 107-19. [PubMed:17606869] [PMC] [WorldCat] [DOI] - ↑
Marsick, B.M., Flynn, K.C., Santiago-Medina, M., Bamburg, J.R., & Letourneau, P.C. (2010).
Activation of ADF/cofilin mediates attractive growth cone turning toward nerve growth factor and netrin-1. Developmental neurobiology, 70(8), 565-88. [PubMed:20506164] [PMC] [WorldCat] [DOI] - ↑
Takenawa, T., & Suetsugu, S. (2007).
The WASP-WAVE protein network: connecting the membrane to the cytoskeleton. Nature reviews. Molecular cell biology, 8(1), 37-48. [PubMed:17183359] [WorldCat] [DOI] - ↑
Oikawa, T., Yamaguchi, H., Itoh, T., Kato, M., Ijuin, T., Yamazaki, D., ..., & Takenawa, T. (2004).
PtdIns(3,4,5)P3 binding is necessary for WAVE2-induced formation of lamellipodia. Nature cell biology, 6(5), 420-6. [PubMed:15107862] [WorldCat] [DOI] - ↑
Shekarabi, M., Moore, S.W., Tritsch, N.X., Morris, S.J., Bouchard, J.F., & Kennedy, T.E. (2005).
Deleted in colorectal cancer binding netrin-1 mediates cell substrate adhesion and recruits Cdc42, Rac1, Pak1, and N-WASP into an intracellular signaling complex that promotes growth cone expansion. The Journal of neuroscience : the official journal of the Society for Neuroscience, 25(12), 3132-41. [PubMed:15788770] [PMC] [WorldCat] [DOI] - ↑
Myers, J.P., Robles, E., Ducharme-Smith, A., & Gomez, T.M. (2012).
Focal adhesion kinase modulates Cdc42 activity downstream of positive and negative axon guidance cues. Journal of cell science, 125(Pt 12), 2918-29. [PubMed:22393238] [PMC] [WorldCat] [DOI] - ↑
Kelley, L.C., Hayes, K.E., Ammer, A.G., Martin, K.H., & Weed, S.A. (2010).
Cortactin phosphorylated by ERK1/2 localizes to sites of dynamic actin regulation and is required for carcinoma lamellipodia persistence. PloS one, 5(11), e13847. [PubMed:21079800] [PMC] [WorldCat] [DOI] - ↑
Huang, C., Ni, Y., Wang, T., Gao, Y., Haudenschild, C.C., & Zhan, X. (1997).
Down-regulation of the filamentous actin cross-linking activity of cortactin by Src-mediated tyrosine phosphorylation. The Journal of biological chemistry, 272(21), 13911-5. [PubMed:9153252] [WorldCat] [DOI] - ↑
Knöll, B., & Drescher, U. (2004).
Src family kinases are involved in EphA receptor-mediated retinal axon guidance. The Journal of neuroscience : the official journal of the Society for Neuroscience, 24(28), 6248-57. [PubMed:15254079] [PMC] [WorldCat] [DOI] - ↑
Cai, L., Holoweckyj, N., Schaller, M.D., & Bear, J.E. (2005).
Phosphorylation of coronin 1B by protein kinase C regulates interaction with Arp2/3 and cell motility. The Journal of biological chemistry, 280(36), 31913-23. [PubMed:16027158] [WorldCat] [DOI] - ↑
Vicente-Manzanares, M., Ma, X., Adelstein, R.S., & Horwitz, A.R. (2009).
Non-muscle myosin II takes centre stage in cell adhesion and migration. Nature reviews. Molecular cell biology, 10(11), 778-90. [PubMed:19851336] [PMC] [WorldCat] [DOI] - ↑
Gallo, G. (2006).
RhoA-kinase coordinates F-actin organization and myosin II activity during semaphorin-3A-induced axon retraction. Journal of cell science, 119(Pt 16), 3413-23. [PubMed:16899819] [PMC] [WorldCat] [DOI] - ↑
Kubo, T., Endo, M., Hata, K., Taniguchi, J., Kitajo, K., Tomura, S., ..., & Yamashita, T. (2008).
Myosin IIA is required for neurite outgrowth inhibition produced by repulsive guidance molecule. Journal of neurochemistry, 105(1), 113-26. [PubMed:18005226] [WorldCat] [DOI] - ↑
Murray, A., Naeem, A., Barnes, S.H., Drescher, U., & Guthrie, S. (2010).
Slit and Netrin-1 guide cranial motor axon pathfinding via Rho-kinase, myosin light chain kinase and myosin II. Neural development, 5, 16. [PubMed:20569485] [PMC] [WorldCat] [DOI]