体温調節の神経回路
英語名:Neural circuitry for thermoregulation、Neural circuitry for body temperature regulation
体温を維持・調節するために機能する、温度感覚情報の伝達・統合ならびに体温調節効果器への指令を行う中枢および末梢の神経回路。ここでは哺乳類の体温調節の神経回路を扱う。
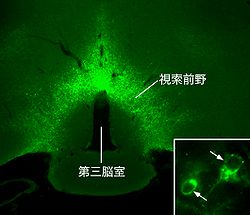
人間を含めた哺乳動物(恒温動物)では、体温を一定に保つために、体内から環境中への熱の放散を調節し、必要な時には体内で積極的に熱を産生する。また、感染が起こった時には発熱を起こし、体温を病原体の増殖至適温度域よりも高くすることで、その増殖を抑制する。こうした生体の反応は、脳内の体温調節中枢を司令塔とする中枢神経システムが、末梢の様々な効果器へ指令を行うことによって惹起される。体温調節中枢は、視床下部の最吻側に位置する視索前野(preoptic area)と呼ばれる領域にあり、感染時の発熱を指令する発熱中枢でもある[1][2]。
体温調節反応の種類
体温の調節に関わる生体の反応は、自律性体温調節反応と行動性体温調節反応に分類される。
自律性体温調節反応

自律性体温調節反応は、体温を維持・調節するために、自律性臓器・器官を効果器として行われる生理反応であり、意識にのぼらない不随意反応である。自律性体温調節反応には、体内で熱の産生を行う反応(熱産生反応)と環境中への体熱の放散を調節する反応(熱放散反応)がある(図1参照)。
熱産生反応
体内の熱は、様々な化学反応や筋運動の副産物として産生されるが、それに加えて、体温調節を目的とした積極的な熱の産生が、主に褐色脂肪組織と骨格筋で行われる。褐色脂肪組織は交感神経系による強い支配を受け、代謝性(非ふるえ)熱産生が起こる。骨格筋では、体性運動神経を介したふるえ熱産生(シバリング)が起こる。
熱放散反応
体熱の放散の様式には、蒸散性熱放散と非蒸散性熱放散の2種類が存在する。蒸散性熱放散は、体表面の水分が蒸発する際に体熱を気化熱として奪うことを利用して熱の放散を促す反応である。暑熱環境では、人や馬は皮膚の汗腺より分泌した汗を蒸発させることで熱放散を促す。汗腺は交感神経の支配を受けるが、他の効果器とは異なり、神経終末からはアセチルコリンが放出される。ラットやマウスは唾液の分泌量を増やし、それを体表面に塗布する。犬はあえぎ(パンティング)を行うことで、口腔内や気道表面の水分の蒸発量を増加させる。
非蒸散性熱放散は、水分の蒸発を伴わず、体表面から環境中への熱の伝導や放射による熱放散反応である。非蒸散性熱放散において重要な働きをする器官の代表的なものとしては、皮膚の血管が挙げられる。皮膚血管は主に交感神経による調節を受け、神経終末から放出されるノルアドレナリンの作用によって血管平滑筋の収縮が起こる。皮膚血管の収縮は皮膚血流の低下につながるため、体表面からの熱の放散が抑制される。一方、交感神経活動が低下すると、皮膚血管の平滑筋が弛緩し、血管径が拡張するので、皮膚血流の増加による体熱の放散促進につながる。また、人間の皮膚血管には、積極的に拡張させる神経も存在することが知られているが、放出される神経伝達物質など、その実体はよく分かっていない。寒冷環境では鳥肌が立つことがあるが、これも非蒸散性熱放散反応の一種である。猿や犬など、長く豊富な体毛を持つ動物では、立毛筋を収縮させ、毛を立てることで、体毛によって構成される皮膚の外側の空気の層の厚くし、断熱性を高める。人間の皮膚には体毛が少ないので、立毛させることによる断熱効果はほとんどないが、進化上の名残として反応が残っているのである。
行動性体温調節反応
行動性体温調節反応は、体温の維持・調節を目的とした、意識的な行動を指す。例えば、「体温の維持に適した温度環境に移動する」という行動に加え、「寒いのでコートを羽織る」、「暑いので冷房のスイッチを入れる」などの行動も含まれる。こうした行動の基盤には、暑さ・寒さに起因する情動が関与すると考えられるが、その中枢神経回路はほとんど分かっていない。
自律性体温調節のための温度知覚
フィードバック制御に関わる温度感知
体温を生理的に適正な温度域内に維持するためには、生体が体温(深部体温)を感知することが必要である。生体の体温調節システムは、体温が至適温度域から逸脱したことを感知し、適正な状態へ戻すための自律性体温調節反応を惹起するのである。このような調節様式をフィードバック制御という[4]。深部体温を感知するニューロンとしては、体温調節中枢である視索前野や前視床下部(anterior hypothalamus)に存在する温度感受性ニューロンが知られており、その多くは、脳組織温度が上昇することによって発火頻度が上昇する温ニューロン(warm-sensitive neuron)である[5]。視索前野や前視床下部の組織温度は、体深部から循環してくる血液の温度の影響を受けるため、深部体温の変動に連動して変化する。そして、視索前野の局所を冷却すると熱産生が惹起され、加温すると皮膚血管の拡張(熱放散の促進)が起こる[6][7]。したがって、脳組織温度に依存した温ニューロンの活動レベルが体温調節反応の出力を決定すると考えられている。
フィードフォワード制御に関わる温度情報の伝達
体温の維持には、深部体温の感知だけでなく、皮膚の知覚神経末端に存在する温度受容器による環境温度の感知も必要である。環境温度が変化した時には、皮膚でそれをいち早く感知し、体温調節中枢へ伝達することによって、深部体温が影響を受けて変動してしまう前に適切な体温調節反応を惹起することが可能になる。このような体温調節様式をフィードフォワード制御という[4]。皮膚の温度受容器で感知した温度情報は、脊髄の後角(dorsal horn)を経て、橋の外側結合腕傍核(lateral parabrachial nucleus)へ伝達され、そこから視索前野へと入力される[8][9](図2参照)。この経路では、温覚と冷覚は別のニューロン群によって中継され、独立して視索前野へ入力される。例えば、外側結合腕傍核では、温覚を中継するニューロンは背側部に局在し、冷覚を中継するものは外側部に局在する[8][9]。 このようにして視索前野へ入力された皮膚の温度情報は、温ニューロンの活動レベルに影響を与える形で脳組織温度の情報と統合され、体温調節反応の出力へとつながるものと考えられている。

自律性体温調節の指令を行う神経回路
視索前野からの下行性抑制
自律性体温調節反応のうち、褐色脂肪組織熱産生や皮膚血管収縮は脊髄の中間外側核(intermediolateral nucleus)からの交感神経出力によって惹起され[10][11]、ふるえ熱産生は脊髄の前角(ventral horn)からの体性運動出力を介して惹起される[12](図2)。視索前野に存在する体温調節中枢は、こうした自律性体温調節反応の惹起を指令する司令塔として機能する[1]。視索前野には下行性投射を行うニューロンが存在し、これらのニューロンが、体温調節効果器への出力を制御する下位の脳領域へ恒常的な抑制性の入力を行うことで、これらの脳領域から体温調節効果器への出力を制御する[13][14][15]。つまり、視索前野からの下行性抑制のトーンが最終的な体温調節性の交感神経や運動神経の出力レベルを決定しているのである。
視索前野から制御を受ける下位脳領域
視索前野からの下行性抑制によって制御される脳領域としては、視床下部背内側部(dorsomedial hypothalamus)と延髄の淡蒼縫線核(raphe pallidus nucleus)が知られている[13][14]。視床下部背内側部には、淡蒼縫線核へ興奮性入力を行う投射ニューロンが存在し、淡蒼縫線核のニューロンの活動に対し促進的に作用する[14]。淡蒼縫線核を中心とした領域には、脊髄へ投射するプレモーターニューロンが分布している。プレモーターニューロンには、上位の脳領域からの体温調節指令を受け取って統合し、その信号を脊髄の出力システムへ伝達する役割がある。このプレモーターニューロンのうち、褐色脂肪組織熱産生や皮膚血管収縮の指令を伝達する交感神経プレモーターニューロンは、小胞性グルタミン酸トランスポーター3(VGLUT3)を発現し、中間外側核においてグルタミン酸を放出すると考えられている[16][17]。この交感神経プレモーターニューロン群のうち、約20%はセロトニンも含有する[16]。また、GABAを含有するものも報告されている[18]。
暑熱・寒冷環境における体温調節指令メカニズム
このような視索前野からの遠心性神経路は、体温の維持・調節において次のように機能すると考えられる(図2参照)。暑熱環境では、視索前野からの下行性抑制のトーンが強まり、視床下部背内側部や淡蒼縫線核のニューロンの活動が低下する。したがって、交感神経や体性運動神経の出力が小さくなるため、熱産生が抑制され、皮膚血管が拡張することにより体熱の放散が促進される。一方、寒冷環境では、視索前野からの下行性抑制のトーンが弱まることで、視床下部背内側部や淡蒼縫線核のニューロンが脱抑制される。したがって、こうしたニューロンからの興奮性信号が交感神経や運動神経の出力を増強する。これによって、熱産生が惹起される一方、皮膚血管が収縮することにより体熱の放散が抑制される。
感染性発熱の神経回路
感染が起こると免疫系が活性化され、サイトカイン類が血中で産生される。これが脳の血管の内皮細胞へ作用すると、内皮細胞内でシクロオキシゲナーゼ−2(cyclooxygenase-2、COX-2)などのプロスタグランジン合成酵素群が発現し、発熱メディエーターであるプロスタグランジンE2(prostaglandin E2、PGE2)が産生される[19]。プロスタグランジンE2は脳実質内へ拡散し、視索前野のニューロンに存在するプロスタグランジンEP3受容体に作用する[20][21](図3参照)。EP3受容体は抑制性のGTP結合蛋白と共役するので[22]、結果的に視索前野のニューロンは抑制される。EP3受容体を発現する視索前野のニューロンはGABA作動性の抑制性ニューロンであり、視床下部背内側部や淡蒼縫線核へ投射することが分かっている[13][14][15]。したがって、プロスタグランジンE2がEP3受容体を発現する視索前野のニューロンの活動を低下させると、寒冷環境における対寒反応の惹起と同様、視床下部背内側部や淡蒼縫線核のニューロンの脱抑制が起こるため、熱産生が惹起され、皮膚血管が収縮する(図2参照)。寒冷環境でもない状態でこうした反応が強く起こると、体温の上昇につながる。これが発熱と呼ばれる生理反応である。
セットポイント仮説の修正
長らくの間提唱されてきた体温調節システムに関する仮説として、セットポイント仮説がある。これは、中枢において体温の単一のセットポイントが設定されており、深部体温が設定温度から逸脱した場合には設定値へ戻すようなフィードバック反応が惹起されるという考え方である。しかし、研究が進むにつれ、体温調節は深部体温だけでなく皮膚で感知した環境温度にも基づいて適切な反応が惹起されること、また、末梢の体温調節効果器の種類によって反応が惹起される温度(深部体温あるいは皮膚温度)の閾値が異なることなどが分かり、深部体温と単一のセットポイントとの単純な比較で体温が調節されているのではないことが明らかとなってきた[4]。
現在では、深部体温と末梢温度(主に皮膚温度)の情報が体温調節中枢で統合され、それに基づいて適切な体温調節反応の種類と強度が決定され、出力されるという考え方が主流である。こうした温度情報の統合と反応出力の決定に関わる中枢神経回路メカニズムについては分かっていないことが多い。しかし、視索前野から視床下部背内側部や淡蒼縫線核へ下行性抑制を行う投射ニューロンの発火活動が体温調節反応の出力強度を決定しているという上記のモデルに従えば、この投射ニューロンが、温ニューロンとしての温度感受性や、またEP3受容体を発現して感染時にプロスタグランジンE2を受容する機能を有する可能性があるが、証明は行われていない。
関連項目
参考文献
- ↑ 1.0 1.1 1.2
Nakamura, K. (2011).
Central circuitries for body temperature regulation and fever. American journal of physiology. Regulatory, integrative and comparative physiology, 301(5), R1207-28. [PubMed:21900642] [WorldCat] [DOI] - ↑
Morrison, S.F., Nakamura, K., & Madden, C.J. (2008).
Central control of thermogenesis in mammals. Experimental physiology, 93(7), 773-97. [PubMed:18469069] [PMC] [WorldCat] [DOI] - ↑ 中村和弘
体温調節の中枢神経機構
日本臨牀:2012 in press - ↑ 4.0 4.1 4.2
Kanosue, K., Crawshaw, L.I., Nagashima, K., & Yoda, T. (2010).
Concepts to utilize in describing thermoregulation and neurophysiological evidence for how the system works. European journal of applied physiology, 109(1), 5-11. [PubMed:19882166] [WorldCat] [DOI] - ↑
NAKAYAMA, T., EISENMAN, J.S., & HARDY, J.D. (1961).
Single unit activity of anterior hypothalamus during local heating. Science (New York, N.Y.), 134(3478), 560-1. [PubMed:13727681] [WorldCat] [DOI] - ↑
Imai-Matsumura, K., Matsumura, K., & Nakayama, T. (1984).
Involvement of ventromedial hypothalamus in brown adipose tissue thermogenesis induced by preoptic cooling in rats. The Japanese journal of physiology, 34(5), 939-43. [PubMed:6533384] [WorldCat] [DOI] - ↑
Kanosue, K., Yanase-Fujiwara, M., & Hosono, T. (1994).
Hypothalamic network for thermoregulatory vasomotor control. The American journal of physiology, 267(1 Pt 2), R283-8. [PubMed:8048634] [WorldCat] [DOI] - ↑ 8.0 8.1
Nakamura, K., & Morrison, S.F. (2008).
A thermosensory pathway that controls body temperature. Nature neuroscience, 11(1), 62-71. [PubMed:18084288] [PMC] [WorldCat] [DOI] - ↑ 9.0 9.1
Nakamura, K., & Morrison, S.F. (2010).
A thermosensory pathway mediating heat-defense responses. Proceedings of the National Academy of Sciences of the United States of America, 107(19), 8848-53. [PubMed:20421477] [PMC] [WorldCat] [DOI] - ↑
Nakamura, K., & Morrison, S.F. (2007).
Central efferent pathways mediating skin cooling-evoked sympathetic thermogenesis in brown adipose tissue. American journal of physiology. Regulatory, integrative and comparative physiology, 292(1), R127-36. [PubMed:16931649] [PMC] [WorldCat] [DOI] - ↑
Rathner, J.A., Madden, C.J., & Morrison, S.F. (2008).
Central pathway for spontaneous and prostaglandin E2-evoked cutaneous vasoconstriction. American journal of physiology. Regulatory, integrative and comparative physiology, 295(1), R343-54. [PubMed:18463193] [PMC] [WorldCat] [DOI] - ↑
Nakamura, K., & Morrison, S.F. (2011).
Central efferent pathways for cold-defensive and febrile shivering. The Journal of physiology, 589(Pt 14), 3641-58. [PubMed:21610139] [PMC] [WorldCat] [DOI] - ↑ 13.0 13.1 13.2
Nakamura, K., Matsumura, K., Kaneko, T., Kobayashi, S., Katoh, H., & Negishi, M. (2002).
The rostral raphe pallidus nucleus mediates pyrogenic transmission from the preoptic area. The Journal of neuroscience : the official journal of the Society for Neuroscience, 22(11), 4600-10. [PubMed:12040067] [PMC] [WorldCat] [DOI] - ↑ 14.0 14.1 14.2 14.3
Nakamura, Y., Nakamura, K., Matsumura, K., Kobayashi, S., Kaneko, T., & Morrison, S.F. (2005).
Direct pyrogenic input from prostaglandin EP3 receptor-expressing preoptic neurons to the dorsomedial hypothalamus. The European journal of neuroscience, 22(12), 3137-46. [PubMed:16367780] [PMC] [WorldCat] [DOI] - ↑ 15.0 15.1
Nakamura, Y., Nakamura, K., & Morrison, S.F. (2009).
Different populations of prostaglandin EP3 receptor-expressing preoptic neurons project to two fever-mediating sympathoexcitatory brain regions. Neuroscience, 161(2), 614-20. [PubMed:19327390] [PMC] [WorldCat] [DOI] - ↑ 16.0 16.1
Nakamura, K., Matsumura, K., Hübschle, T., Nakamura, Y., Hioki, H., Fujiyama, F., ..., & Kaneko, T. (2004).
Identification of sympathetic premotor neurons in medullary raphe regions mediating fever and other thermoregulatory functions. The Journal of neuroscience : the official journal of the Society for Neuroscience, 24(23), 5370-80. [PubMed:15190110] [PMC] [WorldCat] [DOI] - ↑
Nakamura, K., Matsumura, K., Kobayashi, S., & Kaneko, T. (2005).
Sympathetic premotor neurons mediating thermoregulatory functions. Neuroscience research, 51(1), 1-8. [PubMed:15596234] [WorldCat] [DOI] - ↑
Stornetta, R.L., Rosin, D.L., Simmons, J.R., McQuiston, T.J., Vujovic, N., Weston, M.C., & Guyenet, P.G. (2005).
Coexpression of vesicular glutamate transporter-3 and gamma-aminobutyric acidergic markers in rat rostral medullary raphe and intermediolateral cell column. The Journal of comparative neurology, 492(4), 477-94. [PubMed:16228993] [WorldCat] [DOI] - ↑
Yamagata, K., Matsumura, K., Inoue, W., Shiraki, T., Suzuki, K., Yasuda, S., ..., & Kobayashi, S. (2001).
Coexpression of microsomal-type prostaglandin E synthase with cyclooxygenase-2 in brain endothelial cells of rats during endotoxin-induced fever. The Journal of neuroscience : the official journal of the Society for Neuroscience, 21(8), 2669-77. [PubMed:11306620] [PMC] [WorldCat] - ↑
Nakamura, K., Kaneko, T., Yamashita, Y., Hasegawa, H., Katoh, H., Ichikawa, A., & Negishi, M. (1999).
Immunocytochemical localization of prostaglandin EP3 receptor in the rat hypothalamus. Neuroscience letters, 260(2), 117-20. [PubMed:10025713] [WorldCat] [DOI] - ↑
Nakamura, K., Kaneko, T., Yamashita, Y., Hasegawa, H., Katoh, H., & Negishi, M. (2000).
Immunohistochemical localization of prostaglandin EP3 receptor in the rat nervous system. The Journal of comparative neurology, 421(4), 543-69. [PubMed:10842213] [WorldCat] [DOI] - ↑
Narumiya, S., Sugimoto, Y., & Ushikubi, F. (1999).
Prostanoid receptors: structures, properties, and functions. Physiological reviews, 79(4), 1193-226. [PubMed:10508233] [WorldCat] [DOI]
同義語:体温、体温調節、体温調節中枢
重要な関連語:発熱、高体温症、低体温症、熱産生、産熱、ふるえ、シバリング
(執筆者:中村和弘、担当編集委員:渡辺 大)