免疫グロブリンスーパーファミリー
古谷 裕、吉原 良浩
独立行政法人理化学研究所 脳科学総合研究センター
DOI:10.14931/bsd.2329 原稿受付日:2012年8月15日 原稿完成日:2012年9月26日
担当編集委員:柚崎 通介(慶應義塾大学 医学部生理学)
英語名: Immunoglobulin superfamily 独:Immungloblin-Superfamilie 仏:superfamille des immunoglobulines
免疫グロブリン様ドメイン(Igドメイン)を分子内に有する多種多様なタンパク質群を総称して、免疫グロブリンスーパーファミリー(Immunoglobulin superfamily: IgSF)と呼ぶ。免疫反応において抗体分子(免疫グロブリン)のIgドメインが抗原の認識と結合を司るように、多くのIgSF分子群はそれらのIgドメインを介して他の分子との接着や認識を行っている。IgSF分子群は神経系のみならず、免疫系や他の生体システムにおいても、細胞間の接着や認識などの重要な役割を担っている。多くのIgSF分子群は膜貫通領域あるいはGPIアンカー構造によって細胞形質膜に局在している。神経系においてIgSF分子群は、細胞外マトリックスタンパク質群や他の細胞接着分子群などと結合して、軸索の伸長・標的領域へのガイダンス、樹状突起の形成、さらにはシナプス構造の形成・成熟・可塑的変化など、様々な神経発達過程に関与している。IgSF分子群の細胞内領域には多様な機能ドメイン(酵素活性ドメイン、特異的分子結合ドメインなど)が存在し、細胞外でのリガンド分子との結合情報を細胞内シグナルに変換する働きや、アクチンなどの細胞骨格系と相互作用して神経突起の形成を促進するはたらきを持っている。IgSF分子群はプラナリアからヒトに至るほとんどすべての動物種において存在し、最も多様な分子ファミリーの1つを形成している。
構造
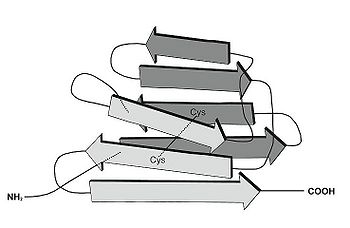
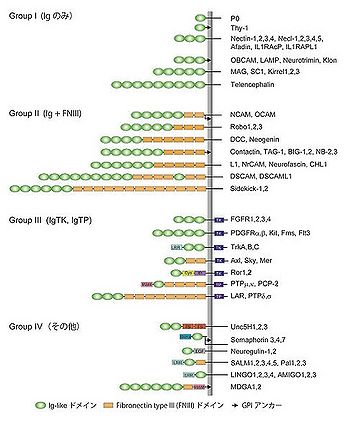
Igドメインは2つのβシートがサンドイッチのように合わさった球状構造を呈する。それぞれのβシートは3つから5つの逆並行βストランドから構成されている(図1)。一般的にIgドメインには2つのシステイン残基が保存されて存在しており、それらシステインのSH基を介したジスルフィド結合によって、Igドメインの球状構造が安定化されている[1][2]。神経系に発現するIgSF分子群は、構造的特徴から以下の4つのグループに大別することができる(図2)。
- グループⅠ:細胞外領域が1つあるいは複数のIgドメインだけから構成される分子群。
- グループⅡ:細胞外領域が複数のIgドメインと複数のフィブロネクチンⅢ型ドメイン(FNⅢドメイン)から構成される分子群。
- グループⅢ:細胞内領域にチロシンキナーゼ(TK)ドメインあるいはチロシンホスファターゼ(TP)ドメインを有する分子群。
- グループⅣ:細胞外領域にトロンボスポンジン様ドメイン、Semaドメイン、EGFドメイン、ロイシンンリッチリピート (LRR)、MAMドメインなどを含む分子群。
これらIgSF分子群の大部分はアミノ末端のシグナルペプチドと1つの膜貫通領域を有するI型膜タンパク質である。一方、一部のIgSF分子群はGPIアンカー構造を介して細胞膜のリン脂質に結合している(図2:→)。NCAMやOCAMでは、それぞれ1つの遺伝子からの選択的スプライシングによって膜貫通型とGPIアンカー型の2つのアイソフォームが神経細胞のタイプ特異的あるいは発達時期特異的に発現する。GPIアンカー型タンパク質は細胞膜のラフト構造に局在し、膜貫通型タンパク質と比較して細胞膜表面での移動の自由度が高い。またGPIアンカー型IgSF分子群は、ホスホリパーゼDを介したGPIアンカー部分の切断によって細胞外領域が膜から遊離され、分泌型リガンドとしての受容体への結合あるいはドミナントネガティブ分子としての接着阻害などの特徴的な機能を発現することがある。
機能
神経系においてIgSF分子群は、細胞間の接着と認識、軸索の伸長とガイダンス、樹状突起の形態形成、さらにはシナプスの形成や成熟などの様々な発達ステップにおいて重要な機能を果たしている。以下にIgSF分子群の代表的な3つの機能を紹介する。
細胞接着
インテグリンやカドヘリンなど他のファミリーに属する細胞接着分子群がMg2+やCa2+などの2価カチオン依存的に結合するのに対して、ほとんどのIgSF分子群の結合はカチオンを必要としない。細胞接着分子の結合様式には、同一細胞膜上に存在する分子間の結合(cis結合)と、対面する他の細胞に発現する分子との結合 (trans結合)があり、多くのIgSF分子群はこれら2種類両方の結合を担う。また、細胞外マトリックスタンパク質をリガンドとするIgSF分子群も数多く報告されている。
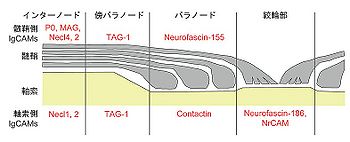
IgSF分子群が司る細胞接着の代表例として髄鞘(ミエリン:myelin)形成が挙げられる(図3)。末梢神経系においてはシュワン細胞、中枢神経系においてはオリゴデンドロサイトの細胞膜突起が幾重にもループのように軸索を取り巻くことで髄鞘が形成され、その部分が絶縁体の構造をとることで神経軸索における電気的信号の跳躍伝導に寄与している。隣り合う髄鞘の間は絞輪部(ノード:node)と呼ばれ、Na+チャネルとともにIgSFに属するニューロファシン-186やNrCAMが集積している。軸索と髄鞘の接着部分はパラノード(paranode)、傍パラノード(juxtaparanode)、インターノード(internode)に分けられる。
パラノードの髄鞘側にはニューロファシン-155が局在し、軸索側に発現するコンタクチンとヘテロフィリックな結合によって接着構造を形成する。傍パラノードでは、軸索と髄鞘の両側にTAG-1が局在して、ホモフィリックな結合を行っている。インターノードにおいては、P0のホモフィリックな相互作用が髄鞘の圧密化(compaction)を担い、さらにNecl同士の結合によって髄鞘と軸索との接着構造が形成される[3]。
軸索ガイダンス
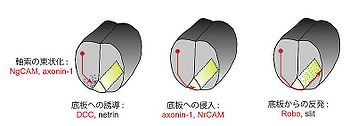
神経細胞はその軸索を、周囲に存在する様々な軸索誘引因子や軸索反発因子を認識しながら伸長させ、最終的に正しい標的細胞と機能的なシナプスを形成する。この軸索ガイダンス機構には多くのIgSF分子群が関与している。その代表例として脊髄における交連神経細胞の軸索投射が挙げられる(図4)。この過程では、NgCAM、アクソニン-1、DCC、NrCAM及びRoboなど多くのIgSF分子群が重要な働きを果たす。
脊髄の背側部に存在する交連神経細胞の軸索は、NgCAM及びアクソニン-1の作用によって束状化されながら、底板(floor plate)から分泌される誘引因子ネトリン(netrin)の濃度勾配に従って腹側方向へと伸長する。この時、ネトリンの受容体であるDCCが交連軸索に発現して機能している。次に、交連軸索に発現するアクソニン-1と底板に発現するNrCAMの相互作用によって、軸索の底板への侵入が起こる。
いったん正中線を横切って反対側へと到達した軸索は、吻側方向へと脳へと向けて伸長し、二度と同側に戻ることはない。これは底板から分泌される軸索反発因子スリット(slit)と軸索に発現するその受容体Roboの相互作用によるものである[4][5][6]。
軸索ガイダンスにおいてIgSF分子群が機能する別の例として、嗅上皮から嗅球へと至る一次嗅覚神経回路の構築メカニズムが挙げられる。特定の嗅覚受容体を発現する嗅細胞群は、それらの軸索を嗅球の同じ糸球体へと集束させる。これは脳における匂い情報コーディングおよびプロセシングの基盤となっており、Kirrel 2、Kirrel 3、BIG-2(コンタクチン4)などのIgSF分子群が標的糸球体への軸索集束過程において重要な役割を果たしている[7][8]。
樹状突起発達とシナプス形成
軸索ガイダンスにおける機能とともに、多くのIgSF分子群は樹状突起の発達およびシナプス形成過程においても重要な役割を果たしている。
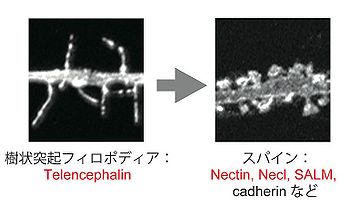
発達期において多くの神経細胞の樹状突起には、まるで薔薇の棘のように細く、長い突起構造が観察される。これは樹状突起フィロポディア(dendritic filopodia)と呼ばれ、その後スパインへと形態的かつ機能的に成熟して、シナプスの形成へと至る。テレンセファリン(Telencephalin; ICAM-5)は哺乳類終脳の神経細胞特異的な発現かつ樹状突起選択的な局在を示すIgSF分子である。テレンセファリンは、樹状突起フィロポディアに豊富に存在しており、樹状突起フィロポディアの形成及び維持を促進することで、スパインへの急速な成熟にブレーキをかけて臨界期を保つというユニークな機能を現す(図5)[9][10][11]。
特異的シナプスの形成過程においても多種多様なIgSF分子群が重要な役割を果たしている。Necl-2 (SynCAM 1)はシナプス前部と後部の両方に局在しており、ホモフィリックなcis結合及びtrans結合によって多量体を形成して、興奮性シナプスの形成を促進している[12]。Dscam, DscamL, Sidekick-1,-2はニワトリの網膜においてそれぞれ異なる介在神経細胞と網膜神経節細胞に発現しており、ホモフィリックな結合によってこれらの神経細胞間での特異的シナプス形成を制御している[13]。
PTPδはシナプス前部に局在しており、シナプス後部に局在するIL1RAPL1と、trans結合することによってシナプス形成を促進する。IL1RAPL1の遺伝子変異は非症候性精神遅滞や自閉症に関連している[14]。
SALMは軸索伸長及びシナプス形成に関与しており、特にSALM5遺伝子は自閉症や家族性統合失調症への関連が示唆されている[15]。
以上のようにIgSF分子群は様々な神経システムにおいて、神経細胞タイプ特異的な発現パターンを呈し、軸索を適切な方向へと伸長し、樹状突起の形態を構築し、標的細胞を正しく認識して機能的シナプス結合を形成するための目印になっていると考えられる。これらIgSF分子群の発現・機能障害は、神経回路の形成不全を招き、多様な精神疾患の一因となっていると考えられている。
関連項目
参考文献
- ↑
Brümmendorf, T., & Rathjen, F.G. (1994).
Cell adhesion molecules. 1: immunoglobulin superfamily. Protein profile, 1(9), 951-1058. [PubMed:8528906] [WorldCat] - ↑
Yoshihara, Y., Oka, S., Ikeda, J., & Mori, K. (1991).
Immunoglobulin superfamily molecules in the nervous system. Neuroscience research, 10(2), 83-105. [PubMed:1710044] [WorldCat] [DOI] - ↑
Salzer, J.L., Brophy, P.J., & Peles, E. (2008).
Molecular domains of myelinated axons in the peripheral nervous system. Glia, 56(14), 1532-40. [PubMed:18803321] [WorldCat] [DOI] - ↑
Colamarino, S.A., & Tessier-Lavigne, M. (1995).
The axonal chemoattractant netrin-1 is also a chemorepellent for trochlear motor axons. Cell, 81(4), 621-9. [PubMed:7758116] [WorldCat] [DOI] - ↑
Dickson, B.J., & Gilestro, G.F. (2006).
Regulation of commissural axon pathfinding by slit and its Robo receptors. Annual review of cell and developmental biology, 22, 651-75. [PubMed:17029581] [WorldCat] [DOI] - ↑
Stoeckli, E.T., & Landmesser, L.T. (1998).
Axon guidance at choice points. Current opinion in neurobiology, 8(1), 73-9. [PubMed:9568394] [WorldCat] [DOI] - ↑
Kaneko-Goto, T., Yoshihara, S., Miyazaki, H., & Yoshihara, Y. (2008).
BIG-2 mediates olfactory axon convergence to target glomeruli. Neuron, 57(6), 834-46. [PubMed:18367085] [WorldCat] [DOI] - ↑
Serizawa, S., Miyamichi, K., Takeuchi, H., Yamagishi, Y., Suzuki, M., & Sakano, H. (2006).
A neuronal identity code for the odorant receptor-specific and activity-dependent axon sorting. Cell, 127(5), 1057-69. [PubMed:17129788] [WorldCat] [DOI] - ↑
Barkat, T.R., Polley, D.B., & Hensch, T.K. (2011).
A critical period for auditory thalamocortical connectivity. Nature neuroscience, 14(9), 1189-94. [PubMed:21804538] [PMC] [WorldCat] [DOI] - ↑
Furutani, Y., Matsuno, H., Kawasaki, M., Sasaki, T., Mori, K., & Yoshihara, Y. (2007).
Interaction between telencephalin and ERM family proteins mediates dendritic filopodia formation. The Journal of neuroscience : the official journal of the Society for Neuroscience, 27(33), 8866-76. [PubMed:17699668] [PMC] [WorldCat] [DOI] - ↑
Matsuno, H., Okabe, S., Mishina, M., Yanagida, T., Mori, K., & Yoshihara, Y. (2006).
Telencephalin slows spine maturation. The Journal of neuroscience : the official journal of the Society for Neuroscience, 26(6), 1776-86. [PubMed:16467526] [PMC] [WorldCat] [DOI] - ↑
Robbins, E.M., Krupp, A.J., Perez de Arce, K., Ghosh, A.K., Fogel, A.I., Boucard, A., ..., & Biederer, T. (2010).
SynCAM 1 adhesion dynamically regulates synapse number and impacts plasticity and learning. Neuron, 68(5), 894-906. [PubMed:21145003] [PMC] [WorldCat] [DOI] - ↑
Yamagata, M., & Sanes, J.R. (2008).
Dscam and Sidekick proteins direct lamina-specific synaptic connections in vertebrate retina. Nature, 451(7177), 465-9. [PubMed:18216854] [WorldCat] [DOI] - ↑
Yoshida, T., Yasumura, M., Uemura, T., Lee, S.J., Ra, M., Taguchi, R., ..., & Mishina, M. (2011).
IL-1 receptor accessory protein-like 1 associated with mental retardation and autism mediates synapse formation by trans-synaptic interaction with protein tyrosine phosphatase δ. The Journal of neuroscience : the official journal of the Society for Neuroscience, 31(38), 13485-99. [PubMed:21940441] [PMC] [WorldCat] [DOI] - ↑
Nam, J., Mah, W., & Kim, E. (2011).
The SALM/Lrfn family of leucine-rich repeat-containing cell adhesion molecules. Seminars in cell & developmental biology, 22(5), 492-8. [PubMed:21736948] [WorldCat] [DOI]