「全反射顕微鏡」の版間の差分
細編集の要約なし |
細編集の要約なし |
||
| (2人の利用者による、間の5版が非表示) | |||
| 1行目: | 1行目: | ||
<div align="right"> | |||
<font size="+1">[http://researchmap.jp/7000004457 畠山 裕康]</font><br> | |||
''東北大学 大学院医工学研究科 医工学専攻 生体機械システム医工学講座 病態ナノシステム医工学分野''<br> | |||
DOI:<selfdoi /> 原稿受付日:2012年6月22日 原稿完成日:2012年7月18日<br> | |||
担当編集委員:[http://researchmap.jp/haruokasai 河西 春郎](東京大学 大学院医学系研究科)<br> | |||
</div> | |||
英:total internal reflection fluorescence microscopy 独:interne Totalreflexionsfluoreszenzmikroskopie 仏:microscope de fluorescence par réflexion totale interne 英略語:TIRF microscopy, TIRFM<br> | |||
同義語:全反射照明蛍光顕微鏡、エバネッセント場顕微鏡 (Evanescent wave microscopy)<br> | |||
{{box|text= | |||
全反射蛍光顕微鏡は、細胞とカバーガラスとの接着面のごく近傍で起こる分子・細胞内器官の動態や基板表面における1分子[[wikipedia:ja:蛍光|蛍光]]の観察の際に広く用いられている蛍光顕微鏡である。この蛍光顕微鏡では、光が屈折率の異なる界面において全反射するときに反対側にわずかにしみ出す光([[wikipedia:ja:エバネッセント光|エバネッセント光]])を励起光として利用することで、界面のごく近傍のみが照明される。したがって、照明領域以外に存在する蛍光分子の励起を避け、背景光を極めて低減させることが可能となる。 | |||
}} | |||
== | == 全反射顕微鏡とは == | ||
全反射蛍光顕微鏡は、細胞とカバーガラスとの接着面のごく近傍で起こる分子・細胞内器官の動態や基板表面における1分子蛍光の観察の際に広く用いられている蛍光顕微鏡である。現在までに、以下のような細胞機能等広い領域において全反射顕微鏡を用いた可視化が行われている。個々の具体例については、参考文献を参照のこと<ref><pubmed>19118676</pubmed></ref>。 | |||
*[[開口放出]](exocytosis)/[[エンドサイトーシス]] | |||
*[[細胞接着]]/[[細胞骨格]] | |||
*[[シグナル伝達]]([[カルシウム|Ca<sup>2+</sup>]]、[[cAMP]]など) | |||
== | == 原理と特徴 == | ||
=== 全反射 === | |||
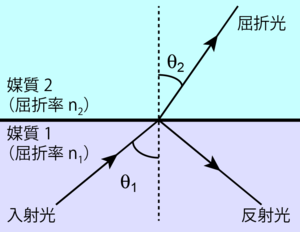
[[Image:TIRF Fig1.png|thumb|<b>図1 光の屈折と反射</b>]] | |||
[[wikipedia:ja:屈折率|屈折率]]の異なる2つの媒質(媒質1、媒質2)の界面に対し斜めに光を入射させると、屈折光と反射光が発生する。2つの媒質の屈折率をそれぞれn<sub>1</sub>、n<sub>2</sub>、入射角をθ<sub>1</sub>、屈折角をθ<sub>2</sub>としたとき、これらの間には[[wikipedia:ja:スネルの法則|スネルの法則]] <br> | |||
::<math>\dfrac{\sin \theta_1}{\sin \theta_2} = \dfrac{n_2}{n_1}</math><br> | |||
[[ | が成立する(図1)。屈折角θ<sub>2</sub>が90°になるときの入射角を特に'''[[wikipedia:ja:臨界角|臨界角]](critical angle)'''といい、<br> | ||
= | ::<math>\theta_C = \sin^{-1} \left( \dfrac{n_2}{n_1} \right)</math><br> | ||
で示される(ただしθ<sub>C</sub>:臨界角)。2つの媒質の屈折率がn<sub>1</sub>>n<sub>2</sub>を満たすとき、θ<sub>1</sub>>θ<sub>C</sub>の条件で光が入射すると、媒質2には光は透過せず、すべてが反射する。この現象が'''全反射(total internal reflection)'''である。ガラス(n<sub>1</sub>=1.52)と水(n<sub>2</sub>=1.33)の間における臨界角は約61°となる。 | |||
=== | === 界面におけるエバネッセント場の形成 === | ||
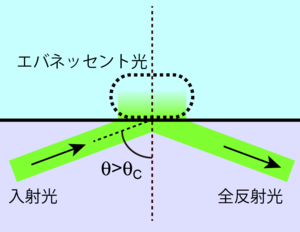
[[Image:TIRF Fig2.png|thumb|<b>図2 全反射</b>]] | |||
< | |||
図2のようにガラス面に臨界角以上の角度で光を入射させ、全反射させた場合に試料側で起こる現象を考える。このとき、ガラス側に存在する光が試料側で急にゼロになるということは起こらず(光を含む電磁波は電荷のない界面においては連続的に変化する)、試料側へと光がしみ出す(図2)。このしみ出した光をエバネッセント光と呼び、全反射蛍光顕微鏡ではこの光を励起光として利用する。 エバネッセント光の強度は全反射面からの距離の関数であり、<br> | |||
::<math>I(z)=I_0 \exp \left(- \dfrac{z}{d}\right)</math><br> | |||
::<math>d=\dfrac{\lambda}{4\pi \sqrt{n_1^2 \sin^2 \theta_1-n_2^2}}</math><br> | |||
で示される。(ただし、I(z): 全反射面からの距離zにおけるエバネッセント光強度、I<sub>0</sub>: 全反射面における光の強度、d: 光の強度が1/eとなる界面からの距離、λ: 入射光の波長)。たとえばガラス(n<sub>1</sub>=1.52)と水(n<sub>2</sub>=1.33)の間に形成されたエバネッセント光がしみ出す深さdは、励起光として可視光を用いた場合にはおよそ50–200 nmとなる。 | |||
=== 特徴 === | |||
上に示したように、エバネッセント光強度は界面から遠ざかるにつれて急速に減衰する。また、エバネッセント光強度は、界面において最大で入射光の約4倍に強くなる<ref>'''鶴田匡夫'''<br/>応用光学I<br/>''培風館'':1990</ref>。したがって、界面のごく近傍に存在する蛍光分子のみを効率的に励起できる一方で背景光となる深部に存在する蛍光分子の励起は少なく、高いコントラストで蛍光を観察することが可能となる。 | |||
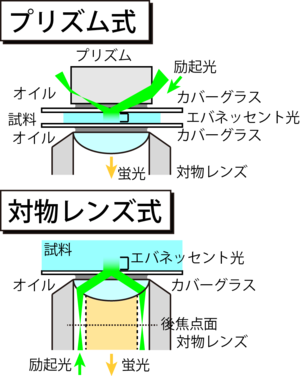
[[Image:TIRF Fig3.png|thumb|<b>図3 励起方式</b>]] | |||
== 装置構成 == | |||
全反射蛍光顕微鏡は、基本的には通常の[[wikipedia:ja:蛍光顕微鏡|蛍光顕微鏡]]と同様に[[wikipedia:ja:顕微鏡|顕微鏡]]本体と励起光源・検出器([[wikipedia:ja:CCDカメラ|CCDカメラ]])から構成され、ここに全反射を実現するための光学系を組み込むことによって構築可能である。各顕微鏡メーカーからもシステムとして市販されている。励起光源にはレーザー光が広く用いられるが、[[wikipedia:ja:水銀ランプ|水銀ランプ]]や[[wikipedia:ja:キセノンランプ|キセノンランプ]]などの[[wikipedia:ja:アーク光源|アーク光源]]でも実現可能である。 | |||
=== 励起方式 === | |||
全反射照明を達成するための励起光の導入方式には、「プリズム式」と「対物レンズ式」の2種類が存在する(図3)。プリズム式は比較的安価に構築でき、背景光を低減できること、入射角を幅広く確保できることなどの利点があるが、試料上方の空間が塞がれてしまうために試料操作が困難であることが欠点である。一方で対物レンズ式は試料上方に空間が得られ、溶液交換や電極設置などの操作が容易に行える。またこの方式ではレーザー光の入射位置を調節するだけで容易に全反射照明と落射照明とを切り替えることが可能である。このような操作性の高さから、複数の顕微鏡メーカーから市販されている全反射蛍光顕微鏡システムでは「対物レンズ式」が用いられている。 | |||
=== 対物レンズの選択 === | |||
[[Image:TIRF Fig4.png|thumb|<b>図4 満たすべき対物レンズの要件</b>]] 全反射蛍光顕微鏡を構築する際に重要となる試料への励起光導入条件は以下の2点である。<br> | |||
*臨界角以上の角度での照射<br> | |||
*試料の均一な照明<br> | |||
対物レンズ式全反射蛍光顕微鏡においてこれらの条件を満たすためには、励起光を対物レンズの後焦点面の辺縁部へと集光すれば良い。「辺縁部」とは、具体的には対物レンズ中心軸からの距離が試料の屈折率で決まるd<sub>n2</sub>と対物レンズの[[wikipedia:ja:開口数|開口数]](Numerical Aperture; NA)で決まるd<sub>NA</sub>の間、である(図4)。このため、この方式の全反射蛍光顕微鏡で用いられる対物レンズは、開口数が試料の屈折率よりも大きいものであることが必須である。各顕微鏡メーカーから1.65/1.49/1.45といった高い開口数を持つ対物レンズが市販されており、目的に応じてこれらの対物レンズを選択すると良い。 | |||
== 参考文献 == | |||
<references /> | |||
2014年6月6日 (金) 16:31時点における最新版
畠山 裕康
東北大学 大学院医工学研究科 医工学専攻 生体機械システム医工学講座 病態ナノシステム医工学分野
DOI:10.14931/bsd.2005 原稿受付日:2012年6月22日 原稿完成日:2012年7月18日
担当編集委員:河西 春郎(東京大学 大学院医学系研究科)
英:total internal reflection fluorescence microscopy 独:interne Totalreflexionsfluoreszenzmikroskopie 仏:microscope de fluorescence par réflexion totale interne 英略語:TIRF microscopy, TIRFM
同義語:全反射照明蛍光顕微鏡、エバネッセント場顕微鏡 (Evanescent wave microscopy)
全反射蛍光顕微鏡は、細胞とカバーガラスとの接着面のごく近傍で起こる分子・細胞内器官の動態や基板表面における1分子蛍光の観察の際に広く用いられている蛍光顕微鏡である。この蛍光顕微鏡では、光が屈折率の異なる界面において全反射するときに反対側にわずかにしみ出す光(エバネッセント光)を励起光として利用することで、界面のごく近傍のみが照明される。したがって、照明領域以外に存在する蛍光分子の励起を避け、背景光を極めて低減させることが可能となる。
全反射顕微鏡とは
全反射蛍光顕微鏡は、細胞とカバーガラスとの接着面のごく近傍で起こる分子・細胞内器官の動態や基板表面における1分子蛍光の観察の際に広く用いられている蛍光顕微鏡である。現在までに、以下のような細胞機能等広い領域において全反射顕微鏡を用いた可視化が行われている。個々の具体例については、参考文献を参照のこと[1]。
原理と特徴
全反射
屈折率の異なる2つの媒質(媒質1、媒質2)の界面に対し斜めに光を入射させると、屈折光と反射光が発生する。2つの媒質の屈折率をそれぞれn1、n2、入射角をθ1、屈折角をθ2としたとき、これらの間にはスネルの法則
が成立する(図1)。屈折角θ2が90°になるときの入射角を特に臨界角(critical angle)といい、
で示される(ただしθC:臨界角)。2つの媒質の屈折率がn1>n2を満たすとき、θ1>θCの条件で光が入射すると、媒質2には光は透過せず、すべてが反射する。この現象が全反射(total internal reflection)である。ガラス(n1=1.52)と水(n2=1.33)の間における臨界角は約61°となる。
界面におけるエバネッセント場の形成
図2のようにガラス面に臨界角以上の角度で光を入射させ、全反射させた場合に試料側で起こる現象を考える。このとき、ガラス側に存在する光が試料側で急にゼロになるということは起こらず(光を含む電磁波は電荷のない界面においては連続的に変化する)、試料側へと光がしみ出す(図2)。このしみ出した光をエバネッセント光と呼び、全反射蛍光顕微鏡ではこの光を励起光として利用する。 エバネッセント光の強度は全反射面からの距離の関数であり、
で示される。(ただし、I(z): 全反射面からの距離zにおけるエバネッセント光強度、I0: 全反射面における光の強度、d: 光の強度が1/eとなる界面からの距離、λ: 入射光の波長)。たとえばガラス(n1=1.52)と水(n2=1.33)の間に形成されたエバネッセント光がしみ出す深さdは、励起光として可視光を用いた場合にはおよそ50–200 nmとなる。
特徴
上に示したように、エバネッセント光強度は界面から遠ざかるにつれて急速に減衰する。また、エバネッセント光強度は、界面において最大で入射光の約4倍に強くなる[2]。したがって、界面のごく近傍に存在する蛍光分子のみを効率的に励起できる一方で背景光となる深部に存在する蛍光分子の励起は少なく、高いコントラストで蛍光を観察することが可能となる。
装置構成
全反射蛍光顕微鏡は、基本的には通常の蛍光顕微鏡と同様に顕微鏡本体と励起光源・検出器(CCDカメラ)から構成され、ここに全反射を実現するための光学系を組み込むことによって構築可能である。各顕微鏡メーカーからもシステムとして市販されている。励起光源にはレーザー光が広く用いられるが、水銀ランプやキセノンランプなどのアーク光源でも実現可能である。
励起方式
全反射照明を達成するための励起光の導入方式には、「プリズム式」と「対物レンズ式」の2種類が存在する(図3)。プリズム式は比較的安価に構築でき、背景光を低減できること、入射角を幅広く確保できることなどの利点があるが、試料上方の空間が塞がれてしまうために試料操作が困難であることが欠点である。一方で対物レンズ式は試料上方に空間が得られ、溶液交換や電極設置などの操作が容易に行える。またこの方式ではレーザー光の入射位置を調節するだけで容易に全反射照明と落射照明とを切り替えることが可能である。このような操作性の高さから、複数の顕微鏡メーカーから市販されている全反射蛍光顕微鏡システムでは「対物レンズ式」が用いられている。
対物レンズの選択
全反射蛍光顕微鏡を構築する際に重要となる試料への励起光導入条件は以下の2点である。
- 臨界角以上の角度での照射
- 試料の均一な照明
対物レンズ式全反射蛍光顕微鏡においてこれらの条件を満たすためには、励起光を対物レンズの後焦点面の辺縁部へと集光すれば良い。「辺縁部」とは、具体的には対物レンズ中心軸からの距離が試料の屈折率で決まるdn2と対物レンズの開口数(Numerical Aperture; NA)で決まるdNAの間、である(図4)。このため、この方式の全反射蛍光顕微鏡で用いられる対物レンズは、開口数が試料の屈折率よりも大きいものであることが必須である。各顕微鏡メーカーから1.65/1.49/1.45といった高い開口数を持つ対物レンズが市販されており、目的に応じてこれらの対物レンズを選択すると良い。
参考文献
- ↑
Axelrod, D. (2008).
Chapter 7: Total internal reflection fluorescence microscopy. Methods in cell biology, 89, 169-221. [PubMed:19118676] [WorldCat] [DOI] - ↑ 鶴田匡夫
応用光学I
培風館:1990