分裂促進因子活性化タンパク質キナーゼ
石川 広幸、名黒 功、一條 秀憲
東京大学 大学院薬学系研究科 細胞情報学教室
DOI:10.14931/bsd.1583 原稿受付日:2012年5月30日 原稿完成日:2015年1月27日
担当編集委員:柚崎 通介(慶應義塾大学 医学部生理学)
英語名:Mitogen-activated Protein Kinase 英語略名:MAPK、MAP kinase
同義語:MAPキナーゼ、マイトジェン活性化プロテインキナーゼ
分裂促進因子活性化タンパク質キナーゼ (Mitogen-activated Protein Kinase, MAPK) とは様々な刺激によって活性化されるセリン/スレオニンキナーゼの一種で、活性化されたMAPKは転写因子などの基質をリン酸化し、増幅されたシグナルが核に伝わることで、基質や刺激に応じた細胞増殖や細胞分化、アポトーシスなどのストレス応答反応を引き起こす。
MAPKとは
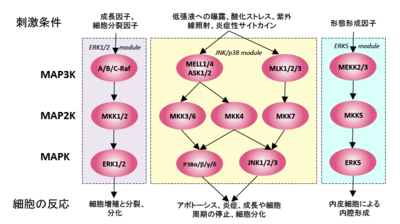
MAPKは様々な刺激によって活性化されるセリン/スレオニンキナーゼの一種で、上流のセリン/スレオニン/チロシンキナーゼであるMAPKキナーゼ (MAPK Kinase, MAPKK) によるリン酸化を受けて活性化し、さらにMAPKKは上流のMAPKKキナーゼ (MAPKK Kinase, MAPKKK) によるリン酸化を受けて活性化する。この一連のリン酸化シグナルカスケードはMAPキナーゼカスケードと呼ばれ、酵母から哺乳類に至るまで真核生物において進化的に高度に保存されたシグナル伝達経路である。MAPキナーゼはその活性化にキナーゼサブドメインⅦとⅧの間の活性化ループに存在するスレオニン/チロシン両残基のリン酸化を必要とするが、それら特徴を備えたMAPキナーゼは、分子のアミノ酸の一次配列の相同性に基づいて細胞外シグナル調節キナーゼ (Extracellular Signal-regulated Kinase, ERK)、p38、c-Jun N端末キナーゼ (c-Jun N-terminal kinase, JNK) に分類される。
ERK
ERKとは
ERKはEGFや血清刺激、酸化ストレスなどによって活性化されるMAPKのサブファミリーで、ERKはその関わるシグナル伝達経路の違いからERK1/2, ERK5, ERK7, ERK8に分けられる。上皮増殖促進因子受容体 (Epidermal Growth Factor Receptor, EGFR) などのチロシンキナーゼ受容体にリガンドが結合することでシグナルが流れた結果、ERKの活性化ループに存在するTEYモチーフがリン酸化されて活性化する。
ERK1/2は分子量が44 kDaのERK1と42 kDaのERK2から成り、アミノ酸配列の一次構造は互いに85%の相同性を有する。上流のMAPKKKはRafやMos、MAPKKはMEK1/2で、ERK1/2はEGF刺激などの結果MEK1/2にリン酸化されて活性化すると、Elk1やc-Mycなどの転写因子、またはRSKなどのリン酸化酵素をリン酸化することで細胞増殖シグナルを活性化する。
ERK5は、N端はERK1/2と高い相同性を示すがC末はERK1/2に比べて長く、分子量は115 kDaと他のMAPKの約2倍の大きさである。上流のMAPKKKはMEKK2とMEKK3、MAPKKはMEK5であり、酸化ストレスや血清刺激、EGF刺激によって活性化されるとSap1a, c-Myc, RSKなどの基質をリン酸化し、ERK1/2同様に細胞増殖シグナルを活性化する。
ERK7は他のERK分子同様リン酸化をうけるTEYモチーフを持つが、上流の活性化因子は報告されておらず、自己リン酸化によって活性化されることが知られている[1]。他のERK分子と異なりEGF刺激による活性化は起こらないが、血清飢餓刺激によって活性化されることが知られている[2]。
ERK8は約60 kDaのタンパク質で、ERK7とアミノ酸の一次配列において約69 %の相同性をもつ。ERK8はERK7同様上流のMAPKKが報告されておらず、またEGFやPMA刺激による活性変化はほぼ見られない。過酸化水素や浸透圧刺激によって活性化されるが、その活性化の生理的な意義は未だよくわかっていない[3]。
神経系とERKの関わり
ERK1/2が神経系に及ぼす多くの影響が報告されている。神経伝達物質によってERKが活性化されることが知られており、興奮性神経伝達を担うグルタミン酸受容体においては、NMDA型と代謝型の受容体が共にERK1/2の活性化に寄与していると言われている[4]。グルタミン酸受容体の活性化に伴うカルシウムの細胞質への流入やPKAの活性化によって活性化されたERK1/2はCREBのリン酸化などを通して様々な遺伝子の発現制御を行っている。
シナプス可塑性とERK1/2の関連性も報告されている。マウス海馬ではNMDA型グルタミン酸受容体が活性化されると長期増強(Long-term potentiation: LTP)と呼ばれるシナプス可塑性現象が起きるが、このときにシナプス後神経細胞ではERK1/2が活性化されており、逆にERK1/2の活性を阻害することでNMDA型受容体依存的な長期増強が抑制される[5]。また、ラットにおいても海馬のシナプスを高頻度電気刺激することで長期増強が誘導されるが、この時にもERK2が活性化され、その阻害によって長期増強が阻害される[6] [7]。一方、小脳プルキンエ細胞においては、平行線維の活動とプルキンエ細胞の脱分極が同時に起きることによって平行線維ープルキンエ細胞シナプスのおいて長期抑圧(Long-term depression: LTD)という、長期増強とは逆方向のシナプス可塑性が起きる。この際にもプルキンエ細胞においてERK1/2が活性化され、逆にERK1/2を阻害すると長期抑圧は起きない[8] [9]。その他、ERKの活性がAMPA型グルタミン酸受容体の輸送や樹状突起の構造変化において重要な役割を果たすという報告もなされている[10] [11]。
ERK5は発生初期の脳において発現が強く見られ、脳の皮質幹細胞が神経細胞に分化する過程にその活性が重要であることが示されている[12]。また、ERK1とERK2は脳においてcAMPや神経栄養因子、皮質ニューロンの活性化によって活性化されるが、ERK5は神経栄養因子によってのみ活性化される[13] 。神経栄養因子とERK5の関係については、神経栄養因子飢餓状態の脳の皮質ニューロンに脳由来神経栄養因子 (brain-derived neurotrophic factor, BDNF) を添加することでBDNFによる神経保護が引き起こされるのだが、この過程においてERK5の活性化によってMEF2を介した遺伝子発現が誘導されることが重要であると示唆されている[14]。その他、自殺者の視床下部においてERK5とその上流のMAPKKであるMEK5の活性が低下傾向にあること、ERK5のmRNAとタンパク質の量が減少していることなどが示唆されている[15]。ERK7、ERK8に関しては、脳において機能的な役割を果たしているという報告はなされていない。
p38
p38とは
p38はα, β, δ, γの4種類のアイソフォームを持つMAPKのサブファミリーで、様々な環境ストレスや炎症性サイトカインによって活性化される。p38を活性化するほとんどのストレスはJNKも活性化する。上流のMAPKKはMKK3とMKK6であり、MKK3はp38αとp38βのみを活性化させるがMKK6は全てのアイソフォームを活性化させられる。上流のMAPKKKはASK1やTAK1、TAOやMEKK4など様々な分子が知られており、それぞれのMAPKKKに応じた活性化刺激によって下流にシグナルが伝えられ、p38が活性化された結果MAPKAPKやATF2などの様々な基質がリン酸化され、ストレス応答反応が引き起こされる[16]。
神経系とp38との関わり
海馬CA1ではシェファー側枝を低頻度刺激すると長期抑圧が起きるが、この際にシナプス後部細胞においてp38が活性化され、逆にp38を阻害すると長期抑圧が起きないことが明らかになっている[17]。一方小脳プルキンエ細胞における長期抑圧にはp38は関与しない[8]。神経細胞においてp38が酸化ストレスや炎症性サイトカイン刺激によって活性化すると、細胞骨格タンパク質のリン酸化、サイトカインの産生やNOSの発現を介するNOの産生によって神経変性を促進することが知られている。
筋萎縮性側索硬化症 (amyotrophic lateral sclerosis, ALS) はその発症原因として運動神経の細胞死との関連が示唆されているが、ALSのモデルとして用いられているSOD1変異体を発現しているトランスジェニックマウスにおいては、ALSの進行時のマウスの腰髄に存在する運動神経にp38が多量に発現していることから、ALSの進行とp38の関連が示唆されている[18]。
神経障害性疼痛の症状を呈する患者に対してp38の阻害剤の経口投与を行った臨床実験においては、対照群と比較して有意に痛みが減少したという報告もなされている[19]。神経細胞周囲においてグルタミン酸濃度が高濃度に達することでグルタミン酸興奮毒性が起こるが、その結果引き起こされる神経細胞のアポトーシスの過程においてRhoキナーゼの活性化に伴うp38の活性化の必要性が示唆されている[20]。
JNK
JNKとは
JNKは哺乳類ではjnk1, jnk2, jnk3の3つの遺伝子を持ち、それぞれに代表的な分子量46 kDaと54 kDaのアイソフォームを含めて複数のスプライシングフォームが存在する[21]。シクロヘキシミドを用いたタンパク質合成阻害刺激によって活性化するキナーゼとして同定され、その後温度刺激や酸化ストレス、機械的刺激などの多くのストレス刺激に対して活性化することが明らかになった[22]。上流のMAPKKはSEK1 (MKK4) とMKK7、上流のMAPKKKはMEKK1、ASK1、MLK2やMLK3などであり、それぞれのMAPKKKに応じた活性化刺激によって下流にシグナルが伝達され、JNKが活性化された結果c-JunやATF2、Elk1など転写因子を含む様々な基質がリン酸化され、ストレス応答反応が引き起こされる。JNK1とJNK2はユビキタスに発現が見られるが、JNK3は脳、心臓、睾丸において選択的に発現している。
神経系とJNKとの関わり
遺伝子欠損マウスの実験の結果、JNK1, JNK2, JNK3は脳において異なる役割を果たすことが明らかになっている。グルタミン酸受容体のアゴニストであるカイニン酸はマウスに投与するとけいれん発作を引き起こすが、このときに海馬において神経細胞のアポトーシスが起こることが知られている。しかし、JNK3のノックアウトマウスはカイニン酸によるけいれん発作に対して抵抗性を示し、さらに海馬の神経細胞におけるアポトーシスも減弱していることが明らかになっている[23]。また、各アイソフォームを組み合わせたダブルノックアウトマウスの解析から、JNK1とJNK2のどちらかが存在することが脳の発生時に必要なアポトーシスにおいて重要であることが示されている[24][25]。JNK1とJNK2のダブルノックアウトマウスは胚性致死であるが、これは脳幹形成時の後脳におけるアポトーシスが起こらないことが原因である[26][27]。しかしこの変異体の前脳においてはアポトーシスが亢進しており、JNK1とJNK2が前脳と後脳におけるアポトーシスを逆向きに調節していることが示唆されている。
その他、BDNFが神経細胞に作用することが軸索の分岐や軸索の伸長に重要であるが、BDNF刺激によって神経細胞内で脱リン酸化酵素であるMKP-1の発現が誘導され、そのMKP-1によってJNKが脱リン酸化により不活性化される。この結果、JNKの基質であるスタスミンがリン酸化できずに微小管の安定性が低下して軸索分岐や伸長が引き起こされることが、MKP-1のノックアウトマウス由来の神経細胞を用いた実験によって明らかになっている[28]。線虫における神経損傷後において、成長因子であるSVH-1がその受容体であるSVH-2に作用することで神経再生が起こるが、その過程でJNKが活性化されることの重要性が示唆されている[29]。神経変性疾患とJNKの関連も報告があり、ハンチントン病の病原因子である変異ハンチントンタンパク質 (Htt) は速い軸索輸送を阻害することでハンチントン病を引き起こすという仮説が立てられているが、このHttが神経細胞軸索のJNK3を特異的に活性化し、JNK3の基質であるキネシン1のモータードメインがリン酸化されることでキネシン1が微小管に結合するのが阻害され、速い軸索輸送が阻害されているという報告がなされている[30]。
神経細胞におけるMAPKの相互作用
虚血状態や損傷をうけた脳において、神経細胞はアポトーシスによる神経細胞死を引き起こすが、この神経細胞死を引き起こす過程においてMAPKは重要な役割を果たしている。神経細胞分化のモデルとして用いられるPC12細胞は神経成長因子 (NGF) 飢餓刺激によってアポトーシスが引き起こされるが、NGF飢餓刺激によってp38とJNKの持続的な活性化とERKの持続的な不活性化が引き起こされる。このときp38またはJNKの活性を阻害すること、またはERKを強制的に活性化することでアポトーシスが起こらなくなることなどから、MAPKの分子間での活性化と不活性化のバランスが神経細胞死において重要であることが示唆されている[31]。
関連項目
参考文献
- ↑
Abe, M.K., Kahle, K.T., Saelzler, M.P., Orth, K., Dixon, J.E., & Rosner, M.R. (2001).
ERK7 is an autoactivated member of the MAPK family. The Journal of biological chemistry, 276(24), 21272-9. [PubMed:11287416] [WorldCat] [DOI] - ↑
Abe, M.K., Kuo, W.L., Hershenson, M.B., & Rosner, M.R. (1999).
Extracellular signal-regulated kinase 7 (ERK7), a novel ERK with a C-terminal domain that regulates its activity, its cellular localization, and cell growth. Molecular and cellular biology, 19(2), 1301-12. [PubMed:9891064] [PMC] [WorldCat] [DOI] - ↑
Klevernic, I.V., Stafford, M.J., Morrice, N., Peggie, M., Morton, S., & Cohen, P. (2006).
Characterization of the reversible phosphorylation and activation of ERK8. The Biochemical journal, 394(Pt 1), 365-73. [PubMed:16336213] [PMC] [WorldCat] [DOI] - ↑
Roberson, E.D., English, J.D., Adams, J.P., Selcher, J.C., Kondratick, C., & Sweatt, J.D. (1999).
The mitogen-activated protein kinase cascade couples PKA and PKC to cAMP response element binding protein phosphorylation in area CA1 of hippocampus. The Journal of neuroscience : the official journal of the Society for Neuroscience, 19(11), 4337-48. [PubMed:10341237] [PMC] [WorldCat] - ↑
Schmitt, J.M., Guire, E.S., Saneyoshi, T., & Soderling, T.R. (2005).
Calmodulin-dependent kinase kinase/calmodulin kinase I activity gates extracellular-regulated kinase-dependent long-term potentiation. The Journal of neuroscience : the official journal of the Society for Neuroscience, 25(5), 1281-90. [PubMed:15689566] [PMC] [WorldCat] [DOI] - ↑
English, J.D., & Sweatt, J.D. (1996).
Activation of p42 mitogen-activated protein kinase in hippocampal long term potentiation. The Journal of biological chemistry, 271(40), 24329-32. [PubMed:8798683] [WorldCat] [DOI] - ↑
English, J.D., & Sweatt, J.D. (1997).
A requirement for the mitogen-activated protein kinase cascade in hippocampal long term potentiation. The Journal of biological chemistry, 272(31), 19103-6. [PubMed:9235897] [WorldCat] [DOI] - ↑ 8.0 8.1
Ito-Ishida, A., Kakegawa, W., & Yuzaki, M. (2006).
ERK1/2 but not p38 MAP kinase is essential for the long-term depression in mouse cerebellar slices. The European journal of neuroscience, 24(6), 1617-22. [PubMed:17004925] [WorldCat] [DOI] - ↑
Tanaka, K., & Augustine, G.J. (2008).
A positive feedback signal transduction loop determines timing of cerebellar long-term depression. Neuron, 59(4), 608-20. [PubMed:18760697] [PMC] [WorldCat] [DOI] - ↑
Zhu, J.J., Qin, Y., Zhao, M., Van Aelst, L., & Malinow, R. (2002).
Ras and Rap control AMPA receptor trafficking during synaptic plasticity. Cell, 110(4), 443-55. [PubMed:12202034] [WorldCat] [DOI] - ↑
Wu, G.Y., Deisseroth, K., & Tsien, R.W. (2001).
Spaced stimuli stabilize MAPK pathway activation and its effects on dendritic morphology. Nature neuroscience, 4(2), 151-8. [PubMed:11175875] [WorldCat] [DOI] - ↑
Liu, L., Cundiff, P., Abel, G., Wang, Y., Faigle, R., Sakagami, H., ..., & Xia, Z. (2006).
Extracellular signal-regulated kinase (ERK) 5 is necessary and sufficient to specify cortical neuronal fate. Proceedings of the National Academy of Sciences of the United States of America, 103(25), 9697-702. [PubMed:16766652] [PMC] [WorldCat] [DOI] - ↑
Su, C., Underwood, W., Rybalchenko, N., & Singh, M. (2011).
ERK1/2 and ERK5 have distinct roles in the regulation of brain-derived neurotrophic factor expression. Journal of neuroscience research, 89(10), 1542-50. [PubMed:21647938] [WorldCat] [DOI] - ↑
Liu, L., Cavanaugh, J.E., Wang, Y., Sakagami, H., Mao, Z., & Xia, Z. (2003).
ERK5 activation of MEF2-mediated gene expression plays a critical role in BDNF-promoted survival of developing but not mature cortical neurons. Proceedings of the National Academy of Sciences of the United States of America, 100(14), 8532-7. [PubMed:12826611] [PMC] [WorldCat] [DOI] - ↑
Dwivedi, Y., Rizavi, H.S., Teppen, T., Sasaki, N., Chen, H., Zhang, H., ..., & Pandey, G.N. (2007).
Aberrant extracellular signal-regulated kinase (ERK) 5 signaling in hippocampus of suicide subjects. Neuropsychopharmacology : official publication of the American College of Neuropsychopharmacology, 32(11), 2338-50. [PubMed:17342168] [WorldCat] [DOI] - ↑
Kyriakis, J.M., & Avruch, J. (2001).
Mammalian mitogen-activated protein kinase signal transduction pathways activated by stress and inflammation. Physiological reviews, 81(2), 807-69. [PubMed:11274345] [WorldCat] [DOI] - ↑
Bolshakov, V.Y., Carboni, L., Cobb, M.H., Siegelbaum, S.A., & Belardetti, F. (2000).
Dual MAP kinase pathways mediate opposing forms of long-term plasticity at CA3-CA1 synapses. Nature neuroscience, 3(11), 1107-12. [PubMed:11036267] [WorldCat] [DOI] - ↑
Tortarolo, M., Veglianese, P., Calvaresi, N., Botturi, A., Rossi, C., Giorgini, A., ..., & Bendotti, C. (2003).
Persistent activation of p38 mitogen-activated protein kinase in a mouse model of familial amyotrophic lateral sclerosis correlates with disease progression. Molecular and cellular neurosciences, 23(2), 180-92. [PubMed:12812752] [WorldCat] - ↑
Anand, P., Shenoy, R., Palmer, J.E., Baines, A.J., Lai, R.Y., Robertson, J., ..., & Chizh, B.A. (2011).
Clinical trial of the p38 MAP kinase inhibitor dilmapimod in neuropathic pain following nerve injury. European journal of pain (London, England), 15(10), 1040-8. [PubMed:21576029] [WorldCat] [DOI] - ↑
Semenova, M.M., Mäki-Hokkonen, A.M., Cao, J., Komarovski, V., Forsberg, K.M., Koistinaho, M., ..., & Courtney, M.J. (2007).
Rho mediates calcium-dependent activation of p38alpha and subsequent excitotoxic cell death. Nature neuroscience, 10(4), 436-43. [PubMed:17369826] [WorldCat] [DOI] - ↑
Waetzig, V., & Herdegen, T. (2005).
Context-specific inhibition of JNKs: overcoming the dilemma of protection and damage. Trends in pharmacological sciences, 26(9), 455-61. [PubMed:16054242] [WorldCat] [DOI] - ↑
Adler, V., Schaffer, A., Kim, J., Dolan, L., & Ronai, Z. (1995).
UV irradiation and heat shock mediate JNK activation via alternate pathways. The Journal of biological chemistry, 270(44), 26071-7. [PubMed:7592807] [WorldCat] [DOI] - ↑
Yang, D.D., Kuan, C.Y., Whitmarsh, A.J., Rincón, M., Zheng, T.S., Davis, R.J., ..., & Flavell, R.A. (1997).
Absence of excitotoxicity-induced apoptosis in the hippocampus of mice lacking the Jnk3 gene. Nature, 389(6653), 865-70. [PubMed:9349820] [WorldCat] [DOI] - ↑
Kuan, C.Y., Yang, D.D., Samanta Roy, D.R., Davis, R.J., Rakic, P., & Flavell, R.A. (1999).
The Jnk1 and Jnk2 protein kinases are required for regional specific apoptosis during early brain development. Neuron, 22(4), 667-76. [PubMed:10230788] [WorldCat] [DOI] - ↑
Sabapathy, K., Jochum, W., Hochedlinger, K., Chang, L., Karin, M., & Wagner, E.F. (1999).
Defective neural tube morphogenesis and altered apoptosis in the absence of both JNK1 and JNK2. Mechanisms of development, 89(1-2), 115-24. [PubMed:10559486] [WorldCat] [DOI] - ↑
Kuan, C.Y., Yang, D.D., Samanta Roy, D.R., Davis, R.J., Rakic, P., & Flavell, R.A. (1999).
The Jnk1 and Jnk2 protein kinases are required for regional specific apoptosis during early brain development. Neuron, 22(4), 667-76. [PubMed:10230788] [WorldCat] [DOI] - ↑
Sabapathy, K., Jochum, W., Hochedlinger, K., Chang, L., Karin, M., & Wagner, E.F. (1999).
Defective neural tube morphogenesis and altered apoptosis in the absence of both JNK1 and JNK2. Mechanisms of development, 89(1-2), 115-24. [PubMed:10559486] [WorldCat] [DOI] - ↑
Jeanneteau, F., Deinhardt, K., Miyoshi, G., Bennett, A.M., & Chao, M.V. (2010).
The MAP kinase phosphatase MKP-1 regulates BDNF-induced axon branching. Nature neuroscience, 13(11), 1373-9. [PubMed:20935641] [PMC] [WorldCat] [DOI] - ↑
Li, C., Hisamoto, N., Nix, P., Kanao, S., Mizuno, T., Bastiani, M., & Matsumoto, K. (2012).
The growth factor SVH-1 regulates axon regeneration in C. elegans via the JNK MAPK cascade. Nature neuroscience, 15(4), 551-7. [PubMed:22388962] [WorldCat] [DOI] - ↑
Morfini, G.A., You, Y.M., Pollema, S.L., Kaminska, A., Liu, K., Yoshioka, K., ..., & Brady, S.T. (2009).
Pathogenic huntingtin inhibits fast axonal transport by activating JNK3 and phosphorylating kinesin. Nature neuroscience, 12(7), 864-71. [PubMed:19525941] [PMC] [WorldCat] [DOI] - ↑
Xia, Z., Dickens, M., Raingeaud, J., Davis, R.J., & Greenberg, M.E. (1995).
Opposing effects of ERK and JNK-p38 MAP kinases on apoptosis. Science (New York, N.Y.), 270(5240), 1326-31. [PubMed:7481820] [WorldCat] [DOI]