到達運動
名:reaching, reaching movement, arm reaching
到達運動は、目標に向かって腕を伸ばし、手先を目標の位置に動かす運動である。この運動を実現するためには、運動の意図、目標の定位、効果器の選択、手先の位置から目標に向かう軌道の計画、空間座標から関節・筋座標への変換、運動指令の生成、誤差の修正、学習・適応などの過程が必要となる。脳内では、一次運動野、運動前野などの高次運動野、頭頂連合野、小脳、大脳基底核などがこれらの過程に関わっていると考えられている
到達運動とは
上肢の肩、肘の関節を動かし、手先を目標の位置にもっていく運動である。脳の中での上肢運動の制御は、ロボットの複数の関節を動かすための制御問題を解くことと共通しており、多くの生理学的研究とともに理論的な研究が行われている。そこでは、目標の定位、座標変換、軌道計画、運動指令の生成・制御、適応・学習の問題を解く必要がある[2][3]。脳内では、空間情報が視覚の背側経路に含まれる頭頂連合野で処理されている。その空間情報をもとにした視覚運動変換、運動指令の生成と制御が前頭葉の一次運動野や高次運動野へ至るネットワークで行われる。運動の調節、学習・適応には、小脳、大脳基底核が関わっていると考えられている。
目標の定位・座標変換
到達運動に必要な空間上の目標の位置は、空間知覚のシステムによって網膜の上の位置(網膜座標系)から、眼球中心座標系、頭部中心座標系・身体中心座標系、身体部位中心座標系(手先中心座標)などの座標に変換される必要がある[4]。これらの座標系は、脳内で順序だって変換されているわけではなく、状況や目的に応じて必要な座標系が使われる。これらは、外部空間や身体上のどこかを原点として、身体や外部環境との関係を記述した空間座標系といえる。
また一方で、到達運動を実行するためには、これらの空間情報をもとに関節や筋に発生する動きやトルクに変換する必要がある。こうした変数を表現する座標系は、関節座標系、筋座標系と呼ばれる。つまり、到達運動の達成には、空間座標系から関節・筋座標系へ変換が必要である。
到達運動の計算論的モデル
軌道の計画
手先と目標の定位がなされると、理論的には到達運動を実現するために手先軌道が計画され、それを実現するための運動指令の生成が行われると考えられる。手先の初期位置から目標位置への到達運動の軌道は、前後方向でほぼ直線、水平方向では緩やかなカーブを描く。速度は、時間軸に対して、ベル型の曲線を描く[5]。こうした軌道を実現するためには、計算論では脳が何らかの規範に基づいて軌道を生成すると考え、そのためのいくつかの規範(躍度最小化規範、トルク最小化規範、筋指令最小化規範、終点分散最小化規範、最小時間規範など)が提案されている。
これらの規範に対する考え方は、当初の軌道、座標変換、運動指令生成という系列的な処理を行うと枠組みから、次第に運動指令を直接的生成するものに変化してきている[6]。
躍度最小化規範
手先加速度の微分(これを躍度という)の総和を最小化することを目指し、空間座標系における手先の軌道が最適化される[7]。この規範では、求められた軌道から、関節の角度への変換や筋肉への運動指令に変換する事が求められる。
以下は、運動指令を直接生成する考え方である。
トルク最小化規範
関節トルクの時間微分の総和を最小化することを目指し、関節座標系での関節トルクが最適化される[5]。
運動指令変化最小化規範
筋指令の時間微分の総和を最小化する[8]。
終点分散最小化規範
運動指令のノイズのもとで終点のばらつきを最小化することを目標としている[9]。
制御と学習
以上のように軌道が求められたら、それを実行に移すための運動指令の生成や制御を行わなければならない。
正確な運動の実行にあたっては、感覚フィードバックは実際の運動よりも遅れてしまうため、特に速い運動にはフィードバック制御は難しい。そこで、運動前に運動を計画して、フィードバックを使わずに運動を行う制御であるフィードフォワード制御が必要だと考えられた。これには、順モデルや逆モデルと呼ばれる身体と環境の相互作用に関する内部表象である内部モデルが必要となる。逆モデルは、計画された軌道から運動指令を生成する。また、順モデルは、遠心性コピー(運動指令のコピー)/随伴発射によってフィードバックの予測を行う。これらの内部モデルを用いることで、より早いスムースな運動が実現される。
ただし、内部モデルは、フィードバックを必要とする学習によって獲得される。さらに、システム内部にはノイズが存在するため、フィードフォワード制御では運動時間を経るに従って誤差が増大してしまう。また、外力がかかった場合にも容易に修正可能である必要がある。そのため、以下のような感覚フィードバックを取り入れたモデルが考えられている。
フィードバック誤差学習モデル
随意運動制御の学習モデルとして提案されたこのモデルは、目標軌道が大脳皮質で決められると仮定し、計画された軌道と感覚フィードバックを入力とした大脳のフィードバックコントローラーの誤差信号を教師信号として、小脳の逆モデルを学習させるモデルである[10]が、制御も同時行うことが可能である。これは、軌道を予め決定しておく必要がある。視機性眼球反応や前庭動眼反射、追従眼球運動などの眼球運動の生理学的実験の結果にうまく適合する[11]が、上肢運動に関して軌道計画を行う脳領域がどこにあるかは、未だ明確ではない。
最適フィードバック制御モデル
あらかじめ軌道の生成を必要としないモデルとして、カルマンフィルターによる状態の推定[12]と推定された状態をもとに運動指令を生成すること[13]が考えられている。具体的には、順モデルによる予測と実際の感覚フィードバックが重み付け(カルマンゲイン)されて次の時刻の状態が推定される。さらに最適制御からフィードバックゲインを求めて、推定された状態から逐次運動指令を生成する。カルマンゲインとフィードバックゲインの2つのパラメーターを最適化することを目標とする。ShadmehrとKranauerは、このモデルに脳内のいくつかの領域を当てはめる試みをしている[14]。
脳内の到達運動制御
大脳皮質
空間知覚は、視覚前野を経由し頭頂連合野にいたる大脳の背側視覚経路が主に関わっている。視覚野で網膜中心座標系で表現されていた位置情報は、頭頂連合野では単一の座標系ではなく、複数の座標系、つまり眼球中心座標系、頭部中心座標系・身体中心座標系、身体部位中心座標系などの複数の座標系へと座標変換される。これらの座標系は、頭頂連合野の複数の領域で表現されでおり、眼球運動や到達運動、把持運動など、適当な座標系を用いて制御する。運動の種類によって、制御する脳領域が異なる。
頭頂連合野は、運動前野との結合が強く、上縦束(SLF)と呼ばれる皮質下の線維束で、運動前野と結合している[15]。この線維束は、3本に分かれており、特に上頭頂小葉と背側運動前野を結ぶもっとも背側部の経路(SLF-I)が、到達運動に関わっていると考えられている。下頭頂小葉と腹側運動前野を結ぶ腹側部の経路(SLF-III)も一部関っている。この他、一次運動野、小脳、大脳基底核等の領域も到達運動の実現に重要な領域である。
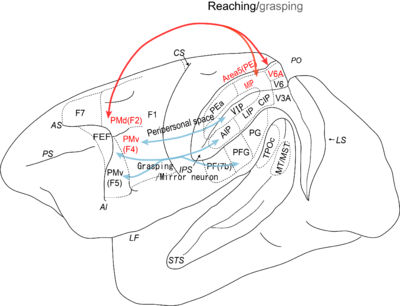
以下にサルの単一ニューロン記録で明らかになった、到達運動に関わると考えられる領域のニューロンの性質を述べる。
SLF-Iによって結ばれる領域
上頭頂小葉と背側運動前野(F2)は、いずれも方向に選択性を示す到達運動ニューロンが記録される。特に、上頭頂小葉では、頭頂間溝の前壁後方部分の内側頭頂間溝野 (medial intraparietal area; MIP野)やその背側の表面に出ている5野(PE)(編集部コメント:PEは何の略でしょうか A: 略語ではなく領域を示す記号です)、さらに頭頂後頭溝の前壁にあるV6A野など複数の領域がある。
内側頭頂間溝野(MIP野)
この領域は頭頂到達領域 (parietal reach region; PRR)とも呼ばれ、主に眼球中心座標系でのターゲットの位置や運動の方向が表現されている[16]。サッケード運動に関わる外側頭頂間溝野 (lateral intraparietal area; LIP野)との結合が強く、眼球運動と到達運動の協調的な制御(eye-hand coordination)が行われていると考えられる。空間情報が提示された後に、そのターゲットに向かってサッケードか到達運動を選択するような課題を行わせると、LIP野ではサッケードに先行し、MIP野では到達運動に先行するニューロン活動がそれぞれ見られたため、特定の運動の準備や意図に関すると考えられている[17]。
5野 (PE)
5野 (PE)は頭頂間溝の背側の表面に出ている領域で、中心後回の最も後ろの5野の一部分に相当する。腕の初期位置からのベクトルで運動の方向を表現することから、手先中心座標の表現がある[18]。ニューロン活動をもとに時系列で情報量解析すると、感覚フィードバックを表現するものと遠心性コピー(運動指令のコピー)/随伴発射(予測された感覚フィードバック)を表現しているものに分類されるという研究がある[19]。解剖学的な結合を考えると、一次運動野や運動前野からの遠心性コピーによって、順モデルによって感覚フィードバックが予測されるというメカニズムが大脳皮質にもあることを示唆している。
また、ターゲットの突然の変更による到達運動の軌道修正の際に、その軌道のオンラインの修正に関わっている活動も認められる[20]。5野は、一次運動野との直接の結合も見られることから、運動をモニターしながら運動指令の修正に関わると考えられる。実際、上頭頂小葉の障害で起こる視覚性運動失調では運動の修正ができない。また、5野のニューロンは、計画された運動と行われた運動の間の内在的なエラーとターゲットと指先の間のエラーの両方を表現することが明らかになっている[21]。
V6A野
V6A野の到達運動ニューロンも、運動の方向や奥行きにも反応選択性を示す。視覚反応も、対側の空間に視覚受容野を持ち、全体として視野の周辺部までカバーする。視覚受容野は、眼球位置によって影響を受けず、頭部中心座標系における位置情報を表現しているニューロンが認められる[22]。さらに、腕の固有感覚や皮膚感覚など体性感覚刺激に反応するニューロンが認められている。また、近年、この領域で到達運動に関わるニューロン以外に把持運動に関連するニューロン活動が記録されている[23]。これらのニューロンは、到達運動と把持運動の協調的制御を行っていると考えられる。
背側運動前野(PMd)
背側運動前野 (dorsal premotor area; PMd (F2))では、到達運動や手首の傾きに関わるニューロン活動が記録される[24]。視覚刺激を出してから遅延を与えて到達運動をする課題では、運動に先行した活動(準備関連活動 set-related activity)が見られ、運動の準備に関わる[25]。また、視覚刺激に関わる活動や運動そのものに関わる活動も見られる。運動のためのターゲットの位置が空間的に表現されるのではなく、色や形などで抽象的に表現される場合でも、同様の反応が認められる[26]。視覚情報から運動への変換過程に関わると考えられる。PMdに、運動のキネマティクスの情報が表現されていると実験結果もある[27][28]。運動効果器(右腕 左腕)の選択にも関わることが明らかになっている[29]。
SLF-IIIによって結ばれる領域
腹側運動前野(F4野)と頭頂間溝の底部にある腹側頭頂間溝野 (ventral intraparietal area; VIP野)は、SLF-IIIによって結合しており、いずれも身体のある部分の体性感覚受容野とともに、そのすぐ近くの身体周辺空間(ペリパーソナルスペース)に視覚の受容野を持ち、手の届く範囲の身体部分中心座標を表現している[30][31]。また腹側運動前野のF5と頭頂間溝の外側壁のanterior intraparietal area, AIPを結ぶ回路は、主に把持運動に関わっているが、手の到達位置によって異なる反応を示すニューロンも見つかっている。
腹側運動前野 (F4)と腹側頭頂間溝野 (VIP野)
腹側運動前野 (F4)は、到達運動[32]や向かってくる物体を手を伸ばして避けるような運動に関わる[33]。また、視覚情報がある方向に偏位するようなプリズムメガネをかけて到達運動を繰り返し行い学習によって適応する課題(プリズム適応)では、感覚情報そのものを表現する活動や運動のゴール(適応後もゴールそのもの空間位置は変化していない)に依存するニューロン活動[34]が見られた。Inoueらはさらに、腹側運動前野や一次運動野のニューロンが、到達運動の結果のエラーを表現することが明らかにした。小脳とともに適応学習に関わると考えられる[35]。VIP野やF4野の身体周辺空間の表現は、手先と物体の関係性を記述し、身体部分中心座標(例えば手先など)をもとにした運動の制御に重要な役割があると考えられる。VIP野では、到達運動に関わるニューロンの存在は明らかにされていないが、解剖学的結合から考えて、F4野への視覚情報のソースとなっていると考えられる。
腹側運動前野 (F5)と前頭頂間溝野 (AIP野)
F5野とAIP野では、これまで把持運動の物体の形やそれを把持するときの手の形に選択性を持つニューロンが見つかっており[36]主に把持運動の制御に関わる。近年、それらのニューロンの中に注視点の位置やターゲットの視線をもとにした位置に影響を受けるものが見つかっている[37]。また、AIPでは物体内のターゲットの相対位置によって(例えば物体の中のスイッチの位置)、反応が異なるニューロンも見つかっていて、物体中心座標系におけるターゲットの位置の情報も持っている[38]。物体の中のどこに到達すべきかを制御すると考えられる。
一次運動野(F1)
到達運動に関して一次運動野のニューロン活動は、力[39]、運動や力の方向[40]、速度[41]など、いくつかの運動のパラメーターに相関を持つことが複数の研究で示されている。
一方で、体性感覚刺激に対しても反応することがわかっており、単関節あるいは複数の関節の受動的な動きに反応する[42]。特に遠位の手では、関節の受動的な動きとともに、皮膚に対する触覚刺激にも反応することが知られている。これらの反応潜時は、一次体性感覚野よりもわずかに遅い程度であり[43]、Scottらは、一次運動野が体性感覚野あるいは5野からの体性感覚情報に基づくオンラインの運動制御に関わっており、最適フィードバック制御モデルを適応できると考えている[44]。
小脳
小脳は、運動の教師あり学習に重要な役割をする。小脳の外側部は、大脳皮質の一次運動野、運動前野などの高次運動野、頭頂葉、前頭前野などから入力を受けており、随意運動制御に重要な役割を担っている。到達運動のプリズム適応は、小脳に障害があると起こらない。Kitazawa らは、到達運動をした結果生じた目標との誤差の情報が、登上線維によるプルキンエ細胞に発生する複雑スパイクに表現されていることを明らかにした[45]。つまり、運動の結果のエラーが登上線維によって小脳皮質に入力されることを示した。先に述べた、運動前野あるいは一次運動野におけるエラーの情報が、プルキンエ細胞に入力されている可能性がある。
一方、平行線維による単純スパイクは運動制御の信号が表現されている。小脳には、内部モデルが存在するといわれており、眼球運動においては小脳の単純スパイクが、逆モデルとしての小脳の役割を反映していると考えられている[11]が、上肢運動においては、大脳皮質で計画された運動指令が、小脳の順モデルに入力されるという考えもある[46]。
大脳基底核
大脳基底核の障害は、筋緊張の異常をもたらし、さまざまな不随意運動を誘発する。神経生理学的な研究と合わせて、大脳基底核は、抑制・脱抑制のメカニズムによって、必要な運動と不必要な運動を切り分け、運動発現のタイミングの制御に関わっていると考えられている。大脳基底核は強化学習に関与することも明らかになっている。到達運動のプリズム適応や学習には、小脳の教師あり学習だけでなく、強化学習を組み込んだモデルも考えられている[47][48]
脳損傷による到達運動の障害
視覚性運動失調
視覚性運動失調には注視下の物体へうまく手を到達させることができないoptiche Ataxiaと、周辺視野への到達障害であるataxie optiqueがある。いずれも上頭頂小葉の損傷で起こると考えられている。(編集部コメント:同じ単語のドイツ語表記とフランス語表記に思えますが、異なるのでしょうか A: 神経心理学的には、説明にもある通り区別して使われます。日本語では、両者を統一してしまっているのです)
推尺異常
推尺異常には到達運動の際に、目標点に達しないhypometriaと通り過ぎてしまうhypermetriaがある。
企図振戦
到達運動など、随意的に運動している場合に軌道に震えが生じることを企図振戦という。目標点に近づくにしたがって著明になる。
測定障害も企図振戦も小脳の障害で起こる。
関連項目
謝辞
本項作成にあたり、貴重なご意見を頂いた電気通信大学 阪口 豊先生に感謝申し上げます。
参考文献
- ↑ Murata, A. and H. Ishida
Representation of bodily self in the multimodal parieto-premotor network
in Representation and Brain, S. Funahashi, Editor. 2007, Springer. p. 151-176. - ↑
Kawato, M., Furukawa, K., & Suzuki, R. (1987).
A hierarchical neural-network model for control and learning of voluntary movement. Biological cybernetics, 57(3), 169-85. [PubMed:3676355] [WorldCat] [DOI] - ↑ 阪口 豊
上肢到達運動制御の計算モデルとその課題.
VISION: 2004. 16;765-73. - ↑
Cohen, Y.E., & Andersen, R.A. (2002).
A common reference frame for movement plans in the posterior parietal cortex. Nature reviews. Neuroscience, 3(7), 553-62. [PubMed:12094211] [WorldCat] [DOI] - ↑ 5.0 5.1
Uno, Y., Kawato, M., & Suzuki, R. (1989).
Formation and control of optimal trajectory in human multijoint arm movement. Minimum torque-change model. Biological cybernetics, 61(2), 89-101. [PubMed:2742921] [WorldCat] [DOI] - ↑ 阪口 豊
随意運動における運動指令パタンの双発.
計測と制御: 2009. 48; 88-93 - ↑
Flash, T., & Hogan, N. (1985).
The coordination of arm movements: an experimentally confirmed mathematical model. The Journal of neuroscience : the official journal of the Society for Neuroscience, 5(7), 1688-703. [PubMed:4020415] [WorldCat] - ↑ Kawato, M
Trajectory formation in arm movements: Minimization principles and procedures
in Advances in Motor Learning and Control, Zelaznik, Howard N, Editor. 1996, Human Kinetics. p. 225-259 - ↑
Harris, C.M., & Wolpert, D.M. (1998).
Signal-dependent noise determines motor planning. Nature, 394(6695), 780-4. [PubMed:9723616] [WorldCat] [DOI] - ↑
Kawato, M., & Gomi, H. (1992).
A computational model of four regions of the cerebellum based on feedback-error learning. Biological cybernetics, 68(2), 95-103. [PubMed:1486143] [WorldCat] [DOI] - ↑ 11.0 11.1
Kawato, M. (1999).
Internal models for motor control and trajectory planning. Current opinion in neurobiology, 9(6), 718-27. [PubMed:10607637] [WorldCat] [DOI] - ↑
Wolpert, D.M., Ghahramani, Z., & Jordan, M.I. (1995).
An internal model for sensorimotor integration. Science (New York, N.Y.), 269(5232), 1880-2. [PubMed:7569931] [WorldCat] [DOI] - ↑
Todorov, E., & Jordan, M.I. (2002).
Optimal feedback control as a theory of motor coordination. Nature neuroscience, 5(11), 1226-35. [PubMed:12404008] [WorldCat] [DOI] - ↑
Shadmehr, R., & Krakauer, J.W. (2008).
A computational neuroanatomy for motor control. Experimental brain research, 185(3), 359-81. [PubMed:18251019] [PMC] [WorldCat] [DOI] - ↑
Thiebaut de Schotten, M., Dell'Acqua, F., Valabregue, R., & Catani, M. (2012).
Monkey to human comparative anatomy of the frontal lobe association tracts. Cortex; a journal devoted to the study of the nervous system and behavior, 48(1), 82-96. [PubMed:22088488] [WorldCat] [DOI] - ↑
Cohen, Y.E., & Andersen, R.A. (2002).
A common reference frame for movement plans in the posterior parietal cortex. Nature reviews. Neuroscience, 3(7), 553-62. [PubMed:12094211] [WorldCat] [DOI] - ↑
Andersen, R.A., & Buneo, C.A. (2002).
Intentional maps in posterior parietal cortex. Annual review of neuroscience, 25, 189-220. [PubMed:12052908] [WorldCat] [DOI] - ↑
Bremner, L.R., & Andersen, R.A. (2012).
Coding of the reach vector in parietal area 5d. Neuron, 75(2), 342-51. [PubMed:22841318] [PMC] [WorldCat] [DOI] - ↑
Mulliken, G.H., Musallam, S., & Andersen, R.A. (2008).
Forward estimation of movement state in posterior parietal cortex. Proceedings of the National Academy of Sciences of the United States of America, 105(24), 8170-7. [PubMed:18499800] [PMC] [WorldCat] [DOI] - ↑
Archambault, P.S., Ferrari-Toniolo, S., Caminiti, R., & Battaglia-Mayer, A. (2015).
Visually-guided correction of hand reaching movements: The neurophysiological bases in the cerebral cortex. Vision research, 110(Pt B), 244-56. [PubMed:25264945] [WorldCat] [DOI] - ↑
Inoue, M., & Kitazawa, S. (2018).
Motor Error in Parietal Area 5 and Target Error in Area 7 Drive Distinctive Adaptation in Reaching. Current biology : CB, 28(14), 2250-2262.e3. [PubMed:29983313] [WorldCat] [DOI] - ↑
Galletti, C., Kutz, D.F., Gamberini, M., Breveglieri, R., & Fattori, P. (2003).
Role of the medial parieto-occipital cortex in the control of reaching and grasping movements. Experimental brain research, 153(2), 158-70. [PubMed:14517595] [WorldCat] [DOI] - ↑
Galletti, C., & Fattori, P. (2018).
The dorsal visual stream revisited: Stable circuits or dynamic pathways? Cortex; a journal devoted to the study of the nervous system and behavior, 98, 203-217. [PubMed:28196647] [WorldCat] [DOI] - ↑
Rizzolatti, G., Cattaneo, L., Fabbri-Destro, M., & Rozzi, S. (2014).
Cortical mechanisms underlying the organization of goal-directed actions and mirror neuron-based action understanding. Physiological reviews, 94(2), 655-706. [PubMed:24692357] [WorldCat] [DOI] - ↑
Wise, S.P., Boussaoud, D., Johnson, P.B., & Caminiti, R. (1997).
Premotor and parietal cortex: corticocortical connectivity and combinatorial computations. Annual review of neuroscience, 20, 25-42. [PubMed:9056706] [WorldCat] [DOI] - ↑
Kurata, K., & Wise, S.P. (1988).
Premotor cortex of rhesus monkeys: set-related activity during two conditional motor tasks. Experimental brain research, 69(2), 327-43. [PubMed:3345810] [WorldCat] [DOI] - ↑
Hocherman, S., & Wise, S.P. (1991).
Effects of hand movement path on motor cortical activity in awake, behaving rhesus monkeys. Experimental brain research, 83(2), 285-302. [PubMed:2022240] [WorldCat] [DOI] - ↑
Pilacinski, A., & Lindner, A. (2019).
Distinct contributions of human posterior parietal and dorsal premotor cortex to reach trajectory planning. Scientific reports, 9(1), 1962. [PubMed:30760821] [PMC] [WorldCat] [DOI] - ↑
Hoshi, E., & Tanji, J. (2000).
Integration of target and body-part information in the premotor cortex when planning action. Nature, 408(6811), 466-70. [PubMed:11100727] [WorldCat] [DOI] - ↑
Fogassi, L., Gallese, V., Fadiga, L., Luppino, G., Matelli, M., & Rizzolatti, G. (1996).
Coding of peripersonal space in inferior premotor cortex (area F4). Journal of neurophysiology, 76(1), 141-57. [PubMed:8836215] [WorldCat] [DOI] - ↑
Duhamel, J.R., Colby, C.L., & Goldberg, M.E. (1998).
Ventral intraparietal area of the macaque: congruent visual and somatic response properties. Journal of neurophysiology, 79(1), 126-36. [PubMed:9425183] [WorldCat] [DOI] - ↑
Gentilucci, M., Fogassi, L., Luppino, G., Matelli, M., Camarda, R., & Rizzolatti, G. (1988).
Functional organization of inferior area 6 in the macaque monkey. I. Somatotopy and the control of proximal movements. Experimental brain research, 71(3), 475-90. [PubMed:3416964] [WorldCat] [DOI] - ↑
Graziano, M.S., & Cooke, D.F. (2006).
Parieto-frontal interactions, personal space, and defensive behavior. Neuropsychologia, 44(6), 845-59. [PubMed:16277998] [WorldCat] [DOI] - ↑
Kurata, K., & Hoshi, E. (2002).
Movement-related neuronal activity reflecting the transformation of coordinates in the ventral premotor cortex of monkeys. Journal of neurophysiology, 88(6), 3118-32. [PubMed:12466435] [WorldCat] [DOI] - ↑
Inoue, M., Uchimura, M., & Kitazawa, S. (2016).
Error Signals in Motor Cortices Drive Adaptation in Reaching. Neuron, 90(5), 1114-26. [PubMed:27181058] [WorldCat] [DOI] - ↑
Murata, A., Gallese, V., Luppino, G., Kaseda, M., & Sakata, H. (2000).
Selectivity for the shape, size, and orientation of objects for grasping in neurons of monkey parietal area AIP. Journal of neurophysiology, 83(5), 2580-601. [PubMed:10805659] [WorldCat] [DOI] - ↑
Lehmann, S.J., & Scherberger, H. (2013).
Reach and gaze representations in macaque parietal and premotor grasp areas. The Journal of neuroscience : the official journal of the Society for Neuroscience, 33(16), 7038-49. [PubMed:23595761] [PMC] [WorldCat] [DOI] - ↑
Murata, A., Wen, W., & Asama, H. (2016).
The body and objects represented in the ventral stream of the parieto-premotor network. Neuroscience research, 104, 4-15. [PubMed:26562332] [WorldCat] [DOI] - ↑
Evarts, E.V. (1968).
Relation of pyramidal tract activity to force exerted during voluntary movement. Journal of neurophysiology, 31(1), 14-27. [PubMed:4966614] [WorldCat] [DOI] - ↑
Taira, M., Boline, J., Smyrnis, N., Georgopoulos, A.P., & Ashe, J. (1996).
On the relations between single cell activity in the motor cortex and the direction and magnitude of three-dimensional static isometric force. Experimental brain research, 109(3), 367-76. [PubMed:8817266] [WorldCat] [DOI] - ↑
Moran, D.W., & Schwartz, A.B. (1999).
Motor cortical representation of speed and direction during reaching. Journal of neurophysiology, 82(5), 2676-92. [PubMed:10561437] [WorldCat] [DOI] - ↑
Pruszynski, J.A., Kurtzer, I., Nashed, J.Y., Omrani, M., Brouwer, B., & Scott, S.H. (2011).
Primary motor cortex underlies multi-joint integration for fast feedback control. Nature, 478(7369), 387-90. [PubMed:21964335] [PMC] [WorldCat] [DOI] - ↑
Wolpaw, J.R. (1980).
Correlations between task-related activity and responses to perturbation in primate sensorimotor cortex. Journal of neurophysiology, 44(6), 1122-38. [PubMed:6450275] [WorldCat] [DOI] - ↑
Scott, S.H. (2004).
Optimal feedback control and the neural basis of volitional motor control. Nature reviews. Neuroscience, 5(7), 532-46. [PubMed:15208695] [WorldCat] [DOI] - ↑
Kitazawa, S., Kimura, T., & Yin, P.B. (1998).
Cerebellar complex spikes encode both destinations and errors in arm movements. Nature, 392(6675), 494-7. [PubMed:9548253] [WorldCat] [DOI] - ↑
Ishikawa, T., Tomatsu, S., Izawa, J., & Kakei, S. (2016).
The cerebro-cerebellum: Could it be loci of forward models? Neuroscience research, 104, 72-9. [PubMed:26704591] [WorldCat] [DOI] - ↑ Y Sakaguchi, Y Akashi, M Takano
Visuo-Motor Adaptation to Stepwise and Gradual Changes in the Environment: Relationship between Consciousness and Adaptation
Joumal of Robotics and Mechatronics: 2001. 48(13);601-13 - ↑
Izawa, J., Kondo, T., & Ito, K. (2004).
Biological arm motion through reinforcement learning. Biological cybernetics, 91(1), 10-22. [PubMed:15309543] [WorldCat] [DOI]