前庭動眼反射
Vestibulo-ocular reflex
要約: 前庭動眼反射(Vestibulo-ocular reflex, VOR)は、視機性眼球反応(Optokinetic Response, OKR)とともに姿勢保持の役割を担う重要な反射である。頭の3次元の動きは側頭骨にある前庭器で感知され、その情報は前庭神経核と前庭小脳に伝えられる。VORを中継する前庭神経核の神経細胞は外眼筋の運動神経核群に興奮性若しくは抑制性の出力を送り、頭の動きを補正するような眼球運動を誘発する。VORと視機性眼球反応の働きにより、頭が動いても眼球の網膜に写る像がぶれずにすむ。小脳片葉は、運動学習のメカニズムにより、VORの効率(利得)を調節する。
1.VORの脳幹の神経回路
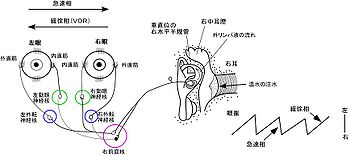
図1に示すように、内耳にある前庭器官には3つの半規管(前半規管、水平(外側)半規管と後半規管)と2つの耳石器(卵形嚢と球形嚢)がある。また眼球には6つの外眼筋があり、水平面と、回旋を含む垂直面の眼球運動を引き起こす。3つの半規管には互いに直交しており、水平 (外側)半規管はネコ、サルやヒトでは水平から約30度後向に傾いている。半規管の内部は内リンパ液で満たされており、膨大部と呼ばれるところには有毛細胞がある。有毛細胞の感覚毛はゼラチン質からなるクプラの中に延びて包みこまれている(図1C)。例えば、頭を水平半規管の面上で右に動く時、半規管内の内リンパ液は慣性により頭の回転とは逆向きに流れる。これにより右側の水平半規管のクプラが曲げられて有毛細胞は脱分極し、生じた活動電位は右側の内側前庭核に伝えられる。また左側の水平半規管の有毛細胞には過分極が生じ、左側の内側前庭核へのドライブが弱まる。VORを中継する前庭核の神経細胞には興奮性のものと抑制性のものがある。興奮性の神経細胞は、同側の眼球の内直筋を支配する動眼神経核の神経細胞と結合するか、もしくは対側の眼球の外直筋を支配する対側の外転神経核の神経細胞と結合する(表1)。一方、抑制性の神経細胞は、同側の眼球の外直筋を支配する同側の外転神経核の神経細胞と結合するか、もしくは対側の眼球の内直筋を支配する対側の動眼神経核の神経細胞と結合する。このような神経回路により、頭が右に回転した時、右側の眼球の内直筋は収縮(興奮)し、外直筋は弛緩(抑制)する。同様に左側の眼球の内直筋は弛緩し、外直筋は収縮する。その結果は両側の眼球は頭とは逆に左に回転する。このようにVORは基本的には3個の神経細胞からなる反射の回路(反射弓)で構成される。水平性のVOR では左右の水平半規管に相反的な活動が生じるが、垂直のVORの場合には一側の前半規管と対側後半規管、一側の後半規管と対側の前半規管との間にそれぞれ相反的な活動が生じる(図1D)。前半規管と同側の眼球の上直筋と下直筋との神経結合、対側の眼球の上斜筋と下斜筋との神経結合、ならびに後半規管と同側の眼球の上斜筋と下斜筋との神経結合、対側の眼球の上直筋と下直筋との神経結合については表1を参照されたい(1,2)。
球形嚢と卵形嚢では平行班に有毛細胞が分布する。有毛細胞の表面はゼラチン様物質からなる耳石膜におおわれており、さらにその上に炭酸カルシウムからなる耳石が分布する。この有毛細胞が刺激されるのは平衡班にせん断力が作用する時、即ち有毛細胞と耳石膜との間にずれが生じるときであり、具体的には水平もしくは垂直方向に線形的な加速度が加わったときである。仰臥位で身体を床に平行に振り直線的加速度を加えてやると、右方向の加速に対して眼は左側に偏位する。また頭をゆっくりと左右に傾けると、両眼球が眼軸を中心として反対側に回旋する。これらの眼球運動は球形嚢由来の反射によると考えられている。卵形嚢が関与するVORについてはよくわかっていない(2)。
2.VORの動特性
VORはslowの眼球運動である。通常0.1-1Hzの周波数で、刺激をする半規管の面に平行になるように頭を固定し、暗闇の中で回転台(ターンテーブル)を正弦波状に振動させVORを誘発する。赤外線テレビカメラもしくはサーチコイルにより、眼誘発された球運動を記録する。サッケード状の急速眼球運動、瞬きや遅いドリフトを除去し、VORに由来する眼球運動を抽出する。それをもとに、VORの利得(ゲイン)と位相差を算出する。図2にVORの計測の例を示す。前述のごとくVORは頭(台)とは逆方向に動きであるので、回転台と眼球運動のズレを、伝統的に位相の進み(phase advance)と呼ぶ(図2B)。 水平性のVORの動特性は魚(コイ、キンギョ)、ニワトリ、マウス、ラット、ウサギ、ネコ、サルやヒトで測定されている。ゲインは動物種によってほぼ一定で周波数依存性はあまりない。サルでは1前後、ヒトでは0.8~0.9、ネコは0.6~0.8程度で。他の動物種では0.4~0.6程度である。図2Bにウサギの水平性VORの動特性を示す。垂直性のVORは、測定が水平性のVORに比べて大がかりになるので、あまり調べられていないが、ゲインは一般的に水平性VORのゲインより低い。位相差はゲインが高いところでは0o付近であり、ゲインが下がるにつれて進みが大きくなる(1,3)。
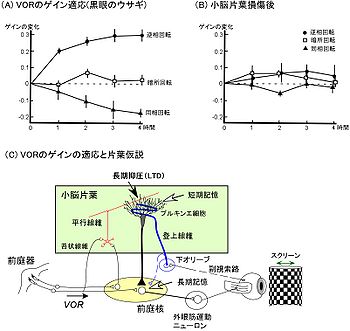
3.VOR のゲインの適応
VORは、頭が動いた時に生じる網膜上の像のブレをなくすように、頭の動きを補正するように働く反射である。前庭器官には頭の動いた結果の情報は入ってこないので、フェードフォーワード(前向き制御)の反射ということになる。これに対して、前庭小脳の片葉が、前庭器官から前庭核に送る信号を傍受するとともに、眼球運動の結果生じたものの見え方の変化をもとに、VORを中継する前庭核への抑制を変えることで、ゲインを短期間の間に調節することができる(1,4,9)。 VORの視覚を組み合わせたトレーニングを数時間行なうと、ゲインに適応(adaptation)が生じる。VORのゲインは、VORが誘発された時にエラーが十分生じるような状況、つまり外界がぶれて見える(retinal slipが生じる)ことが持続すると変化する。ヒト、サル、ネコでは、拡大レンズを装着させて回転台を正弦波状に回転させる訓練を数時間程度行うと、水平性VORのゲインが20~50%程度増加する。一方、縮小レンズや左右逆転プリズムで同様のトレーニングをするとゲインは減少する。また、メガネやプリズムのかわりに、回転台の周りにドラム様のスクリーンを張り、回転台と同期して振動させてトレーニングする方法も有効である。台とスクリーンが反対方向に同じ振幅で動く場合はゲインが増加し、台とスクリーンが同方向に動く場合はゲインが減少する。ウサギのVORゲインの適応を図3Aに示す。このようなVORゲインの変化は、24時間以内に回復するので、短期の適応である(5)。さらに数日間持続的にレンズやプリズムを装着させて訓練を行うと、長期の適応が生じ、ゲインは長期間にわたり大きく変化する(6)。一般的に、逆転プリズムや拡大レンズを用いたトレーニングでゲインが変化しても、位相差はあまり変化しない。例えば、逆転プリズムを長期間装着したときに、ゲインは数日で変化するが、位相差は1~3週にわたり持続的に装着しないと変化しない。 VORの適応は、脳によるゲインの運動学習の実験モデルとして広く研究されてきている。VORのゲインの適応に前庭小脳の片葉が不可欠であることが、1970年台から様々な実験結果により示されている(図3B)。片葉のH-ゾーンと呼ばれる領域のプルキンエ細胞には、前庭神経節もしくは前庭神経核由来の信号が平行線維を介して伝えられる。また適応が起きるのに必要なretinal slipの情報は、下オリーブ内側副核から登上線維によってH-ゾーンのプルキンエ細胞に伝えられる。一方、H-ゾーンのプルキンエ細胞は、水平性のVORを中継する内側前庭核の神経細胞を直接抑制する。実際に適応が生じたときにH-ゾーンのプルキンエ細胞を観察すると、適応と同方向の神経活動が見られる。さらに、平行線維―プルキンエ細胞のシナプスの伝達効率は、同じプルキンエ細胞に入力する登上線維の信号によって長期間にわたり抑制される(長期抑圧)ことが証明されている。これらをもとに、長期抑圧がVORのゲインの適応の原因であるという考え方(片葉仮説)が、伊藤正男(東京大学名誉教授、理化学研究所特別顧問)により提案されている(図3C)。この仮説は30年前に提案され、これまで薬理学や遺伝子ノックアウトマウスなど様々な実験から検証されてきたが、長期抑圧が1~数時間のトレーニングで生じるゲインの適応の原因の1つであることは確かであり、現在、他のメカニズムも関与するかどうかが議論されているところである(1,7,8, 9)。適応に関する記憶が脳のどの部位に保持されていることが、神経組織の活動を薬物(局所麻酔剤)により遮断する方法で調べられている(5,6)。もし神経活動が遮断された脳部位に記憶の痕跡が存在するならば、遮断により記憶が消され、適応によって生じたゲインの変化は直ちに消去されるはずである。VORの適応の記憶の場については、ネコとアカゲザルで調べられており、1~2時間のトレーニングにより生じた適応の記憶は片葉に保持されているが、それ以前のトレーニングによって生じた長期の適応の記憶は前庭核に保持されていることが示唆されている(図3C)。この現象は適応の記憶痕跡のシナプス間移動と呼ばれるが、前庭神経核に長期記憶痕跡ができるメカニズムは現在のところよく知られていない。
4. 臨床におけるVOR
ヒトでは、VORの検査にゲインの測定よりも、カロリックテストと呼ばれる方法がひろく用いられる(図4)。頭を60度後方に傾けた状態にして水平半規管がほぼ垂直になるようにして、一側の外耳道に温水を注入すると、中耳腔と側頭骨の温度差で生じる外リンパ液の対流によって注入側の水平半規管の有毛細胞が脱分極し、対側に向かう水平性VORが誘発される。眼球がある程度対側に偏位すると、リセットの急速な眼球運動が生じ、眼球はもとの位置にもどり、再び対側に向かう水平性VORが誘発される。このようにslowのVOR(緩徐相)とquickの眼球運動(急速相)が繰り返し生じる現象を前庭性眼振(vestibular nystagmus)と呼ぶ。冷水を注入すると、緩徐相と急速相の方向はそれぞれ逆転する。この温度眼振は1914年にNobel医学賞を受賞したバラニー(Robert Bàràny, 1876-1936)によって発見され、末梢性前庭機能の検査方法として臨床的に広く用いられている。1983年にNASAのスペースシャトルで、無重力状態でも、地上と同様な温度眼振が誘発されることが実験的に示された。重力のないところでは対流は生じにくいので、それ以外のメカニズムにも関与するようであるが、それについてはよくわかってはいない。前庭性眼振には、カロリックテストで誘発されるような生理的眼振と、メニエル病のような一側性前庭機能障害によって生じるような病的な自発性の眼振がある。カロリックテストを含む眼振の検査はめまいの診断に用いられる。
前庭器官の有毛細胞は加齢や疾病により損傷を受けると考えられるが、VORのゲインは一生を通じてあまり変化を受けない。またメニエル病や突発性難聴に伴う前庭の機能障害により生じる前庭性眼振は短期間でかなり回復する。このような過程にも片葉によるVORのゲインの調節のメカニズムが関与していることが想定されている。片葉によりVORが制御されることで、前庭系の眼球反射は生涯を通じて比較的安定して機能すると考えられる。
関連項目:視運動性眼振、小脳の神経回路、小脳によるタイミング制御、瞬膜反射の条件付け、小脳プラットフォーム(http://cerebellum.neuroinf.jp)
参考文献 1. Ito M, The cerebellum and neural control. Raven, New York, 1984. 2. 篠田義一. 眼球運動の生理学. 眼球運動の神経学(小松崎、篠田、丸尾編),医学書院,東京、1985. 3. Nagao S: Exp Brain Res 53: 36-46, 1983. 4. Ito M, Nagao S: Comp Biochem Physiol 98C: 221-228, 1991. 5. Nagao S, Kitazawa H: Neuroscience 118: 563-570, 2003. 6. Anzai M, et al.: Neurosci Res 68: 191-198, 2010. 7. 永雄総一: 神経研究の進歩 44:748-758,2000. 8. Ito M: The cerebellum: Brain for an implicit self. FT Press, New York, 2011. 9. 永雄総一, 山崎匡: 生体の科学 63: 3-10, 2012.
(執筆者:永雄総一、編集担当委員:伊佐 正)