こだま定位
長谷 一磨
Department of Psychology, Neuroscience & Behaviour, McMaster University
飛龍 志津子
同志社大学 生命医科学部
DOI:10.14931/bsd.10484 原稿受付日:2023年6月15日 原稿完成日:2023年9月8日
担当編集委員:藤田 一郎(大阪大学 大学院生命機能研究科)
同義語:反響定位、エコロケーション
英:echolocation 独:Echoortung 仏:écholocation
こだま定位とは、動物が自身の音声の反響音(エコー)を用いて物体の定位を行うこと。特にこだま定位がよく研究されてきたコウモリでは、採餌生態に適応した種得意的な超音波音声と聴覚系を持つことが知られている。種によりこだま定位に用いる音声は異なるが、標的までの距離の計算は放射音声(パルス)とエコーの時間差によってなされ、聴覚野にはパルスとエコーの遅延時間に対応した遅延時間地図が存在する。エコーの音圧を一定の範囲内に保つエコー音圧補償行動に加え、エコー周波数を一定に保つドップラーシフト補償行動を行うコウモリも存在する。補償行動は聴覚系におけるパルス・エコーの処理を促進する。集団で飛行する際にコウモリが経験する他個体からの音響的干渉は、受動的・能動的な音声のばらつきによって低減される。
発見
どうしてコウモリが夜でも飛行できるのかについては、古くから多くの科学者に興味を持たれてきた[1]。18世紀、イタリアの生物学者Lazzaro Spallanzaniは、コウモリが完全な真っ暗闇でも障害物に衝突せずに飛行できること、さらには視覚を奪っても問題なく飛行できることを発見し、コウモリは視覚以外の感覚に頼って周囲の環境を把握することを発見した。その後、スイスの外科医であったLouis Jurineが、耳を塞がれたコウモリが正常に飛行できなくなったことを示し、Spallanzaniも同様の結果を得た。彼らは、コウモリが聴覚に頼って周囲の感覚を把握していることを示唆したが、コウモリが発する超音波帯域の音声を聞く術がなかったため、こだま定位の発見には至らなかった。
1938年に、Donald GriffinとGeorge Pierceがともに、超音波検出器を用いて、コウモリが超音波帯域の音声を活発に放射していることを明らかにした。その後、GriffinはRobert Galambosとともに実際に飛行するコウモリが超音波音声を放射していることや、コウモリの口を塞ぐと耳を塞いだときと同様、障害物が避けられなくなることを発見し、コウモリが超音波音声を発しそのエコーで周囲環境を把握する、こだま定位を行うことがわかった。
現在では、こだま定位を行う動物として、イルカ、コウモリ、テンレック、トガリネズミ、アブラヨタカ、アナツバメなどが知られる。
こだま定位音声と聴覚系の適応
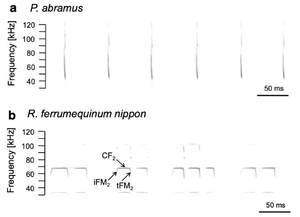
コウモリはこだま定位音声の特徴によってFM型(a、アブラコウモリPipistrellus abramus)とCF-FM型(b, ニホンキクガシラコウモリRhinolophus ferrumequinum nippon)に大別される。参考文献[2]より。
コウモリの超音波音声は口または鼻から発され、通常複数の倍音を伴う(図1)[1][2]。コウモリがこだま定位に用いる音声は、彼らの採餌生態に適応していると考えられている[3]。開けた空間で飛翔昆虫を捉える種は、採餌飛行時には数 msから20 msほどの長さの周波数変調(frequency-modulated, 以下FM)型の音声を放射する。FM型の音声を使用するコウモリはFMコウモリと言われ、こだま定位を行う多くの種がFMコウモリに含まれる。代表的な種は、オオクビワコウモリ(Eptesicus fuscus)やトビイロホオヒゲコウモリ(Myotis lucifugus)などである。
一方で、茂みの中で羽ばたく昆虫を捕食する種は、周波数定常(constant-frequency; 以下CF)型とFM型の組み合わせ音を用いる。茂みのような複雑な環境では、標的となる昆虫からのエコーに加え、こだま定位による検知可能な範囲に存在する物体からの大量のエコー(クラッター)も同時にコウモリへ返ってくる。CF-FM型の音声をこだま定位に用いる種(以下、CF-FMコウモリ)には、キクガシラコウモリ属とカグラコウモリ属のコウモリ、ウオクイコウモリ属、クチビルコウモリ属の一部が含まれ、中でもキクガシラコウモリ(Rhinolophus ferrumequinum)やヒゲコウモリ(Pteronotus pernellii)がよく研究されてきた。CF-FMコウモリは、標的昆虫の羽ばたきによってエコーCF部に生じる周波数及び振幅変調を利用し獲物を検知しているとされる[4]。
距離の計算

(A) ヒゲコウモリの左聴覚野の模式図。図中の数字1-6は異なる機能を持つ神経細胞集団が存在する領野である。
(B) FM–FM野内には、異なる倍音の組み合わせに反応する3つの領域FM1–FM2、FM1–FM3、FM1–FM4がある。
(C) パルス基本音のFM部(P)とエコー第二高調波のFM部(E)、それらの組み合わせ音を異なる時間差で呈示した際のFM1–FM2ニューロンの発火頻度。それぞれの単独呈示の際の発火頻度に比べ、特定の時間差で提示された際の発火頻度は大きくなる(遅延時間同調)。最適遅延時間は6 msである。参考文献[5]より (Copyright 2007, Society for Neuroscience)。
コウモリがこだま定位から得る情報は多岐にわたるが、最も基本的なものは物体までの距離である。コウモリが音声(パルス)を発し、それが物体へ衝突しエコーとしてコウモリへと戻ってくるまでの伝搬時間t [s]と音速c [m/s]によって、コウモリと物体との距離d [m]は以下のように表される。
コウモリが距離の計測にパルスとエコーの時間差を用いていることは、1973年にJames Simmonsによって詳細に確かめられた[6]。Simmonsは左右2つの着地台のうち近い方へと着地するようにオオクビワコウモリ(Eptesicus fuscus)を訓練し、コウモリが1 cm程度(約60 μs)の距離の差を弁別できることを示した。さらに、台の上で静止するコウモリが発するこだま定位音声をマイクロホンで取得し、それを電気的に遅延させてコウモリの左右正面に置いたスピーカ―から異なる遅延時間でそれぞれ再生することでエコーと勘違いさせた。左右のスピーカーから呈示されるエコーの遅延時間が短い方を選択させることで、コウモリが100 μs以下の分解能で時間差を識別できることを明らかにし、距離計測の実態は時間差計測であることを明らかにした。
さらに、Simmonsらは次のような実験を行った。左右のスピーカーのうち、一方からは一定の遅延時間で、もう一方からは遅延時間に揺らぎを設けて、エコーを呈示した。コウモリは2つの標的のうち、遅延時間に揺らぎのある方を選択するよう訓練された。その結果、コウモリは10 nsもの揺らぎを検出できることが報告されている[7][8]。この揺らぎ検出の異常なまでの時間分解能の高さに関しては、現在までさまざまな反論があり[9][10][11][12][13]、自然環境における揺らぎの分解能はせいぜい20 μs程度ではないかと推察されている[12]。
また、複雑な表面を持つ物体は、時間的に重畳したエコーを反射する。例えば、オオクビワコウモリの餌となる飛翔昆虫は羽や頭部といった複数の反射点を持つ。これらは近接して存在するため、100 μs以下の短い時間間隔でエコーを反射する[14]。オオクビワコウモリの音声は数 msであるため、短い時間間隔での反射音は1つの音に統合され、干渉により時間間隔の逆数に比例する間隔でスペクトルの特定の周波数にノッチを生み出す。オオクビワコウモリの下丘においては、FM音に反応する神経細胞が、ノッチの周波数と最適周波数が一致する際に反応強度を低下させることでノッチ周波数が表現されており、重畳するFM音の最小の時間分解能は約6 μsと推定されている[15]。さらに、オオクビワコウモリの聴覚野に存在する遅延時間同調細胞(詳細は後述)は、ある特定の時間差(6-72 μs)に対応するノッチがエコーに存在する際に、最適遅延時間のパルス・エコー刺激に対する反応よりも大きな反応が得られる[16] [15]。単一神経細胞における時間分解能がせいぜい1 ms、さらにこだま定位音声の長さが数 msから数十 msであることを考えると、高い分解能を示すコウモリの聴覚系での情報処理は非常に興味深い。
こだま定位による距離計測の神経基盤であると考えられているのは、遅延時間同調細胞(delay-tuned neuron)である。遅延時間同調細胞とは、パルスとエコーのような2音を連続で呈示された際に、2音間の特定の時間差に選択的に反応の促進を示す神経細胞で(図2)[17] [18]、下丘や内側膝状体、聴覚野などの聴覚系や、上丘で発見されている。特に、聴覚野には最適遅延時間(最も強い反応が誘発される遅延時間)の地図構造が存在し、最適遅延時間の短い神経細胞が吻側に、長いものが尾側に存在する [19]。
下丘や聴覚野の神経細胞の一部は、通常の聴覚系の神経細胞とは異なり、刺激強度が増加するにつれて反応潜時が長くなる、paradoxical latency shift (PLS)を示す[20]。Paradoxical latency shiftは抑制性入力の閾値が興奮性入力の閾値よりも高く、刺激レベルが高くなるにつれ興奮に対する抑制の強度が強くなることによって生じるとされている。
FMコウモリにおいては、paradoxical latency shiftを示す神経細胞によって、コウモリが発する強烈なパルスに対する長い反応潜時と、微弱なエコーに対する短い反応潜時の興奮性入力が、あるパルス・エコー遅延で一致し遅延同調性が形成されるというメカニズムが提案されている[20]。Paradoxical latency shiftは下丘以上で見つかり、さらにGABAA受容体の遮断薬であるビククリンによって消去されることから、paradoxical latency shiftの少なくとも一部は下丘においてGABA作動性の抑制性入力によって新たに形成されると考えられている[21]。ただし、FMコウモリの遅延同調細胞の反応特性の全てがparadoxical latency shiftで説明できるわけではない。
また、CF-FMコウモリにおいては、FMコウモリとは異なり、基本音のFM成分とエコーの高調波のFM成分の組み合わせによってエコー遅延時間が計算され[18]、遅延時間同調細胞の大多数がparadoxical latency shiftを示さない[22]。CF-FMコウモリの遅延同調細胞(FM-FMニューロン)は、パルス(基本音)から長い反応潜時の入力を、エコー(高調波)から短い反応潜時の入力を受け、パルスとエコーの時間差がこれらの潜時の差と一致した際に反応が促進されることで遅延同調性が形成される。下丘における抑制性の入力がこの長い潜時の形成に寄与している。
補償行動
音波は媒質中を伝搬する過程で、吸収・拡散減衰によりその強さが減弱する。さらに、コウモリの発する超音波パルスには指向性がある。そのため、コウモリへ返ってくるエコーの強度は物体との距離・角度によって大きく変動しうる。コウモリは放射パルスの音圧を柔軟に変化させることで、エコーの音圧を一定に保つ[23][24]。これをエコー音圧補償と呼ぶ。上述したparadoxical latency shiftを示す細胞において、エコー遅延時間同調特性が形成されるためには、エコーの音圧レベルがある一定の値よりも小さくならなくてはならない[22]。エコー音圧補償行動は、paradoxical latency shiftによるエコー遅延同調回路がはたらくために必要であるという仮説がある[25]。
エコー周波数も同様にコウモリと標的の相対速度の変化によって大きく変化しうる。CF-FMコウモリは、放射パルスの周波数を制御することで、飛行によって生じるエコーのドップラーシフトを打ち消し、自身の聴覚感度の良い周波数帯域にエコー周波数を保つ、ドップラーシフト補償行動を行う[23][26]。ドップラーシフト補償行動を行う種には、聴覚の末梢レベルにおいてすでに様々な特殊化が見られる。CF-FMコウモリの放射パルスは第二高調波が最強であり、蝸牛有毛細胞の感度と周波数選択性が第二高調波のCF成分(CF2)に対して非常に高い。この特殊化は聴覚系全体を通じて見られる[4]。CF-FMコウモリであるヒゲコウモリ(Pteronotus parnellii)の聴覚野には、FM音の組み合わせに選択的な反応を示す神経細胞(FM-FMニューロン)や、CF音の組み合わせに選択的な神経細胞(CF/CFニューロン)が存在する。FM-FMニューロンは2つのFM音の時間差に選択的であるため距離計測に、CF/CFニューロンは2つのCF音の周波数差に選択的であるため周波数計測にそれぞれ関わると言われる[注釈 1]。さらに、ドップラーシフトしたエコーのCF2に選択的に反応を示すニューロンが存在し、混雑した環境で獲物となる飛翔昆虫の羽ばたきを検知するのに役立つと考えられている[27]。
こだま定位における混信対策
ターゲットとなる物体以外の物体をクラッターと呼ぶ。コウモリが茂みに近い場所で餌となる飛翔昆虫を探索するとき、茂みの葉っぱ一枚一枚からのクラッターエコーが昆虫からの標的エコーと時間的に重畳してしまう[29]。このようなクラッター環境でもコウモリは放射パルスの周波数依存の指向性を利用することで、ターゲットとなる獲物のエコーを抽出していることが示唆されている。放射パルスは高周波ほど指向性が鋭いため、音軸から左右に外れたところに存在する物体からのエコーは、コウモリの真正面からのエコーに比べ高周波がより減衰する。
オオクビワコウモリの放射パルスは通常、複数の倍音を伴うが、基本音と第二高調波が最も顕著である。オオクビワコウモリに昆虫を模した疑似エコーを呈示した際の距離弁別のパフォーマンスは、スペクトルが平坦な妨害音声により著しく低下するが、第二高調波をわずかに減衰させた妨害音声の影響を受けない[30]。また、コウモリから90˚の位置に置いたスピーカーから妨害音声が呈示されても、外耳の指向性により妨害音声の高周波成分が減衰し、標的エコーの聴取は妨害されない[31]。同じくオオクビワコウモリにおいて、FM音声の呈示に対する聴覚誘発電位は、FM音の音圧が1 dB増えるごとに潜時が約16 µs減少する[32]。この刺激強度−潜時のトレードオフによって、高周波が減衰したクラッターエコーにおいて、聴覚系で生じるエコーに対する活動電位の潜時が長くなる。コウモリは高周波に反応する神経細胞の潜時情報を利用し、高周波成分が減衰したクラッターエコーを排除していると考えられている[29]。実際に、第二高調波だけを3 dB減衰させた疑似エコーを用いると、距離弁別課題の誤答率は上昇するが、それを相殺するように、3 dB減衰させた第二高調波を基本音よりも48 µs早めると誤答率は低下する[33]。放射パルスや外耳の指向性によってエコーに生じるわずかな周波数スペクトルの変化は、聴覚系で神経活動の潜時の違いにより表現されている。
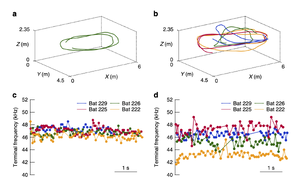
同種のコウモリが複数で飛行する際には、各個体が発するパルスによって複雑な音響環境が引き起こされる。実際に、自身のパルスに類似したパルスを提示されると、距離弁別能が低下する[34]。コウモリはこのような他個体由来の混信に対して、いくつかの戦術を組み合わせて回避している。例えば、2個体で飛行するオオクビワコウモリのうち、一方が他方を追随するように飛行する際、追う方のコウモリがパルス放射をやめ、他個体のパルスを聴取することによって他個体の方向を定位し飛行する(図3)[35]。また、ユビナガコウモリ(Miniopterus fuliginosus)は、単独飛行時に比べ、4個体での同時飛行時に、放射するパルスの終端周波数の個体感の差を拡大させる[28]。このように、コウモリは放射パルスの時間周波数構造を変化させたり[36][37][38]、放射タイミングをコントロールしたりすることで、混信に対処している。
注釈
- ↑ CF音は通常長く、パルスCFとエコーCFが時間的に重畳する一方で、CF-FMコウモリのFM部やFMコウモリのFM音声は短く、パルスとエコーは時間的に重畳しない。組み合わせ感受性を持つ神経細胞は、音声同士の時間的な重畳がある場合には”/“、ない場合には”-“を用いて命名されている。
参考文献
引用文献
- ↑ 1.0 1.1
Grinnell, A.D. (2018).
Early milestones in the understanding of echolocation in bats. Journal of comparative physiology. A, Neuroethology, sensory, neural, and behavioral physiology, 204(6), 519-536. [PubMed:29687162] [WorldCat] [DOI] - ↑ 2.0 2.1
Yamada, Y., Hiryu, S., & Watanabe, Y. (2016).
Species-specific control of acoustic gaze by echolocating bats, Rhinolophus ferrumequinum nippon and Pipistrellus abramus, during flight. Journal of comparative physiology. A, Neuroethology, sensory, neural, and behavioral physiology, 202(11), 791-801. [PubMed:27566319] [PMC] [WorldCat] [DOI] - ↑ Neuweiler, G. (1984).
Foraging, echolocation and audition in bats. Naturwissenschaften. 1984;71: 446-455. [DOI] - ↑ 4.0 4.1
Schnitzler, H.U., & Denzinger, A. (2011).
Auditory fovea and Doppler shift compensation: adaptations for flutter detection in echolocating bats using CF-FM signals. Journal of comparative physiology. A, Neuroethology, sensory, neural, and behavioral physiology, 197(5), 541-59. [PubMed:20857119] [WorldCat] [DOI] - ↑
Tang, J., Xiao, Z., & Suga, N. (2007).
Bilateral cortical interaction: modulation of delay-tuned neurons in the contralateral auditory cortex. The Journal of neuroscience : the official journal of the Society for Neuroscience, 27(31), 8405-13. [PubMed:17670987] [PMC] [WorldCat] [DOI] - ↑
Simmons, J.A. (1973).
The resolution of target range by echolocating bats. The Journal of the Acoustical Society of America, 54(1), 157-73. [PubMed:4738624] [WorldCat] [DOI] - ↑
Simmons, J.A., Ferragamo, M., Moss, C.F., Stevenson, S.B., & Altes, R.A. (1990).
Discrimination of jittered sonar echoes by the echolocating bat, Eptesicus fuscus: the shape of target images in echolocation. Journal of comparative physiology. A, Sensory, neural, and behavioral physiology, 167(5), 589-616. [PubMed:2074548] [DOI] - ↑
Simmons, J.A., Neretti, N., Intrator, N., Altes, R.A., Ferragamo, M.J., & Sanderson, M.I. (2004).
Delay accuracy in bat sonar is related to the reciprocal of normalized echo bandwidth, or Q. Proceedings of the National Academy of Sciences of the United States of America, 101(10), 3638-43. [PubMed:14990794] [PMC] [WorldCat] [DOI] - ↑
Pollak, G.D. (1993).
Some comments on the proposed perception of phase and nanosecond time disparities by echolocating bats. Journal of comparative physiology. A, Sensory, neural, and behavioral physiology, 172(5), 523-31. [PubMed:8331603] [DOI] - ↑
Beedholm, K. (2006).
The transfer function of a target limits the jitter detection threshold with signals of echolocating FM-bats. Journal of comparative physiology. A, Neuroethology, sensory, neural, and behavioral physiology, 192(5), 461-8. [PubMed:16395614] [WorldCat] [DOI] - ↑
Beedholm, K., & Møhl, B. (1998).
Bat sonar: an alternative interpretation of the 10-ns jitter result. Journal of comparative physiology. A, Sensory, neural, and behavioral physiology, 182(3), 259-66. [PubMed:9528108] [DOI] - ↑ 12.0 12.1
Goerlitz, H.R., Geberl, C., & Wiegrebe, L. (2010).
Sonar detection of jittering real targets in a free-flying bat. The Journal of the Acoustical Society of America, 128(3), 1467-75. [PubMed:20815481] [WorldCat] [DOI] - ↑
Goerlitz, H.R. (2018).
Weather conditions determine attenuation and speed of sound: Environmental limitations for monitoring and analyzing bat echolocation. Ecology and evolution, 8(10), 5090-5100. [PubMed:29876084] [PMC] [WorldCat] [DOI] - ↑
Simmons, J.A., & Chen, L. (1989).
The acoustic basis for target discrimination by FM echolocating bats. The Journal of the Acoustical Society of America, 86(4), 1333-50. [PubMed:2808908] [WorldCat] [DOI] - ↑
Sanderson, M.I., & Simmons, J.A. (2000).
Neural responses to overlapping FM sounds in the inferior colliculus of echolocating bats. Journal of neurophysiology, 83(4), 1840-55. [PubMed:10758096] [WorldCat] [DOI] - ↑
Sanderson, M.I., & Simmons, J.A. (2002).
Selectivity for echo spectral interference and delay in the auditory cortex of the big brown bat Eptesicus fuscus. Journal of neurophysiology, 87(6), 2823-34. [PubMed:12037185] [WorldCat] [DOI] - ↑
Sullivan, W.E. (1982).
Neural representation of target distance in auditory cortex of the echolocating bat Myotis lucifugus. Journal of neurophysiology, 48(4), 1011-32. [PubMed:7143030] [WorldCat] [DOI] - ↑ 18.0 18.1
Suga, N., O'Neill, W.E., Kujirai, K., & Manabe, T. (1983).
Specificity of combination-sensitive neurons for processing of complex biosonar signals in auditory cortex of the mustached bat. Journal of neurophysiology, 49(6), 1573-626. [PubMed:6875639] [WorldCat] [DOI] - ↑
Kössl, M., Hechavarria, J.C., Voss, C., Macias, S., Mora, E.C., & Vater, M. (2014).
Neural maps for target range in the auditory cortex of echolocating bats. Current opinion in neurobiology, 24(1), 68-75. [PubMed:24492081] [WorldCat] [DOI] - ↑ 20.0 20.1
Sullivan, W.E. (1982).
Possible neural mechanisms of target distance coding in auditory system of the echolocating bat Myotis lucifugus. Journal of neurophysiology, 48(4), 1033-47. [PubMed:7143031] [WorldCat] [DOI] - ↑
Klug, A., Khan, A., Burger, R.M., Bauer, E.E., Hurley, L.M., Yang, L., ..., & Park, T.J. (2000).
Latency as a function of intensity in auditory neurons: influences of central processing. Hearing research, 148(1-2), 107-23. [PubMed:10978829] [WorldCat] [DOI] - ↑ 22.0 22.1
Berkowitz, A., & Suga, N. (1989).
Neural mechanisms of ranging are different in two species of bats. Hearing research, 41(2-3), 255-64. [PubMed:2808154] [WorldCat] [DOI] - ↑ 23.0 23.1
Hiryu, S., Shiori, Y., Hosokawa, T., Riquimaroux, H., & Watanabe, Y. (2008).
On-board telemetry of emitted sounds from free-flying bats: compensation for velocity and distance stabilizes echo frequency and amplitude. Journal of comparative physiology. A, Neuroethology, sensory, neural, and behavioral physiology, 194(9), 841-51. [PubMed:18663454] [WorldCat] [DOI] - ↑
Hiryu, S., Hagino, T., Riquimaroux, H., & Watanabe, Y. (2007).
Echo-intensity compensation in echolocating bats (Pipistrellus abramus) during flight measured by a telemetry microphone. The Journal of the Acoustical Society of America, 121(3), 1749-57. [PubMed:17407911] [WorldCat] [DOI] - ↑
Budenz, T., Denzinger, A., & Schnitzler, H.U. (2018).
Reduction of emission level in approach signals of greater mouse-eared bats (Myotis myotis): No evidence for a closed loop control system for intensity compensation. PloS one, 13(3), e0194600. [PubMed:29543882] [PMC] [WorldCat] [DOI] - ↑ Schnitzler, H.-U. (1968).
Die Ultraschall-Ortungslaute der Hufeisen-Fledermäuse (Chiroptera-Rhinolophidae) in verschiedenen Orientierungssituationen. J Comp Physiol A Neuroethol Sens Neural Behav Physiol. 1968;57: 376-408. [DOI] - ↑
Suga, N. (1989).
Principles of auditory information-processing derived from neuroethology. The Journal of experimental biology, 146, 277-86. [PubMed:2689566] [WorldCat] [DOI] - ↑ 28.0 28.1
Hase, K., Kadoya, Y., Maitani, Y., Miyamoto, T., Kobayasi, K.I., & Hiryu, S. (2018).
Bats enhance their call identities to solve the cocktail party problem. Communications biology, 1, 39. [PubMed:30271924] [PMC] [WorldCat] [DOI] - ↑ 29.0 29.1
Simmons, J.A. (2014).
Temporal binding of neural responses for focused attention in biosonar. The Journal of experimental biology, 217(Pt 16), 2834-43. [PubMed:25122915] [PMC] [WorldCat] [DOI] - ↑
Bates, M.E., Simmons, J.A., & Zorikov, T.V. (2011).
Bats use echo harmonic structure to distinguish their targets from background clutter. Science (New York, N.Y.), 333(6042), 627-30. [PubMed:21798949] [WorldCat] [DOI] - ↑
Warnecke, M., Bates, M.E., Flores, V., & Simmons, J.A. (2014).
Spatial release from simultaneous echo masking in bat sonar. The Journal of the Acoustical Society of America, 135(5), 3077-85. [PubMed:24926503] [WorldCat] [DOI] - ↑
Simmons, J.A., Moss, C.F., & Ferragamo, M. (1990).
Convergence of temporal and spectral information into acoustic images of complex sonar targets perceived by the echolocating bat, Eptesicus fuscus. Journal of comparative physiology. A, Sensory, neural, and behavioral physiology, 166(4), 449-70. [PubMed:2332837] [DOI] - ↑
Bates, M.E., & Simmons, J.A. (2010).
Effects of filtering of harmonics from biosonar echoes on delay acuity by big brown bats (Eptesicus fuscus). The Journal of the Acoustical Society of America, 128(2), 936-46. [PubMed:20707464] [PMC] [WorldCat] [DOI] - ↑
Masters, W.M., & Raver, K.A. (1996).
The degradation of distance discrimination in big brown bats (Eptesicus fuscus) caused by different interference signals. Journal of comparative physiology. A, Sensory, neural, and behavioral physiology, 179(5), 703-13. [PubMed:8888581] [DOI] - ↑
Chiu, C., Xian, W., & Moss, C.F. (2008).
Flying in silence: Echolocating bats cease vocalizing to avoid sonar jamming. Proceedings of the National Academy of Sciences of the United States of America, 105(35), 13116-21. [PubMed:18725624] [PMC] [WorldCat] [DOI] - ↑
Ulanovsky, N., Fenton, M.B., Tsoar, A., & Korine, C. (2004).
Dynamics of jamming avoidance in echolocating bats. Proceedings. Biological sciences, 271(1547), 1467-75. [PubMed:15306318] [PMC] [WorldCat] [DOI] - ↑
Chiu, C., Xian, W., & Moss, C.F. (2009).
Adaptive echolocation behavior in bats for the analysis of auditory scenes. The Journal of experimental biology, 212(Pt 9), 1392-404. [PubMed:19376960] [PMC] [WorldCat] [DOI] - ↑
Hiryu, S., Bates, M.E., Simmons, J.A., & Riquimaroux, H. (2010).
FM echolocating bats shift frequencies to avoid broadcast-echo ambiguity in clutter. Proceedings of the National Academy of Sciences of the United States of America, 107(15), 7048-53. [PubMed:20351291] [PMC] [WorldCat] [DOI]
その他初学者向けの書籍
- Erbe, C., & Thomas, J. A. (2022).
Exploring Animal Behavior Through Sound: Volume 1: Methods (p. 517). Springer Nature. ISBN 978-3030975388 - Neuweiler, G. (2000).
The biology of bats. Oxford University Press. ISBN 978-0195099515 - Fenton, M. B., Grinnell, A. D., Popper, A. N., & Fay, R. R. (Eds.). (2016).
Bat bioacoustics. Springer New York. ISBN 978-1-4939-3525-3 - Popper, A. N., & Fay, R. R. (Eds.). (1995).
Hearing by bats. Springer New York. ISBN 978-1-4615-1919-5 - J.D. オルトリンガム(著) 松村澄子(監修) コウモリの会翻訳グループ (訳) (1998).
コウモリ―進化・生態・行動 八坂書房 ISBN 978-4896944129 - 船越公威 (2020).
コウモリ学: 適応と進化 東京大学出版会 ISBN 978-4130602402 - 船越公威・福井大・河合久仁子・吉行瑞子 (2007).
コウモリのふしぎ 逆さまなのにもワケがある」 技術評論社 ISBN 978-4774131351