「味覚受容体」の版間の差分
Nobuaki Tanaka (トーク | 投稿記録) 細編集の要約なし |
細 (→Gタンパク質共役型受容体) |
||
| (2人の利用者による、間の3版が非表示) | |||
| 2行目: | 2行目: | ||
<font size="+1">[http://researchmap.jp/nktanaka 田中暢明]</font><br> | <font size="+1">[http://researchmap.jp/nktanaka 田中暢明]</font><br> | ||
''北海道大学 理学研究院''<br> | ''北海道大学 理学研究院''<br> | ||
DOI:<selfdoi /> | DOI:<selfdoi /> 原稿受付日:2012年5月7日 原稿完成日:2012年7月9日 一部改訂:2021年8月24日<br> | ||
担当編集委員:[http://researchmap.jp/michisukeyuzaki 柚崎 通介](慶應義塾大学 医学部生理学)<br> | 担当編集委員:[http://researchmap.jp/michisukeyuzaki 柚崎 通介](慶應義塾大学 医学部生理学)<br> | ||
</div> | </div> | ||
| 8行目: | 8行目: | ||
英:taste receptor、gustatory receptor 独:Geschmacksrezeptor 仏:récepteurs gustatifs | 英:taste receptor、gustatory receptor 独:Geschmacksrezeptor 仏:récepteurs gustatifs | ||
{{box|text= | {{box|text= 味には、[[甘味]]、[[酸味]]、[[塩味]]、[[苦味]]、[[うま味]]の[[5基本味]]があるが、それぞれの味覚を生じさせる味物質は、[[味細胞]]に発現する特定の味覚受容体を介して検出される。味覚受容体には、7回膜貫通型の[[Gタンパク質共役型受容体]]や[[イオンチャネル型受容体]]が報告されており、それぞれの基本味に対する主要な味覚受容体は既に同定されている。その一方で、基本味以外にも、[[カルシウム味]]や[[脂肪酸味]]などに応答する[[味細胞]]が報告されているが、カルシウムや脂肪酸に対する受容体はいまだ確定されていない。}} | ||
味には、[[甘味]]、[[酸味]]、[[塩味]]、[[苦味]]、[[うま味]]の[[5基本味]]があるが、それぞれの味覚を生じさせる味物質は、[[味細胞]]に発現する特定の味覚受容体を介して検出される。味覚受容体には、7回膜貫通型の[[Gタンパク質共役型受容体]]や[[イオンチャネル型受容体]]が報告されており、それぞれの基本味に対する主要な味覚受容体は既に同定されている。その一方で、基本味以外にも、[[カルシウム味]]や[[脂肪酸味]]などに応答する[[味細胞]]が報告されているが、カルシウムや脂肪酸に対する受容体はいまだ確定されていない。}} | |||
==味覚受容体とは== | |||
味覚受容体は、接触した[[wj:化学物質|化学物質]]を検出するための[[受容体]]で、1999年に、[[味細胞]]に発現する7回膜貫通型の[[Gタンパク質共役型受容体]]として初めて哺乳類から同定された<ref><pubmed> 10052456 </pubmed></ref>。その後、[[wj:分子生物学的手法|分子生物学的手法]]や[[wj:ゲノムプロジェクト|ゲノムプロジェクト]]の発展に伴い、さまざまな動物種で味覚受容体遺伝子のクローニングが進められ、[[甘味]]、[[酸味]]、[[塩味]]、[[苦味]]、[[うま味]]の[[5基本味]]に対する主要な受容体が同定された<ref>'''二ノ宮裕三、重村憲徳、實松敬介'''<br>化学受容の科学(東原和成編)5章「味覚受容体」<br>''化学同人(京都)'':2012</ref><ref name="ref5"><pubmed> 19837029 </pubmed></ref>。 | |||
== 哺乳類の味覚受容体 == | == 哺乳類の味覚受容体 == | ||
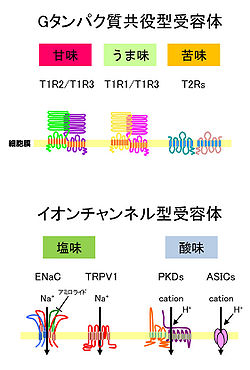
哺乳類の味覚受容体には、7回膜貫通型のGタンパク質共役型受容体([[T1R]]、[[T2R]]ファミリー)と、[[イオンチャネル型受容体]]などがある('''図''')。そうした味覚受容体を発現する味細胞は、主に、舌の[[味蕾]](taste buds)にあるが、[[wj:軟口蓋|軟口蓋]]、[[wj:喉頭蓋|喉頭蓋]]などにも分布している<ref name="ref5" />。さらに、甘味受容体などが[[wj:腸管|腸管]]や脳内でも発現していることが明らかになっている<ref><pubmed> 15667333 </pubmed></ref><ref><pubmed> 19587847 </pubmed></ref>。 | |||
[[Image:味覚受容体.jpg|thumb|right|250px|'''図 味覚受容体の構造'''<br>化学受容の科学(化学同人)5章より改変(實松敬介氏提供)]] | |||
=== Gタンパク質共役型受容体 === | === Gタンパク質共役型受容体 === | ||
7回膜貫通型のタンパク質で、多量体を形成する。味物質と結合すると[[Gタンパク質]]を活性化することにより、セカンドメッセンジャー経路を介して、最終的に[[Transient receptor potentialチャネル#TRPM|Transient receptor potential channel type M5]]([[TRPM5]])を開口させる。その結果、Na<sup>+</sup>が細胞内に流入して、[[味細胞]]を[[脱分極]]させる<ref><pubmed> 12581520 </pubmed></ref>。個々の受容体タンパク質に複数のリガンド結合サイトがあると考えられており、1個の受容体は複数の味覚刺激物質を検出する<ref><pubmed> 15353592 </pubmed></ref><ref><pubmed> 17935609 </pubmed></ref>。生体にとって栄養源となるうま味や甘味などを認識するT1Rファミリーと、生体にとって有害な苦味を検出するT2Rファミリーの2種があり、T1RとT2Rはそれぞれ異なる味細胞で発現することが知られている<ref><pubmed> 10761934 </pubmed></ref>。 | |||
味覚受容体は、一般的なGタンパク質共役型受容体と比較すると種間のアミノ酸配列の相違が大きく、この相違が種間の味覚の違いを生んでいることが示されている。例えばマウスでは、大部分のL型[[wj:アミノ酸|アミノ酸]]がうま味として認識されるのに対して、ヒトではL型[[グルタミン酸]]やL型[[アスパラギン酸]]しか強く認識されないのは、受容体の構造の違いによる<ref name="ref2"><pubmed> 11894099 </pubmed></ref>。 | |||
味覚受容体は、一般的なGタンパク質共役型受容体と比較すると種間のアミノ酸配列の相違が大きく、この相違が種間の味覚の違いを生んでいることが示されている。例えばマウスでは、大部分のL型[[ | |||
==== うま味/甘味受容体(T1Rファミリー)==== | ==== うま味/甘味受容体(T1Rファミリー)==== | ||
T1Rファミリーには、[[T1R1]]、[[T1R2]]、[[T1R3]]の3種類のサブユニットがあり、T1R1とT1R3がヘテロ2量体を形成している場合はグルタミン酸などのうま味物質の受容体として<ref name="ref2" />、T1R2とT1R3がヘテロ2量体を形成している際は[[糖]]や[[グリシン]]、甘味を持つタンパク質([[wj:モネリン|モネリン]]や[[wj:ソーマチン|ソーマチン]])などの受容体として機能する<ref><pubmed> 14636554 </pubmed></ref><ref><pubmed> 11509186 </pubmed></ref><ref><pubmed> 11894099 </pubmed></ref>。 ただし、うま味受容体に関しては、T1R1/T1R3以外にも、味蕾に発現しているtaste-[[mGluR]]4がグルタミン酸を受容しているという報告もある<ref><pubmed> 10649565 </pubmed></ref>。 | |||
T1Rファミリーには、[[T1R1]]、[[T1R2]]、[[T1R3]]の3種類のサブユニットがあり、T1R1とT1R3がヘテロ2量体を形成している場合はグルタミン酸などのうま味物質の受容体として<ref name="ref2" />、T1R2とT1R3がヘテロ2量体を形成している際は[[糖]]や[[グリシン]]、甘味を持つタンパク質([[ | |||
==== 苦味受容体(T2Rファミリー) ==== | ==== 苦味受容体(T2Rファミリー) ==== | ||
T2Rファミリーには多種類の受容体が含まれ、マウスでは30種類ほどある<ref><pubmed> 10761934 </pubmed></ref>。複数種の受容体が同じ味細胞に共発現し、ホモ/ヘテロ・オリゴマーを形成して苦味物質を検出する<ref><pubmed> 20212011 </pubmed></ref>。 | |||
T2Rファミリーには多種類の受容体が含まれ、マウスでは30種類ほどある<ref><pubmed> 10761934 </pubmed></ref>。複数種の受容体が同じ味細胞に共発現し、ホモ/ヘテロ・オリゴマーを形成して苦味物質を検出する<ref><pubmed> 20212011 </pubmed></ref>。 | |||
=== イオンチャネル型受容体 === | === イオンチャネル型受容体 === | ||
Gタンパク質共役型受容体が味物質と結合してGタンパク質を活性化するのとは対照的に、イオンチャネル型受容体は、細胞外のH<sup>+</sup>(酸味)やNa<sup>+</sup>(塩味)などのイオンを透過させる[[イオンチャネル]]として働くことにより、味物質を検出させていると考えられている。 | Gタンパク質共役型受容体が味物質と結合してGタンパク質を活性化するのとは対照的に、イオンチャネル型受容体は、細胞外のH<sup>+</sup>(酸味)やNa<sup>+</sup>(塩味)などのイオンを透過させる[[イオンチャネル]]として働くことにより、味物質を検出させていると考えられている。 | ||
==== 酸味受容体 ==== | ==== 酸味受容体 ==== | ||
[[Transient receptor potential channel]]([[TRP channel]])の1種である[[PKD2L1]]を発現している味細胞を欠くと酸味応答がなくなることが報告されている<ref><pubmed> 16929298 </pubmed></ref>。しかしながら、PKD2L1の膜局在に必要な[[PKD1L3]]を欠損するマウスでも酸味に対する応答が変化しなかったり<ref><pubmed> 20605874 </pubmed></ref>、PKD2L1とPKD1L3を共発現させた[[培養細胞]]が酸刺激をとめた時にしか応答しないことから<ref><pubmed> 18535624 </pubmed></ref>、PKD2L1は酸味の後味に関与していて、PKD以外にも酸受容体があると考えられた。酸味を受容する受容体としては、他にも[[Acid-sensing ion channel]]([[ASIC]])や[[hyperpolarization-activated cyclic nucleotide-gated channel]] ([[HCN channel]]) などが候補として挙げられてきたが、個体レベルで酸味の検出に必要だという証明はされていない<ref><pubmed> 12736332 </pubmed></ref><ref><pubmed> 11675786 </pubmed></ref>。その一方で、H<sup>+</sup>イオンに選択性のあるイオンチャネルを形成する[[Otopetrin1]]が、PKD2L1を発現している味細胞で発現し、酸の受容に関与することが示された<ref><pubmed> 29371428</pubmed></ref><ref><pubmed> 31543264</pubmed></ref>。 | |||
[[Transient receptor potential channel]] | |||
==== 塩味受容体 ==== | ==== 塩味受容体 ==== | ||
低濃度の塩味(Na<sup>+</sup>イオン)に対するマウスの嗜好性は、[[アミロライド]]によって抑制されるので、[[上皮性アミロライド感受性Na+チャネル|上皮性アミロライド感受性Na<sup>+</sup>チャネル]] | 低濃度の塩味(Na<sup>+</sup>イオン)に対するマウスの嗜好性は、[[アミロライド]]によって抑制されるので、[[上皮性アミロライド感受性Na+チャネル|上皮性アミロライド感受性Na<sup>+</sup>チャネル]]([[ENaC]])によって、塩味は受容されると考えられている<ref><pubmed> 20107438 </pubmed></ref>。他方、高濃度の塩味に対する嫌悪はアミロライドによって抑制されないことから、高濃度の塩味は別の機構で受容されており、[[TRPV1t]](vanilloid receptor)がその候補として考えられている<ref><pubmed> 15146042 </pubmed></ref>。近年、アミロライドに依存しない塩味応答が、Na<sup>+</sup>イオンではなくCl<sup>-</sup>イオンによって起こるという報告がなされたが、その分子機構は明らかになっていない<ref><pubmed> 31171579</pubmed></ref>。<br> | ||
== 昆虫の味覚受容体 == | == 昆虫の味覚受容体 == | ||
昆虫の[[味細胞]]は、口吻、咽頭、跗節や交尾器などの[[感覚子]](sensillum)に存在する<ref name="ref4"><pubmed> 8118845 </pubmed></ref>。進化的には哺乳類とかけはなれた昆虫も、味覚の区分は哺乳類と極めて類似しており、糖や低濃度の塩、脂肪酸に対しては嗜好性を示し、高濃度の塩や苦味などを嫌悪する<ref name="ref5" />。また、[[甘味受容体]]の遺伝子数が、[[苦味受容体]]に比べると少ない点も共通している<ref><pubmed> 21262465 </pubmed></ref>。しかし、昆虫には食物を味わう目的以外に、たとえば脚にある味覚受容器の味覚受容体が産卵先の宿主植物が持つ化学物質や、求愛相手の[[wj:性フェロモン|性フェロモン]]の検知に関わっていることが報告されている<ref><pubmed> 22086342 </pubmed></ref><ref><pubmed> 22632976 </pubmed></ref>。 | |||
ここでは、昆虫で最も味覚受容体の同定が進んでいる[[ショウジョウバエ]]を例に概説する。ショウジョウバエでは68種類の7回膜貫通型の味覚受容体(gustatory receptor, GR)からなる遺伝子ファミリーが同定されており、糖や苦み物質に対する受容体や、その受容体を発現する[[味細胞]]が明らかになっている<ref><pubmed> 19660932 </pubmed></ref>。ただし、GRファミリーには、[[嗅覚受容体]]として機能する受容体なども含まれており、すべてが味覚受容体として機能しているわけではない。GRファミリーに含まれる味覚受容体は、7回膜貫通型のタンパク質ではあるが、少なくとも一部の受容体はGタンパク質共役型ではなく、リガンド結合型イオンチャネルとして機能することが報告されている<ref><pubmed> 21709218</pubmed></ref>。また、個々の[[味細胞]]は、異なる組み合わせのGR遺伝子を発現することで、様々な糖を受容していると考えられている<ref><pubmed> 25702577 </pubmed></ref>。しかしながら、受容体として機能する際のGRのサブユニット構成は解明されていない。唯一、[[GR43a]]はその発現だけで陽イオンチャネルとして機能することが明らかにされている<ref><pubmed> 21709218</pubmed></ref>。ちなみに、そのGR43aは脳では血リンパ中の[[wj:果糖|果糖]]の濃度をモニターするのにも役立っている<ref><pubmed> 23178127</pubmed></ref>。 | |||
GRファミリー以外にも、イオンチャネル型受容体(IR)やENaCファミリーの[[pickpocketチャネル]]、TRPチャネルなども味覚受容体として機能していると考えられている<ref><pubmed> 33683373 </pubmed></ref>。例としては、[[Pickpocket28]]([[PPK28]])が[[水受容細胞]]で低浸透圧を検知する[[水味受容体]]として働いていることが報告されている<ref><pubmed> 20364123 </pubmed></ref>。それ以外では、Na<sup>+</sup>の受容にはIR76bなど<ref><pubmed> 30307393 </pubmed></ref>、[[アミノ酸]]に対する感受性には[[IR76b]]と[[IR20a]]<ref><pubmed> 28099851 </pubmed></ref>、[[性フェロモン]]の受容にはP[[PK23]]や[[PPK29]]<ref><pubmed> 22632976 </pubmed></ref>が関与していることが報告されているが、それらが味覚受容体として機能しているという直接的な証拠はまだない。 | |||
== 関連項目 == | == 関連項目 == | ||
2021年8月27日 (金) 20:07時点における最新版
田中暢明
北海道大学 理学研究院
DOI:10.14931/bsd.1302 原稿受付日:2012年5月7日 原稿完成日:2012年7月9日 一部改訂:2021年8月24日
担当編集委員:柚崎 通介(慶應義塾大学 医学部生理学)
英:taste receptor、gustatory receptor 独:Geschmacksrezeptor 仏:récepteurs gustatifs
味には、甘味、酸味、塩味、苦味、うま味の5基本味があるが、それぞれの味覚を生じさせる味物質は、味細胞に発現する特定の味覚受容体を介して検出される。味覚受容体には、7回膜貫通型のGタンパク質共役型受容体やイオンチャネル型受容体が報告されており、それぞれの基本味に対する主要な味覚受容体は既に同定されている。その一方で、基本味以外にも、カルシウム味や脂肪酸味などに応答する味細胞が報告されているが、カルシウムや脂肪酸に対する受容体はいまだ確定されていない。
味覚受容体とは
味覚受容体は、接触した化学物質を検出するための受容体で、1999年に、味細胞に発現する7回膜貫通型のGタンパク質共役型受容体として初めて哺乳類から同定された[1]。その後、分子生物学的手法やゲノムプロジェクトの発展に伴い、さまざまな動物種で味覚受容体遺伝子のクローニングが進められ、甘味、酸味、塩味、苦味、うま味の5基本味に対する主要な受容体が同定された[2][3]。
哺乳類の味覚受容体
哺乳類の味覚受容体には、7回膜貫通型のGタンパク質共役型受容体(T1R、T2Rファミリー)と、イオンチャネル型受容体などがある(図)。そうした味覚受容体を発現する味細胞は、主に、舌の味蕾(taste buds)にあるが、軟口蓋、喉頭蓋などにも分布している[3]。さらに、甘味受容体などが腸管や脳内でも発現していることが明らかになっている[4][5]。
Gタンパク質共役型受容体
7回膜貫通型のタンパク質で、多量体を形成する。味物質と結合するとGタンパク質を活性化することにより、セカンドメッセンジャー経路を介して、最終的にTransient receptor potential channel type M5(TRPM5)を開口させる。その結果、Na+が細胞内に流入して、味細胞を脱分極させる[6]。個々の受容体タンパク質に複数のリガンド結合サイトがあると考えられており、1個の受容体は複数の味覚刺激物質を検出する[7][8]。生体にとって栄養源となるうま味や甘味などを認識するT1Rファミリーと、生体にとって有害な苦味を検出するT2Rファミリーの2種があり、T1RとT2Rはそれぞれ異なる味細胞で発現することが知られている[9]。
味覚受容体は、一般的なGタンパク質共役型受容体と比較すると種間のアミノ酸配列の相違が大きく、この相違が種間の味覚の違いを生んでいることが示されている。例えばマウスでは、大部分のL型アミノ酸がうま味として認識されるのに対して、ヒトではL型グルタミン酸やL型アスパラギン酸しか強く認識されないのは、受容体の構造の違いによる[10]。
うま味/甘味受容体(T1Rファミリー)
T1Rファミリーには、T1R1、T1R2、T1R3の3種類のサブユニットがあり、T1R1とT1R3がヘテロ2量体を形成している場合はグルタミン酸などのうま味物質の受容体として[10]、T1R2とT1R3がヘテロ2量体を形成している際は糖やグリシン、甘味を持つタンパク質(モネリンやソーマチン)などの受容体として機能する[11][12][13]。 ただし、うま味受容体に関しては、T1R1/T1R3以外にも、味蕾に発現しているtaste-mGluR4がグルタミン酸を受容しているという報告もある[14]。
苦味受容体(T2Rファミリー)
T2Rファミリーには多種類の受容体が含まれ、マウスでは30種類ほどある[15]。複数種の受容体が同じ味細胞に共発現し、ホモ/ヘテロ・オリゴマーを形成して苦味物質を検出する[16]。
イオンチャネル型受容体
Gタンパク質共役型受容体が味物質と結合してGタンパク質を活性化するのとは対照的に、イオンチャネル型受容体は、細胞外のH+(酸味)やNa+(塩味)などのイオンを透過させるイオンチャネルとして働くことにより、味物質を検出させていると考えられている。
酸味受容体
Transient receptor potential channel(TRP channel)の1種であるPKD2L1を発現している味細胞を欠くと酸味応答がなくなることが報告されている[17]。しかしながら、PKD2L1の膜局在に必要なPKD1L3を欠損するマウスでも酸味に対する応答が変化しなかったり[18]、PKD2L1とPKD1L3を共発現させた培養細胞が酸刺激をとめた時にしか応答しないことから[19]、PKD2L1は酸味の後味に関与していて、PKD以外にも酸受容体があると考えられた。酸味を受容する受容体としては、他にもAcid-sensing ion channel(ASIC)やhyperpolarization-activated cyclic nucleotide-gated channel (HCN channel) などが候補として挙げられてきたが、個体レベルで酸味の検出に必要だという証明はされていない[20][21]。その一方で、H+イオンに選択性のあるイオンチャネルを形成するOtopetrin1が、PKD2L1を発現している味細胞で発現し、酸の受容に関与することが示された[22][23]。
塩味受容体
低濃度の塩味(Na+イオン)に対するマウスの嗜好性は、アミロライドによって抑制されるので、上皮性アミロライド感受性Na+チャネル(ENaC)によって、塩味は受容されると考えられている[24]。他方、高濃度の塩味に対する嫌悪はアミロライドによって抑制されないことから、高濃度の塩味は別の機構で受容されており、TRPV1t(vanilloid receptor)がその候補として考えられている[25]。近年、アミロライドに依存しない塩味応答が、Na+イオンではなくCl-イオンによって起こるという報告がなされたが、その分子機構は明らかになっていない[26]。
昆虫の味覚受容体
昆虫の味細胞は、口吻、咽頭、跗節や交尾器などの感覚子(sensillum)に存在する[27]。進化的には哺乳類とかけはなれた昆虫も、味覚の区分は哺乳類と極めて類似しており、糖や低濃度の塩、脂肪酸に対しては嗜好性を示し、高濃度の塩や苦味などを嫌悪する[3]。また、甘味受容体の遺伝子数が、苦味受容体に比べると少ない点も共通している[28]。しかし、昆虫には食物を味わう目的以外に、たとえば脚にある味覚受容器の味覚受容体が産卵先の宿主植物が持つ化学物質や、求愛相手の性フェロモンの検知に関わっていることが報告されている[29][30]。
ここでは、昆虫で最も味覚受容体の同定が進んでいるショウジョウバエを例に概説する。ショウジョウバエでは68種類の7回膜貫通型の味覚受容体(gustatory receptor, GR)からなる遺伝子ファミリーが同定されており、糖や苦み物質に対する受容体や、その受容体を発現する味細胞が明らかになっている[31]。ただし、GRファミリーには、嗅覚受容体として機能する受容体なども含まれており、すべてが味覚受容体として機能しているわけではない。GRファミリーに含まれる味覚受容体は、7回膜貫通型のタンパク質ではあるが、少なくとも一部の受容体はGタンパク質共役型ではなく、リガンド結合型イオンチャネルとして機能することが報告されている[32]。また、個々の味細胞は、異なる組み合わせのGR遺伝子を発現することで、様々な糖を受容していると考えられている[33]。しかしながら、受容体として機能する際のGRのサブユニット構成は解明されていない。唯一、GR43aはその発現だけで陽イオンチャネルとして機能することが明らかにされている[34]。ちなみに、そのGR43aは脳では血リンパ中の果糖の濃度をモニターするのにも役立っている[35]。
GRファミリー以外にも、イオンチャネル型受容体(IR)やENaCファミリーのpickpocketチャネル、TRPチャネルなども味覚受容体として機能していると考えられている[36]。例としては、Pickpocket28(PPK28)が水受容細胞で低浸透圧を検知する水味受容体として働いていることが報告されている[37]。それ以外では、Na+の受容にはIR76bなど[38]、アミノ酸に対する感受性にはIR76bとIR20a[39]、性フェロモンの受容にはPPK23やPPK29[40]が関与していることが報告されているが、それらが味覚受容体として機能しているという直接的な証拠はまだない。
関連項目
参考文献
- ↑
Hoon, M.A., Adler, E., Lindemeier, J., Battey, J.F., Ryba, N.J., & Zuker, C.S. (1999).
Putative mammalian taste receptors: a class of taste-specific GPCRs with distinct topographic selectivity. Cell, 96(4), 541-51. [PubMed:10052456] [WorldCat] [DOI] - ↑ 二ノ宮裕三、重村憲徳、實松敬介
化学受容の科学(東原和成編)5章「味覚受容体」
化学同人(京都):2012 - ↑ 3.0 3.1 3.2
Yarmolinsky, D.A., Zuker, C.S., & Ryba, N.J. (2009).
Common sense about taste: from mammals to insects. Cell, 139(2), 234-44. [PubMed:19837029] [PMC] [WorldCat] [DOI] - ↑
Dyer, J., Salmon, K.S., Zibrik, L., & Shirazi-Beechey, S.P. (2005).
Expression of sweet taste receptors of the T1R family in the intestinal tract and enteroendocrine cells. Biochemical Society transactions, 33(Pt 1), 302-5. [PubMed:15667333] [WorldCat] [DOI] - ↑
Ren, X., Zhou, L., Terwilliger, R., Newton, S.S., & de Araujo, I.E. (2009).
Sweet taste signaling functions as a hypothalamic glucose sensor. Frontiers in integrative neuroscience, 3, 12. [PubMed:19587847] [PMC] [WorldCat] [DOI] - ↑
Zhang, Y., Hoon, M.A., Chandrashekar, J., Mueller, K.L., Cook, B., Wu, D., ..., & Ryba, N.J. (2003).
Coding of sweet, bitter, and umami tastes: different receptor cells sharing similar signaling pathways. Cell, 112(3), 293-301. [PubMed:12581520] [WorldCat] [DOI] - ↑
Xu, H., Staszewski, L., Tang, H., Adler, E., Zoller, M., & Li, X. (2004).
Different functional roles of T1R subunits in the heteromeric taste receptors. Proceedings of the National Academy of Sciences of the United States of America, 101(39), 14258-63. [PubMed:15353592] [PMC] [WorldCat] [DOI] - ↑
Winnig, M., Bufe, B., Kratochwil, N.A., Slack, J.P., & Meyerhof, W. (2007).
The binding site for neohesperidin dihydrochalcone at the human sweet taste receptor. BMC structural biology, 7, 66. [PubMed:17935609] [PMC] [WorldCat] [DOI] - ↑
Adler, E., Hoon, M.A., Mueller, K.L., Chandrashekar, J., Ryba, N.J., & Zuker, C.S. (2000).
A novel family of mammalian taste receptors. Cell, 100(6), 693-702. [PubMed:10761934] [WorldCat] [DOI] - ↑ 10.0 10.1
Nelson, G., Chandrashekar, J., Hoon, M.A., Feng, L., Zhao, G., Ryba, N.J., & Zuker, C.S. (2002).
An amino-acid taste receptor. Nature, 416(6877), 199-202. [PubMed:11894099] [WorldCat] [DOI] - ↑
Zhao, G.Q., Zhang, Y., Hoon, M.A., Chandrashekar, J., Erlenbach, I., Ryba, N.J., & Zuker, C.S. (2003).
The receptors for mammalian sweet and umami taste. Cell, 115(3), 255-66. [PubMed:14636554] [WorldCat] [DOI] - ↑
Nelson, G., Hoon, M.A., Chandrashekar, J., Zhang, Y., Ryba, N.J., & Zuker, C.S. (2001).
Mammalian sweet taste receptors. Cell, 106(3), 381-90. [PubMed:11509186] [WorldCat] [DOI] - ↑
Nelson, G., Chandrashekar, J., Hoon, M.A., Feng, L., Zhao, G., Ryba, N.J., & Zuker, C.S. (2002).
An amino-acid taste receptor. Nature, 416(6877), 199-202. [PubMed:11894099] [WorldCat] [DOI] - ↑
Chaudhari, N., Landin, A.M., & Roper, S.D. (2000).
A metabotropic glutamate receptor variant functions as a taste receptor. Nature neuroscience, 3(2), 113-9. [PubMed:10649565] [WorldCat] [DOI] - ↑
Adler, E., Hoon, M.A., Mueller, K.L., Chandrashekar, J., Ryba, N.J., & Zuker, C.S. (2000).
A novel family of mammalian taste receptors. Cell, 100(6), 693-702. [PubMed:10761934] [WorldCat] [DOI] - ↑
Kuhn, C., Bufe, B., Batram, C., & Meyerhof, W. (2010).
Oligomerization of TAS2R bitter taste receptors. Chemical senses, 35(5), 395-406. [PubMed:20212011] [WorldCat] [DOI] - ↑
Huang, A.L., Chen, X., Hoon, M.A., Chandrashekar, J., Guo, W., Tränkner, D., ..., & Zuker, C.S. (2006).
The cells and logic for mammalian sour taste detection. Nature, 442(7105), 934-8. [PubMed:16929298] [PMC] [WorldCat] [DOI] - ↑
Nelson, T.M., Lopezjimenez, N.D., Tessarollo, L., Inoue, M., Bachmanov, A.A., & Sullivan, S.L. (2010).
Taste function in mice with a targeted mutation of the pkd1l3 gene. Chemical senses, 35(7), 565-77. [PubMed:20605874] [PMC] [WorldCat] [DOI] - ↑
Inada, H., Kawabata, F., Ishimaru, Y., Fushiki, T., Matsunami, H., & Tominaga, M. (2008).
Off-response property of an acid-activated cation channel complex PKD1L3-PKD2L1. EMBO reports, 9(7), 690-7. [PubMed:18535624] [PMC] [WorldCat] [DOI] - ↑
Ugawa, S., Yamamoto, T., Ueda, T., Ishida, Y., Inagaki, A., Nishigaki, M., & Shimada, S. (2003).
Amiloride-insensitive currents of the acid-sensing ion channel-2a (ASIC2a)/ASIC2b heteromeric sour-taste receptor channel. The Journal of neuroscience : the official journal of the Society for Neuroscience, 23(9), 3616-22. [PubMed:12736332] [PMC] [WorldCat] - ↑
Stevens, D.R., Seifert, R., Bufe, B., Müller, F., Kremmer, E., Gauss, R., ..., & Lindemann, B. (2001).
Hyperpolarization-activated channels HCN1 and HCN4 mediate responses to sour stimuli. Nature, 413(6856), 631-5. [PubMed:11675786] [WorldCat] [DOI] - ↑
Tu, Y.H., Cooper, A.J., Teng, B., Chang, R.B., Artiga, D.J., Turner, H.N., ..., & Liman, E.R. (2018).
An evolutionarily conserved gene family encodes proton-selective ion channels. Science (New York, N.Y.), 359(6379), 1047-1050. [PubMed:29371428] [PMC] [WorldCat] [DOI] - ↑
Zhang, J., Jin, H., Zhang, W., Ding, C., O'Keeffe, S., Ye, M., & Zuker, C.S. (2019).
Sour Sensing from the Tongue to the Brain. Cell, 179(2), 392-402.e15. [PubMed:31543264] [WorldCat] [DOI] - ↑
Chandrashekar, J., Kuhn, C., Oka, Y., Yarmolinsky, D.A., Hummler, E., Ryba, N.J., & Zuker, C.S. (2010).
The cells and peripheral representation of sodium taste in mice. Nature, 464(7286), 297-301. [PubMed:20107438] [PMC] [WorldCat] [DOI] - ↑
Lyall, V., Heck, G.L., Vinnikova, A.K., Ghosh, S., Phan, T.H., Alam, R.I., ..., & DeSimone, J.A. (2004).
The mammalian amiloride-insensitive non-specific salt taste receptor is a vanilloid receptor-1 variant. The Journal of physiology, 558(Pt 1), 147-59. [PubMed:15146042] [PMC] [WorldCat] [DOI] - ↑
Roebber, J.K., Roper, S.D., & Chaudhari, N. (2019).
The Role of the Anion in Salt (NaCl) Detection by Mouse Taste Buds. The Journal of neuroscience : the official journal of the Society for Neuroscience, 39(32), 6224-6232. [PubMed:31171579] [PMC] [WorldCat] [DOI] - ↑
Stocker, R.F. (1994).
The organization of the chemosensory system in Drosophila melanogaster: a review. Cell and tissue research, 275(1), 3-26. [PubMed:8118845] [WorldCat] [DOI] - ↑
Weiss, L.A., Dahanukar, A., Kwon, J.Y., Banerjee, D., & Carlson, J.R. (2011).
The molecular and cellular basis of bitter taste in Drosophila. Neuron, 69(2), 258-72. [PubMed:21262465] [PMC] [WorldCat] [DOI] - ↑
Ozaki, K., Ryuda, M., Yamada, A., Utoguchi, A., Ishimoto, H., Calas, D., ..., & Yoshikawa, H. (2011).
A gustatory receptor involved in host plant recognition for oviposition of a swallowtail butterfly. Nature communications, 2, 542. [PubMed:22086342] [WorldCat] [DOI] - ↑
Thistle, R., Cameron, P., Ghorayshi, A., Dennison, L., & Scott, K. (2012).
Contact chemoreceptors mediate male-male repulsion and male-female attraction during Drosophila courtship. Cell, 149(5), 1140-51. [PubMed:22632976] [PMC] [WorldCat] [DOI] - ↑
Montell, C. (2009).
A taste of the Drosophila gustatory receptors. Current opinion in neurobiology, 19(4), 345-53. [PubMed:19660932] [PMC] [WorldCat] [DOI] - ↑
Sato, K., Tanaka, K., & Touhara, K. (2011).
Sugar-regulated cation channel formed by an insect gustatory receptor. Proceedings of the National Academy of Sciences of the United States of America, 108(28), 11680-5. [PubMed:21709218] [PMC] [WorldCat] [DOI] - ↑
Fujii, S., Yavuz, A., Slone, J., Jagge, C., Song, X., & Amrein, H. (2015).
Drosophila sugar receptors in sweet taste perception, olfaction, and internal nutrient sensing. Current biology : CB, 25(5), 621-627. [PubMed:25702577] [PMC] [WorldCat] [DOI] - ↑
Sato, K., Tanaka, K., & Touhara, K. (2011).
Sugar-regulated cation channel formed by an insect gustatory receptor. Proceedings of the National Academy of Sciences of the United States of America, 108(28), 11680-5. [PubMed:21709218] [PMC] [WorldCat] [DOI] - ↑
Miyamoto, T., Slone, J., Song, X., & Amrein, H. (2012).
A fructose receptor functions as a nutrient sensor in the Drosophila brain. Cell, 151(5), 1113-25. [PubMed:23178127] [PMC] [WorldCat] [DOI] - ↑
Montell, C. (2021).
Drosophila sensory receptors-a set of molecular Swiss Army Knives. Genetics, 217(1), 1-34. [PubMed:33683373] [PMC] [WorldCat] [DOI] - ↑
Cameron, P., Hiroi, M., Ngai, J., & Scott, K. (2010).
The molecular basis for water taste in Drosophila. Nature, 465(7294), 91-5. [PubMed:20364123] [PMC] [WorldCat] [DOI] - ↑
Jaeger, A.H., Stanley, M., Weiss, Z.F., Musso, P.Y., Chan, R.C., Zhang, H., ..., & Gordon, M.D. (2018).
A complex peripheral code for salt taste in Drosophila. eLife, 7. [PubMed:30307393] [PMC] [WorldCat] [DOI] - ↑
Ganguly, A., Pang, L., Duong, V.K., Lee, A., Schoniger, H., Varady, E., & Dahanukar, A. (2017).
A Molecular and Cellular Context-Dependent Role for Ir76b in Detection of Amino Acid Taste. Cell reports, 18(3), 737-750. [PubMed:28099851] [PMC] [WorldCat] [DOI] - ↑
Thistle, R., Cameron, P., Ghorayshi, A., Dennison, L., & Scott, K. (2012).
Contact chemoreceptors mediate male-male repulsion and male-female attraction during Drosophila courtship. Cell, 149(5), 1140-51. [PubMed:22632976] [PMC] [WorldCat] [DOI]