英語名:entorhinal cortex
同義語:嗅内皮質
位置と細胞構築
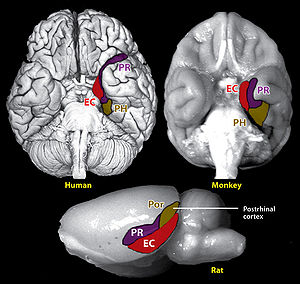
嗅内野は側頭葉にある皮質領域で、主にブロードマンの脳地図の28野にあたる。霊長類では側頭葉前部の内側領域に位置し、嗅脳溝の内側部分を占める(図1)[1]。嗅内野は外側と内背側においてそれぞれ嗅周野(perirhinal cortex)と海馬台(subiculum)と接し、尾側で海馬傍皮質(parahippocampal cortex)と接する。嗅内野は細胞構築学的には不等皮質(allocortex)と呼ばれる、第4層を欠く無顆粒皮質(agranular cortex)である。げっ歯類では嗅内野は側頭葉後部、嗅脳溝の腹側部分を占める(図1)。
結合
嗅内野の浅層から海馬体(hippocampal formation)へ投射される軸策線維を貫通線維(perforant path)と呼ぶ[2]。貫通線維の内、第2層から投射されるものは主に歯状回(dentate gyrus)とCA3領域に、第3層から投射されるものはCA1領域と海馬台にそれぞれ結合する。嗅内野の浅層が海馬体に入力信号を与える一方で、嗅内野の深層(第5層)は海馬体の海馬台とCA1領域からの出力を受け取る。嗅内野と皮質の主な結合については、サルの場合は海馬傍皮質]脳梁膨大後部皮質(retrosplenial cortex)からの入力が尾側に、嗅周野からの入力が吻側に与えられる。げっ歯類では梨状皮質(piriform cortex)からの入力が嗅内野全体で最も強い。梨状皮質は嗅覚に関わる。梨状皮質に次いでは、嗅内野の外側領域では主に嗅周野と島皮質(insular cortex)、そして前頭皮質(frontal cortex)から、内側領域では帯状皮質(cingulate cortex)や後部視覚野からの入力が見られる。これら皮質からの入力は嗅内野の浅層に届き、嗅内野から皮質領域に対する出力は深層より投射される。
機能
嗅内野は内側側頭葉記憶システム[1]の構成要素として、海馬に対する入出力ゲートとしての役割を担う。そのため、嗅内野はエピソード記憶が正常に機能するために必須の領域である。ところが単なる中継地点としてではなく、嗅内野自身が新たに付け加える機能については、まだ良く分かっていない。
こうしたなか、空間情報処理またはナビゲーションに関わる嗅内野の神経メカニズムが、げっ歯類を使用した電気生理学的研究によって明らかにされつつある。Moser達のグループはラットの嗅内野の内側領域ににおいてグリッド細胞と呼ばれるニューロンを発見した[4][3](図2)。グリッド細胞は複数の場所受容野を持ち、さらにそれら場所受容野は等間隔に規則正しく配列して6角形または3角形の格子を形成している。場所受容野間の間隔は背側部から腹側部に向かうに従い広がっていく。グリッド細胞がコードする幾何学的な空間情報は海馬に供給され、場所細胞(place cell)が示す神経活動パターンに寄与する。グリッド細胞はげっ歯類だけでなく、ヒトにおいても存在することが機能的核磁気共鳴画像を使った実験において示唆されている[5]。嗅内野の内側領域にはグリッド細胞の他にも、動物がどの方角を向いているかによって反応強度が異なる頭部方向性細胞(head-direction cell)が見つかっている[6]。
嗅内野の内側領域が空間情報処理と関わる一方、外側領域はオブジェクトといった非空間情報の処理により関わると考えられている。
アルツハイマー病
嗅内野における病変がアルツハイマー病や側頭葉性のてんかん、統合失調症の発病と関連するといった報告がある。アルツハイマー病ではその初期の段階において、嗅内野の特に第2層で神経原線維変化と呼ばれる病変が見られることが知られている[7]。嗅内野における神経原繊維変化は通常の加齢においても見られるが、アルツハイマー上では、さらに海馬やその他の皮質へと病変が拡大していく。
関連項目
参考文献
- ↑ 1.0 1.1 1.2
Squire, L.R., & Wixted, J.T. (2011).
The cognitive neuroscience of human memory since H.M. Annual review of neuroscience, 34, 259-88. [PubMed:21456960] [PMC] [WorldCat] [DOI] - ↑
Witter, M.P. (2007).
The perforant path: projections from the entorhinal cortex to the dentate gyrus. Progress in brain research, 163, 43-61. [PubMed:17765711] [WorldCat] [DOI] - ↑ 3.0 3.1
Moser, E.I., & Moser, M.B. (2008).
A metric for space. Hippocampus, 18(12), 1142-56. [PubMed:19021254] [WorldCat] [DOI] - ↑
Hafting, T., Fyhn, M., Molden, S., Moser, M.B., & Moser, E.I. (2005).
Microstructure of a spatial map in the entorhinal cortex. Nature, 436(7052), 801-6. [PubMed:15965463] [WorldCat] [DOI] - ↑
Doeller, C.F., Barry, C., & Burgess, N. (2010).
Evidence for grid cells in a human memory network. Nature, 463(7281), 657-61. [PubMed:20090680] [PMC] [WorldCat] [DOI] - ↑
Hargreaves, E.L., Rao, G., Lee, I., & Knierim, J.J. (2005).
Major dissociation between medial and lateral entorhinal input to dorsal hippocampus. Science (New York, N.Y.), 308(5729), 1792-4. [PubMed:15961670] [WorldCat] [DOI] - ↑
Gómez-Isla, T., Price, J.L., McKeel, D.W., Morris, J.C., Growdon, J.H., & Hyman, B.T. (1996).
Profound loss of layer II entorhinal cortex neurons occurs in very mild Alzheimer's disease. The Journal of neuroscience : the official journal of the Society for Neuroscience, 16(14), 4491-500. [PubMed:8699259] [WorldCat]
(執筆者:納家勇治 担当編集委員:岡本仁)