「嗅球」の版間の差分
細編集の要約なし |
細編集の要約なし |
||
| 2行目: | 2行目: | ||
<font size="+1">[http://researchmap.jp/takeshi.imai 今井 猛]</font><br> | <font size="+1">[http://researchmap.jp/takeshi.imai 今井 猛]</font><br> | ||
''独立行政法人理化学研究所 発生・再生科学総合研究センター 感覚神経回路形成研究チーム''<br> | ''独立行政法人理化学研究所 発生・再生科学総合研究センター 感覚神経回路形成研究チーム''<br> | ||
DOI:<selfdoi /> 原稿受付日:2012年4月25日 原稿完成日:2015年2月4日<br> | |||
担当編集委員:[http:// | 担当編集委員:[http://researchmap.jp/noritakaichinohe 一戸 紀孝](国立精神・神経医療研究センター 神経研究所)<br> | ||
</div> | </div> | ||
2015年2月4日 (水) 11:45時点における版
今井 猛
独立行政法人理化学研究所 発生・再生科学総合研究センター 感覚神経回路形成研究チーム
DOI:10.14931/bsd.1010 原稿受付日:2012年4月25日 原稿完成日:2015年2月4日
担当編集委員:一戸 紀孝(国立精神・神経医療研究センター 神経研究所)
英:olfactory bulb 独:Riechkolben 仏:bulbe olfactif
嗅球(きゅうきゅう)は脊椎動物の終脳吻側に位置する脳の領域で嗅覚情報処理に関わる。嗅上皮で匂い受容を行う嗅神経細胞からの入力を受け、嗅皮質に出力する。
解剖学的構造
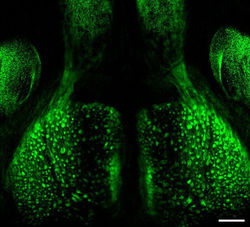
嗅球はヒトにおいては前頭葉の下に位置する長円形の小さな構造である。マウスなどのげっ歯類においては、それに比べると脳の中で比較的大きな割合を占めており、終脳吻側に突き出た構造となっている(図1)。鼻腔中の嗅上皮で匂い受容を行う嗅神経細胞からの入力を受け、嗅皮質に出力する。他の感覚情報(視覚・聴覚・体性感覚・味覚)はいずれも視床を介して大脳皮質一次感覚野に入力するのに対し、嗅覚情報は嗅球から直接一次嗅皮質に入力する。左右の嗅球の間に交連繊維はなく、独立している。
げっ歯類においては、嗅球は嗅上皮(主嗅上皮)からの入力を受ける主嗅球(main olfactory bulb)、鋤鼻器からの入力を受ける副嗅球(accessory olfactory bulb)、およびその他の特殊な嗅神経細胞からの入力を受けるネックレス糸球体(necklace glomeruli)などからなる。嗅球の大部分を主嗅球が占めており、副嗅球は嗅球尾背側に位置している。ネックレス糸球体は嗅球の最も尾側をリング状に取り囲んでいる。ヒトにおいては鋤鼻器や副嗅球は存在しないか、あっても痕跡程度であるとされており、主嗅球のみが機能的であると考えられている。ここでは主にマウスでの知見に基づいて述べる。
主嗅球
入力回路:嗅神経細胞の軸索投射
匂い分子は嗅上皮の嗅神経細胞によって検出される。嗅神経細胞(olfactory sensory neuron; OSN)は単一の樹状突起を嗅上皮の表面に向かって伸ばしており、その先端から20-30本の嗅繊毛を嗅粘膜中に伸ばしている。嗅繊毛にはGタンパク質共役型受容体である嗅覚受容体(odorant receptor; OR)が発現しており、嗅粘液中に溶け込んだ匂い分子を検出する。嗅覚受容体遺伝子はマウスで約1,000種類、ヒトで約350種類存在するが、個々の嗅神経細胞はこれらの中から1種類のみを発現している。嗅神経細胞は単一の軸索を有し、軸索束を形成しながら篩骨(ethmoid bone)の篩板(cribriform plate)を経て嗅球の糸球体(glomerulus)に接続する。他の感覚系や昆虫の嗅覚系と比較した場合、左右の交叉がなく同側(ipsilateral)の脳にのみ投射するという点は特徴的である。また、嗅神経細胞の軸索はミエリン(髄鞘)をもたないという特徴がある。
マウスの嗅球には約1,800個の糸球体が存在する(図2)。同じ嗅覚受容体を発現する数1000個もの嗅神経細胞は、嗅上皮上で散在しているにも関わらず、それらの軸索は1ないし2個の糸球体(glomerulus)と呼ばれる構造に収斂する[1](図3)。逆に、単一の糸球体は特定の嗅覚受容体を発現する嗅神経細胞の軸索のみを受け入れている。従って、匂い刺激によってどの嗅覚受容体が反応したかという情報は、嗅球のどの糸球体が発火したかという情報へと変換される。特定の嗅覚受容体を発現する嗅神経細胞の軸索投射位置は、局所的には個体差があるものの、大域的には個体間で保存されている。多くの嗅覚受容体では、左右の嗅球それぞれについて内側と外側に一対の投射先が認められる。嗅球内側と外側の糸球体配置はおおむね鏡像対称となっている。
嗅球には、入力する嗅神経細胞の種類に応じたドメイン構造が存在する[2]。嗅上皮の背内側領域(Dゾーン)に位置する嗅神経細胞の軸索は嗅球背側領域(Dドメイン)に投射する。Dゾーンの中でも、クラスI嗅覚受容体を発現する嗅神経細胞の軸索は、より背側のDIドメインに、クラスII嗅覚受容体を発現する嗅神経細胞軸索はより腹側のDIIドメインに投射する。嗅上皮の腹外側領域(Vゾーン)の嗅神経細胞の軸索(クラスII嗅覚受容体を発現)は嗅球腹側領域(Vドメイン)に投射する。更に、Vゾーン内でも嗅覚受容体の種類によって発現領域に偏りがあり、嗅上皮の背内-腹外軸方向の発現分布が嗅球背腹軸方向の投射位置におおよそ対応する。
嗅球内の局所回路
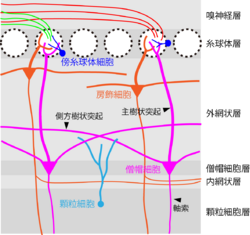
嗅球には層構造があり、表層から順に、嗅神経層(olfactory nerve layer)、糸球体層(glomerular layer)、外網状層(external plexiform layer)、僧帽細胞層(mitral cell layer)、内網状層(internal plexiform layer)、顆粒細胞層(granule cell layer)からなる。嗅球の神経細胞には、興奮性ニューロンとして僧帽細胞(mitral cell)と房飾細胞(tufted cell)があり、抑制性ニューロン(介在ニューロン)として傍糸球体細胞(periglomerular cell)と顆粒細胞(granule cell)がある。実際には傍糸球体細胞と顆粒細胞は多様な抑制性ニューロンの総称である。この他に短軸細胞(short axon cell)と総称されるものもあるが、まだ不明な点が多く、定義が確立していない。嗅球の神経細胞の中で、嗅球から嗅皮質へと出力するのは僧帽細胞と房飾細胞のみである[2][3](図4)。
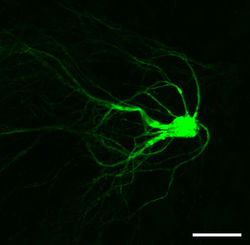
嗅神経細胞の軸索は嗅神経層を経て糸球体層に存在する直径50-100μm(マウスの場合)の糸球体に接続する。糸球体の中では嗅神経細胞軸索が僧帽細胞・房飾細胞や傍糸球体細胞の樹状突起にグルタミン酸性の興奮性シナプスを作る。球状の糸球体の周りに存在する傍糸球体細胞もまた、僧帽・房飾細胞や嗅神経細胞軸索にGABA性の抑制性シナプスを作っている。僧帽細胞の細胞体は僧帽細胞層に存在するが、房飾細胞の細胞体は主に外網状層の表層に分布する。僧帽細胞と房飾細胞は匂い刺激に対する応答特性も異なることから、異なる機能を有していると考えられている。僧帽・房飾細胞は単一の主樹状突起をもち、糸球体内でのみ房状分岐をもつ。この結果、個々の僧帽・房飾細胞は単一の糸球体からのみ直接的な興奮性入力を受け入れている。
1つの糸球体には20-50個の僧帽・房飾細胞の主樹状突起が接続する。同じ糸球体に接続している僧帽・房飾細胞は姉妹僧帽・房飾細胞と呼ばれる。姉妹僧帽細胞同士は糸球体内で樹状突起間ギャップ結合を形成している。僧帽・房飾細胞はまた、複数の側方樹状突起(lateral dendrite)を外網状層に広く伸ばしており、顆粒細胞樹状突起との間でシナプスを作っている。僧帽・房飾細胞と傍糸球体細胞の間のシナプス、僧帽・房飾細胞と顆粒細胞の間のシナプスはしばしば双方向性シナプスであるという点が特徴的である。顆粒細胞は無軸索細胞であり、樹状突起で入力とGABA性の出力の両方を行う。僧帽・房飾細胞や傍糸球体細胞もまた、樹状突起で入力と出力の両方を行う。房飾細胞の一部の軸索分枝は内網状層を経て内側・外側の同種糸球体カラム同士を正確に接続していることが知られているが、機能は不明である。また嗅球は嗅皮質の多くの領域からグルタミン酸性の遠心性入力を受けるほか、ノルアドレナリン、アセチルコリン、セロトニンなどの遠心性神経修飾も受ける[4]。
出力回路:嗅球から嗅皮質への投射
嗅球から嗅皮質へと出力するのは興奮性ニューロンである僧帽細胞と房飾細胞のみである。僧帽・房飾細胞の軸索は軸索束を形成し、嗅球の後方外側で外側嗅索(lateral olfactory tract)となって嗅皮質へと伸びる。嗅皮質は前嗅核(anterior olfactory nucleus、もしくはanterior olfactory cortex)、嗅結節(olfactory tubercle)、梨状皮質(piriform cortex)、扁桃体皮質核(cortical amygdala)、嗅内皮質(entorhinal cortex)などからなる[2]。個々の僧帽・房飾細胞は外側嗅索から多くの軸索分岐を伸ばして複数の皮質領域へと投射する。僧帽細胞は梨状皮質に多く出力するが、房飾細胞は嗅結節に多く出力する、という違いが見られる[2]。梨状皮質への投射においては嗅球での位置関係は保たれていない。梨状皮質の個々の錐体細胞には複数の糸球体からの情報が入力されていることが知られている。
発生と再生
嗅神経細胞の嗅球への軸索投射は胎生後期から開始し、生後数日までには糸球体および嗅覚地図が完成する。嗅神経細胞の軸索投射位置は、発現する嗅覚受容体の種類によって規定される。この過程では、嗅覚受容体がサイクリックAMPシグナルを介して軸索ガイダンス分子や細胞接着分子の遺伝子発現を制御する、というユニークな機構が知られている[2]。嗅神経細胞は生涯に亘って常時再生し続けており、30-120日で新しい嗅神経細胞に置き換わる。通常の再生時には嗅神経細胞は嗅球の正しい位置に接続するが、重篤なウイルス感染等によって一度に多くの嗅神経細胞が死んでしまったり、嗅神経細胞軸索が物理的に切断されたりした場合には、たとえ嗅神経細胞が再生しても正しい嗅覚地図が再現されないことが知られており、これが異臭症の一因と考えられている[5]。
僧帽・房飾細胞は出生直後には複数の樹状突起を複数の糸球体に伸ばしているが、生後数日目までにシナプスの刈り込みを行い、最終的に単一の主樹状突起を単一の糸球体に接続し、同時に複数の側方樹状突起を形成する。僧帽細胞・房飾細胞は生後再生しない。一方、顆粒細胞と傍糸球体細胞は生後においても除去と新生が起こることが知られている[6]。これらは側脳室側壁に面した脳室下帯で産生され、吻側細胞移動経路(rostral migratory stream)を細胞移動して嗅球に到達する。中枢神経系において生後でも持続して神経新生が起こるのは脳室下帯と海馬の歯状回だけである。
嗅球の機能
嗅球の匂い地図
視覚、体性感覚においては、末梢で受容される情報の位置関係が脳においても保たれたまま表現されており、これはそれぞれ視覚地図、体性感覚地図と呼ばれる。これに対し、嗅球の匂い地図(嗅覚地図)は嗅上皮の位置情報を表現している訳ではない。嗅球においてはそれぞれの糸球体が1種類の嗅覚受容体の情報を表現している。また、嗅球においては、同じ種類の嗅覚受容体を発現する数1000個の嗅神経細胞の軸索が少数の糸球体に収斂することから、情報の集約が起こっているといえる。これによって、個々の嗅神経細胞のレベルよりも糸球体のレベルの方が、シグナルが増幅されて感度が上がるとともに、匂い情報の信号対雑音比(signal-to-noise ratio)も向上すると考えられる。また、糸球体に情報が集約されていることで、ゲインコントロールなどの情報処理をまとめてやりやすくなっていると言える。
匂いの種類によって活性化する糸球体の種類や数が異なる。大域的には嗅球の領域によって匂い分子に対する特異性やチューニングが異なっており、匂いクラスターと呼ばれるが[7]、局所レベルでは必ずしも近傍の糸球体が似た匂い分子に応答するというわけではなく、他の感覚系の地図のように、受容野の類似性にもとづく厳密なマップ(ケモトピー; chemotopy)が存在するわけではない[8]。こうしたことから、匂い地図の配置の意味は不明である。また、古くは嗅覚にも味覚の五味のような基本臭があるのではないかという説もあったが、嗅球の匂い地図からその根拠を見出すことは今のところ困難である。しかしながら、遺伝学的手法を用いてDドメインのみを欠失させたマウスでは先天的嗅覚恐怖行動が無くなることが知られており、機能的には何らかのドメイン構造があるものと考えられている[2]。
嗅球局所回路における情報処理
傍糸球体細胞は糸球体内で嗅神経細胞軸索にGABA性前シナプス抑制を行うとともに、僧帽・房飾細胞に対しても双方向性シナプスを介してGABA性の抑制を行う。糸球体内には数1000本の嗅神経細胞軸索が入力しており、しかもシナプス放出確率も高いため、傍糸球体細胞による抑制回路は入力のダイナミックレンジを広くするために有効であると考えられる。糸球体間でどのような興奮性・抑制性相互作用があるかについては、さまざまな議論があるがよく分かっていない。意外なことに、僧帽細胞への興奮性入力は、嗅神経細胞からの直接入力の寄与は小さく、むしろ房飾細胞を介した入力を多く受け取っている。同じ糸球体に接続している姉妹僧帽細胞どうしは糸球体内におけるグルタミン酸の放出やギャップ結合によって同期性の高い入力を受けている。
僧帽・房飾細胞の側方樹状突起は、顆粒細胞を介して自己の抑制および他の僧帽・房飾細胞の側方抑制を行う。側方抑制は匂いシグナルのコントラストをつける働きがあるほか、嗅球における同期活動や非同期化にも重要であると考えられている。しかしながら、顆粒細胞や傍糸球体細胞を介した抑制性回路の接続特異性については不明な点が多く、側方抑制の結果、僧帽・房飾細胞がどのような受容野を有するのかについてもよく分かっていない[8]。
従来、匂いの情報は活動する僧帽・房飾細胞の組み合わせによってコードされていると考えられてきたが、最近では時間的な活動パターンも重要であるという考えが受け入れられつつある(temporal coding)[3]。すなわち、側方抑制は僧帽・房飾細胞の活動の時間的なパターン、たとえば呼吸サイクルにおける発火の位相を変化させ、これが匂い情報をコードしている可能性がある。嗅皮質の個々の錐体細胞は多くの僧帽・房飾細胞からの入力を受けていることから、僧帽・房飾細胞における発火の位相が異なれば錐体細胞の活動パターンも変わり得る。
副嗅球
副嗅球は嗅球の後背側に位置し、鋤鼻器からの入力を受ける。鋤鼻器は揮発性のみならず、ペプチド性の化学物質も受容するという点が嗅上皮と異なる。こうしたリガンドはしばしばフェロモンとして作用することから、鋤鼻受容体はフェロモン受容体とも呼ばれる。しかしながら、鋤鼻器は天敵の匂いや通常の匂い分子も受容しているし、主嗅覚系でもフェロモン分子を受容していることから、嗅上皮=匂い受容、鋤鼻器=フェロモン受容という図式は正確ではない。
鋤鼻器の鋤鼻神経細胞は、V1Rと呼ばれる受容体ファミリー発現する表層の神経細胞と、V2RおよびMHC H2-Mvファミリーを発現する深層の神経細胞とに分けられる。V1R鋤鼻神経細胞は副嗅球の吻側領域へ、V2R鋤鼻神経細胞は副嗅球の尾側領域へと投射する[9]。主嗅球の場合とは異なり、同一の鋤鼻受容体を発現する鋤鼻神経細胞の軸索は10以上もの糸球体に収斂する。主嗅球の匂い地図のような内側・外側の鏡像対称性は存在しない。副嗅球では、個々の僧帽・房飾細胞は複数の樹状突起を複数の糸球体に伸ばしている。これらは必ずしも同種鋤鼻受容体の糸球体にのみ接続する訳ではなく、類似した異なる鋤鼻受容体の糸球体に接続する場合もある。従って、副嗅球においては、個々の僧帽・房飾細胞は類似した複数の鋤鼻受容体由来の興奮性入力を受け取っており、部分的に情報の統合が起こっていると言える[9]。
副嗅球の僧帽・房飾細胞は、扁桃体内側核(medial amygdala)や扁桃体後内側皮質核(posteromedial cortical amygdala)、分界条床核(bed nucleus of the stria terminalis)など、主嗅球の僧帽・房飾細胞とは異なる領域に軸索を投射している。
嗅覚系には主嗅覚系と副嗅覚系の他にもいくつかのサブシステムが存在する。主嗅上皮においてグアニル酸シクラーゼDを発現する嗅神経細胞は、副嗅球周辺を取り囲む複数の糸球体構造、ネックレス糸球体に投射する。この特殊な嗅神経細胞は二酸化炭素を検出するという報告や、グアニリン・ウログアニリンに応答するという報告がある。他に、鼻腔先端部に存在するグリューンベルク核(Grüneberg ganglion)に存在する嗅神経細胞もネックレス糸球体の一部に投射する。グリューンベルク核は警報フェロモンを検出するという報告や低温度環境に応答するといった報告があるが、まだ不明な点が多い。
関連項目
参考文献
- ↑
Mombaerts, P., Wang, F., Dulac, C., Chao, S.K., Nemes, A., Mendelsohn, M., ..., & Axel, R. (1996).
Visualizing an olfactory sensory map. Cell, 87(4), 675-86. [PubMed:8929536] [WorldCat] [DOI] - ↑ 2.0 2.1 2.2 2.3 2.4 2.5
Mori, K., & Sakano, H. (2011).
How is the olfactory map formed and interpreted in the mammalian brain? Annual review of neuroscience, 34, 467-99. [PubMed:21469960] [WorldCat] [DOI] - ↑ 3.0 3.1
Wilson, R.I., & Mainen, Z.F. (2006).
Early events in olfactory processing. Annual review of neuroscience, 29, 163-201. [PubMed:16776583] [WorldCat] [DOI] - ↑
Fletcher, M.L., & Chen, W.R. (2010).
Neural correlates of olfactory learning: Critical role of centrifugal neuromodulation. Learning & memory (Cold Spring Harbor, N.Y.), 17(11), 561-70. [PubMed:20980444] [PMC] [WorldCat] [DOI] - ↑
Costanzo, R.M. (2000).
Rewiring the olfactory bulb: changes in odor maps following recovery from nerve transection. Chemical senses, 25(2), 199-205. [PubMed:10781027] [WorldCat] [DOI] - ↑
Lazarini, F., & Lledo, P.M. (2011).
Is adult neurogenesis essential for olfaction? Trends in neurosciences, 34(1), 20-30. [PubMed:20980064] [WorldCat] [DOI] - ↑
Mori, K., Takahashi, Y.K., Igarashi, K.M., & Yamaguchi, M. (2006).
Maps of odorant molecular features in the Mammalian olfactory bulb. Physiological reviews, 86(2), 409-33. [PubMed:16601265] [WorldCat] [DOI] - ↑ 8.0 8.1
Murthy, V.N. (2011).
Olfactory maps in the brain. Annual review of neuroscience, 34, 233-58. [PubMed:21692659] [WorldCat] [DOI] - ↑ 9.0 9.1
Dulac, C., & Wagner, S. (2006).
Genetic analysis of brain circuits underlying pheromone signaling. Annual review of genetics, 40, 449-67. [PubMed:16953793] [WorldCat] [DOI]