吉良 潤一
九州大学 大学院医学研究院 神経内科学
DOI XXXX/XXXX 原稿受付日:2013年4月15日 原稿完成日:2014年2月21日
担当編集委員:漆谷 真(京都大学 大学院医学研究科)
英語名:multiple sclerosis 英略名:MS 独:Multiple Sklerose 仏:sclérose en plaques
多発性硬化症は、時間的・空間的に多発する中枢神経系特異的な非化膿性炎症性脱髄性疾患である。中枢神経系の様々な部位が傷害されるので、MSの臨床症状は多彩である。中枢神経髄鞘抗原を標的にした自己免疫性疾患であると考えられている。遺伝因子と環境的因子の両者が発症のリスクになると考えられている。90%は再発寛解の経過を呈する再発寛解型で、残り10%程度は病初期から再発なしに慢性に症状が悪化していく一次性進行型を呈する。再発寛解型の半数は、10年ほどの経過で、再発なしに次第に障害が増悪する二次性進行型MSへ移行する。欧米白人に多いが日本人にも増加しつつある。急性期には副腎皮質ステロイド薬、再発・障害進行防止には、インターフェロンβ(interferon β, IFNβ)、フィンゴリモドを用いる。
多発性硬化症とは
多発性硬化症は、中枢神経系を侵す非化膿性炎症性脱髄性疾患である。中枢神経髄鞘抗原を標的にした自己免疫性疾患であると考えられているが、証明はできていない。末梢神経は傷害されない。病因は現在のところ確立されていないが、遺伝因子と環境的因子の両者が発症のリスクになると考えられている。中枢神経白質の傷害に基く症候が、再発と寛解を繰り返し(時間的多発性という)、中枢神経の様々な部位が多巣性に侵される(空間的多発性という)。即ち、臨床的にはMSは中枢神経白質傷害に基づく症候が時間的・空間的に多発し、他の疾患が除外されるときに診断される。MSの90%は再発寛解の経過を呈する再発寛解型(relapsing remitting MS, RRMS)で、残り10%程度は病初期から再発なしに慢性に症状が悪化していく一次性進行型(primary progressive MS)を呈する。再発寛解型MSの半数は、10年ほどの経過で、再発なしに次第に障害が増悪する二次性進行型MS(secondary progressive MS)へ移行する[1]。
臨床症候
発症は急性であることが多いが,亜急性に,あるいは緩徐に発症することもある.中枢神経の様々な部位が傷害されるので、MSの臨床症状は多彩である。視力・視野障害、運動麻痺、運動失調、痙性歩行、感覚障害・異常感覚、排尿・排便障害、複視などが主なものである。
神経学的診察所見としては、視神経萎縮、視神経乳頭耳側蒼白(乳頭黄斑線維が視神経炎で障害されやすいため)、視野欠損等の視神経障害、片麻痺、対麻痺、四肢麻痺等の運動障害、痙縮、四肢腱反射亢進、病的反射の出現、痙縮、小脳性運動失調、感覚鈍麻、感覚性失調、膀胱直腸障害、内側縦束 (medial longitudinal fasciculus, MLF)症候群等に代表される眼球運動障害、眼振等がみられる。脳幹病変により三叉神経痛、顔面筋麻痺、構音・嚥下障害、めまい、難聴などを来すこともある。さらに、大脳病巣により記憶障害、注意障害、遂行機能障害などの認知機能障害を呈することがある。精神症状としては、抑うつ、不安、多幸症などを認めることもある。 けいれん、高度の認知症、パーキンソニズムを呈することは稀である。
検査所見
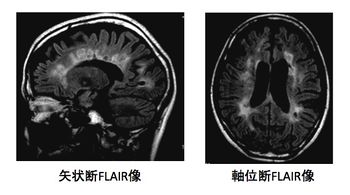
MS病巣は核磁気共鳴画像 (magnetic resonance imaging, MRI)で最も鋭敏に検出される。頭部MRI画像では、側脳室周囲から大脳白質に垂直方向に伸びる卵円形の病巣(ovoid lesion)が比較的本症に特徴的とされる。大脳深部白質、皮質直下の白質、脳梁、脳幹、脊髄に病巣がみられることが多い。T2強調画像やFLAIR画像で高信号、T1強調画像で低信号に描出される。新しい病巣は、血液脳関門の破綻を反映して、ガドリニウムなどの造影剤で造影される。脊髄病巣は2椎体を超えず白質主体に存在することが多い。
誘発電位検査は、当該伝導路に存在する潜在性病巣の検出に有用である。視覚誘発電位(visual evoked potential)、体性感覚誘発電位(somatosensory evoked potential)、聴性脳幹誘発反応 (auditory brainstem evoked potential)などがある。錐体路病巣の検出には、磁気刺激装置を用いた運動誘発電位(motor evoked potential)が用いられる。
血液検査ではMSに特異的な所見は乏しく、主に膠原病などによる中枢神経病巣を鑑別診断するために各種自己抗体を検索する。MSは抗核抗体が弱陽性になる例があるが、それ以外の特異的な自己抗体は検出されない。視神経と脊髄が選択的に侵される視神経脊髄炎では、アストロサイトの足突起に存在する水チャネルであるaquaporin-4に対する自己抗体が約半数で検出される。髄液細胞数と総タンパク質量は、再発期には軽度の細胞増多(単核球)と総タンパク質量増加がみられることがある。髄鞘の破壊を反映した髄鞘塩基性タンパク質 (myelin basic protein, MBP)の上昇、IgG indexの上昇,髄液中のオリゴクローナルIgGバンド陽性などがみられることもある。オリゴクローナルIgGバンドは、欧米白人のMSの90%、日本人MSの約60%で陽性となり、比較的本症に特徴的といえる[2][3][4][5]。
治療
MSの治療は、急性期の短縮、再発・障害進行防止、対症療法が行われる。
急性期
急性期の治療として最も一般的なものが副腎皮質ステロイド薬である。短期的な機能改善を促進する作用があるが、長期的な予後には影響がなく再発防止効果もないとされる。ステロイドパルス療法として、メチルプレドニゾロン1000mg/日を3-5日間点滴静注することが多い。後療法として経口プレドニゾロンを漸減投与することが一般的である。ステロイド不応例や投与困難例については,血漿交換療法が行われることもある。
再発・障害進行防止
再発・障害進行防止には、病態修飾薬(disease-modifying drug)が用いられる。これには、インターフェロンβ (interferon β, IFNβ)が使用されることが多い。本薬は再発を30%程度減らす効果があり、20年以上使用しても重篤な副作用の出現は稀である。通常、再発寛解型MSまたは二次性進行型MSで再発が重畳している場合やMRIで造影病巣が認められる場合に、IFNβ-1bを800万単位隔日皮下注、 またはIFNβ-1aを30μg週1回筋注する。病初期から慢性進行性の経過をとる一次性進行型MSでは、障害の進行を防止する効果は証明されていない。2011年より我が国でも経口の再発・障害進行防止治療薬としてフィンゴリモドが使用可能となっている。経口内服薬であるため治療コンプライアンスの面ではIFNβより有用であるが、長期使用に関するエビデンスは必ずしも十分に蓄積されてはいない。
IFNβ、フィンゴリモド無効ないし使用不可能な症例には、アザチオプリン、 シクロフォスファミド、ミトキサントロン、メトトレキセート等の免疫抑制剤が使用されることもある。リンパ球が脳内に浸潤する際に用いる接着分子であるα4β1インテグリンに対するモノクローナル抗体製剤であるナタリズマブが、MSの再発を顕著に減少する効果がある。欧米では活動性の高いMSに使用されているが、2年以上使用すると脳内のT細胞の免疫監視が十分でなくなるため、JCウイルスによる進行性多巣性白質脳症が副作用として出現することがあり、長期使用にはJCウイルス抗体陰性例に限るなどの注意が必要である[6]。
経過と予後
MSは上述のように再発寛解を繰り返しながら障害が蓄積し少しずつ進行していく疾患である.生命予後の点からみると、MS患者は同年代の健常者と比べて約5年程度平均余命が短いといわれている。しかし近年,早期に病態修飾薬を使用開始することで、二次性進行期に移行するのが有意に遅延するなどのエビデンスが蓄積されつつあり、早期診断・早期治療開始が重要視されるようになった。それにより本症の予後の改善が期待されている。
疫学
MSは欧米白人に多く、かつ同じ人種では緯度が高いほど有病率が高い。北欧では、人口10万人あたり100人を超える有病率となっている。日本人においてもMSはこの30年間で患者数が約4倍増加した(推定患者数9,900人、有病率7.7/100,000人)。増加の理由は不明であるが、遺伝的背景は変わらないので、乳幼児期の衛生環境の改善や欧米型の食生活が免疫系を介して発症を高めていると推定されている。平均発症年齢は約30歳と若年成人に好発する。男女比は1:3前後である。我が国では発症年齢のピークが30歳代から20歳代に若年化した。女性の比率が約2 倍増え、男女比は1:2.9となった[7]。
関連項目
参考文献
- ↑ Lisak R, Kira J
Multiple sclerosis. International Neurology.
A Clinical Approach. Ed. by Lisak R, Truong D, Carrol W, Bhidayasiri R. Blackwell pp. 366-374, 2009 - ↑
Kira, J. (2011).
Neuromyelitis optica and opticospinal multiple sclerosis: Mechanisms and pathogenesis. Pathophysiology : the official journal of the International Society for Pathophysiology, 18(1), 69-79. [PubMed:20494560] [WorldCat] [DOI] - ↑
Kira, J. (2011).
Autoimmunity in neuromyelitis optica and opticospinal multiple sclerosis: astrocytopathy as a common denominator in demyelinating disorders. Journal of the neurological sciences, 311(1-2), 69-77. [PubMed:21962794] [WorldCat] [DOI] - ↑ 吉良潤一
日本における多発性硬化症の臨床像・疾患観念の変遷.アクチュアル脳・神経疾患の臨床.最新アプローチ 多発性硬化症と視神経脊髄炎.
辻省次(総編集).吉良潤一(専門編集).中山書店 pp. 2-8, 2012. - ↑ 吉良潤一
自然経過からみた病型分類と予後.アクチュアル脳・神経疾患の臨床.最新アプローチ 多発性硬化症と視神経脊髄炎.
辻省次(総編集).吉良潤一(専門編集).中山書店 pp. 18-28, 2012. - ↑ 吉良潤一
「多発性硬化症治療ガイドライン2010」の使用に関してのガイダンス.
多発性硬化症治療ガイドライン2010. 日本神経学会、日本神経免疫学会、日本神経治療学会(監).医学書院 pp. 2-10, 2010. - ↑ Kira J
Genetic and environmental backgrounds responsible for the change in the phenotype of MS in Japanese subjects.
Multiple Sclerosis and Related Disorders 1: 188-195, 2012.