「子宮内手術法」の版間の差分
細編集の要約なし |
細編集の要約なし |
||
| (3人の利用者による、間の11版が非表示) | |||
| 1行目: | 1行目: | ||
<div align="right"> | |||
[ | <font size="+1">[http://researchmap.jp/tetsuichirosaito 斎藤 哲一郎]</font><br> | ||
''千葉大学 大学院 医学研究院''<br> | |||
DOI:<selfdoi /> 原稿受付日:2012年7月13日 原稿完成日:2013年3月28日<br> | |||
担当編集委員:[http://researchmap.jp/noriko1128 大隅 典子](東北大学 大学院医学系研究科 附属創生応用医学研究センター 脳神経科学コアセンター 発生発達神経科学分野)<br> | |||
</div> | |||
英:''in utero'' surgery 独:intrauterinen Operation 仏:chirurgie in utero | |||
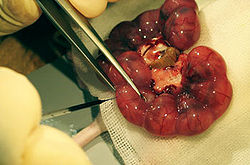
[[Image:図−子宮内手術法.jpg|thumb|right|250px|<b>図.子宮内手術の1例</b><br />妊娠マウスを開腹し子宮内の胎仔の脳室へマイクロピペットで溶液を注入<ref name="ref1"><pubmed>11784059</pubmed></ref>。本図では、溶液を可視化するため色素を用いている。]] | |||
{{box|text= | |||
子宮内手術法とは、[[wj:哺乳類|哺乳類]]の[[wj:発生|発生]]機構などを解析することを目的として[[wj:子宮|子宮]]内の胎仔に施す[[wj:外科|外科]]的手法である。手術後の胎仔を子宮内で生育させることが可能であるため、胎仔に移植した細胞や導入した[[wj:遺伝子|遺伝子]]の機能を長期間にわたり個体レベルで解析できるのが特長である。 | |||
}} | |||
== 歴史 == | == 歴史 == | ||
子宮内手術は、子宮内のラット胎仔の足や尾などを切断後、胎仔の生存を調べた実験に遡る<ref name="ref2">'''E Bors'''<br>Die Methodik der | 子宮内手術は、子宮内のラット胎仔の足や尾などを切断後、胎仔の生存を調べた実験に遡る<ref name="ref2">'''E Bors'''<br>Die Methodik der intrauterinen Operation am überlebenden Säugetierfoetus.<br>''Arch Entwichl-Mech Org.'': 1925, 105;655-666</ref><ref name="ref3">'''J S Nicholas'''<br>Notes on the application of experimental methods upon mammalian embryos.<br>''Anatomical Records'': 1925, 31;385-396</ref>。手技や発生生物学の進歩とともに、マウス胎仔へ[[wj:血球|血球]]系細胞 <ref name="ref4"><pubmed>42904</pubmed></ref>や[[神経堤]]細胞<ref name="ref5"><pubmed>4058595</pubmed></ref>を移植し、出生後のマウスを解析することにより、移植に用いた細胞がどのような細胞に[[分化]]できるか(分化能)を調べる実験が行われた。その後、マウス脳の細胞などをラット胎仔の脳に移植する実験も行われ、神経系細胞の個性を生体内で解析できるようになった<ref name="ref6"><pubmed>7720584</pubmed></ref><ref name="ref7"><pubmed>8845151</pubmed></ref><ref name="ref8"><pubmed>8845152</pubmed></ref>。 | ||
一方、1980年にマウス胎仔へ[[wj:レトロウイルス|レトロウイルス]]を感染させる実験が行われ<ref name="ref9"><pubmed>7357600</pubmed></ref>、[[wj:遺伝子組換え|遺伝子組換え]]技術により[[wj:大腸菌|大腸菌]]の[[wj:β−ガラクトシダーゼ|β−ガラクトシダーゼ]]の遺伝子を持つ組換えレトロウイルスが作られるようになると、β−ガラクトシダーゼをレポーターとして感染した細胞の標識が可能となった<ref name="ref10"><pubmed>3102226</pubmed></ref>。レトロウイルスのcDNAは感染細胞のゲノムに組み込まれ感染細胞の子孫の細胞でもレポーターを発現し続けるため、[[細胞分裂]]毎に希釈される[[wj:蛍光色素|蛍光色素]]の欠点が克服され、[[wj:細胞系譜|細胞系譜]]の解析は容易となった<ref name="ref11"><pubmed>3137660</pubmed></ref>。さらに、[[ウイルスベクター]]の改良が進むとともに[[緑色蛍光タンパク質]](GFP)がレポーターとして使われ始めると、''GFP''を持つ組換えウイルスや[[トランスジェニック動物]]を用い、研究が一段と進むこととなった。 | |||
しかし、組換えウイルスやトランスジェニック動物の作製にはかなりの時間を要する点が大きな問題であったが、子宮内の胎仔に[[電気穿孔法]]で遺伝子導入する生体内電気穿孔法が開発され<ref name="ref1"><pubmed>11784059</pubmed></ref><ref name="ref12"><pubmed>17406448</pubmed></ref>、胎仔を用いた遺伝子の解析が飛躍的に進展している。 | |||
== 手法 == | == 手法 == | ||
細胞の増殖能や分化能、遺伝子の機能などを哺乳類が発生する過程で解析することを目的とし、[[wj:妊娠|妊娠]]動物を開腹し子宮内の胎仔に細胞移植や[[wj:遺伝子導入|遺伝子導入]]、薬剤の注入などを行う。図は、マウス胎仔の脳室へ溶液を注入する様子を示す<ref name="ref13461864"><pubmed>13461864</pubmed></ref>。適切な処置が施されれば、胎仔は子宮とともに母体に戻すことで生育でき、出産も可能である。 | |||
マウスの場合、子宮壁を切開した状態でも[[wj:卵黄囊|卵黄囊]]の中で胎仔は生存できるため、子宮壁を切開後に細胞移植などを行い、子宮壁を縫合せずに母体に戻す手術も行われ、子宮外手術法(exo utero surgery)と呼ばれる<ref name="ref13"><pubmed>20691868</pubmed></ref>。子宮外手術を行っても、胎仔は正常に生育できるが、母マウスは自力で出産できないため、生後のマウスを必要な場合は出産期に[[wj:帝王切開|帝王切開]]が必要となる。 | |||
<br> 神経細胞の多くは胎生期に作られるため、生体内における神経細胞の分化の解析などには、子宮内手術や子宮外手術は威力を発揮する。 | |||
神経発生の研究では[[wj:ラット|ラット]]が多用されていた時期があり、ラット胎仔への異種細胞移植が先行するが、[[マウス]]の細胞をマウス胎仔脳へ移植することにより、細胞の分化能なども調べられている<ref name="ref14"><pubmed>9354324</pubmed></ref><ref name="ref15"><pubmed>15750183</pubmed></ref>。[[wj:超音波顕微鏡|超音波顕微鏡]]を用い、子宮内の胎仔の脳室内部を可視化する実験系が使われることもある<ref name="ref14"><pubmed>9354324</pubmed></ref>。 | |||
マウス胎仔に遺伝子組換えウイルスを注入し、感染細胞で遺伝子を強制発現させ遺伝子の機能を解析したり<ref name="ref16"><pubmed>10461220</pubmed></ref>、''GFP''などのレポーター遺伝子の導入により細胞を標識し細胞の形態や移動<ref name="ref17"><pubmed>11217860</pubmed></ref>の解析などに用いられる。 | |||
生体内電気穿孔法では、胎仔に[[wj:DNA|DNA]]や[[wj:RNA|RNA]]を注入した後でピンセット型電極などで電気パルスを与えることにより胎仔の細胞へ遺伝子を導入することができ、遺伝子の機能<ref name="ref1"><pubmed>11784059</pubmed></ref><ref name="ref15"><pubmed>15750183</pubmed></ref><ref name="ref18"><pubmed>12657654</pubmed></ref>や遺伝子の[[wj:発現|発現]]調節機構<ref name="ref18"><pubmed>12657654</pubmed></ref><ref name="ref19"><pubmed>15121842</pubmed></ref>、細胞の移動<ref name="ref20"><pubmed>18482404</pubmed></ref>などが解析されている。ウイルスを特定の部位のみに感染させることは技術的に困難であるが、生体内電気穿孔法は陽極側に近い細胞のみに一方向に遺伝子を導入できる特長を有する。 | |||
技術に習熟すれば、細胞やウイルスなどの注入実験ではほぼ全ての胎仔を生存させることができる。生体内電気穿孔法でも9割近い胎仔の生存率と遺伝子導入は可能である。 | |||
== 関連項目 == | == 関連項目 == | ||
| 20行目: | 44行目: | ||
== 参考文献 == | == 参考文献 == | ||
<references /> | <references /> | ||
2020年7月27日 (月) 21:03時点における最新版
斎藤 哲一郎
千葉大学 大学院 医学研究院
DOI:10.14931/bsd.2141 原稿受付日:2012年7月13日 原稿完成日:2013年3月28日
担当編集委員:大隅 典子(東北大学 大学院医学系研究科 附属創生応用医学研究センター 脳神経科学コアセンター 発生発達神経科学分野)
英:in utero surgery 独:intrauterinen Operation 仏:chirurgie in utero
子宮内手術法とは、哺乳類の発生機構などを解析することを目的として子宮内の胎仔に施す外科的手法である。手術後の胎仔を子宮内で生育させることが可能であるため、胎仔に移植した細胞や導入した遺伝子の機能を長期間にわたり個体レベルで解析できるのが特長である。
歴史
子宮内手術は、子宮内のラット胎仔の足や尾などを切断後、胎仔の生存を調べた実験に遡る[2][3]。手技や発生生物学の進歩とともに、マウス胎仔へ血球系細胞 [4]や神経堤細胞[5]を移植し、出生後のマウスを解析することにより、移植に用いた細胞がどのような細胞に分化できるか(分化能)を調べる実験が行われた。その後、マウス脳の細胞などをラット胎仔の脳に移植する実験も行われ、神経系細胞の個性を生体内で解析できるようになった[6][7][8]。
一方、1980年にマウス胎仔へレトロウイルスを感染させる実験が行われ[9]、遺伝子組換え技術により大腸菌のβ−ガラクトシダーゼの遺伝子を持つ組換えレトロウイルスが作られるようになると、β−ガラクトシダーゼをレポーターとして感染した細胞の標識が可能となった[10]。レトロウイルスのcDNAは感染細胞のゲノムに組み込まれ感染細胞の子孫の細胞でもレポーターを発現し続けるため、細胞分裂毎に希釈される蛍光色素の欠点が克服され、細胞系譜の解析は容易となった[11]。さらに、ウイルスベクターの改良が進むとともに緑色蛍光タンパク質(GFP)がレポーターとして使われ始めると、GFPを持つ組換えウイルスやトランスジェニック動物を用い、研究が一段と進むこととなった。
しかし、組換えウイルスやトランスジェニック動物の作製にはかなりの時間を要する点が大きな問題であったが、子宮内の胎仔に電気穿孔法で遺伝子導入する生体内電気穿孔法が開発され[1][12]、胎仔を用いた遺伝子の解析が飛躍的に進展している。
手法
細胞の増殖能や分化能、遺伝子の機能などを哺乳類が発生する過程で解析することを目的とし、妊娠動物を開腹し子宮内の胎仔に細胞移植や遺伝子導入、薬剤の注入などを行う。図は、マウス胎仔の脳室へ溶液を注入する様子を示す[13]。適切な処置が施されれば、胎仔は子宮とともに母体に戻すことで生育でき、出産も可能である。
マウスの場合、子宮壁を切開した状態でも卵黄囊の中で胎仔は生存できるため、子宮壁を切開後に細胞移植などを行い、子宮壁を縫合せずに母体に戻す手術も行われ、子宮外手術法(exo utero surgery)と呼ばれる[14]。子宮外手術を行っても、胎仔は正常に生育できるが、母マウスは自力で出産できないため、生後のマウスを必要な場合は出産期に帝王切開が必要となる。
神経細胞の多くは胎生期に作られるため、生体内における神経細胞の分化の解析などには、子宮内手術や子宮外手術は威力を発揮する。
神経発生の研究ではラットが多用されていた時期があり、ラット胎仔への異種細胞移植が先行するが、マウスの細胞をマウス胎仔脳へ移植することにより、細胞の分化能なども調べられている[15][16]。超音波顕微鏡を用い、子宮内の胎仔の脳室内部を可視化する実験系が使われることもある[15]。
マウス胎仔に遺伝子組換えウイルスを注入し、感染細胞で遺伝子を強制発現させ遺伝子の機能を解析したり[17]、GFPなどのレポーター遺伝子の導入により細胞を標識し細胞の形態や移動[18]の解析などに用いられる。
生体内電気穿孔法では、胎仔にDNAやRNAを注入した後でピンセット型電極などで電気パルスを与えることにより胎仔の細胞へ遺伝子を導入することができ、遺伝子の機能[1][16][19]や遺伝子の発現調節機構[19][20]、細胞の移動[21]などが解析されている。ウイルスを特定の部位のみに感染させることは技術的に困難であるが、生体内電気穿孔法は陽極側に近い細胞のみに一方向に遺伝子を導入できる特長を有する。
技術に習熟すれば、細胞やウイルスなどの注入実験ではほぼ全ての胎仔を生存させることができる。生体内電気穿孔法でも9割近い胎仔の生存率と遺伝子導入は可能である。
関連項目
参考文献
- ↑ 1.0 1.1 1.2
Saito, T., & Nakatsuji, N. (2001).
Efficient gene transfer into the embryonic mouse brain using in vivo electroporation. Developmental biology, 240(1), 237-46. [PubMed:11784059] [WorldCat] [DOI] - ↑ E Bors
Die Methodik der intrauterinen Operation am überlebenden Säugetierfoetus.
Arch Entwichl-Mech Org.: 1925, 105;655-666 - ↑ J S Nicholas
Notes on the application of experimental methods upon mammalian embryos.
Anatomical Records: 1925, 31;385-396 - ↑
Fleischman, R.A., & Mintz, B. (1979).
Prevention of genetic anemias in mice by microinjection of normal hematopoietic stem cells into the fetal placenta. Proceedings of the National Academy of Sciences of the United States of America, 76(11), 5736-40. [PubMed:42904] [PMC] [WorldCat] [DOI] - ↑
Jaenisch, R. (1985).
Mammalian neural crest cells participate in normal embryonic development on microinjection into post-implantation mouse embryos. Nature, 318(6042), 181-3. [PubMed:4058595] [WorldCat] [DOI] - ↑
Fishell, G. (1995).
Striatal precursors adopt cortical identities in response to local cues. Development (Cambridge, England), 121(3), 803-12. [PubMed:7720584] [WorldCat] - ↑
Campbell, K., Olsson, M., & Björklund, A. (1995).
Regional incorporation and site-specific differentiation of striatal precursors transplanted to the embryonic forebrain ventricle. Neuron, 15(6), 1259-73. [PubMed:8845151] [WorldCat] [DOI] - ↑
Brüstle, O., Maskos, U., & McKay, R.D. (1995).
Host-guided migration allows targeted introduction of neurons into the embryonic brain. Neuron, 15(6), 1275-85. [PubMed:8845152] [WorldCat] [DOI] - ↑
Jaenisch, R. (1980).
Retroviruses and embryogenesis: microinjection of Moloney leukemia virus into midgestation mouse embryos. Cell, 19(1), 181-8. [PubMed:7357600] [WorldCat] [DOI] - ↑
Sanes, J.R., Rubenstein, J.L., & Nicolas, J.F. (1986).
Use of a recombinant retrovirus to study post-implantation cell lineage in mouse embryos. The EMBO journal, 5(12), 3133-42. [PubMed:3102226] [PMC] [WorldCat] - ↑
Walsh, C., & Cepko, C.L. (1988).
Clonally related cortical cells show several migration patterns. Science (New York, N.Y.), 241(4871), 1342-5. [PubMed:3137660] [WorldCat] [DOI] - ↑
Saito, T. (2006).
In vivo electroporation in the embryonic mouse central nervous system. Nature protocols, 1(3), 1552-8. [PubMed:17406448] [WorldCat] [DOI] - ↑
STAMPFLI, R., & WILLI, M. (1957).
Membrane potential of a Ranvier node measured after electrical destruction of its membrane. Experientia, 13(7), 297-8. [PubMed:13461864] [WorldCat] [DOI] - ↑
Ngô-Muller, V., & Muneoka, K. (2010).
In utero and exo utero surgery on rodent embryos. Methods in enzymology, 476, 205-26. [PubMed:20691868] [WorldCat] [DOI] - ↑ 15.0 15.1
Olsson, M., Campbell, K., & Turnbull, D.H. (1997).
Specification of mouse telencephalic and mid-hindbrain progenitors following heterotopic ultrasound-guided embryonic transplantation. Neuron, 19(4), 761-72. [PubMed:9354324] [WorldCat] [DOI] - ↑ 16.0 16.1
Mizutani, K., & Saito, T. (2005).
Progenitors resume generating neurons after temporary inhibition of neurogenesis by Notch activation in the mammalian cerebral cortex. Development (Cambridge, England), 132(6), 1295-304. [PubMed:15750183] [WorldCat] [DOI] - ↑
Gaiano, N., Kohtz, J.D., Turnbull, D.H., & Fishell, G. (1999).
A method for rapid gain-of-function studies in the mouse embryonic nervous system. Nature neuroscience, 2(9), 812-9. [PubMed:10461220] [WorldCat] [DOI] - ↑
Noctor, S.C., Flint, A.C., Weissman, T.A., Dammerman, R.S., & Kriegstein, A.R. (2001).
Neurons derived from radial glial cells establish radial units in neocortex. Nature, 409(6821), 714-20. [PubMed:11217860] [WorldCat] [DOI] - ↑ 19.0 19.1
Saba, R., Nakatsuji, N., & Saito, T. (2003).
Mammalian BarH1 confers commissural neuron identity on dorsal cells in the spinal cord. The Journal of neuroscience : the official journal of the Society for Neuroscience, 23(6), 1987-91. [PubMed:12657654] [PMC] [WorldCat] - ↑
Miyagi, S., Saito, T., Mizutani, K., Masuyama, N., Gotoh, Y., Iwama, A., ..., & Okuda, A. (2004).
The Sox-2 regulatory regions display their activities in two distinct types of multipotent stem cells. Molecular and cellular biology, 24(10), 4207-20. [PubMed:15121842] [PMC] [WorldCat] [DOI] - ↑
Tabata, H., & Nakajima, K. (2008).
Labeling embryonic mouse central nervous system cells by in utero electroporation. Development, growth & differentiation, 50(6), 507-11. [PubMed:18482404] [WorldCat] [DOI]