「小胞グルタミン酸トランスポーター」の版間の差分
細編集の要約なし |
細編集の要約なし |
||
| 15行目: | 15行目: | ||
==VGLUTの構造とサブファミリー== | ==VGLUTの構造とサブファミリー== | ||
[[哺乳類]]では3つのVGLUT(VGLUT1, 2, 3)が同定されている<ref name=ref1><pubmed></pubmed></ref> <ref name=ref2><pubmed></pubmed></ref> <ref name=ref3><pubmed></pubmed></ref>。これらはI型リン酸トランスポーター・ファミリーに属し、現にVGLUT1とVGLUT2は、[[形質膜]]に存在しリン酸を輸送するトランスポーターとしてクローニングされ、それぞれBNPI, DNPIと呼ばれていた<ref name=ref4><pubmed></pubmed></ref> <ref name=ref5><pubmed></pubmed></ref>。現在の分類では、SLC17ファミリーに属し、VGLUT1, 2, 3はそれぞれSLC17A7, A6, A8と呼ばれる。同じファミリーのSialin(SLC17A5)は[[リソソーム]]からのシアル酸排出に関わるトランスポーターとして知られるが<ref name=ref6><pubmed></pubmed></ref>、最近、グルタミン酸やアスパラギン酸輸送活性を持つことが示されVEAT(vesicular excitatory amino acid transporter)と名付けられた<ref name=ref7><pubmed></pubmed></ref>。しかしながら、sialin/VEATがグルタミン酸やアスパラギン酸を介した[[シナプス]]伝達に関わっているか否かは議論の的となっている<ref name=ref8><pubmed></pubmed></ref>。VGLUTは約560個のアミノ酸からなる分子量約65kDaのタンパク質で、10~ | [[哺乳類]]では3つのVGLUT(VGLUT1, 2, 3)が同定されている<ref name=ref1><pubmed>10938000</pubmed></ref> <ref name=ref2><pubmed>16765470</pubmed></ref> <ref name=ref3><pubmed>11001057</pubmed></ref>。これらはI型リン酸トランスポーター・ファミリーに属し、現にVGLUT1とVGLUT2は、[[形質膜]]に存在しリン酸を輸送するトランスポーターとしてクローニングされ、それぞれBNPI, DNPIと呼ばれていた<ref name=ref4><pubmed>10820226</pubmed></ref> <ref name=ref5><pubmed>8202535</pubmed></ref>。現在の分類では、SLC17ファミリーに属し、VGLUT1, 2, 3はそれぞれSLC17A7, A6, A8と呼ばれる。同じファミリーのSialin(SLC17A5)は[[リソソーム]]からのシアル酸排出に関わるトランスポーターとして知られるが<ref name=ref6><pubmed>15510212</pubmed></ref>、最近、グルタミン酸やアスパラギン酸輸送活性を持つことが示されVEAT(vesicular excitatory amino acid transporter)と名付けられた<ref name=ref7><pubmed>18695252</pubmed></ref>。しかしながら、sialin/VEATがグルタミン酸やアスパラギン酸を介した[[シナプス]]伝達に関わっているか否かは議論の的となっている<ref name=ref8><pubmed>26180193</pubmed></ref>。VGLUTは約560個のアミノ酸からなる分子量約65kDaのタンパク質で、10~12個の膜貫通部位を持っている。N末端、C末端ともに細胞質側に位置しており、その部分のアミノ酸配列がアイソフォーム間で多様性に富む。第1膜貫通部位と第2膜貫通部位の間のループ領域は小胞内腔側に位置し、N型の糖鎖修飾を受けている<ref name=ref9><pubmed>12151341</pubmed></ref>。VGLUT1のC末端にはProline-rich domainが存在し、エンドサイトーシス関連タンパク質であるエンドフィリンと結合し、高頻度刺激時におけるVGLUT1タンパク質の効率的なエンドサイトーシスに関与していることが示唆されている<ref name=ref10><pubmed>16815333</pubmed></ref>。VGLUT1~3のグルタミン酸取込み活性には大きな違いが認められていない。 | ||
==発現分布== | ==発現分布== | ||
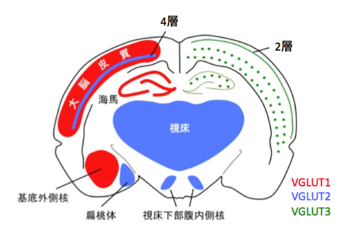
[[image:小胞グルタミン酸トランスポーター1.png|thumb|350px|'''図1.3つのVGLUTアイソフォームの脳内分布の概要'''<br>哺乳類脳内には3つのVGLUTアイソフォームが発現している。mRNAの発現パターンを見ると、VGLUT1とVGLUT2は相補的に発現しているのに対して、VGLUT3の発現はごく一部の細胞に限局している。参考文献11より改訂。]] | [[image:小胞グルタミン酸トランスポーター1.png|thumb|350px|'''図1.3つのVGLUTアイソフォームの脳内分布の概要'''<br>哺乳類脳内には3つのVGLUTアイソフォームが発現している。mRNAの発現パターンを見ると、VGLUT1とVGLUT2は相補的に発現しているのに対して、VGLUT3の発現はごく一部の細胞に限局している。参考文献11より改訂。]] | ||
通常グルタミン酸を放出しないニューロンにVGLUTを発現させるとグルタミン酸放出が喚起されることから、今日ではグルタミン酸作動性ニューロンの[[神経終末]]マーカーとして、抗VGLUT抗体が広く使用されている。興味深いことに、成体の脳においてVGLUT1とVGLUT2は異なるニューロンに発現している(図1)<ref name=ref11><pubmed></pubmed></ref> <ref name=ref12><pubmed></pubmed></ref> <ref name=ref13><pubmed></pubmed></ref>。VGLUT1は主に[[大脳皮質]]・[[海馬]]に、VGLUT2は視床・[[視床下部]][[腹内側核]]・[[扁桃体]]に発現が認められる。また、[[小脳]]においては、平行繊維がVGLUT1を、登上繊維がVGLUT2を発現するなど、ここでも相補的な発現パターンを示す。一方、例外的にVGLUT1とVGLUT2の両方を発現するニューロンや、発達過程でアイソフォームの発現量が変化する例も報告されている<ref name=ref14><pubmed></pubmed></ref>。また、脳以外では、膵臓のα細胞やβ細胞、松果体、精子頭部のアクロソームでの発現が確認されており、末梢器官におけるグルタミン酸シグナリングの重要性が示唆されている<ref name=ref15><pubmed></pubmed></ref>。 | 通常グルタミン酸を放出しないニューロンにVGLUTを発現させるとグルタミン酸放出が喚起されることから、今日ではグルタミン酸作動性ニューロンの[[神経終末]]マーカーとして、抗VGLUT抗体が広く使用されている。興味深いことに、成体の脳においてVGLUT1とVGLUT2は異なるニューロンに発現している(図1)<ref name=ref11><pubmed>15102489</pubmed></ref> <ref name=ref12><pubmed></pubmed></ref> <ref name=ref13><pubmed></pubmed></ref>。VGLUT1は主に[[大脳皮質]]・[[海馬]]に、VGLUT2は視床・[[視床下部]][[腹内側核]]・[[扁桃体]]に発現が認められる。また、[[小脳]]においては、平行繊維がVGLUT1を、登上繊維がVGLUT2を発現するなど、ここでも相補的な発現パターンを示す。一方、例外的にVGLUT1とVGLUT2の両方を発現するニューロンや、発達過程でアイソフォームの発現量が変化する例も報告されている<ref name=ref14><pubmed></pubmed></ref>。また、脳以外では、膵臓のα細胞やβ細胞、松果体、精子頭部のアクロソームでの発現が確認されており、末梢器官におけるグルタミン酸シグナリングの重要性が示唆されている<ref name=ref15><pubmed></pubmed></ref>。 | ||
主要なVGLUTアイソフォームであるVGLUT1,2に比べて、VGLUT3を発現しているニューロンは極めて少ない<ref name=ref16><pubmed></pubmed></ref> <ref name=ref17><pubmed></pubmed></ref>。興味深いことに、VGLUT3は従来グルタミン酸作動性ニューロンと思われていなかったニューロン、例えば海馬や大脳皮質の[[GABA作動性]]ニューロンや[[モノアミン]]作動性ニューロンでの発現が認められることから、グルタミン酸と[[GABA]]や[[ドーパミン]]の共放出が示唆された。また、VGLUT3は神経終末のみならず、一部の細胞では細胞体や樹状突起での発現が認められることから、ポストシナプス側からのグルタミン酸放出による逆行性シグナル伝達を担う可能性が指摘されている。[[肝臓]]や[[腎臓]]においても発現が検出されているが、その生理機能は不明である。 | 主要なVGLUTアイソフォームであるVGLUT1,2に比べて、VGLUT3を発現しているニューロンは極めて少ない<ref name=ref16><pubmed></pubmed></ref> <ref name=ref17><pubmed></pubmed></ref>。興味深いことに、VGLUT3は従来グルタミン酸作動性ニューロンと思われていなかったニューロン、例えば海馬や大脳皮質の[[GABA作動性]]ニューロンや[[モノアミン]]作動性ニューロンでの発現が認められることから、グルタミン酸と[[GABA]]や[[ドーパミン]]の共放出が示唆された。また、VGLUT3は神経終末のみならず、一部の細胞では細胞体や樹状突起での発現が認められることから、ポストシナプス側からのグルタミン酸放出による逆行性シグナル伝達を担う可能性が指摘されている。[[肝臓]]や[[腎臓]]においても発現が検出されているが、その生理機能は不明である。 | ||
2016年1月29日 (金) 11:52時点における版
高森 茂雄
同志社大学 脳科学研究科
DOI:10.14931/bsd.6758 原稿受付日:2016年1月28日 原稿完成日:2016年月日
担当編集委員:河西 春郎(東京大学 大学院医学系研究科)
英語名:vesicular glutamate transporter
英語略語名:VGLUT(ヴィ・グルット)
同義語:小胞性グルタミン酸トランスポーター、小胞型グルタミン酸トランスポーター
哺乳類中枢神経系における興奮性シナプス伝達の多くはグルタミン酸(glutamate, glutamic acid)を介して行なわれる。実に、哺乳類脳内の約8割のニューロンがグルタミン酸を放出する。グルタミン酸は、体内の全ての細胞内に比較的高濃度で存在しているため、ニューロンがグルタミン酸を放出するためには、分泌小胞であるシナプス小胞内腔にグルタミン酸が濃縮される必要がある。グルタミン酸をシナプス小胞に輸送するトランスポーターが小胞型グルタミン酸トランスポーター(VGLUT; vesicular glutamate transporter)であり、これまで哺乳類では3つのアイソフォームが同定されている。VGLUTは、液胞型プロトンATPaseによって形成されるプロトン電気化学勾配を駆動力として、グルタミン酸を小胞内に濃縮する。Na+勾配を駆動力としてグルタミン酸を輸送する形質膜型のグルタミン酸トランスポーターとはアミノ酸配列の相同性がない。近年、各VGLUTアイソフォームのノックアウトマウスの解析から、VGLUTがグルタミン酸放出に必須の因子であることや、各々のVGLUTを使ったグルタミン酸神経回路の生理的な重要性が明らかになってきた。
VGLUTの構造とサブファミリー
哺乳類では3つのVGLUT(VGLUT1, 2, 3)が同定されている[1] [2] [3]。これらはI型リン酸トランスポーター・ファミリーに属し、現にVGLUT1とVGLUT2は、形質膜に存在しリン酸を輸送するトランスポーターとしてクローニングされ、それぞれBNPI, DNPIと呼ばれていた[4] [5]。現在の分類では、SLC17ファミリーに属し、VGLUT1, 2, 3はそれぞれSLC17A7, A6, A8と呼ばれる。同じファミリーのSialin(SLC17A5)はリソソームからのシアル酸排出に関わるトランスポーターとして知られるが[6]、最近、グルタミン酸やアスパラギン酸輸送活性を持つことが示されVEAT(vesicular excitatory amino acid transporter)と名付けられた[7]。しかしながら、sialin/VEATがグルタミン酸やアスパラギン酸を介したシナプス伝達に関わっているか否かは議論の的となっている[8]。VGLUTは約560個のアミノ酸からなる分子量約65kDaのタンパク質で、10~12個の膜貫通部位を持っている。N末端、C末端ともに細胞質側に位置しており、その部分のアミノ酸配列がアイソフォーム間で多様性に富む。第1膜貫通部位と第2膜貫通部位の間のループ領域は小胞内腔側に位置し、N型の糖鎖修飾を受けている[9]。VGLUT1のC末端にはProline-rich domainが存在し、エンドサイトーシス関連タンパク質であるエンドフィリンと結合し、高頻度刺激時におけるVGLUT1タンパク質の効率的なエンドサイトーシスに関与していることが示唆されている[10]。VGLUT1~3のグルタミン酸取込み活性には大きな違いが認められていない。
発現分布
通常グルタミン酸を放出しないニューロンにVGLUTを発現させるとグルタミン酸放出が喚起されることから、今日ではグルタミン酸作動性ニューロンの神経終末マーカーとして、抗VGLUT抗体が広く使用されている。興味深いことに、成体の脳においてVGLUT1とVGLUT2は異なるニューロンに発現している(図1)[11] [12] [13]。VGLUT1は主に大脳皮質・海馬に、VGLUT2は視床・視床下部腹内側核・扁桃体に発現が認められる。また、小脳においては、平行繊維がVGLUT1を、登上繊維がVGLUT2を発現するなど、ここでも相補的な発現パターンを示す。一方、例外的にVGLUT1とVGLUT2の両方を発現するニューロンや、発達過程でアイソフォームの発現量が変化する例も報告されている[14]。また、脳以外では、膵臓のα細胞やβ細胞、松果体、精子頭部のアクロソームでの発現が確認されており、末梢器官におけるグルタミン酸シグナリングの重要性が示唆されている[15]。
主要なVGLUTアイソフォームであるVGLUT1,2に比べて、VGLUT3を発現しているニューロンは極めて少ない[16] [17]。興味深いことに、VGLUT3は従来グルタミン酸作動性ニューロンと思われていなかったニューロン、例えば海馬や大脳皮質のGABA作動性ニューロンやモノアミン作動性ニューロンでの発現が認められることから、グルタミン酸とGABAやドーパミンの共放出が示唆された。また、VGLUT3は神経終末のみならず、一部の細胞では細胞体や樹状突起での発現が認められることから、ポストシナプス側からのグルタミン酸放出による逆行性シグナル伝達を担う可能性が指摘されている。肝臓や腎臓においても発現が検出されているが、その生理機能は不明である。
遺伝子改変マウスと生理機能
VGLUT1. VGLUT1ノックアウトマウスは、生後2~3週齢までは野生型と区別がつかないが、その後急激に成長が遅滞し死に到る[12] [18]。この時期に食餌を人工的に行なうと、1年以上生存するとの報告もある[12] [19]。死に至る直前のVGLUT1ノックアウトマウスは、異常な驚愕反射を呈する。VGLUT1マウス由来の海馬初代培養細胞や海馬スライス標本では、グルタミン酸による興奮性神経伝達のほとんどが消失する。幼弱期に若干残存する活性は、おそらくVGLUT2の一過性な発現によると考えられている。VGLUT1のヘテロマウスから得られた神経標本での電気生理学的測定では、刺激に応答したグルタミン酸シナプス伝達や小胞内グルタミン酸量を反映するminiature EPSCの振幅は減少しないが[12] [18]、長期増強(LTP)の減弱が見られる[20]。また、モーリス水迷路試験における逆転学習の低下、不安傾向や鬱症状などを呈することから、VGLUT1の発現減少が脳機能に何らかの役割を果たすと考えられている[20] [21]。
VGLUT2. VGLUT2ノックアウトマウスは生後直後に、呼吸不能により死亡する。したがって、脳幹部位のVGLUT2陽性ニューロンが呼吸を支えるグルタミン酸シナプス伝達を担っていると考えられる[22] [23]。また、VGLUT2のコンディショナル・ノックアウトマウスも精力的に作成され、視床下部腹内側核や大脳皮質及び扁桃体のVGLUT2が欠損すると、それぞれ低血糖反応の低下や多動を含む統合失調症様の行動異常を示すことが明らかになった[24] [25]。また、VGLUT2のヘテロマウスの解析結果から、視床においてVGLUT2が司るグルタミン酸性神経回路が神経因性疼痛の発現に関与していることが示唆された[22]。また、VGLUT2ヘテロマウスではminiature EPSCの振幅低下が検出され、VGLUT1ヘテロマウスの解析結果と一致しない。
VGLUT3. VGLUT3ノックアウトマウスは、一見正常に産まれるが、聴覚障害を呈するのみならず、不安傾向の増大やてんかんを呈する。また、炎症や機械的な傷害に対する痛みの感受性が低下することから、VGLUT3が司る神経回路が痛みの受容に関与することが示唆された[26] [27] [28]。
グルタミン酸輸送機構
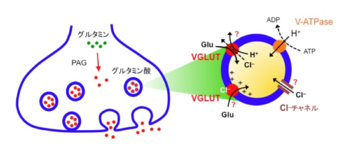
興奮性神経伝達物質であるグルタミン酸は、シナプス終末の細胞質に存在するPAG(phosphate-activated glutaminase)の働きにより、グルタミン酸から作られる。VGLUTによるグルタミン酸輸送は、液胞型プロトンATPaseが形成するプロトン電気化学勾配によって駆動されるが、輸送メカニズムの詳細は不明である。特にCl–の役割については2つの説が提唱されており、VGLUTが持つCl–透過性が輸送活性を制御する説(上)と、Cl–がVGLUTに直接結合することによりVGLUTが活性化されるとする説(下)がある。また、VGLUTがグルタミン酸/H+対向輸送体なのか、膜電位駆動型グルタミン酸単輸送体なのかは定かではない。
グルタミン酸のシナプス小胞内への輸送は、プロトンの電気化学勾配を駆動力とする二次輸送である[29]。小胞膜に存在する液胞型プロトンATPaseは、ATP加水分解のエネルギーを使って細胞質から小胞内腔にプロトンを運ぶことにより、膜電位勾配(小胞内が+)とpH勾配(小胞内が酸性)を形成する。哺乳類脳から精製したシナプス小胞を使った生化学的取込み測定の結果から、グルタミン酸の輸送は主に膜電位勾配によって駆動されると考えられているが、その詳細なメカニズムはいまだに不明である(図2)。一方、輸送の駆動力である膜電位勾配とpH勾配は、小胞膜上にある塩化物イオンチャネルの活性によって調節されるが、その分子実態は諸説ある。電位依存性Cl–チャネルファミリーのClC-3とする説[30]と、VGLUT自体がチャネル活性を持つとする説である[1] [19]。また、塩化物イオンがVGLUTに直接結合し、グルタミン酸輸送活性を調整するという仮説も提唱されており[31] [32]、Cl–はプロトン電気化学勾配とVGLUTの両方を修飾している可能性が示唆されている。
脳から精製したシナプス小胞で測定可能なグルタミン酸輸送速度は、時定数が数分程度であるが、カリックスのヘルドシナプスにおいては、室温で測定した場合、時定数15秒程度であることが報告されている[33]。また、輸送速度は、細胞質のCl–濃度によって修飾されること、生後発達過程で徐々に速くなること等が示された。
参考文献
- ↑ 1.0 1.1
Bellocchio, E.E., Reimer, R.J., Fremeau, R.T., & Edwards, R.H. (2000).
Uptake of glutamate into synaptic vesicles by an inorganic phosphate transporter. Science (New York, N.Y.), 289(5481), 957-60. [PubMed:10938000] [WorldCat] [DOI] - ↑
Takamori, S. (2006).
VGLUTs: 'exciting' times for glutamatergic research? Neuroscience research, 55(4), 343-51. [PubMed:16765470] [WorldCat] [DOI] - ↑
Takamori, S., Rhee, J.S., Rosenmund, C., & Jahn, R. (2000).
Identification of a vesicular glutamate transporter that defines a glutamatergic phenotype in neurons. Nature, 407(6801), 189-94. [PubMed:11001057] [WorldCat] [DOI] - ↑
Aihara, Y., Mashima, H., Onda, H., Hisano, S., Kasuya, H., Hori, T., ..., & Takeda, J. (2000).
Molecular cloning of a novel brain-type Na(+)-dependent inorganic phosphate cotransporter. Journal of neurochemistry, 74(6), 2622-5. [PubMed:10820226] [WorldCat] [DOI] - ↑
Ni, B., Rosteck, P.R., Nadi, N.S., & Paul, S.M. (1994).
Cloning and expression of a cDNA encoding a brain-specific Na(+)-dependent inorganic phosphate cotransporter. Proceedings of the National Academy of Sciences of the United States of America, 91(12), 5607-11. [PubMed:8202535] [PMC] [WorldCat] [DOI] - ↑
Morin, P., Sagné, C., & Gasnier, B. (2004).
Functional characterization of wild-type and mutant human sialin. The EMBO journal, 23(23), 4560-70. [PubMed:15510212] [PMC] [WorldCat] [DOI] - ↑
Miyaji, T., Echigo, N., Hiasa, M., Senoh, S., Omote, H., & Moriyama, Y. (2008).
Identification of a vesicular aspartate transporter. Proceedings of the National Academy of Sciences of the United States of America, 105(33), 11720-4. [PubMed:18695252] [PMC] [WorldCat] [DOI] - ↑
Herring, B.E., Silm, K., Edwards, R.H., & Nicoll, R.A. (2015).
Is Aspartate an Excitatory Neurotransmitter? The Journal of neuroscience : the official journal of the Society for Neuroscience, 35(28), 10168-71. [PubMed:26180193] [PMC] [WorldCat] [DOI] - ↑
Takamori, S., Malherbe, P., Broger, C., & Jahn, R. (2002).
Molecular cloning and functional characterization of human vesicular glutamate transporter 3. EMBO reports, 3(8), 798-803. [PubMed:12151341] [PMC] [WorldCat] [DOI] - ↑
Voglmaier, S.M., Kam, K., Yang, H., Fortin, D.L., Hua, Z., Nicoll, R.A., & Edwards, R.H. (2006).
Distinct endocytic pathways control the rate and extent of synaptic vesicle protein recycling. Neuron, 51(1), 71-84. [PubMed:16815333] [WorldCat] [DOI] - ↑
Fremeau, R.T., Voglmaier, S., Seal, R.P., & Edwards, R.H. (2004).
VGLUTs define subsets of excitatory neurons and suggest novel roles for glutamate. Trends in neurosciences, 27(2), 98-103. [PubMed:15102489] [WorldCat] [DOI] - ↑ 12.0 12.1 12.2 12.3 Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ 18.0 18.1 Resource not found in PubMed.
- ↑ 19.0 19.1 Resource not found in PubMed.
- ↑ 20.0 20.1 Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ 22.0 22.1 Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.