「水道周囲灰白質」の版間の差分
細編集の要約なし |
細編集の要約なし |
||
| (3人の利用者による、間の24版が非表示) | |||
| 1行目: | 1行目: | ||
<div align="right"> | |||
<font size="+1">[http://researchmap.jp/koyamay 小山 純正]</font><br> | |||
''福島大学 共生システム理工学類''<br> | |||
DOI:<selfdoi /> 原稿受付日:2013年3月4日 原稿完成日:2016年6月11日<br> | |||
担当編集委員:[http://researchmap.jp/keijitanaka 田中 啓治](独立行政法人理化学研究所 脳科学総合研究センター)<br> | |||
</div> | |||
英語名:periaqueductal gray 独:periaquäduktales Grau 仏:substance grise périaqueducale | |||
英語略名:PAG | |||
同義語:中脳中心灰白質 | |||
{{box|text= | |||
水道周囲灰白質(PAG)は、[[中脳水道]]の周囲に広がる細胞集団で、[[大脳辺縁系]]や[[視床下部]]などから[[情動]]やそれに伴う[[自律神経性]]の入力を、[[脳幹]]や[[脊髄]]からは[[感覚性]]入力を受け、これらの情報を統合して、適切な行動や自律神経系活動の発現に関与する。 | |||
}} | |||
==構造== | |||
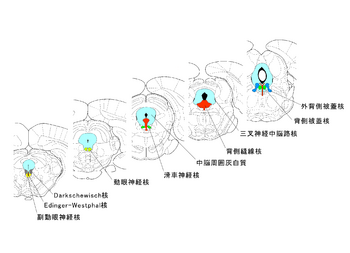
[[Image:Yoshimasakoyama_Fig_1.png|thumb|right|350px|'''図1.水道周囲灰白質の概観図'''<br>[[wikipedia:ja:ラット|ラット]]脳の前額断面図の吻側(左下)から尾側(右上)に水道周囲灰白質とその周辺の諸核を示す]] | |||
== | ===構成=== | ||
[[第三脳室]]と[[第四脳室]]を結ぶ中脳水道を取り巻く細胞集団<ref name=ref2>'''佐野豊'''<br>神経科学 形態学的基礎 Ⅱ脊髄・脳幹 p.763-777<br>''金芳堂'':1999</ref> 。 | |||
大脳辺縁系( | 内側、外側、背側に分けられ、種によってはさらに細分される。明確な境界はないが、前後軸にそったカラム状の機能単位が存在する。一方、PAGの吻側の被蓋領域には、正中腹側部に、[[Darkschewisch核]]、[[動眼神経副核]]、[[Edinger-Westphal核]]、さらに[[動眼神経核]]、[[滑車神経核]]など、[[眼球運動]]や[[瞳孔反射]]に関連するニューロン群が分布する。その尾側には[[セロトニン]]作動性ニューロンを豊富に含む[[背側縫線核]]が、腹外側部には[[アセチルコリン]]作動性ニューロンの局在する[[外背側被蓋核]]が拡がる。背側縫線核、外背側被蓋核は、構造的には中脳水道周囲に位置しPAGに含まれるが、明確な細胞集団を形成し、PAGとは異なる細胞群として扱われることが多い。これらの詳細については、「縫線核」「睡眠制御の神経回路」などを参照して欲しい。 | ||
=== 線維連絡 === | |||
====入力==== | |||
大脳辺縁系([[海馬]]、[[扁桃体]])、視床下部、[[不確帯]]、[[分界条床核]]、[[脚傍核]]などから、情動やそれに伴う自律神経性の入力を受ける<ref name=ref2 />。特に情動の発現に関連する大脳辺縁系と密接な線維連絡がある。[[上丘]]、[[脳幹網様体]]、[[三叉神経脊髄路核]]、[[脊髄]]などからは、自律神経性入力に加え、[[痛覚]]や[[体性感覚]]などの感覚性入力を受ける。[[wikipedia:ja:ラット|ラット]]、[[wikipedia:ja:ウサギ|ウサギ]]、[[wikipedia:ja:ネコ|ネコ]]では、[[一次運動野]]から運動情報の入力を受ける。[[wikipedia:ja:サル|サル]]では、[[前運動野]]/[[補足運動野]]([[6野]])、[[前頭眼野]]([[8野]])、[[前頭前野]]([[9野]])、[[前頭極]]([[10野]])からの入力を受ける。 | |||
興奮性入力としては、[[グルタミン酸]]作動性ニューロンが主であるが、視床下部の[[結節乳頭核]]からは[[ヒスタミン]]作動性、視床下部外側部からは[[オレキシン]]作動性ニューロンが投射する。脳幹網様体からは、[[青斑核]]を始め、[[延髄腹外側部]]([[ノルアドレナリン#主な投射系|A1]])、[[延髄背側部]]([[ノルアドレナリン#主な投射系|A2]])、[[橋腹外側部]]([[ノルアドレナリン#主な投射系|A5]])から[[ノルアドレナリン]]作動性入力を、[[延髄腹外側部]]([[アドレナリン#主な投射系と機能|C1]])、[[延髄背側部]]([[アドレナリン#主な投射系と機能|C2]])から[[アドレナリン]]作動性入力を受ける。また、橋、延髄の縫線核群からはセロトニン作動性入力を、外背側被蓋核や脚橋被蓋核からアセチルコリン作動性入力を受ける。 | |||
=== | ====出力==== | ||
視床下部、不確帯、脳幹網様体、上丘、[[外側脚傍核]]、縫線核群、脊髄などに投射する。これらの領域との結合はいずれも双方向性であり、これらの領域から受け取るさまざまな情報を統合して、適切な行動や自律神経系活動を発現させるための情報を送り返している。 | |||
<br> | === おもな神経伝達物質=== | ||
PAGのニューロンは、主な興奮性伝達物質としてグルタミン酸、抑制性伝達物質として[[GABA]]、[[グリシン]]をもつ。表1に示すように、さまざまなペプタイドを含有するニューロンと、その受容体を発現するニューロンが分布する<ref>'''遠山正彌 編'''<br>分子脳・神経機能解剖学 3章 脳の構造と化学的神経回路 B延髄・橋・中脳 p.59-113<br>''金芳堂'':2004</ref>。 | |||
{| | {|cellspacing="1" cellpadding="1" border="1" | ||
|+'''表1.水道周囲灰白質に存在するペプタイド''' | |||
|- | |- | ||
| style="background-color:#d3d3d3; text-align:center" | 物質名 | | style="background-color:#d3d3d3; text-align:center" | 物質名 | ||
| 35行目: | 45行目: | ||
| style="background-color:#d3d3d3; text-align:center" | 受容体 | | style="background-color:#d3d3d3; text-align:center" | 受容体 | ||
|- | |- | ||
| ソマトスタチン | | [[ソマトスタチン]] | ||
| style="text-align:center" | SOM | | style="text-align:center" | SOM | ||
| style="text-align:center" | + | | style="text-align:center" | + | ||
| style="text-align:center" | + | | style="text-align:center" | + | ||
| | | | ||
|- | |- | ||
| サブスタンスP | | [[サブスタンスP]] | ||
| style="text-align:center" | SP | | style="text-align:center" | SP | ||
| style="text-align:center" | + | | style="text-align:center" | + | ||
| style="text-align:center" | + | | style="text-align:center" | + | ||
| style="text-align:center" | +(NK1) | | style="text-align:center" | +([[NK1]]) | ||
|- | |- | ||
| エンケファリン | | [[エンケファリン]] | ||
| style="text-align:center" | Enk | | style="text-align:center" | Enk | ||
| style="text-align:center" | + | | style="text-align:center" | + | ||
| style="text-align:center" | + | | style="text-align:center" | + | ||
| style="text-align:center" | +(μ) | | style="text-align:center" | +([[μ]]) | ||
|- | |- | ||
| ダイノルフィン | | [[ダイノルフィン]] | ||
| style="text-align:center" | Dyn | | style="text-align:center" | Dyn | ||
| style="text-align:center" | + | | style="text-align:center" | + | ||
| style="text-align:center" | + | | style="text-align:center" | + | ||
| style="text-align:center" | +(κ) | | style="text-align:center" | +([[κ]]) | ||
|- | |- | ||
| コレシストキニン | | [[コレシストキニン]] | ||
| style="text-align:center" | CCK | | style="text-align:center" | CCK | ||
| style="text-align:center" | + | | style="text-align:center" | + | ||
| style="text-align:center" | + | | style="text-align:center" | + | ||
| style="text-align:center" | +(CCK-A) | | style="text-align:center" | +([[CCK-A]]) | ||
|- | |- | ||
| ニューロペプタイドY | | [[ニューロペプタイドY]] | ||
| style="text-align:center" | NPY | | style="text-align:center" | NPY | ||
| | | | ||
| style="text-align:center" | + | | style="text-align:center" | + | ||
| style="text-align:center" | +(Y2) | | style="text-align:center" | +([[Y2]]) | ||
|- | |- | ||
| ニューロテンシン | | [[ニューロテンシン]] | ||
| style="text-align:center" | NT | | style="text-align:center" | NT | ||
| style="text-align:center" | + | | style="text-align:center" | + | ||
| 77行目: | 87行目: | ||
| style="text-align:center" | + | | style="text-align:center" | + | ||
|- | |- | ||
| カルシトニン遺伝子関連ペプチド | | [[カルシトニン遺伝子関連ペプチド]] | ||
| style="text-align:center" | CGRP | | style="text-align:center" | CGRP | ||
| style="text-align:center" | - | | style="text-align:center" | - | ||
| 83行目: | 93行目: | ||
| | | | ||
|- | |- | ||
| γメラニン細胞刺激ホルモン | | [[γメラニン細胞刺激ホルモン]] | ||
| style="text-align:center" | γMSH | | style="text-align:center" | γMSH | ||
| style="text-align:center" | - | | style="text-align:center" | - | ||
| 89行目: | 99行目: | ||
| | | | ||
|- | |- | ||
| コルチコトロピン放出ホルモン | | [[コルチコトロピン放出ホルモン]] | ||
| style="text-align:center" | CRF | | style="text-align:center" | CRF | ||
| style="text-align:center" | + | | style="text-align:center" | + | ||
| style="text-align:center" | + | | style="text-align:center" | + | ||
| style="text-align:center" | +(CRF1) | | style="text-align:center" | +([[CRF1]]) | ||
|- | |- | ||
| ガラニン放出ペプタイド | | [[ガラニン放出ペプタイド]] | ||
| style="text-align:center" | GRP | | style="text-align:center" | GRP | ||
| style="text-align:center" | + | | style="text-align:center" | + | ||
| 101行目: | 111行目: | ||
| style="text-align:center" | + | | style="text-align:center" | + | ||
|- | |- | ||
| ニューロメジンB | | [[ニューロメジンB]] | ||
| style="text-align:center" | NMB | | style="text-align:center" | NMB | ||
| style="text-align:center" | - | | style="text-align:center" | - | ||
| 107行目: | 117行目: | ||
| style="text-align:center" | + | | style="text-align:center" | + | ||
|- | |- | ||
| ガラニン | | [[ガラニン]] | ||
| style="text-align:center" | Gal | | style="text-align:center" | Gal | ||
| style="text-align:center" | + | | style="text-align:center" | + | ||
| 113行目: | 123行目: | ||
| style="text-align:center" | + | | style="text-align:center" | + | ||
|- | |- | ||
| バソプレシン | | [[バソプレシン]] | ||
| style="text-align:center" | VP | | style="text-align:center" | VP | ||
| style="text-align:center" | - | | style="text-align:center" | - | ||
| style="text-align:center" | + | | style="text-align:center" | + | ||
| style="text-align:center" | +(V2) | | style="text-align:center" | +([[V2]]) | ||
|- | |- | ||
| オキシトシン | | [[オキシトシン]] | ||
| style="text-align:center" | Ox | | style="text-align:center" | Ox | ||
| style="text-align:center" | - | | style="text-align:center" | - | ||
| 125行目: | 135行目: | ||
| style="text-align:center" | + | | style="text-align:center" | + | ||
|- | |- | ||
| オレキシン | | [[オレキシン]] | ||
| style="text-align:center" | Orx | | style="text-align:center" | Orx | ||
| style="text-align:center" | - | | style="text-align:center" | - | ||
| style="text-align:center" | + | | style="text-align:center" | + | ||
| style="text-align:center" | +(1R, 2R) | | style="text-align:center" | +([[オレキシン#受容体|1R]], [[オレキシン#受容体|2R]]) | ||
|- | |- | ||
| 甲状腺刺激ホルモン放出ホルモン | | [[甲状腺刺激ホルモン放出ホルモン]] | ||
| style="text-align:center" | TRH | | style="text-align:center" | TRH | ||
| style="text-align:center" | + | | style="text-align:center" | + | ||
| 137行目: | 147行目: | ||
| style="text-align:center" | + | | style="text-align:center" | + | ||
|- | |- | ||
| 生殖腺刺激ホルモン放出ホルモン | | [[生殖腺刺激ホルモン放出ホルモン]] | ||
| style="text-align:center" | | | style="text-align:center" | GnRH | ||
| style="text-align:center" | - | | style="text-align:center" | - | ||
| style="text-align:center" | + | | style="text-align:center" | + | ||
| 144行目: | 154行目: | ||
|} | |} | ||
存在が確認されているペプタイドニューロンの細胞体、神経線維、[[受容体]]のサブタイプを示す。 | |||
== おもな機能 == | == おもな機能 == | ||
=== 痛覚抑制作用 === | === 痛覚抑制作用 === | ||
PAGの広範な領域の電気刺激によって痛覚抑制効果が得られる。PAGの痛覚抑制系には、PAGから[[視床]]に投射する上行性抑制系と延髄に投射する下行性抑制系がある。 | |||
上行性抑制系では、背側縫線核からのセロトニン作動性ニューロンと、その周辺の非セロトニン作動性ニューロンが、視床の腹側基底核群や髄板内核群の侵害受容ニューロンを抑制することによって痛覚抑制を引き起こす。 | |||
下行性抑制系は、背内側部(dmPAG)、腹外側部(vlPAG)から[[吻側延髄腹内側部]](rostroventromedial medulla; RVM)に投射する。主にグルタミン酸作動性であり、RVMの脊髄投射ニューロンを活性化する。 | |||
RVMには、セロトニン作動性ニューロンを含む[[大縫線核]](Raphe Magnus: RMn)、非セロトニン作動性の[[巨大細胞網様核]](nucleus gigantocellularis: nGi)、[[傍巨大細胞網様核]](nucleus paragigantocellularis: nPGi)などが存在し、これらのニューロンが[[脊髄後核]]の[[侵害受容ニューロン]]を抑制する<ref name=ref1>'''横田勝一'''<br> 鎮痛機構. 臨床医のための痛みのメカニズム 第2版 p.71-89 <br> ''南江堂'':1997</ref>。 | |||
PAGの痛覚抑制ニューロンは、PAG内のGABA作動性ニューロンの抑制を受けている。視床下部から投射する[[βエンドルフィン]]作動性ニューロン、PAG内の[[エンケファリン]]作動性ニューロンなどの[[オピオイド系]]は、このGABA作動性ニューロンを抑制することにより痛覚抑制を引き起こす<ref name=ref1 />。 | |||
[[エンドカンナビノイド]]系も、このGABA作動性ニューロンの作用(GABA放出)を抑えることにより、あるいはRVMに投射するグルタミン酸作動性ニューロンを活性化することにより痛覚抑制を引き起こす<ref><pubmed>18077685</pubmed></ref>。 | |||
ニューロテンシン作動性ニューロンは、エンドカンナビノイド系を介してGABA作動性ニューロンを抑制<ref><pubmed>19359367</pubmed></ref>、あるいはRMnに投射するグルタミン酸作動性ニューロンを直接活性化する<ref><pubmed>11287471</pubmed></ref>。サブスタンスP、コレシストキニンも、ニューロテンシンと同様のメカニズムで痛覚抑制に関与する<ref><pubmed>19494144</pubmed></ref><ref><pubmed>21525858</pubmed></ref>。 | |||
=== 情動行動 === | |||
PAGの背側および背外側部への電気刺激やグルタミン酸[[作動薬]]の投与によって、[[攻撃]](aggression)、[[防御]](defence)、[[威嚇]](rage)などの反応が誘発される。その尾側の領域の刺激によって[[逃走反応]](flighting)が、腹外側の刺激では、[[すくみ反応]](freezing)が誘発される。 | |||
情動の中枢とされる大脳辺縁系(海馬、扁桃体、[[中隔核]])から直接に、あるいは視床下部を介して入力を受ける<ref name=ref7><pubmed>11263761</pubmed></ref>。 | |||
[[扁桃体基底核群]](basal complex)からPAGへの直接の入力は防衛/威嚇反応を促進し、[[扁桃体中心核]](central amygdale)からの入力は、防御/威嚇反応を抑制する<ref name=ref8><pubmed>7633640</pubmed></ref>。扁桃体内側核(medial amygdala)は、視床下部内側部を介して、防御/威嚇反応を促進し、攻撃行動を抑制する<ref name=ref8 />。視床下部外側部からの入力は攻撃反応を促進する<ref name=ref8 />。 | |||
これらの系の活性化には、主にグルタミン酸作動性ニューロンが関与しており、背側PAGへのセロトニン入力は、[[5HT1Aレセプター]]を介して防御反応の抑制を引き起こす<ref><pubmed>1410130</pubmed></ref>。 | |||
= | また、さまざまなペプタイドニューロンも関与し、背側PAGへのサブスタンスP<ref><pubmed>14642448</pubmed></ref>、コレシストキニン<ref><pubmed>9689451</pubmed></ref>、CRF入力<ref><pubmed>17095103</pubmed></ref>は防御反応を促進する。扁桃体中心核からのμレセプターを介したオピオイド系入力は、防御/威嚇反応を抑制する<ref name=ref8 />。 | ||
1つの情動行動の発現系は、他の行動の発現系と相互抑制の関係にあり、たとえば上記のように攻撃行動と防御/威嚇反応は、PAGのレベルで拮抗関係にある。この抑制にはGABA作動性ニューロンが関与すると考えられている<ref name=ref7 />。マウスでは、PAG吻外側部への[[モルフィン]]の投与によって、生きた餌への狩猟行動(hunting)が促進し、[[育児行動]]が抑制される<ref><pubmed>16510737</pubmed></ref>。コレシストキニン(CCK)は、モルフィンの作用に拮抗的に働く<ref><pubmed>17194502</pubmed></ref>。 | |||
1つの情動行動の発現系は、他の行動の発現系と相互抑制の関係にあり、たとえば上記のように攻撃行動と防御/威嚇反応は、PAGのレベルで拮抗関係にある。この抑制にはGABA作動性ニューロンが関与すると考えられている<ref name=ref7 /> | |||
=== 自律神経系(血圧、心拍)の変動 === | === 自律神経系(血圧、心拍)の変動 === | ||
背側/背外側PAGは、攻撃、防御、威嚇行動などの発現に伴い、[[交感神経]]活動、[[wikipedia:ja:血圧|血圧]]、[[wikipedia:ja:心拍|心拍]]数の上昇を引き起こし、腹外側PAGは、すくみ反応の発現に伴い、血圧、心拍数の低下を引き起こす<ref name=ref15><pubmed>8202441</pubmed></ref>。背側/背外側PAGは視床下部背内側核(dorsomedial hypothalamic nucleus: DMH)から交感神経性の入力を受ける。背側/背外側PAGの活動による血圧上昇は、エンドカンナビノイド<ref><pubmed>21228344</pubmed></ref> 、[[アルギニンバソプレシン]]を介し<ref name=ref15 />、セロトニンによって抑制される<ref><pubmed>19303372</pubmed></ref>。[[アンギオテンシン]]<ref><pubmed>9200674</pubmed></ref>、[[エンドセリン]] <ref><pubmed>7898082</pubmed></ref>、ノルアドレナリン<ref><pubmed>16367785</pubmed></ref>もPAGに作用して血圧上昇を促進する。 | |||
背側/ | |||
=== 体温調節 === | === 体温調節 === | ||
体温調節中枢である視索前野/前視床下部(POA/AH)には、脳温の変化によって活動の変化する温度感受性ニューロンが存在し、直接、あるいは視床下部背内側核(DMH)を介してPAGに作用し、適切な体温調節反応を起こすと考えられている<ref>'''入来正躬'''<br>体温調節中枢. 体温生理学テキストp.110-117<br>文光堂:2003</ref> <ref name=ref><pubmed>15927405</pubmed></ref>。一方、DMHからの下行路に関しては、PAGを介さず直接延髄(淡蒼縫線核)に投射する系も明らかになり、議論が分かれている<ref><pubmed>24981837</pubmed></ref>。 | |||
=== 呼吸・発声=== | === 呼吸・発声=== | ||
PAGからは、[[Botzinger complex]]、[[後疑核]]([[retroambiguus nucleus]])、[[孤束核]]([[nucleus tractus solitarius]])など、延髄の[[呼吸]]ニューロン群に直接の投射があり、呼吸リズムの修飾、状況に応じたさまざまな呼吸パターンの発現に関与する。PAGのさまざまな領域をグルタミン酸作動薬で刺激すると、例えば、PAGの背内側部からは深呼吸や呼吸停止(dyspnea)、背外側部からは頻呼吸(tachypnea)、内側部からは持続性吸息(inspiratory apneusis)など、さまざまな呼吸パターンが誘発される<ref><pubmed>19020021</pubmed></ref>。 | |||
一方発声は、呼吸運動にも密接に関連し、呼吸筋・補助呼吸筋と発声筋の協調運動によって起こる。PAGの活動によって、呼吸運動から発声への切り替わりが起こる。外側PAG、腹外側PAGやその外側の中脳網様体への電気刺激によって、種特異的な、さまざまな発声パターンが誘発される<ref><pubmed> 9631474</pubmed></ref><ref name=ref26><pubmed>7945960</pubmed></ref>。発声に関しては、PAGから後疑核への投射が重要な役割を果たす<ref name=ref27><pubmed>10906701</pubmed></ref>。後疑核からは、発声筋を支配する種々の[[運動神経]]群([[三叉神経核]]、[[顔面神経核]]、[[舌下神経核]]、[[擬核]])に投射している<ref name=ref27 />。上丘、[[下丘]]、三叉神経脊髄路核などからの感覚性入力、大脳辺縁系(前帯状皮質、中隔、扁桃体)や[[大脳基底核]]、視床下部、視床正中部などの発声誘発領域からPAGへの入力は、情動に伴う発声、あるいは随意性の発声に重要な役割を果たす<ref name=ref26 />。 | |||
PAGへの伝達物質の発声に関する作用としては、グルタミン酸の促進性作用、GABAの抑制性作用に加え、アセチルコリン、ヒスタミンは促進性に、グリシン、オピエートは抑制性に作用する<ref name=ref26 />。 | |||
=== 性行動 === | === 性行動 === | ||
PAGは、[[内側視索前野]]([[medial preoptic area]]: [[MPOA]])や視床下部からの投射を受け、オス、メスの性行動の発現に重要な役割を果たす。 | |||
オスでは、MPOAからPAGへの経路が[[wikipedia:ja:陰茎|陰茎]]勃起に関与している<ref><pubmed>15337249</pubmed></ref>。[[マウンティング]]に始まる一連の[[性行動]]の発現には、MPOAから腹側被蓋、[[黒質]]、[[中脳網様核]]などへの経路が関与すると考えられている<ref><pubmed>1946721</pubmed></ref>。 | |||
メスでは[[視床下部腹内側核]](VMH)から背側PAGへの経路が[[ロードシス]](腰を突き上げてオスを迎え入れる姿勢)の促進系として働く<ref><pubmed>469715</pubmed></ref>。外側中隔から腹側PAGには、ロードシスの抑制系が働く<ref><pubmed>11170006</pubmed></ref>。性行動の発現に関連するPAGからの出力は、[[延髄巨大細胞網様核]]([[nucleus gigantocellularis]]: [[nGi]])や[[傍巨大細胞網様核]]([[nucleus paragigantocellularis]]: [[nPGi]])、後疑核(retroambiguus nucleus)に投射する<ref name=ref27><pubmed>10906701</pubmed></ref> <ref><pubmed>10087093</pubmed></ref>。背側PAGには末梢からの感覚情報も入力し、ここでMPOA/VMHからの促進性入力と感覚入力との統合が行われる。 | |||
PAGからnPGiへの投射ニューロンの多くは、[[ステロイド]] ホルモン([[エストロゲン]]、[[アンドロゲン]])の[[レセプター]]を発現しており、この系の活性化は、ステロイドホルモンに強く依存する<ref><pubmed>11536188</pubmed></ref>。 | |||
PAG背側部へのLHRH、[[プロラクチン]]、サブスタンスP入力はロードシスに促進性に作用する<ref><pubmed>6339979</pubmed></ref><ref><pubmed>6828874</pubmed></ref><ref><pubmed>2441308</pubmed></ref>。CRF、βエンドルフィンは、LHRHの作用に拮抗することにより、抑制性に作用する<ref><pubmed>6209590</pubmed></ref><ref><pubmed>2860950</pubmed></ref>。 | |||
=== 排尿 === | === 排尿 === | ||
PAG尾側の腹外側部(vlPAG)は、腰仙髄を介して[[wikipedia:ja:膀胱|膀胱]]からの感覚性入力を受け、橋の排尿中枢([[バーリントン核]])に直接投射する<ref><pubmed>7499530</pubmed></ref>。vlPAGへの電気刺激や興奮性アミノ酸の投与によって排尿反応が起こり<ref><pubmed>11113354</pubmed></ref>、GABA作動薬([[ムシモル]])によって排尿が抑制されることから<ref><pubmed>21486804</pubmed></ref>、vlPAGが排尿の促進野と考えられる。一方、PAG吻側の背外側部(dlPAG)は、GABA作動性ニューロンを介して、排尿中枢に抑制系として作用する<ref><pubmed>18385467</pubmed></ref>。 | |||
前頭葉や扁桃体からPAGへの入力は、排尿抑制系として作用する。このシステムは、行動発現時に排尿を抑制することにより、必要な行動をよりスムースに発現させる役割を持つ<ref><pubmed>20025036</pubmed></ref>。 | 前頭葉や扁桃体からPAGへの入力は、排尿抑制系として作用する。このシステムは、行動発現時に排尿を抑制することにより、必要な行動をよりスムースに発現させる役割を持つ<ref><pubmed>20025036</pubmed></ref>。 | ||
=== 睡眠・覚醒 === | === 睡眠・覚醒 === | ||
レム睡眠の発現は、橋被蓋領域のレム睡眠中枢に存在するアセチルコリン作動性ニューロンとグルタミン酸作動性ニューロンによって調節されているが、PAG腹外側部のGABA作動性ニューロンはこのレム睡眠中枢に投射し、覚醒時に活動してレム睡眠の発現を抑制する<ref><pubmed>22083642</pubmed></ref>]。 | |||
== 関連項目 == | == 関連項目 == | ||
*[[動眼神経核]] | *[[動眼神経核]] | ||
*[[視床下部]] | *[[視床下部]] | ||
| 213行目: | 226行目: | ||
*[[呼吸制御の神経回路]] | *[[呼吸制御の神経回路]] | ||
*[[脳幹網様体賦活系]] | *[[脳幹網様体賦活系]] | ||
*[[睡眠制御の神経回路]] | |||
== 参考文献 == | == 参考文献 == | ||
<references /> | <references /> | ||
2016年6月15日 (水) 00:39時点における最新版
小山 純正
福島大学 共生システム理工学類
DOI:10.14931/bsd.1303 原稿受付日:2013年3月4日 原稿完成日:2016年6月11日
担当編集委員:田中 啓治(独立行政法人理化学研究所 脳科学総合研究センター)
英語名:periaqueductal gray 独:periaquäduktales Grau 仏:substance grise périaqueducale
英語略名:PAG
同義語:中脳中心灰白質
水道周囲灰白質(PAG)は、中脳水道の周囲に広がる細胞集団で、大脳辺縁系や視床下部などから情動やそれに伴う自律神経性の入力を、脳幹や脊髄からは感覚性入力を受け、これらの情報を統合して、適切な行動や自律神経系活動の発現に関与する。
構造
構成
第三脳室と第四脳室を結ぶ中脳水道を取り巻く細胞集団[1] 。
内側、外側、背側に分けられ、種によってはさらに細分される。明確な境界はないが、前後軸にそったカラム状の機能単位が存在する。一方、PAGの吻側の被蓋領域には、正中腹側部に、Darkschewisch核、動眼神経副核、Edinger-Westphal核、さらに動眼神経核、滑車神経核など、眼球運動や瞳孔反射に関連するニューロン群が分布する。その尾側にはセロトニン作動性ニューロンを豊富に含む背側縫線核が、腹外側部にはアセチルコリン作動性ニューロンの局在する外背側被蓋核が拡がる。背側縫線核、外背側被蓋核は、構造的には中脳水道周囲に位置しPAGに含まれるが、明確な細胞集団を形成し、PAGとは異なる細胞群として扱われることが多い。これらの詳細については、「縫線核」「睡眠制御の神経回路」などを参照して欲しい。
線維連絡
入力
大脳辺縁系(海馬、扁桃体)、視床下部、不確帯、分界条床核、脚傍核などから、情動やそれに伴う自律神経性の入力を受ける[1]。特に情動の発現に関連する大脳辺縁系と密接な線維連絡がある。上丘、脳幹網様体、三叉神経脊髄路核、脊髄などからは、自律神経性入力に加え、痛覚や体性感覚などの感覚性入力を受ける。ラット、ウサギ、ネコでは、一次運動野から運動情報の入力を受ける。サルでは、前運動野/補足運動野(6野)、前頭眼野(8野)、前頭前野(9野)、前頭極(10野)からの入力を受ける。
興奮性入力としては、グルタミン酸作動性ニューロンが主であるが、視床下部の結節乳頭核からはヒスタミン作動性、視床下部外側部からはオレキシン作動性ニューロンが投射する。脳幹網様体からは、青斑核を始め、延髄腹外側部(A1)、延髄背側部(A2)、橋腹外側部(A5)からノルアドレナリン作動性入力を、延髄腹外側部(C1)、延髄背側部(C2)からアドレナリン作動性入力を受ける。また、橋、延髄の縫線核群からはセロトニン作動性入力を、外背側被蓋核や脚橋被蓋核からアセチルコリン作動性入力を受ける。
出力
視床下部、不確帯、脳幹網様体、上丘、外側脚傍核、縫線核群、脊髄などに投射する。これらの領域との結合はいずれも双方向性であり、これらの領域から受け取るさまざまな情報を統合して、適切な行動や自律神経系活動を発現させるための情報を送り返している。
おもな神経伝達物質
PAGのニューロンは、主な興奮性伝達物質としてグルタミン酸、抑制性伝達物質としてGABA、グリシンをもつ。表1に示すように、さまざまなペプタイドを含有するニューロンと、その受容体を発現するニューロンが分布する[2]。
| 物質名 | 略号 | 細胞体 | 神経線維 | 受容体 |
| ソマトスタチン | SOM | + | + | |
| サブスタンスP | SP | + | + | +(NK1) |
| エンケファリン | Enk | + | + | +(μ) |
| ダイノルフィン | Dyn | + | + | +(κ) |
| コレシストキニン | CCK | + | + | +(CCK-A) |
| ニューロペプタイドY | NPY | + | +(Y2) | |
| ニューロテンシン | NT | + | + | + |
| カルシトニン遺伝子関連ペプチド | CGRP | - | + | |
| γメラニン細胞刺激ホルモン | γMSH | - | + | |
| コルチコトロピン放出ホルモン | CRF | + | + | +(CRF1) |
| ガラニン放出ペプタイド | GRP | + | + | |
| ニューロメジンB | NMB | - | + | |
| ガラニン | Gal | + | + | + |
| バソプレシン | VP | - | + | +(V2) |
| オキシトシン | Ox | - | + | + |
| オレキシン | Orx | - | + | +(1R, 2R) |
| 甲状腺刺激ホルモン放出ホルモン | TRH | + | + | + |
| 生殖腺刺激ホルモン放出ホルモン | GnRH | - | + |
存在が確認されているペプタイドニューロンの細胞体、神経線維、受容体のサブタイプを示す。
おもな機能
痛覚抑制作用
PAGの広範な領域の電気刺激によって痛覚抑制効果が得られる。PAGの痛覚抑制系には、PAGから視床に投射する上行性抑制系と延髄に投射する下行性抑制系がある。
上行性抑制系では、背側縫線核からのセロトニン作動性ニューロンと、その周辺の非セロトニン作動性ニューロンが、視床の腹側基底核群や髄板内核群の侵害受容ニューロンを抑制することによって痛覚抑制を引き起こす。
下行性抑制系は、背内側部(dmPAG)、腹外側部(vlPAG)から吻側延髄腹内側部(rostroventromedial medulla; RVM)に投射する。主にグルタミン酸作動性であり、RVMの脊髄投射ニューロンを活性化する。
RVMには、セロトニン作動性ニューロンを含む大縫線核(Raphe Magnus: RMn)、非セロトニン作動性の巨大細胞網様核(nucleus gigantocellularis: nGi)、傍巨大細胞網様核(nucleus paragigantocellularis: nPGi)などが存在し、これらのニューロンが脊髄後核の侵害受容ニューロンを抑制する[3]。
PAGの痛覚抑制ニューロンは、PAG内のGABA作動性ニューロンの抑制を受けている。視床下部から投射するβエンドルフィン作動性ニューロン、PAG内のエンケファリン作動性ニューロンなどのオピオイド系は、このGABA作動性ニューロンを抑制することにより痛覚抑制を引き起こす[3]。
エンドカンナビノイド系も、このGABA作動性ニューロンの作用(GABA放出)を抑えることにより、あるいはRVMに投射するグルタミン酸作動性ニューロンを活性化することにより痛覚抑制を引き起こす[4]。
ニューロテンシン作動性ニューロンは、エンドカンナビノイド系を介してGABA作動性ニューロンを抑制[5]、あるいはRMnに投射するグルタミン酸作動性ニューロンを直接活性化する[6]。サブスタンスP、コレシストキニンも、ニューロテンシンと同様のメカニズムで痛覚抑制に関与する[7][8]。
情動行動
PAGの背側および背外側部への電気刺激やグルタミン酸作動薬の投与によって、攻撃(aggression)、防御(defence)、威嚇(rage)などの反応が誘発される。その尾側の領域の刺激によって逃走反応(flighting)が、腹外側の刺激では、すくみ反応(freezing)が誘発される。
情動の中枢とされる大脳辺縁系(海馬、扁桃体、中隔核)から直接に、あるいは視床下部を介して入力を受ける[9]。
扁桃体基底核群(basal complex)からPAGへの直接の入力は防衛/威嚇反応を促進し、扁桃体中心核(central amygdale)からの入力は、防御/威嚇反応を抑制する[10]。扁桃体内側核(medial amygdala)は、視床下部内側部を介して、防御/威嚇反応を促進し、攻撃行動を抑制する[10]。視床下部外側部からの入力は攻撃反応を促進する[10]。
これらの系の活性化には、主にグルタミン酸作動性ニューロンが関与しており、背側PAGへのセロトニン入力は、5HT1Aレセプターを介して防御反応の抑制を引き起こす[11]。
また、さまざまなペプタイドニューロンも関与し、背側PAGへのサブスタンスP[12]、コレシストキニン[13]、CRF入力[14]は防御反応を促進する。扁桃体中心核からのμレセプターを介したオピオイド系入力は、防御/威嚇反応を抑制する[10]。
1つの情動行動の発現系は、他の行動の発現系と相互抑制の関係にあり、たとえば上記のように攻撃行動と防御/威嚇反応は、PAGのレベルで拮抗関係にある。この抑制にはGABA作動性ニューロンが関与すると考えられている[9]。マウスでは、PAG吻外側部へのモルフィンの投与によって、生きた餌への狩猟行動(hunting)が促進し、育児行動が抑制される[15]。コレシストキニン(CCK)は、モルフィンの作用に拮抗的に働く[16]。
自律神経系(血圧、心拍)の変動
背側/背外側PAGは、攻撃、防御、威嚇行動などの発現に伴い、交感神経活動、血圧、心拍数の上昇を引き起こし、腹外側PAGは、すくみ反応の発現に伴い、血圧、心拍数の低下を引き起こす[17]。背側/背外側PAGは視床下部背内側核(dorsomedial hypothalamic nucleus: DMH)から交感神経性の入力を受ける。背側/背外側PAGの活動による血圧上昇は、エンドカンナビノイド[18] 、アルギニンバソプレシンを介し[17]、セロトニンによって抑制される[19]。アンギオテンシン[20]、エンドセリン [21]、ノルアドレナリン[22]もPAGに作用して血圧上昇を促進する。
体温調節
体温調節中枢である視索前野/前視床下部(POA/AH)には、脳温の変化によって活動の変化する温度感受性ニューロンが存在し、直接、あるいは視床下部背内側核(DMH)を介してPAGに作用し、適切な体温調節反応を起こすと考えられている[23] [24]。一方、DMHからの下行路に関しては、PAGを介さず直接延髄(淡蒼縫線核)に投射する系も明らかになり、議論が分かれている[25]。
呼吸・発声
PAGからは、Botzinger complex、後疑核(retroambiguus nucleus)、孤束核(nucleus tractus solitarius)など、延髄の呼吸ニューロン群に直接の投射があり、呼吸リズムの修飾、状況に応じたさまざまな呼吸パターンの発現に関与する。PAGのさまざまな領域をグルタミン酸作動薬で刺激すると、例えば、PAGの背内側部からは深呼吸や呼吸停止(dyspnea)、背外側部からは頻呼吸(tachypnea)、内側部からは持続性吸息(inspiratory apneusis)など、さまざまな呼吸パターンが誘発される[26]。
一方発声は、呼吸運動にも密接に関連し、呼吸筋・補助呼吸筋と発声筋の協調運動によって起こる。PAGの活動によって、呼吸運動から発声への切り替わりが起こる。外側PAG、腹外側PAGやその外側の中脳網様体への電気刺激によって、種特異的な、さまざまな発声パターンが誘発される[27][28]。発声に関しては、PAGから後疑核への投射が重要な役割を果たす[29]。後疑核からは、発声筋を支配する種々の運動神経群(三叉神経核、顔面神経核、舌下神経核、擬核)に投射している[29]。上丘、下丘、三叉神経脊髄路核などからの感覚性入力、大脳辺縁系(前帯状皮質、中隔、扁桃体)や大脳基底核、視床下部、視床正中部などの発声誘発領域からPAGへの入力は、情動に伴う発声、あるいは随意性の発声に重要な役割を果たす[28]。
PAGへの伝達物質の発声に関する作用としては、グルタミン酸の促進性作用、GABAの抑制性作用に加え、アセチルコリン、ヒスタミンは促進性に、グリシン、オピエートは抑制性に作用する[28]。
性行動
PAGは、内側視索前野(medial preoptic area: MPOA)や視床下部からの投射を受け、オス、メスの性行動の発現に重要な役割を果たす。
オスでは、MPOAからPAGへの経路が陰茎勃起に関与している[30]。マウンティングに始まる一連の性行動の発現には、MPOAから腹側被蓋、黒質、中脳網様核などへの経路が関与すると考えられている[31]。
メスでは視床下部腹内側核(VMH)から背側PAGへの経路がロードシス(腰を突き上げてオスを迎え入れる姿勢)の促進系として働く[32]。外側中隔から腹側PAGには、ロードシスの抑制系が働く[33]。性行動の発現に関連するPAGからの出力は、延髄巨大細胞網様核(nucleus gigantocellularis: nGi)や傍巨大細胞網様核(nucleus paragigantocellularis: nPGi)、後疑核(retroambiguus nucleus)に投射する[29] [34]。背側PAGには末梢からの感覚情報も入力し、ここでMPOA/VMHからの促進性入力と感覚入力との統合が行われる。
PAGからnPGiへの投射ニューロンの多くは、ステロイド ホルモン(エストロゲン、アンドロゲン)のレセプターを発現しており、この系の活性化は、ステロイドホルモンに強く依存する[35]。
PAG背側部へのLHRH、プロラクチン、サブスタンスP入力はロードシスに促進性に作用する[36][37][38]。CRF、βエンドルフィンは、LHRHの作用に拮抗することにより、抑制性に作用する[39][40]。
排尿
PAG尾側の腹外側部(vlPAG)は、腰仙髄を介して膀胱からの感覚性入力を受け、橋の排尿中枢(バーリントン核)に直接投射する[41]。vlPAGへの電気刺激や興奮性アミノ酸の投与によって排尿反応が起こり[42]、GABA作動薬(ムシモル)によって排尿が抑制されることから[43]、vlPAGが排尿の促進野と考えられる。一方、PAG吻側の背外側部(dlPAG)は、GABA作動性ニューロンを介して、排尿中枢に抑制系として作用する[44]。
前頭葉や扁桃体からPAGへの入力は、排尿抑制系として作用する。このシステムは、行動発現時に排尿を抑制することにより、必要な行動をよりスムースに発現させる役割を持つ[45]。
睡眠・覚醒
レム睡眠の発現は、橋被蓋領域のレム睡眠中枢に存在するアセチルコリン作動性ニューロンとグルタミン酸作動性ニューロンによって調節されているが、PAG腹外側部のGABA作動性ニューロンはこのレム睡眠中枢に投射し、覚醒時に活動してレム睡眠の発現を抑制する[46]]。
関連項目
参考文献
- ↑ 1.0 1.1 佐野豊
神経科学 形態学的基礎 Ⅱ脊髄・脳幹 p.763-777
金芳堂:1999 - ↑ 遠山正彌 編
分子脳・神経機能解剖学 3章 脳の構造と化学的神経回路 B延髄・橋・中脳 p.59-113
金芳堂:2004 - ↑ 3.0 3.1 横田勝一
鎮痛機構. 臨床医のための痛みのメカニズム 第2版 p.71-89
南江堂:1997 - ↑
Starowicz, K., Maione, S., Cristino, L., Palazzo, E., Marabese, I., Rossi, F., ..., & Di Marzo, V. (2007).
Tonic endovanilloid facilitation of glutamate release in brainstem descending antinociceptive pathways. The Journal of neuroscience : the official journal of the Society for Neuroscience, 27(50), 13739-49. [PubMed:18077685] [PMC] [WorldCat] [DOI] - ↑
Mitchell, V.A., Kawahara, H., & Vaughan, C.W. (2009).
Neurotensin inhibition of GABAergic transmission via mGluR-induced endocannabinoid signalling in rat periaqueductal grey. The Journal of physiology, 587(Pt 11), 2511-20. [PubMed:19359367] [PMC] [WorldCat] [DOI] - ↑
Li, A.H., Hwang, H.M., Tan, P.P., Wu, T., & Wang, H.L. (2001).
Neurotensin excites periaqueductal gray neurons projecting to the rostral ventromedial medulla. Journal of neurophysiology, 85(4), 1479-88. [PubMed:11287471] [WorldCat] [DOI] - ↑
Drew, G.M., Lau, B.K., & Vaughan, C.W. (2009).
Substance P drives endocannabinoid-mediated disinhibition in a midbrain descending analgesic pathway. The Journal of neuroscience : the official journal of the Society for Neuroscience, 29(22), 7220-9. [PubMed:19494144] [PMC] [WorldCat] [DOI] - ↑
Mitchell, V.A., Jeong, H.J., Drew, G.M., & Vaughan, C.W. (2011).
Cholecystokinin exerts an effect via the endocannabinoid system to inhibit GABAergic transmission in midbrain periaqueductal gray. Neuropsychopharmacology : official publication of the American College of Neuropsychopharmacology, 36(9), 1801-10. [PubMed:21525858] [PMC] [WorldCat] [DOI] - ↑ 9.0 9.1
Gregg, T.R., & Siegel, A. (2001).
Brain structures and neurotransmitters regulating aggression in cats: implications for human aggression. Progress in neuro-psychopharmacology & biological psychiatry, 25(1), 91-140. [PubMed:11263761] [WorldCat] [DOI] - ↑ 10.0 10.1 10.2 10.3
Siegel, A., & Schubert, K. (1995).
Neurotransmitters regulating feline aggressive behavior. Reviews in the neurosciences, 6(1), 47-61. [PubMed:7633640] [WorldCat] - ↑
Beckett, S.R., Lawrence, A.J., Marsden, C.A., & Marshall, P.W. (1992).
Attenuation of chemically induced defence response by 5-HT1 receptor agonists administered into the periaqueductal gray. Psychopharmacology, 108(1-2), 110-4. [PubMed:1410130] [WorldCat] [DOI] - ↑
Gregg, T.R., & Siegel, A. (2003).
Differential effects of NK1 receptors in the midbrain periaqueductal gray upon defensive rage and predatory attack in the cat. Brain research, 994(1), 55-66. [PubMed:14642448] [WorldCat] [DOI] - ↑
Luo, B., Cheu, J.W., & Siegel, A. (1998).
Cholecystokinin B receptors in the periaqueductal gray potentiate defensive rage behavior elicited from the medial hypothalamus of the cat. Brain research, 796(1-2), 27-37. [PubMed:9689451] [WorldCat] [DOI] - ↑
Carvalho-Netto, E.F., Litvin, Y., Nunes-de-Souza, R.L., Blanchard, D.C., & Blanchard, R.J. (2007).
Effects of intra-PAG infusion of ovine CRF on defensive behaviors in Swiss-Webster mice. Behavioural brain research, 176(2), 222-9. [PubMed:17095103] [PMC] [WorldCat] [DOI] - ↑
Sukikara, M.H., Mota-Ortiz, S.R., Baldo, M.V., Felício, L.F., & Canteras, N.S. (2006).
A role for the periaqueductal gray in switching adaptive behavioral responses. The Journal of neuroscience : the official journal of the Society for Neuroscience, 26(9), 2583-9. [PubMed:16510737] [PMC] [WorldCat] [DOI] - ↑
Miranda-Paiva, C.M., Canteras, N.S., Sukikara, M.H., Nasello, A.G., Mackowiak, I.I., & Felicio, L.F. (2007).
Periaqueductal gray cholecystokinin infusions block morphine-induced disruption of maternal behavior. Peptides, 28(3), 657-62. [PubMed:17194502] [WorldCat] [DOI] - ↑ 17.0 17.1
Rossi, F., Maione, S., & Berrino, L. (1994).
Periaqueductal gray area and cardiovascular function. Pharmacological research, 29(1), 27-36. [PubMed:8202441] [WorldCat] [DOI] - ↑
Dean, C. (2011).
Endocannabinoid modulation of sympathetic and cardiovascular responses to acute stress in the periaqueductal gray of the rat. American journal of physiology. Regulatory, integrative and comparative physiology, 300(3), R771-9. [PubMed:21228344] [WorldCat] [DOI] - ↑
Villela, D.C., da Silva, L.G., & Fontes, M.A. (2009).
Activation of 5-HT receptors in the periaqueductal gray attenuates the tachycardia evoked from dorsomedial hypothalamus. Autonomic neuroscience : basic & clinical, 148(1-2), 36-43. [PubMed:19303372] [WorldCat] [DOI] - ↑
D'Amico, M., Di Filippo, C., Berrino, L., & Rossi, F. (1997).
AT1 receptors mediate pressor responses induced by angiotensin II in the periaqueductal gray area of rats. Life sciences, 61(1), PL17-20. [PubMed:9200674] [WorldCat] [DOI] - ↑
D'Amico, M., Berrino, L., Filippelli, A., Maione, S., & Rossi, F. (1994).
Relation between L-arginine-nitric oxide pathway and endothelin-1 effects in periaqueductal gray area of rats. Journal of cardiovascular pharmacology, 24(6), 974-8. [PubMed:7898082] [WorldCat] [DOI] - ↑
Pelosi, G.G., & Corrêa, F.M. (2005).
Cardiovascular effects of noradrenaline microinjected into the dorsal periaqueductal gray area of unanaesthetized rats. The European journal of neuroscience, 22(12), 3188-94. [PubMed:16367785] [WorldCat] [DOI] - ↑ 入来正躬
体温調節中枢. 体温生理学テキストp.110-117
文光堂:2003 - ↑
Yoshida, K., Konishi, M., Nagashima, K., Saper, C.B., & Kanosue, K. (2005).
Fos activation in hypothalamic neurons during cold or warm exposure: projections to periaqueductal gray matter. Neuroscience, 133(4), 1039-46. [PubMed:15927405] [WorldCat] [DOI] - ↑
Kataoka, N., Hioki, H., Kaneko, T., & Nakamura, K. (2014).
Psychological stress activates a dorsomedial hypothalamus-medullary raphe circuit driving brown adipose tissue thermogenesis and hyperthermia. Cell metabolism, 20(2), 346-58. [PubMed:24981837] [WorldCat] [DOI] - ↑
Subramanian, H.H., Balnave, R.J., & Holstege, G. (2008).
The midbrain periaqueductal gray control of respiration. The Journal of neuroscience : the official journal of the Society for Neuroscience, 28(47), 12274-83. [PubMed:19020021] [PMC] [WorldCat] [DOI] - ↑
Kyuhou, S., & Gemba, H. (1998).
Two vocalization-related subregions in the midbrain periaqueductal gray of the guinea pig. Neuroreport, 9(7), 1607-10. [PubMed:9631474] [WorldCat] [DOI] - ↑ 28.0 28.1 28.2
Jürgens, U. (1994).
The role of the periaqueductal grey in vocal behaviour. Behavioural brain research, 62(2), 107-17. [PubMed:7945960] [WorldCat] [DOI] - ↑ 29.0 29.1 29.2
Vanderhorst, V.G., Terasawa, E., Ralston, H.J., & Holstege, G. (2000).
Monosynaptic projections from the lateral periaqueductal gray to the nucleus retroambiguus in the rhesus monkey: implications for vocalization and reproductive behavior. The Journal of comparative neurology, 424(2), 251-68. [PubMed:10906701] [WorldCat] [DOI] - ↑
Marson, L. (2004).
Lesions of the periaqueductal gray block the medial preoptic area-induced activation of the urethrogenital reflex in male rats. Neuroscience letters, 367(3), 278-82. [PubMed:15337249] [WorldCat] [DOI] - ↑
Okada, E., Aou, S., Takaki, A., Oomura, Y., & Hori, T. (1991).
Electrical stimulation of male monkey's midbrain elicits components of sexual behavior. Physiology & behavior, 50(1), 229-36. [PubMed:1946721] [WorldCat] [DOI] - ↑
Pfaff, D.W., & Sakuma, Y. (1979).
Facilitation of the lordosis reflex of female rats from the ventromedial nucleus of the hypothalamus. The Journal of physiology, 288, 189-202. [PubMed:469715] [PMC] [WorldCat] - ↑
Tsukahara, S., & Yamanouchi, K. (2001).
Neurohistological and behavioral evidence for lordosis-inhibiting tract from lateral septum to periaqueductal gray in male rats. The Journal of comparative neurology, 431(3), 293-310. [PubMed:11170006] [WorldCat] - ↑
Daniels, D., Miselis, R.R., & Flanagan-Cato, L.M. (1999).
Central neuronal circuit innervating the lordosis-producing muscles defined by transneuronal transport of pseudorabies virus. The Journal of neuroscience : the official journal of the Society for Neuroscience, 19(7), 2823-33. [PubMed:10087093] [PMC] [WorldCat] - ↑
Murphy, A.Z., & Hoffman, G.E. (2001).
Distribution of gonadal steroid receptor-containing neurons in the preoptic-periaqueductal gray-brainstem pathway: a potential circuit for the initiation of male sexual behavior. The Journal of comparative neurology, 438(2), 191-212. [PubMed:11536188] [WorldCat] [DOI] - ↑
Sakuma, Y., & Pfaff, D.W. (1983).
Modulation of the lordosis reflex of female rats by LHRH, its antiserum and analogs in the mesencephalic central gray. Neuroendocrinology, 36(3), 218-24. [PubMed:6339979] [WorldCat] [DOI] - ↑
Harlan, R.E., Shivers, B.D., & Pfaff, D.W. (1983).
Midbrain microinfusions of prolactin increase the estrogen-dependent behavior, lordosis. Science (New York, N.Y.), 219(4591), 1451-3. [PubMed:6828874] [WorldCat] [DOI] - ↑
Dornan, W.A., Malsbury, C.W., & Penney, R.B. (1987).
Facilitation of lordosis by injection of substance P into the midbrain central gray. Neuroendocrinology, 45(6), 498-506. [PubMed:2441308] [WorldCat] [DOI] - ↑
Sirinathsinghji, D.J. (1984).
Modulation of lordosis behavior of female rats by naloxone, beta-endorphin and its antiserum in the mesencephalic central gray: possible mediation via GnRH. Neuroendocrinology, 39(3), 222-30. [PubMed:6209590] [WorldCat] [DOI] - ↑
Sirinathsinghji, D.J. (1985).
Modulation of lordosis behaviour in the female rat by corticotropin releasing factor, beta-endorphin and gonadotropin releasing hormone in the mesencephalic central gray. Brain research, 336(1), 45-55. [PubMed:2860950] [WorldCat] [DOI] - ↑
Blok, B.F., De Weerd, H., & Holstege, G. (1995).
Ultrastructural evidence for a paucity of projections from the lumbosacral cord to the pontine micturition center or M-region in the cat: a new concept for the organization of the micturition reflex with the periaqueductal gray as central relay. The Journal of comparative neurology, 359(2), 300-9. [PubMed:7499530] [WorldCat] [DOI] - ↑
Matsuura, S., Downie, J.W., & Allen, G.V. (2000).
Micturition evoked by glutamate microinjection in the ventrolateral periaqueductal gray is mediated through Barrington's nucleus in the rat. Neuroscience, 101(4), 1053-61. [PubMed:11113354] [WorldCat] [DOI] - ↑
Stone, E., Coote, J.H., Allard, J., & Lovick, T.A. (2011).
GABAergic control of micturition within the periaqueductal grey matter of the male rat. The Journal of physiology, 589(Pt 8), 2065-78. [PubMed:21486804] [PMC] [WorldCat] [DOI] - ↑
Numata, A., Iwata, T., Iuchi, H., Taniguchi, N., Kita, M., Wada, N., ..., & Kakizaki, H. (2008).
Micturition-suppressing region in the periaqueductal gray of the mesencephalon of the cat. American journal of physiology. Regulatory, integrative and comparative physiology, 294(6), R1996-2000. [PubMed:18385467] [WorldCat] [DOI] - ↑
Holstege, G. (2010).
The emotional motor system and micturition control. Neurourology and urodynamics, 29(1), 42-8. [PubMed:20025036] [WorldCat] [DOI] - ↑
Luppi, P.H., Clement, O., Sapin, E., Peyron, C., Gervasoni, D., Léger, L., & Fort, P. (2012).
Brainstem mechanisms of paradoxical (REM) sleep generation. Pflugers Archiv : European journal of physiology, 463(1), 43-52. [PubMed:22083642] [WorldCat] [DOI]