「熱ショックタンパク質」の版間の差分
Hiroshiishii (トーク | 投稿記録) 細編集の要約なし |
Hiroshiishii (トーク | 投稿記録) 細編集の要約なし |
||
| 1行目: | 1行目: | ||
英語名:Heat shock protein | 英語名:Heat shock protein | ||
{{Pfam_box | {{Pfam_box | ||
| Symbol = HSP70 | | Symbol = HSP70 | ||
| 22行目: | 14行目: | ||
| TCDB = | | TCDB = | ||
}} | }} | ||
<br><span lang="EN-US"> [[熱ショックタンパク質]](</span><span lang="EN-US">Heat | |||
Shock Protein</span><span lang="EN-US">; </span><span lang="EN-US">HSP)</span><span lang="EN-US">とは細胞が熱、化学物質、虚血などのストレスにさらされた際に発現が上昇して細胞を保護するタンパク質の一群である。分子シャペロンとして機能し、ストレスタンパク質</span><span lang="EN-US">(</span><span lang="EN-US">Stress Protein</span><span lang="EN-US">)</span><span lang="EN-US">とも呼ばれる<ref><pubmed> 4219221 </pubmed></ref></span><span lang="EN-US">。</span><span lang="EN-US">HSP</span><span lang="EN-US">はその分子量により</span><span lang="EN-US">Hsp60</span><span lang="EN-US">、Hsp</span><span lang="EN-US">70</span><span lang="EN-US">、Hsp</span><span lang="EN-US">90</span><span lang="EN-US">などと個別に命名されている。</span><span lang="EN-US"> HSP</span><span lang="EN-US">は細菌からヒトまで広く似た機能を持つことが知られており、そのアミノ酸配列は生物の進化の過程においてよく保存されている<ref><pubmed> 8690199 </pubmed></ref>。</span> | |||
<span lang="EN-US"> </span><span lang="EN-US">HSP</span><span lang="EN-US">は合成されたタンパク質に結合することによりタンパク質のフォールディング(折り畳み)を制御する分子シャペロンとしての機能を持ち、また分子シャペロンの多くは</span><span lang="EN-US">HSP</span><span lang="EN-US">である。高温条件化において変性したタンパク質、あるいは新生タンパク質の</span><span lang="EN-US">う</span><span lang="EN-US">ちフォールディングの段階に問題があり、機能できないものなどには</span><span lang="EN-US">HSP</span><span lang="EN-US">が結合してその処理を行</span><span lang="EN-US">う</span><span lang="EN-US">ことが知られている。</span><span lang="EN-US">HSP</span><span lang="EN-US">はこのよ</span><span lang="EN-US">う</span><span lang="EN-US">な高次構造の破壊されたタンパク質の修復およびタンパク質変性の抑制機能を有し、修復が不可能であると判断されたタンパク質はユビキチン化を受け、プロテアソームと呼ばれる酵素複合体へ運搬されて分解される。このフォールディングの段階に異常があり、不良品タンパク質が細胞内に蓄積するとフォールディング病と呼ばれる疾患に陥る。神経変性疾患である筋萎縮性側索硬化症(Amyotrophic | |||
lateral sclerosis; ALS)、アルツハイマー病(Altzheimer’s disease; AD)やパーキンソン病(Parkinson’s | |||
disease; PD)もまたフォールディングの異常に基づくフォールディング病と考えられている<ref><pubmed> 15516999 </pubmed></ref><ref><pubmed> 15459709 </pubmed></ref><ref><pubmed> 15611723 </pubmed></ref>。</span> | |||
== <span>Hsp70による脳虚血保護作用 </span> == | == <span>Hsp70による脳虚血保護作用 </span> == | ||
2012年1月23日 (月) 17:38時点における版
英語名:Heat shock protein
| Hsp70 protein | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 Structure of the ATPase fragment of a 70K heat-shock cognate protein.[1] | |||||||||
| Identifiers | |||||||||
| Symbol | HSP70 | ||||||||
| Pfam | PF00012 | ||||||||
| Pfam clan | CL0108 | ||||||||
| InterPro | IPR013126 | ||||||||
| PROSITE | PDOC00269 | ||||||||
| SCOP | 3hsc | ||||||||
| SUPERFAMILY | 3hsc | ||||||||
| |||||||||
熱ショックタンパク質(Heat
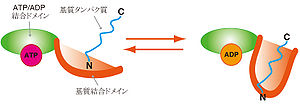
Shock Protein; HSP)とは細胞が熱、化学物質、虚血などのストレスにさらされた際に発現が上昇して細胞を保護するタンパク質の一群である。分子シャペロンとして機能し、ストレスタンパク質(Stress Protein)とも呼ばれる[2]。HSPはその分子量によりHsp60、Hsp70、Hsp90などと個別に命名されている。 HSPは細菌からヒトまで広く似た機能を持つことが知られており、そのアミノ酸配列は生物の進化の過程においてよく保存されている[3]。
HSPは合成されたタンパク質に結合することによりタンパク質のフォールディング(折り畳み)を制御する分子シャペロンとしての機能を持ち、また分子シャペロンの多くはHSPである。高温条件化において変性したタンパク質、あるいは新生タンパク質のうちフォールディングの段階に問題があり、機能できないものなどにはHSPが結合してその処理を行うことが知られている。HSPはこのような高次構造の破壊されたタンパク質の修復およびタンパク質変性の抑制機能を有し、修復が不可能であると判断されたタンパク質はユビキチン化を受け、プロテアソームと呼ばれる酵素複合体へ運搬されて分解される。このフォールディングの段階に異常があり、不良品タンパク質が細胞内に蓄積するとフォールディング病と呼ばれる疾患に陥る。神経変性疾患である筋萎縮性側索硬化症(Amyotrophic
lateral sclerosis; ALS)、アルツハイマー病(Altzheimer’s disease; AD)やパーキンソン病(Parkinson’s
disease; PD)もまたフォールディングの異常に基づくフォールディング病と考えられている[4][5][6]。
Hsp70による脳虚血保護作用
脳虚血の動物モデルや培養組織において、Hsp70を過剰発現させると虚血による損傷が軽減され、神経とグリア細胞に保護作用を示す[7][8][9]。これらの作用はHsp70のカルボキシ端末を介すると考えられている[10]。
フォールディング病
神経においてβアミロイドを過剰発現してADを再構成した系で、Hsp70を強制発現するとβアミロイドを介する神経毒性が回避される[11][12]。またADマウスモデルにおいてHsp70を過剰発現させると、Aβの発現およびAβの組織沈着そして神経とシナプスの脱落が軽減され認知機能の低下が抑制されると報告されている[13]。またαシヌクレイン発現によるDrosophilaパーキンソン病モデルにおいて、ヒトHsp70を発現させると、 αシヌクレインによる毒性から免れると報告されている[14]。
Hsp90βと神経筋接合部
アセチルコリンレセプターは細胞内でRapsynというタンパク質を介してHsp90βと会合し、 神経筋接合部の発達と維持に関わっている[15]。
熱ショックタンパク質作動薬
熱ショックタンパク質の作動薬であるArimoclimolはマウスALSモデルにおいてHsp70、Hsp90の発現を亢進し、病気の進行を抑えることが分かっている[16]。また培養運動神経に熱ショックやグルタミン酸を投与した場合にHsp70の発現が阻害されるが、 Arimoclimolを加えるとこれが回避される[17]。製薬会社のCytRxは、 臨床試験第2相を施行している[18]。
ニシキギ科の植物から抽出したquinine methide tritepeneであるCelastrol[19]はPD、ALSそしてハンチントン病などの動物モデルにおいて、Hsp70を誘導し、保護的に働く[20][21][22]。
熱ショックによる前処理と神経保護作用
あらかじめ熱ショックを組織に加えることにより、Hsp70、Hsc70、Hsp32やHsp27が亢進し、神経保護作用を示すことが分かっている[23][24][25][26][27][28][29]。熱ストレスによりHsc70が大脳皮質のシナプスに局在し、Hsp40と会合し、変性タンパク質をリフォールディングする[30]。また熱ストレスによりグリア細胞からHsp70が産生され、細胞間を移動し、隣り合う神経細胞の突起に輸送されることが分かっている[31]。この生理反応を応用し、坐骨神経細胞の切断端にHsp70/Hsc70を細胞外から添加すると神経細胞死が抑制されると報告されている[32][33]。
Hsc70の発現と神経変性疾患
Hsc70は神経組織において発現が高い。ALSの病変となる脊髄では比較的高いレベルのHsc70が発現しているが、ADの病変となる海馬や内嗅皮質においては低レベルの発現が見られる。そしてPDの病変箇所である黒質においては中間の発現レベルであることが確認されており、丁度それぞれの疾患の発症頻度とよく逆相関しているため、Hsc70の神経変性疾患における神経保護作用が示唆されている[34]。
== 参考文献 ==
- ↑ Flaherty KM, DeLuca-Flaherty C, McKay DB (1990). "Three-dimensional structure of the ATPase fragment of a 70K heat-shock cognate protein". Nature. 346 (6285): 623–8. doi:10.1038/346623a0. PMID 2143562.
{{cite journal}}: Unknown parameter|month=ignored (help)CS1 maint: multiple names: authors list (link) - ↑
Tissières, A., Mitchell, H.K., & Tracy, U.M. (1974).
Protein synthesis in salivary glands of Drosophila melanogaster: relation to chromosome puffs. Journal of molecular biology, 84(3), 389-98. [PubMed:4219221] [WorldCat] [DOI] - ↑
Hirakawa, T., Rokutan, K., Nikawa, T., & Kishi, K. (1996).
Geranylgeranylacetone induces heat shock proteins in cultured guinea pig gastric mucosal cells and rat gastric mucosa. Gastroenterology, 111(2), 345-57. [PubMed:8690199] [WorldCat] [DOI] - ↑
Selkoe, D.J. (2004).
Cell biology of protein misfolding: the examples of Alzheimer's and Parkinson's diseases. Nature cell biology, 6(11), 1054-61. [PubMed:15516999] [WorldCat] [DOI] - ↑
Forman, M.S., Trojanowski, J.Q., & Lee, V.M. (2004).
Neurodegenerative diseases: a decade of discoveries paves the way for therapeutic breakthroughs. Nature medicine, 10(10), 1055-63. [PubMed:15459709] [WorldCat] [DOI] - ↑
Muchowski, P.J., & Wacker, J.L. (2005).
Modulation of neurodegeneration by molecular chaperones. Nature reviews. Neuroscience, 6(1), 11-22. [PubMed:15611723] [WorldCat] [DOI] - ↑
Rajdev, S., Hara, K., Kokubo, Y., Mestril, R., Dillmann, W., Weinstein, P.R., & Sharp, F.R. (2000).
Mice overexpressing rat heat shock protein 70 are protected against cerebral infarction. Annals of neurology, 47(6), 782-91. [PubMed:10852544] [WorldCat] - ↑
Hoehn, B., Ringer, T.M., Xu, L., Giffard, R.G., Sapolsky, R.M., Steinberg, G.K., & Yenari, M.A. (2001).
Overexpression of HSP72 after induction of experimental stroke protects neurons from ischemic damage. Journal of cerebral blood flow and metabolism : official journal of the International Society of Cerebral Blood Flow and Metabolism, 21(11), 1303-9. [PubMed:11702045] [WorldCat] [DOI] - ↑
Giffard, R.G., Xu, L., Zhao, H., Carrico, W., Ouyang, Y., Qiao, Y., ..., & Yenari, M.A. (2004).
Chaperones, protein aggregation, and brain protection from hypoxic/ischemic injury. The Journal of experimental biology, 207(Pt 18), 3213-20. [PubMed:15299042] [WorldCat] [DOI] - ↑
Sun, Y., Ouyang, Y.B., Xu, L., Chow, A.M., Anderson, R., Hecker, J.G., & Giffard, R.G. (2006).
The carboxyl-terminal domain of inducible Hsp70 protects from ischemic injury in vivo and in vitro. Journal of cerebral blood flow and metabolism : official journal of the International Society of Cerebral Blood Flow and Metabolism, 26(7), 937-50. [PubMed:16292251] [WorldCat] [DOI] - ↑
Magrané, J., Smith, R.C., Walsh, K., & Querfurth, H.W. (2004).
Heat shock protein 70 participates in the neuroprotective response to intracellularly expressed beta-amyloid in neurons. The Journal of neuroscience : the official journal of the Society for Neuroscience, 24(7), 1700-6. [PubMed:14973234] [PMC] [WorldCat] [DOI] - ↑
Smith, R.C., Rosen, K.M., Pola, R., & Magrané, J. (2005).
Stress proteins in Alzheimer's disease. International journal of hyperthermia : the official journal of European Society for Hyperthermic Oncology, North American Hyperthermia Group, 21(5), 421-31. [PubMed:16048839] [WorldCat] [DOI] - ↑
Hoshino, T., Murao, N., Namba, T., Takehara, M., Adachi, H., Katsuno, M., ..., & Mizushima, T. (2011).
Suppression of Alzheimer's disease-related phenotypes by expression of heat shock protein 70 in mice. The Journal of neuroscience : the official journal of the Society for Neuroscience, 31(14), 5225-34. [PubMed:21471357] [PMC] [WorldCat] [DOI] - ↑
Auluck, P.K., Chan, H.Y., Trojanowski, J.Q., Lee, V.M., & Bonini, N.M. (2002).
Chaperone suppression of alpha-synuclein toxicity in a Drosophila model for Parkinson's disease. Science (New York, N.Y.), 295(5556), 865-8. [PubMed:11823645] [WorldCat] [DOI] - ↑
Luo, S., Zhang, B., Dong, X.P., Tao, Y., Ting, A., Zhou, Z., ..., & Mei, L. (2008).
HSP90 beta regulates rapsyn turnover and subsequent AChR cluster formation and maintenance. Neuron, 60(1), 97-110. [PubMed:18940591] [PMC] [WorldCat] [DOI] - ↑
Kieran, D., Kalmar, B., Dick, J.R., Riddoch-Contreras, J., Burnstock, G., & Greensmith, L. (2004).
Treatment with arimoclomol, a coinducer of heat shock proteins, delays disease progression in ALS mice. Nature medicine, 10(4), 402-5. [PubMed:15034571] [WorldCat] [DOI] - ↑
Batulan, Z., Shinder, G.A., Minotti, S., He, B.P., Doroudchi, M.M., Nalbantoglu, J., ..., & Durham, H.D. (2003).
High threshold for induction of the stress response in motor neurons is associated with failure to activate HSF1. The Journal of neuroscience : the official journal of the Society for Neuroscience, 23(13), 5789-98. [PubMed:12843283] [PMC] [WorldCat] - ↑ "Phase II/III Randomized, Placebo-Controlled Trial of Arimoclomol in SOD1 Positive Familial Amyotrophic Lateral Sclerosis - Full Text View - ClinicalTrials.gov". Retrieved 2009-05-18.
- ↑
Zhou, B.N. (1991).
Some progress on the chemistry of natural bioactive terpenoids from Chinese medicinal plants. Memorias do Instituto Oswaldo Cruz, 86 Suppl 2, 219-26. [PubMed:1842005] [WorldCat] [DOI] - ↑
Cleren, C., Calingasan, N.Y., Chen, J., & Beal, M.F. (2005).
Celastrol protects against MPTP- and 3-nitropropionic acid-induced neurotoxicity. Journal of neurochemistry, 94(4), 995-1004. [PubMed:16092942] [WorldCat] [DOI] - ↑
Kiaei, M., Kipiani, K., Petri, S., Chen, J., Calingasan, N.Y., & Beal, M.F. (2005).
Celastrol blocks neuronal cell death and extends life in transgenic mouse model of amyotrophic lateral sclerosis. Neuro-degenerative diseases, 2(5), 246-54. [PubMed:16909005] [WorldCat] [DOI] - ↑
Wang, J., Gines, S., MacDonald, M.E., & Gusella, J.F. (2005).
Reversal of a full-length mutant huntingtin neuronal cell phenotype by chemical inhibitors of polyglutamine-mediated aggregation. BMC neuroscience, 6, 1. [PubMed:15649316] [PMC] [WorldCat] [DOI] - ↑
Karunanithi, S., Barclay, J.W., Robertson, R.M., Brown, I.R., & Atwood, H.L. (1999).
Neuroprotection at Drosophila synapses conferred by prior heat shock. The Journal of neuroscience : the official journal of the Society for Neuroscience, 19(11), 4360-9. [PubMed:10341239] [PMC] [WorldCat] - ↑
Karunanithi, S., Barclay, J.W., Brown, I.R., Robertson, R.M., & Atwood, H.L. (2002).
Enhancement of presynaptic performance in transgenic Drosophila overexpressing heat shock protein Hsp70. Synapse (New York, N.Y.), 44(1), 8-14. [PubMed:11842441] [WorldCat] [DOI] - ↑
Neal, S.J., Karunanithi, S., Best, A., So, A.K., Tanguay, R.M., Atwood, H.L., & Westwood, J.T. (2006).
Thermoprotection of synaptic transmission in a Drosophila heat shock factor mutant is accompanied by increased expression of Hsp83 and DnaJ-1. Physiological genomics, 25(3), 493-501. [PubMed:16595740] [WorldCat] [DOI] - ↑
Kelty, J.D., Noseworthy, P.A., Feder, M.E., Robertson, R.M., & Ramirez, J.M. (2002).
Thermal preconditioning and heat-shock protein 72 preserve synaptic transmission during thermal stress. The Journal of neuroscience : the official journal of the Society for Neuroscience, 22(1), RC193. [PubMed:11756523] [PMC] [WorldCat] - ↑
Xiao, C., Mileva-Seitz, V., Seroude, L., & Robertson, R.M. (2007).
Targeting HSP70 to motoneurons protects locomotor activity from hyperthermia in Drosophila. Developmental neurobiology, 67(4), 438-55. [PubMed:17443800] [WorldCat] [DOI] - ↑
Bechtold, D.A., Rush, S.J., & Brown, I.R. (2000).
Localization of the heat-shock protein Hsp70 to the synapse following hyperthermic stress in the brain. Journal of neurochemistry, 74(2), 641-6. [PubMed:10646515] [WorldCat] [DOI] - ↑
Bechtold, D.A., & Brown, I.R. (2000).
Heat shock proteins Hsp27 and Hsp32 localize to synaptic sites in the rat cerebellum following hyperthermia. Brain research. Molecular brain research, 75(2), 309-20. [PubMed:10686353] [WorldCat] [DOI] - ↑
Chen, S., & Brown, I.R. (2007).
Translocation of constitutively expressed heat shock protein Hsc70 to synapse-enriched areas of the cerebral cortex after hyperthermic stress. Journal of neuroscience research, 85(2), 402-9. [PubMed:17203483] [WorldCat] [DOI] - ↑
Tytell, M., Greenberg, S.G., & Lasek, R.J. (1986).
Heat shock-like protein is transferred from glia to axon. Brain research, 363(1), 161-4. [PubMed:3947949] [WorldCat] [DOI] - ↑
Houenou, L.J., Li, L., Lei, M., Kent, C.R., & Tytell, M. (1996).
Exogenous heat shock cognate protein Hsc 70 prevents axotomy-induced death of spinal sensory neurons. Cell stress & chaperones, 1(3), 161-6. [PubMed:9222601] [PMC] [WorldCat] [DOI] - ↑
Tidwell, J.L., Houenou, L.J., & Tytell, M. (2004).
Administration of Hsp70 in vivo inhibits motor and sensory neuron degeneration. Cell stress & chaperones, 9(1), 88-98. [PubMed:15270081] [PMC] [WorldCat] [DOI] - ↑
Chen, S., & Brown, I.R. (2007).
Neuronal expression of constitutive heat shock proteins: implications for neurodegenerative diseases. Cell stress & chaperones, 12(1), 51-8. [PubMed:17441507] [PMC] [WorldCat] [DOI]
執筆者:石井宏史、山下俊英 担当編集委員:柚崎通介