「熱ショックタンパク質」の版間の差分
Hiroshiishii (トーク | 投稿記録) 細編集の要約なし |
細編集の要約なし |
||
| (4人の利用者による、間の59版が非表示) | |||
| 1行目: | 1行目: | ||
<div align="right"> | |||
[ | <font size="+1">石井 宏史</font><br> | ||
''金沢大学''<br> | |||
<font size="+1">[http://researchmap.jp/ToshihideYamashita 山下 俊英]</font><br> | |||
''大阪大学 大学院医学系研究科分子神経科学 分子神経科学''<br> | |||
DOI:<selfdoi /> 原稿受付日:2012年1月25日 原稿完成日:2012年2月2日 修正日:2014年6月15日<br> | |||
担当編集委員:[http://researchmap.jp/michisukeyuzaki 柚崎 通介](慶應義塾大学 医学部生理学)<br> | |||
</div> | |||
英語名:Heat shock protein 独:Hitzeschockproteine 仏:protéine de choc thermique 英略称:HSP | |||
= | {{box|text= 熱ショックタンパク質とは細胞が熱、化学物質、虚血などのストレスにさらされた際に発現が上昇して細胞を保護する[[wj:タンパク質|タンパク質]]の一群である。合成されたタンパク質に結合することによりタンパク質の[[wj:フォールディング|フォールディング]](折り畳み)とアンフォールディング(折り畳みの解除)を制御する分子シャペロンとしての機能し、ストレスタンパク質(Stress Protein)とも呼ばれる。タンパク質の複合体の形成、タンパク質の移動、選別、細胞周期やシグナリングそしてストレス/アポトーシスから細胞を保護する機能も知られている一方、抗原ペプチドを主要組織適合遺伝子複合体 クラスI/クラスII分子まで輸送して抗原提示を担うことも分かっている。細胞外HSPは抗原提示を担う細胞であるマクロファージや樹上細胞の抗原提示を促すことが知られている<ref><pubmed> 18432918 </pubmed></ref>。分子量によりHsp60、Hsp70、Hsp90などに分類されている。[[wj:真性細菌|細菌]]から[[wj:ヒト|ヒト]]まで広く似た機能を持つことが知られており、その[[wj:一次構造|アミノ酸配列]]は生物の進化の過程においてよく保存されている。}} | ||
==熱ショックタンパク質とは== | |||
熱ショックタンパク質とは細胞が熱、[[wj:化学物質|化学物質]]、[[虚血]]などの[[wj:ストレス|ストレス]]にさらされた際に発現が上昇して細胞を保護する[[wj:タンパク質|タンパク質]]の一群である。1962年にイタリアの遺伝学者Ferruccio Ritossaが、熱と代謝脱共役材の[[wj:2,4-ジニトロフェノール|2,4-ジニトロフェノール]]により[[ショウジョウバエ]]の[[wj:染色体|染色体]]の特徴的なパッフィング([[mRNA]]転写により生ずる膨らみ)が誘導されることを報告した<ref><pubmed>PMC248460</pubmed></ref><ref><pubmed> 4219221 </pubmed></ref>。 | |||
< | この発見により後の熱ショックタンパク質(HSP)あるいはパフに象徴されるストレスタンパク質が認識されることになった。そして熱ショックなどのストレスに続いて合成が増加するショウジョウバエの細胞の特定のタンパク質が初めて1974年に報告された<ref><pubmed>2197269</pubmed></ref>。 | ||
== | ==サブタイプ== | ||
HSPはその分子量によりHsp60、Hsp70、Hsp90などに分類されている。 | |||
{| class="wikitable" | |||
|+表 熱ショックタンパク質の分類(Wikipediaより改変) | |||
!分子量!![[真正細菌]]!![[wj:古細菌|古細菌]]!![[真核生物]]!!機能 | |||
|- | |||
|10kDa||GroES||Hsp10||[[Hsp10]]||[[Hsp60]](GroEL)の機能を補助する[[コシャペロン]]として働く。 | |||
|- | |||
|style="white-space:nowrap"|20-30kDa||GrpE||無し||[[HspB]]ファミリー(例:[[Hsp27]]([[HspB1]]))|| | |||
|- | |||
|40kDa||DnaJ||Hsp40([[wj:ユリアーキオータ門|ユリアーキオータ]]のみ)||[[Hsp40]]|| | |||
|- | |||
|60kDa||GroEL||Hsp60||[[Hsp60]], [[TRiC]]||タンパク質のフォールディング | |||
|- | |||
|70kDa||DnaK||Hsp70(ユリアーキオータのみ)||[[HspA]]ファミリー(例:[[Hsp70]]、[[Hsc70]]、[[Hsp72]]、[[Grp78]]([[BiP]])、[[Hsx70]]、[[mtHsp70]])||タンパク質のフォールディングに関与し、熱に対する耐性を形成させる。タンパク質の[[ミトコンドリア]]や[[葉緑体]]などへの翻訳後輸送に関与。 | |||
|- | |||
|90kDa||HtpG、C62.5||無し||[[HspC]]ファミリー(例:[[Hsp90]]、[[Grp94]])||ミスフォールディングされたタンパク質を安定化させる。シグナルタンパク質や[[ステロイド受容体]]や[[転写因子]]、[[チロシンリン酸化|チロシンキナーゼ]]などの機能維持に必要。 | |||
|- | |||
|100kDa||style="white-space:nowrap"|ClpB、ClpA、ClpX||無し||[[Hsp104]]、[[Hsp110]]||タンパク質凝集や高温に対する耐性形成に関与。 | |||
|} | |||
==構造== | |||
HSPは[[wj:真性細菌|細菌]]から[[wj:ヒト|ヒト]]まで広く似た機能を持つことが知られており、その[[wj:一次構造|アミノ酸配列]]は生物の進化の過程においてよく保存されている。 | |||
HSP90は3つの構造ドメイン | |||
#N末端ヌクレオチド結合ドメイン N-terminal nucleotide binding domain (NBD) (HSP90阻害タンパクも結合できる。ペプチドも結合する可能性がある。) | |||
#対象タンパク質が結合する中間構造 | |||
#ホモダイマー結合の際に機能すると考えられているC末端領域 | |||
から構成される。 | |||
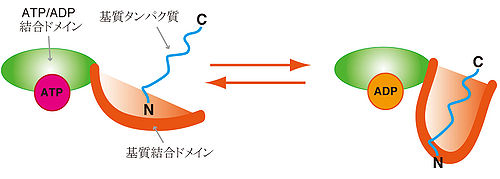
HSP70は2つの構造ドメイン | |||
#N末端ヌクレオチド結合ドメイン | |||
#基質結合ドメイン substrate binding domain (SBD) | |||
から構成される。44kDaのN末端ヌクレオチド結合ドメインは[[ATPアーゼ]]活性を持ち、Hsp70シャペロンの[[DnaJ]]と会合する。27kDaのC末端は基質結合ドメインと蓋となる領域でできており、両者ははリンカーによって繋がっている<ref name="MacAry17675458"><pubmed> 17675458 </pubmed></ref>。 | |||
==発現== | |||
熱ショックタンパク質はあらゆる場所で発現している。全ての臓器、異なる細胞構造物に存在している。 | |||
< | ==機能== | ||
===分子機能=== | |||
[[Image:PDB 3hsc EBI.jpg|thumb|right|500px|'''図. Hsp70の分子構造と基質結合'''<br>基質結合部位と基質がATP加水分解により捕獲される。<ref name="Turturici21403864"><pubmed> 21403864 </pubmed></ref>]] | |||
合成されたタンパク質に結合することによりタンパク質の[[wj:フォールディング|フォールディング]](折り畳み)を制御する分子シャペロンとしての機能を持ち、また分子シャペロンの多くはHSPである<ref><pubmed> 4219221 </pubmed></ref>。高温条件化において変性したタンパク質や、あるいはフォールディングの段階に問題があり機能できない新生タンパク質には熱ショックタンパク質が結合することが知られている。熱ショックタンパク質はこのような高次構造が破壊されたタンパク質修復機能やタンパク質[[wj:変性|変性]]抑制機能を有する。修復が不可能なタンパク質は[[ユビキチン]]化を受け、[[プロテアソーム]]と呼ばれる[[wj:酵素|酵素]]複合体へ運搬されて分解される。 | |||
===神経系での機能=== | |||
フォールディング過程の異常のために不良品タンパク質が細胞内に蓄積するとフォールディング病と呼ばれる一連の疾患を引き起こす。神経変性疾患である[[筋萎縮性側索硬化症]](Amyotrophic lateral sclerosis; ALS)、[[アルツハイマー病]](Altzheimer’s disease)や[[パーキンソン病]](Parkinson’s disease)はフォールディング病と考えられている<ref><pubmed> 15516999 </pubmed></ref>。 | |||
== < | ==== Hsp70による脳虚血保護作用==== | ||
: 動物や培養組織を用いた脳虚血モデルにおいて、神経と[[グリア細胞]]にHsp70を過剰発現させると虚血による損傷が軽減される。このような脳虚血保護作用はHsp70の[[wj:C末端|カルボキシ末端]]を介すると考えられている<ref><pubmed> 16292251 </pubmed></ref>。 | |||
====神経変性疾患モデルとHsp70==== | |||
: 神経細胞に[[Βアミロイド|βアミロイド]]を過剰発現するとアルツハイマー病と同様に神経細胞死が引き起こされる。Hsp70を神経細胞に強制発現させるとこのようなβアミロイドによる[[神経毒性]]を軽減することができる<ref><pubmed> 14973234 </pubmed></ref>。またβアミロイドを過剰発現させて作成したマウスアルツハイマー病モデルにおいてもHsp70を神経細胞に過剰発現させると、[[Aβ]]の発現やAβの組織沈着、さらに神経細胞変性と[[シナプス]]減少を軽減し、行動実験における[[認知]]機能の低下が抑制されると報告されている<ref><pubmed> 21471357 </pubmed></ref>。また[[αシヌクレイン]]をショウジョウバエに過剰発現させて作成したハエ[[パーキンソン病]]モデルにおいて、ヒトHsp70を過剰発現させると、 αシヌクレインによる細胞死を防ぐことができると報告されている<ref><pubmed> 11823645 </pubmed></ref>。 | |||
==== Hsp90βと神経筋接合部==== | |||
: [[アセチルコリン]]受容体は筋細胞内で[[ラプシン]]を介してHsp90βと会合し、 [[神経筋接合部]]の発達と維持に関わっている<ref><pubmed> 18940591 </pubmed></ref>。 | |||
== < | ====熱ショックによる前処理と神経保護作用==== | ||
: あらかじめ熱ショックを組織に加えることにより、Hsp70、[[Hsc70]]、[[Hsp32]]や[[Hsp27]]が亢進し、神経保護作用を示すことが分かっている<ref><pubmed> 10341239 </pubmed></ref>。熱ストレスによりHsc70が[[大脳皮質]][[神経細胞]]のシナプスに局在し、[[Hsp40]]と会合し、変性タンパク質をリフォールディングする。また熱ストレスによりグリア細胞においてHsp70が産生され、細胞間を移動し、隣り合う神経細胞の突起に輸送される<ref><pubmed> 3947949 </pubmed></ref>。この反応を応用し、[[坐骨神経]]細胞の切断端にHsp70/Hsc70を細胞外から添加すると、神経細胞死が抑制される<ref><pubmed> 9222601 </pubmed></ref>。 | |||
====シャペロン介在オートファジーによるハンチントン病の治療==== | |||
: マウス[[ハンチントン病]]モデルでは、神経細胞に伸長[[ポリグルタミン]]鎖が蓄積する。Hsc70の伸長ポリグルタミン鎖への結合を促進すると、伸長ポリグルタミン鎖が[[リソソーム]]に運ばれ、[[オートファジー]]により分解される。これにより行動異常が改善され、寿命が延びる<ref><pubmed> 20190739 </pubmed></ref>。 | |||
====自己免疫疾患とHsp70==== | |||
: Hsp70は[[wj:抗原|抗原]]に結合して、[[wj:主要組織適合遺伝子複合体|MHCIおよびMHCII]]依存的に[[wj:抗原|抗原]]性を高める<ref name="Turturici21403864"><pubmed> 21403864 </pubmed></ref>。また[[多発性硬化症]](multiple sclerosis)の[[動物モデル]]である実験的[[自己免疫性脳脊髄炎]](experimental autoimmune encephalomyelitis)の発症および増悪にHsp70が関わる<ref name="Turturici21403864"><pubmed> 21403864 </pubmed></ref>。多発性硬化症患者の[[脳脊髄液]]には、Hsp70に対する自己抗体が、運動神経疾患の患者と比較して高い頻度で観察される。そして多発性硬化症患者において、自己抗原である[[ミエリン塩基性タンパク質]](myelin basic protein; MBP)や[[Myelin proteolipid protein]](PLP)とHsp70との会合も観察されている。しかし一方でHsp70が[[wj:ナチュラルキラー細胞|ナチュラルキラー細胞]]に働きかけて自己免疫性脳脊髄炎の増悪を抑制するとの報告もあるため[[中枢神経系]]の[[wj:自己免疫疾患|自己免疫疾患]]における役割が議論されている<ref name="Turturici21403864"><pubmed> 21403864 </pubmed></ref>。 | |||
== < | ==== 熱ショックタンパク質作動薬==== | ||
: 熱ショックタンパク質の[[作動薬]]である[[w:Arimoclomol|Arimoclomol]]は、マウスALSモデルにおいてHsp70、Hsp90の発現を亢進させ、病気の進行を抑えることが分かっている<ref name="Arimo"><pubmed> 15034571 </pubmed></ref>。培養脊髄組織に熱ショックあるいは[[グルタミン酸]]処理によりストレスを与えた場合に、アストロサイトにおいてHsp70の発現が上昇する。しかし同様のストレスを与えても、運動神経におけるHsp70の発現は上昇しない。このようなストレス下で、Arimoclomolを加えると、神経細胞のHsp70の発現が上昇して神経保護作用を示す<ref name="Arimo"><pubmed> 15034571 </pubmed></ref>。製薬会社の[[w:CytRx|CytRx]]社は、[[wj:臨床試験|臨床試験]]第2相を施行している<ref>[http://clinicaltrials.gov/ct2/show/NCT00706147 Phase II/III Randomized, Placebo-Controlled Trial of Arimoclomol in SOD1 Positive Familial Amyotrophic Lateral Sclerosis - Full Text View - ClinicalTrials.gov]</ref>。 | |||
[[ | : [[wj:ニシキギ科|ニシキギ科]]の植物から抽出した[[w:Quinone methide|キノンメチド]][[wj:トリテルペン|トリテルペン]]である[[w:Celastrol|Celastrol]]はパーキンソン病、ALSそして[[ハンチントン病]]などの動物モデルにおいて、Hsp70を誘導し、保護的に働く<ref>|<pubmed> 16092942 </pubmed></ref>。 | ||
==関連項目== | |||
*[[プロテアソーム]] | |||
*[[ユビキチン]] | |||
== 参考文献 == | |||
<references /> | |||
2020年10月5日 (月) 23:39時点における最新版
石井 宏史
金沢大学
山下 俊英
大阪大学 大学院医学系研究科分子神経科学 分子神経科学
DOI:10.14931/bsd.489 原稿受付日:2012年1月25日 原稿完成日:2012年2月2日 修正日:2014年6月15日
担当編集委員:柚崎 通介(慶應義塾大学 医学部生理学)
英語名:Heat shock protein 独:Hitzeschockproteine 仏:protéine de choc thermique 英略称:HSP
熱ショックタンパク質とは細胞が熱、化学物質、虚血などのストレスにさらされた際に発現が上昇して細胞を保護するタンパク質の一群である。合成されたタンパク質に結合することによりタンパク質のフォールディング(折り畳み)とアンフォールディング(折り畳みの解除)を制御する分子シャペロンとしての機能し、ストレスタンパク質(Stress Protein)とも呼ばれる。タンパク質の複合体の形成、タンパク質の移動、選別、細胞周期やシグナリングそしてストレス/アポトーシスから細胞を保護する機能も知られている一方、抗原ペプチドを主要組織適合遺伝子複合体 クラスI/クラスII分子まで輸送して抗原提示を担うことも分かっている。細胞外HSPは抗原提示を担う細胞であるマクロファージや樹上細胞の抗原提示を促すことが知られている[1]。分子量によりHsp60、Hsp70、Hsp90などに分類されている。細菌からヒトまで広く似た機能を持つことが知られており、そのアミノ酸配列は生物の進化の過程においてよく保存されている。
熱ショックタンパク質とは
熱ショックタンパク質とは細胞が熱、化学物質、虚血などのストレスにさらされた際に発現が上昇して細胞を保護するタンパク質の一群である。1962年にイタリアの遺伝学者Ferruccio Ritossaが、熱と代謝脱共役材の2,4-ジニトロフェノールによりショウジョウバエの染色体の特徴的なパッフィング(mRNA転写により生ずる膨らみ)が誘導されることを報告した[2][3]。
この発見により後の熱ショックタンパク質(HSP)あるいはパフに象徴されるストレスタンパク質が認識されることになった。そして熱ショックなどのストレスに続いて合成が増加するショウジョウバエの細胞の特定のタンパク質が初めて1974年に報告された[4]。
サブタイプ
HSPはその分子量によりHsp60、Hsp70、Hsp90などに分類されている。
| 分子量 | 真正細菌 | 古細菌 | 真核生物 | 機能 |
|---|---|---|---|---|
| 10kDa | GroES | Hsp10 | Hsp10 | Hsp60(GroEL)の機能を補助するコシャペロンとして働く。 |
| 20-30kDa | GrpE | 無し | HspBファミリー(例:Hsp27(HspB1)) | |
| 40kDa | DnaJ | Hsp40(ユリアーキオータのみ) | Hsp40 | |
| 60kDa | GroEL | Hsp60 | Hsp60, TRiC | タンパク質のフォールディング |
| 70kDa | DnaK | Hsp70(ユリアーキオータのみ) | HspAファミリー(例:Hsp70、Hsc70、Hsp72、Grp78(BiP)、Hsx70、mtHsp70) | タンパク質のフォールディングに関与し、熱に対する耐性を形成させる。タンパク質のミトコンドリアや葉緑体などへの翻訳後輸送に関与。 |
| 90kDa | HtpG、C62.5 | 無し | HspCファミリー(例:Hsp90、Grp94) | ミスフォールディングされたタンパク質を安定化させる。シグナルタンパク質やステロイド受容体や転写因子、チロシンキナーゼなどの機能維持に必要。 |
| 100kDa | ClpB、ClpA、ClpX | 無し | Hsp104、Hsp110 | タンパク質凝集や高温に対する耐性形成に関与。 |
構造
HSPは細菌からヒトまで広く似た機能を持つことが知られており、そのアミノ酸配列は生物の進化の過程においてよく保存されている。
HSP90は3つの構造ドメイン
- N末端ヌクレオチド結合ドメイン N-terminal nucleotide binding domain (NBD) (HSP90阻害タンパクも結合できる。ペプチドも結合する可能性がある。)
- 対象タンパク質が結合する中間構造
- ホモダイマー結合の際に機能すると考えられているC末端領域
から構成される。
HSP70は2つの構造ドメイン
- N末端ヌクレオチド結合ドメイン
- 基質結合ドメイン substrate binding domain (SBD)
から構成される。44kDaのN末端ヌクレオチド結合ドメインはATPアーゼ活性を持ち、Hsp70シャペロンのDnaJと会合する。27kDaのC末端は基質結合ドメインと蓋となる領域でできており、両者ははリンカーによって繋がっている[5]。
発現
熱ショックタンパク質はあらゆる場所で発現している。全ての臓器、異なる細胞構造物に存在している。
機能
分子機能
合成されたタンパク質に結合することによりタンパク質のフォールディング(折り畳み)を制御する分子シャペロンとしての機能を持ち、また分子シャペロンの多くはHSPである[7]。高温条件化において変性したタンパク質や、あるいはフォールディングの段階に問題があり機能できない新生タンパク質には熱ショックタンパク質が結合することが知られている。熱ショックタンパク質はこのような高次構造が破壊されたタンパク質修復機能やタンパク質変性抑制機能を有する。修復が不可能なタンパク質はユビキチン化を受け、プロテアソームと呼ばれる酵素複合体へ運搬されて分解される。
神経系での機能
フォールディング過程の異常のために不良品タンパク質が細胞内に蓄積するとフォールディング病と呼ばれる一連の疾患を引き起こす。神経変性疾患である筋萎縮性側索硬化症(Amyotrophic lateral sclerosis; ALS)、アルツハイマー病(Altzheimer’s disease)やパーキンソン病(Parkinson’s disease)はフォールディング病と考えられている[8]。
Hsp70による脳虚血保護作用
- 動物や培養組織を用いた脳虚血モデルにおいて、神経とグリア細胞にHsp70を過剰発現させると虚血による損傷が軽減される。このような脳虚血保護作用はHsp70のカルボキシ末端を介すると考えられている[9]。
神経変性疾患モデルとHsp70
- 神経細胞にβアミロイドを過剰発現するとアルツハイマー病と同様に神経細胞死が引き起こされる。Hsp70を神経細胞に強制発現させるとこのようなβアミロイドによる神経毒性を軽減することができる[10]。またβアミロイドを過剰発現させて作成したマウスアルツハイマー病モデルにおいてもHsp70を神経細胞に過剰発現させると、Aβの発現やAβの組織沈着、さらに神経細胞変性とシナプス減少を軽減し、行動実験における認知機能の低下が抑制されると報告されている[11]。またαシヌクレインをショウジョウバエに過剰発現させて作成したハエパーキンソン病モデルにおいて、ヒトHsp70を過剰発現させると、 αシヌクレインによる細胞死を防ぐことができると報告されている[12]。
Hsp90βと神経筋接合部
熱ショックによる前処理と神経保護作用
- あらかじめ熱ショックを組織に加えることにより、Hsp70、Hsc70、Hsp32やHsp27が亢進し、神経保護作用を示すことが分かっている[14]。熱ストレスによりHsc70が大脳皮質神経細胞のシナプスに局在し、Hsp40と会合し、変性タンパク質をリフォールディングする。また熱ストレスによりグリア細胞においてHsp70が産生され、細胞間を移動し、隣り合う神経細胞の突起に輸送される[15]。この反応を応用し、坐骨神経細胞の切断端にHsp70/Hsc70を細胞外から添加すると、神経細胞死が抑制される[16]。
シャペロン介在オートファジーによるハンチントン病の治療
- マウスハンチントン病モデルでは、神経細胞に伸長ポリグルタミン鎖が蓄積する。Hsc70の伸長ポリグルタミン鎖への結合を促進すると、伸長ポリグルタミン鎖がリソソームに運ばれ、オートファジーにより分解される。これにより行動異常が改善され、寿命が延びる[17]。
自己免疫疾患とHsp70
- Hsp70は抗原に結合して、MHCIおよびMHCII依存的に抗原性を高める[6]。また多発性硬化症(multiple sclerosis)の動物モデルである実験的自己免疫性脳脊髄炎(experimental autoimmune encephalomyelitis)の発症および増悪にHsp70が関わる[6]。多発性硬化症患者の脳脊髄液には、Hsp70に対する自己抗体が、運動神経疾患の患者と比較して高い頻度で観察される。そして多発性硬化症患者において、自己抗原であるミエリン塩基性タンパク質(myelin basic protein; MBP)やMyelin proteolipid protein(PLP)とHsp70との会合も観察されている。しかし一方でHsp70がナチュラルキラー細胞に働きかけて自己免疫性脳脊髄炎の増悪を抑制するとの報告もあるため中枢神経系の自己免疫疾患における役割が議論されている[6]。
熱ショックタンパク質作動薬
- 熱ショックタンパク質の作動薬であるArimoclomolは、マウスALSモデルにおいてHsp70、Hsp90の発現を亢進させ、病気の進行を抑えることが分かっている[18]。培養脊髄組織に熱ショックあるいはグルタミン酸処理によりストレスを与えた場合に、アストロサイトにおいてHsp70の発現が上昇する。しかし同様のストレスを与えても、運動神経におけるHsp70の発現は上昇しない。このようなストレス下で、Arimoclomolを加えると、神経細胞のHsp70の発現が上昇して神経保護作用を示す[18]。製薬会社のCytRx社は、臨床試験第2相を施行している[19]。
関連項目
参考文献
- ↑
Li, Z., & Srivastava, P. (2004).
Heat-shock proteins. Current protocols in immunology, Appendix 1, Appendix 1T. [PubMed:18432918] [WorldCat] [DOI] - ↑
Ritossa, F. (1996).
Discovery of the heat shock response. Cell stress & chaperones, 1(2), 97-8. [PubMed:9222594] [PMC] [WorldCat] [DOI] - ↑
Tissières, A., Mitchell, H.K., & Tracy, U.M. (1974).
Protein synthesis in salivary glands of Drosophila melanogaster: relation to chromosome puffs. Journal of molecular biology, 84(3), 389-98. [PubMed:4219221] [WorldCat] [DOI] - ↑
Schlesinger, M.J. (1990).
Heat shock proteins. The Journal of biological chemistry, 265(21), 12111-4. [PubMed:2197269] [WorldCat] - ↑
Javid, B., MacAry, P.A., & Lehner, P.J. (2007).
Structure and function: heat shock proteins and adaptive immunity. Journal of immunology (Baltimore, Md. : 1950), 179(4), 2035-40. [PubMed:17675458] [WorldCat] [DOI] - ↑ 6.0 6.1 6.2 6.3
Turturici, G., Sconzo, G., & Geraci, F. (2011).
Hsp70 and its molecular role in nervous system diseases. Biochemistry research international, 2011, 618127. [PubMed:21403864] [PMC] [WorldCat] [DOI] - ↑
Tissières, A., Mitchell, H.K., & Tracy, U.M. (1974).
Protein synthesis in salivary glands of Drosophila melanogaster: relation to chromosome puffs. Journal of molecular biology, 84(3), 389-98. [PubMed:4219221] [WorldCat] [DOI] - ↑
Selkoe, D.J. (2004).
Cell biology of protein misfolding: the examples of Alzheimer's and Parkinson's diseases. Nature cell biology, 6(11), 1054-61. [PubMed:15516999] [WorldCat] [DOI] - ↑
Sun, Y., Ouyang, Y.B., Xu, L., Chow, A.M., Anderson, R., Hecker, J.G., & Giffard, R.G. (2006).
The carboxyl-terminal domain of inducible Hsp70 protects from ischemic injury in vivo and in vitro. Journal of cerebral blood flow and metabolism : official journal of the International Society of Cerebral Blood Flow and Metabolism, 26(7), 937-50. [PubMed:16292251] [WorldCat] [DOI] - ↑
Magrané, J., Smith, R.C., Walsh, K., & Querfurth, H.W. (2004).
Heat shock protein 70 participates in the neuroprotective response to intracellularly expressed beta-amyloid in neurons. The Journal of neuroscience : the official journal of the Society for Neuroscience, 24(7), 1700-6. [PubMed:14973234] [PMC] [WorldCat] [DOI] - ↑
Hoshino, T., Murao, N., Namba, T., Takehara, M., Adachi, H., Katsuno, M., ..., & Mizushima, T. (2011).
Suppression of Alzheimer's disease-related phenotypes by expression of heat shock protein 70 in mice. The Journal of neuroscience : the official journal of the Society for Neuroscience, 31(14), 5225-34. [PubMed:21471357] [PMC] [WorldCat] [DOI] - ↑
Auluck, P.K., Chan, H.Y., Trojanowski, J.Q., Lee, V.M., & Bonini, N.M. (2002).
Chaperone suppression of alpha-synuclein toxicity in a Drosophila model for Parkinson's disease. Science (New York, N.Y.), 295(5556), 865-8. [PubMed:11823645] [WorldCat] [DOI] - ↑
Luo, S., Zhang, B., Dong, X.P., Tao, Y., Ting, A., Zhou, Z., ..., & Mei, L. (2008).
HSP90 beta regulates rapsyn turnover and subsequent AChR cluster formation and maintenance. Neuron, 60(1), 97-110. [PubMed:18940591] [PMC] [WorldCat] [DOI] - ↑
Karunanithi, S., Barclay, J.W., Robertson, R.M., Brown, I.R., & Atwood, H.L. (1999).
Neuroprotection at Drosophila synapses conferred by prior heat shock. The Journal of neuroscience : the official journal of the Society for Neuroscience, 19(11), 4360-9. [PubMed:10341239] [PMC] [WorldCat] - ↑
Tytell, M., Greenberg, S.G., & Lasek, R.J. (1986).
Heat shock-like protein is transferred from glia to axon. Brain research, 363(1), 161-4. [PubMed:3947949] [WorldCat] [DOI] - ↑
Houenou, L.J., Li, L., Lei, M., Kent, C.R., & Tytell, M. (1996).
Exogenous heat shock cognate protein Hsc 70 prevents axotomy-induced death of spinal sensory neurons. Cell stress & chaperones, 1(3), 161-6. [PubMed:9222601] [PMC] [WorldCat] [DOI] - ↑
Bauer, P.O., Goswami, A., Wong, H.K., Okuno, M., Kurosawa, M., Yamada, M., ..., & Nukina, N. (2010).
Harnessing chaperone-mediated autophagy for the selective degradation of mutant huntingtin protein. Nature biotechnology, 28(3), 256-63. [PubMed:20190739] [WorldCat] [DOI] - ↑ 18.0 18.1
Kieran, D., Kalmar, B., Dick, J.R., Riddoch-Contreras, J., Burnstock, G., & Greensmith, L. (2004).
Treatment with arimoclomol, a coinducer of heat shock proteins, delays disease progression in ALS mice. Nature medicine, 10(4), 402-5. [PubMed:15034571] [WorldCat] [DOI] - ↑ Phase II/III Randomized, Placebo-Controlled Trial of Arimoclomol in SOD1 Positive Familial Amyotrophic Lateral Sclerosis - Full Text View - ClinicalTrials.gov
- ↑ |
Cleren, C., Calingasan, N.Y., Chen, J., & Beal, M.F. (2005).
Celastrol protects against MPTP- and 3-nitropropionic acid-induced neurotoxicity. Journal of neurochemistry, 94(4), 995-1004. [PubMed:16092942] [WorldCat] [DOI]