神経栄養因子
小原 圭吾
関西医科大学 附属生命医学研究所 細胞機能部門
DOI:10.14931/bsd.9363 原稿受付日:2020年8月25日 原稿完成日:2020年8月26日
担当編集委員:河崎 洋志(金沢大学 医学系 脳神経医学教室)
英:neurotrophin 独:Neurotrophin 仏:neurotrophine
神経栄養因子は、神経成長因子(nerve growth factor/NGF)、脳由来神経栄養因子(brain-derived neurotrophic factor /BDNF)、neurotrophin-3 (NT-3)、neurotrophin-4/5 (NT-4/5)の4種類の分泌性蛋白質から構成される。細胞外に放出された神経栄養因子は、その高親和性受容体であるTrkA, TrkB, TrkC, または低親和性受容体p75と結合することにより、神経細胞の生存、樹状突起や軸索の伸展、シナプス形成、シナプス機能調節、細胞死、記憶学習形成といった極めて広範で多岐にわたる機能を持つことが知られている。
イントロダクション
神経栄養因子は、最初に1950年代にLevi-Montalciniによって神経成長因子(nerve growth factor, NGF)が発見された[1]。この発見により1986年にノーベル生理学・医学賞授与された。また、ブタの脳1.5kgから精製されたわずか1 μgの脳由来神経栄養因子 (brain-derived neurotrophic factor, BDNF)蛋白質が突破口となり、1982年にBardeとThoenenによってBDNFが発見された[2]。
種類
神経栄養因子は、主に、神経成長因子(nerve growth factor/NGF/neurotrophin-1) [1]、脳由来神経栄養因子 (brain-derived neurotrophic factor /BDNF /neurotrophin-2) [2]、neurotrophin-3 (NT-3) [3]、neurotrophin-4/5 (NT-4/5) [4][5]の4種類のファミリー蛋白質が存在することがわかっている(図1)。
構造
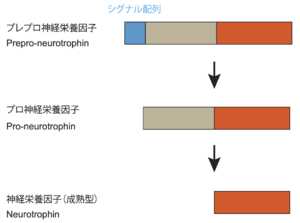
神経栄養因子はシグナル配列を含むプレプロ神経栄養因子(prepro-neurotrophin)として最初に合成される。次に、シグナル配列が切断された後、プロ神経栄養因子(pro-neurotrophin)となる[6]。その後、プロ神経栄養因子は、プロテアーゼによって切断されたのち、成熟型の神経栄養因子(mature neurotrophin)となる[6][7](図2)。プロ神経栄養因子と成熟型の神経栄養因子はそれぞれホモ2量体を構成する[6](図1)。
発現
組織分布
NGFは心筋、平滑筋、脂肪組織、卵巣といった末梢部位の組織に広範囲に発現が分布している。NGFの中枢部位(脳)における発現は、網膜、海馬の一部の抑制性神経細胞など特定の部位においてみられる(プロテインアトラスNGF)。
BDNFは中枢部位において、大脳皮質、海馬、小脳などにおいて広く発現する。肺、心筋、平滑筋、精巣上体といった末梢部位の組織においても発現がみられる(プロテインアトラスBDNF)。
またNGF、BDNFは血清、血漿中にも存在する(プロテインアトラスNGF)(プロテインアトラスBDNF)。
細胞内分布
NGFとBDNFは、神経活動に依存して遺伝子発現が上昇する[8][9][10]。BDNFのmRNAは細胞体だけでなく樹状突起にも分布する[11]。
神経栄養因子は小胞体内で合成された後に、ゴルジ体を経て分泌小胞に充填される[6]。
NGF、NT-3、NT-4/5は構成的経路を通って、神経活動非依存的に分泌小胞から細胞外に放出される。BDNFは主に調節的経路を通って、神経活動依存的に有芯顆粒から細胞外に放出される[6]。
歴史的に、「神経栄養因子は標的細胞(シナプス後部)から放出されて入力神経細胞(シナプス前部)へ逆行的に作用する」という説(ドグマ)が古典的に強く信じられていたが[12]、分子生物学的にタグ標識されたBDNFや遺伝子組換え動物を用いた近年の研究[13][14][15][16][17]によってその古典的ドグマは改訂され、BDNFは神経細胞のシナプス前部(軸索終末)とシナプス後部(樹状突起)の両方から放出されることが明らかになっている[10][13][14][15][16][17][18][19]。
機能
分子機能
神経栄養因子はその高親和性受容体チロシンキナーゼTrkファミリータンパク質(TrkA, TrkB, TrkC)の細胞外ドメインと結合する。神経栄養因子と結合したTrkA, TrkB, TrkCは2量体化し、その下流のシグナル経路が活性化される[10][12]。
神経栄養因子はTrkA, TrkB, TrkCを活性化して、神経細胞の生存[10][12]、樹状突起の伸展[10][12][14]、シナプス形成[10][12][20][21][22][23]、シナプス機能を調節する機能[10][12][24]を持つ。
また神経栄養因子は、低親和性受容体p75の細胞外ドメインにも結合して、p75を活性化し、細胞死や細胞生存、軸索伸展、シナプス機能などを負の方向に調節する機能を持つ[25][26]。
NGFは末梢交感神経細胞、知覚神経細胞、コリン作動性神経細胞等の増殖、分化促進、軸索伸展、生存維持する機能を持つ[12][27]。
BDNFは海馬や大脳における神経伝達の長期増強 (long-term potentiation/LTP)の成立・維持に必要であることがわかっている[7][10][12][28][29][30][31]。またプロBDNF(pro-BDNF)は樹状突起の進展を抑制する機能を持つことがわかっている[25][26]。
個体での機能
BDNFは記憶・学習形成・維持において重要な機能を持つことが明らかになっている[32][33]。
疾患との関わり
ヒトBDNFの遺伝子の一部に一塩基の変異(前駆体部分に位置する66番目のアミノ酸バリンがメチオニンに変異)が起こると(一塩基多型ともいう)、神経活動依存的なBDNFの分泌が抑えられて、エピソード記憶の低下がみられる[34]。同様にBDNFの66番目のアミノ酸バリンがメチオニンに変異した遺伝子ノックインマウスは、記憶学習の低下と不安様行動の増加、海馬の萎縮を示す[35]。このため、不安障害やうつ病といった精神疾患にBDNF遺伝子の変異が関連している可能性も考えられる。
脳内でのBDNF発現量低下と認知症の間に相関があることも明らかになっている[26] 。
関連項目
参考文献
- ↑ 1.0 1.1
Zeliadt, N. (2013).
Rita Levi-Montalcini: NGF, the prototypical growth factor. Proceedings of the National Academy of Sciences of the United States of America, 110(13), 4873-6. [PubMed:23515326] [PMC] [WorldCat] [DOI] - ↑ 2.0 2.1
Barde, Y.A., Edgar, D., & Thoenen, H. (1982).
Purification of a new neurotrophic factor from mammalian brain. The EMBO journal, 1(5), 549-53. [PubMed:7188352] [PMC] [WorldCat] - ↑
Maisonpierre, P.C., Belluscio, L., Squinto, S., Ip, N.Y., Furth, M.E., Lindsay, R.M., & Yancopoulos, G.D. (1990).
Neurotrophin-3: a neurotrophic factor related to NGF and BDNF. Science (New York, N.Y.), 247(4949 Pt 1), 1446-51. [PubMed:2321006] [WorldCat] [DOI] - ↑
Hallböök, F., Ibáñez, C.F., & Persson, H. (1991).
Evolutionary studies of the nerve growth factor family reveal a novel member abundantly expressed in Xenopus ovary. Neuron, 6(5), 845-58. [PubMed:2025430] [WorldCat] [DOI] - ↑
Ip, N.Y., Ibáñez, C.F., Nye, S.H., McClain, J., Jones, P.F., Gies, D.R., ..., & Squinto, S.P. (1992).
Mammalian neurotrophin-4: structure, chromosomal localization, tissue distribution, and receptor specificity. Proceedings of the National Academy of Sciences of the United States of America, 89(7), 3060-4. [PubMed:1313578] [PMC] [WorldCat] [DOI] - ↑ 6.0 6.1 6.2 6.3 6.4
Lou, H., Kim, S.K., Zaitsev, E., Snell, C.R., Lu, B., & Loh, Y.P. (2005).
Sorting and activity-dependent secretion of BDNF require interaction of a specific motif with the sorting receptor carboxypeptidase e. Neuron, 45(2), 245-55. [PubMed:15664176] [WorldCat] [DOI] - ↑ 7.0 7.1
Pang, P.T., Teng, H.K., Zaitsev, E., Woo, N.T., Sakata, K., Zhen, S., ..., & Lu, B. (2004).
Cleavage of proBDNF by tPA/plasmin is essential for long-term hippocampal plasticity. Science (New York, N.Y.), 306(5695), 487-91. [PubMed:15486301] [WorldCat] [DOI] - ↑
Zafra, F., Hengerer, B., Leibrock, J., Thoenen, H., & Lindholm, D. (1990).
Activity dependent regulation of BDNF and NGF mRNAs in the rat hippocampus is mediated by non-NMDA glutamate receptors. The EMBO journal, 9(11), 3545-50. [PubMed:2170117] [PMC] [WorldCat] - ↑
Bessho, Y., Nakanishi, S., & Nawa, H. (1993).
Glutamate receptor agonists enhance the expression of BDNF mRNA in cultured cerebellar granule cells. Brain research. Molecular brain research, 18(3), 201-8. [PubMed:7684481] [WorldCat] [DOI] - ↑ 10.0 10.1 10.2 10.3 10.4 10.5 10.6 10.7
Park, H., & Poo, M.M. (2013).
Neurotrophin regulation of neural circuit development and function. Nature reviews. Neuroscience, 14(1), 7-23. [PubMed:23254191] [WorldCat] [DOI] - ↑
Tongiorgi, E., Righi, M., & Cattaneo, A. (1997).
Activity-dependent dendritic targeting of BDNF and TrkB mRNAs in hippocampal neurons. The Journal of neuroscience : the official journal of the Society for Neuroscience, 17(24), 9492-505. [PubMed:9391005] [PMC] [WorldCat] - ↑ 12.0 12.1 12.2 12.3 12.4 12.5 12.6 12.7
Huang, E.J., & Reichardt, L.F. (2001).
Neurotrophins: roles in neuronal development and function. Annual review of neuroscience, 24, 677-736. [PubMed:11520916] [PMC] [WorldCat] [DOI] - ↑ 13.0 13.1
Kohara, K., Kitamura, A., Morishima, M., & Tsumoto, T. (2001).
Activity-dependent transfer of brain-derived neurotrophic factor to postsynaptic neurons. Science (New York, N.Y.), 291(5512), 2419-23. [PubMed:11264540] [WorldCat] [DOI] - ↑ 14.0 14.1 14.2
Kohara, K., Kitamura, A., Adachi, N., Nishida, M., Itami, C., Nakamura, S., & Tsumoto, T. (2003).
Inhibitory but not excitatory cortical neurons require presynaptic brain-derived neurotrophic factor for dendritic development, as revealed by chimera cell culture. The Journal of neuroscience : the official journal of the Society for Neuroscience, 23(14), 6123-31. [PubMed:12853431] [PMC] [WorldCat] - ↑ 15.0 15.1
Dean, C., Liu, H., Dunning, F.M., Chang, P.Y., Jackson, M.B., & Chapman, E.R. (2009).
Synaptotagmin-IV modulates synaptic function and long-term potentiation by regulating BDNF release. Nature neuroscience, 12(6), 767-76. [PubMed:19448629] [PMC] [WorldCat] [DOI] - ↑ 16.0 16.1
Matsuda, N., Lu, H., Fukata, Y., Noritake, J., Gao, H., Mukherjee, S., ..., & Poo, M.M. (2009).
Differential activity-dependent secretion of brain-derived neurotrophic factor from axon and dendrite. The Journal of neuroscience : the official journal of the Society for Neuroscience, 29(45), 14185-98. [PubMed:19906967] [PMC] [WorldCat] [DOI] - ↑ 17.0 17.1
Dieni, S., Matsumoto, T., Dekkers, M., Rauskolb, S., Ionescu, M.S., Deogracias, R., ..., & Barde, Y.A. (2012).
BDNF and its pro-peptide are stored in presynaptic dense core vesicles in brain neurons. The Journal of cell biology, 196(6), 775-88. [PubMed:22412021] [PMC] [WorldCat] [DOI] - ↑
Kojima, M., Takei, N., Numakawa, T., Ishikawa, Y., Suzuki, S., Matsumoto, T., ..., & Hatanaka, H. (2001).
Biological characterization and optical imaging of brain-derived neurotrophic factor-green fluorescent protein suggest an activity-dependent local release of brain-derived neurotrophic factor in neurites of cultured hippocampal neurons. Journal of neuroscience research, 64(1), 1-10. [PubMed:11276045] [WorldCat] [DOI] - ↑
Hartmann, M., Heumann, R., & Lessmann, V. (2001).
Synaptic secretion of BDNF after high-frequency stimulation of glutamatergic synapses. The EMBO journal, 20(21), 5887-97. [PubMed:11689429] [PMC] [WorldCat] [DOI] - ↑
Kohara, K., Yasuda, H., Huang, Y., Adachi, N., Sohya, K., & Tsumoto, T. (2007).
A local reduction in cortical GABAergic synapses after a loss of endogenous brain-derived neurotrophic factor, as revealed by single-cell gene knock-out method. The Journal of neuroscience : the official journal of the Society for Neuroscience, 27(27), 7234-44. [PubMed:17611276] [PMC] [WorldCat] [DOI] - ↑
Yamada, M.K., Nakanishi, K., Ohba, S., Nakamura, T., Ikegaya, Y., Nishiyama, N., & Matsuki, N. (2002).
Brain-derived neurotrophic factor promotes the maturation of GABAergic mechanisms in cultured hippocampal neurons. The Journal of neuroscience : the official journal of the Society for Neuroscience, 22(17), 7580-5. [PubMed:12196581] [PMC] [WorldCat] - ↑
Choo, M., Miyazaki, T., Yamazaki, M., Kawamura, M., Nakazawa, T., Zhang, J., ..., & Kano, M. (2017).
Retrograde BDNF to TrkB signaling promotes synapse elimination in the developing cerebellum. Nature communications, 8(1), 195. [PubMed:28775326] [PMC] [WorldCat] [DOI] - ↑
Hata, Y., Ohshima, M., Ichisaka, S., Wakita, M., Fukuda, M., & Tsumoto, T. (2000).
Brain-derived neurotrophic factor expands ocular dominance columns in visual cortex in monocularly deprived and nondeprived kittens but does not in adult cats. The Journal of neuroscience : the official journal of the Society for Neuroscience, 20(3), RC57. [PubMed:10648732] [PMC] [WorldCat] - ↑
Tanaka, J., Horiike, Y., Matsuzaki, M., Miyazaki, T., Ellis-Davies, G.C., & Kasai, H. (2008).
Protein synthesis and neurotrophin-dependent structural plasticity of single dendritic spines. Science (New York, N.Y.), 319(5870), 1683-7. [PubMed:18309046] [PMC] [WorldCat] [DOI] - ↑ 25.0 25.1
Yang, J., Harte-Hargrove, L.C., Siao, C.J., Marinic, T., Clarke, R., Ma, Q., ..., & Hempstead, B.L. (2014).
proBDNF negatively regulates neuronal remodeling, synaptic transmission, and synaptic plasticity in hippocampus. Cell reports, 7(3), 796-806. [PubMed:24746813] [PMC] [WorldCat] [DOI] - ↑ 26.0 26.1 26.2
Miranda, M., Morici, J.F., Zanoni, M.B., & Bekinschtein, P. (2019).
Brain-Derived Neurotrophic Factor: A Key Molecule for Memory in the Healthy and the Pathological Brain. Frontiers in cellular neuroscience, 13, 363. [PubMed:31440144] [PMC] [WorldCat] [DOI] - ↑ 27.0 27.1
Denk, F., Bennett, D.L., & McMahon, S.B. (2017).
Nerve Growth Factor and Pain Mechanisms. Annual review of neuroscience, 40, 307-325. [PubMed:28441116] [WorldCat] [DOI] - ↑
Korte, M., Carroll, P., Wolf, E., Brem, G., Thoenen, H., & Bonhoeffer, T. (1995).
Hippocampal long-term potentiation is impaired in mice lacking brain-derived neurotrophic factor. Proceedings of the National Academy of Sciences of the United States of America, 92(19), 8856-60. [PubMed:7568031] [PMC] [WorldCat] [DOI] - ↑
Figurov, A., Pozzo-Miller, L.D., Olafsson, P., Wang, T., & Lu, B. (1996).
Regulation of synaptic responses to high-frequency stimulation and LTP by neurotrophins in the hippocampus. Nature, 381(6584), 706-9. [PubMed:8649517] [WorldCat] [DOI] - ↑
Zakharenko, S.S., Patterson, S.L., Dragatsis, I., Zeitlin, S.O., Siegelbaum, S.A., Kandel, E.R., & Morozov, A. (2003).
Presynaptic BDNF required for a presynaptic but not postsynaptic component of LTP at hippocampal CA1-CA3 synapses. Neuron, 39(6), 975-90. [PubMed:12971897] [WorldCat] [DOI] - ↑
Lin, P.Y., Kavalali, E.T., & Monteggia, L.M. (2018).
Genetic Dissection of Presynaptic and Postsynaptic BDNF-TrkB Signaling in Synaptic Efficacy of CA3-CA1 Synapses. Cell reports, 24(6), 1550-1561. [PubMed:30089265] [PMC] [WorldCat] [DOI] - ↑
Gorski, J.A., Balogh, S.A., Wehner, J.M., & Jones, K.R. (2003).
Learning deficits in forebrain-restricted brain-derived neurotrophic factor mutant mice. Neuroscience, 121(2), 341-54. [PubMed:14521993] [WorldCat] [DOI] - ↑
Liu, I.Y., Lyons, W.E., Mamounas, L.A., & Thompson, R.F. (2004).
Brain-derived neurotrophic factor plays a critical role in contextual fear conditioning. The Journal of neuroscience : the official journal of the Society for Neuroscience, 24(36), 7958-63. [PubMed:15356210] [PMC] [WorldCat] [DOI] - ↑
Egan, M.F., Kojima, M., Callicott, J.H., Goldberg, T.E., Kolachana, B.S., Bertolino, A., ..., & Weinberger, D.R. (2003).
The BDNF val66met polymorphism affects activity-dependent secretion of BDNF and human memory and hippocampal function. Cell, 112(2), 257-69. [PubMed:12553913] [WorldCat] [DOI] - ↑
Chen, Z.Y., Jing, D., Bath, K.G., Ieraci, A., Khan, T., Siao, C.J., ..., & Lee, F.S. (2006).
Genetic variant BDNF (Val66Met) polymorphism alters anxiety-related behavior. Science (New York, N.Y.), 314(5796), 140-3. [PubMed:17023662] [PMC] [WorldCat] [DOI]