神経管
高橋 将文
自治医科大学 分子病態治療研究センター 細胞生物研究部
DOI:10.14931/bsd.3178 原稿受付日:2013年1月21日 原稿完成日:2013年2月4日 更新日:2013年9月18日
担当編集委員:村上 富士夫(大阪大学 大学院生命機能研究科)
英語名:neural tube 独:Neuralrohr 仏:tube neural
神経管は脊椎動物の発生過程において形成される管状の構造物であり、脳および脊髄の原基である。その管構造は、外胚葉に由来する板状の神経板 (neural plate) がダイナミックに形態変化することで形成される。発生初期の神経管は、未分化な神経上皮細胞から構成されているが、領域特異的に発現する分泌性因子やその下流で働く転写制御因子の作用により細胞運命が決定され、様々な種類のニューロンやグリア細胞が神経管の前後軸・背腹軸に沿って生み出される。
形成
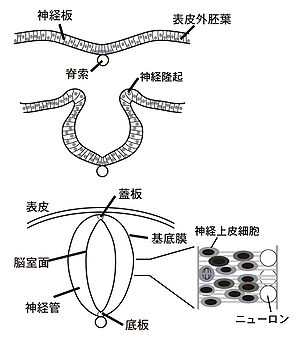
神経管は、発生過程において頭部から尾部にいたる一本の管状構造物であり、中枢神経系を構成する脳・脊髄の原基である。神経管はもとをただせば、単層上皮構造を有する神経板に由来する(図1)。神経板と表皮外胚葉との境界付近の隆起(neural ridge)や神経板正中に神経溝(neural grove)が形成されることで、管構造の形成が開始される。神経板を構成する神経上皮細胞の頂端側に豊富に存在するアクチン細胞骨格が収縮することで神経板に歪みが生じ、神経板が湾曲する。その後、神経板の左右の隆起が癒合することで、神経板は表皮外胚葉から最終的にくびれ切れ、管状の構造へと変化する。このような発生様式は、一次神経形成 (primary neurulation) と呼ばれている(図1)[1]。
一方、哺乳類や鳥類胚の尾部においては、中胚葉性間葉細胞の上皮化による神経管の形成が見られ、この様式は二次神経形成 (secondary neurulation) と呼ばれている。
魚類においては羊膜類胚(鳥類や哺乳類胚)とは神経板の構造がもともと異なっている。例えば、ゼブラフィッシュ胚の神経管形成は、神経板細胞の湾曲ではなく、神経板の左右の細胞が混じりあいながら腹側へ落ち込むことで開始される。Neural keelと呼ばれる構造が形成された後、その正中に接着結合の形成に伴い腔が形成され、神経管が形成される[1]。
外観
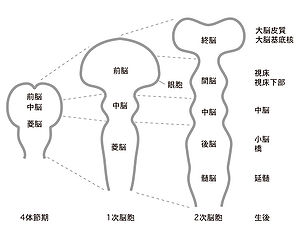
神経管の頭部レベルでは、形態的なくびれにより、前脳胞(prosencephalon)、中脳胞 (mesencephalon) 、および菱脳胞 (rhombencephalon) からなる一次脳胞が形成される[3]。前脳胞の側方部では、将来の網膜になる眼胞が突出する。前脳胞は、終脳 (telencephalon)と間脳 (diencephalon)に細分化され、その後、眼胞は、脳よりくびれ切れる。発生が進むと、神経管は峡部 (isthmus) と呼ばれる中脳・菱脳境界の背側部での形態的くびれが特に明瞭になり、中脳を境に神経管が腹側に大きく屈曲する。菱脳の後方部においても神経管は腹側に屈曲し始める。菱脳の背側領域(蓋板に相当する)は薄い単層の上皮組織からなり、他の神経管領域における蓋板に比べ特殊化している。さらに発生が進むと、菱脳胞は後脳(metencephalon)と髄脳(myelencephalon)に細分化され、5胞脳からなる二次脳胞が形成される(図2)。この時期までに、神経管の後脳・髄脳境界付近では神経管は背側に著しく屈曲する。終脳胞の背側領域からは将来の大脳が形成され、腹側領域からは将来の大脳基底核が形成される。間脳からは視床(thalamus)、視床下部(hypothalamus) が派生し、後脳からは橋(pons)および小脳 (cerebellum)、髄脳からは延髄 (medulla oblongata) が形成される(図2)。
内部構造と細胞分化
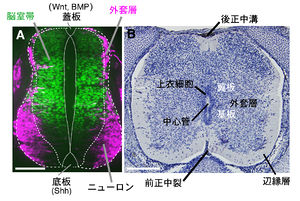
発生初期の神経管は、細長い形態を持つ神経上皮細胞から構成される偽重層上皮である(図1)。神経上皮細胞は、脳室帯(ventricular zone)を形成し、interkinetic nuclear movementまたはエレベーター運動と呼ばれる細胞周期に依存した核の移動運動を行っている[4]。細胞分裂は主に脳室面で起こり、神経上皮細胞は非対称分裂によってニューロンを生み出す。ニューロンが神経管の基底膜側に移動することで、細胞が密集した外套層(mantle layer)が形成される。神経上皮細胞の基底膜側突起は外套層が形成された後も外套層を横断し、神経管を包む基底膜に接している。脊髄原基においては、増殖や運動性に乏しい神経管の最腹側領域の底板(floor plate) や最背側領域の蓋板(roof plate) からはニューロンは生み出されないが、これらの領域は、神経管の背腹軸領域化(パターン化)に関与する分泌性因子(Shh、BMP、Wnt等)を産生するシグナリングセンターとして機能している[5]。
発生後期になると、脳室帯の脳室面側には境界溝(sulcus limitance)が形成され、形態的にも神経管の背腹境界が明確となる。外套層の拡大にともない、神経上皮細胞の基底膜側突起の丈はより長くなり、神経上皮細胞は放射状グリア細胞(radial glial cell)と呼ばれるようになる。外套層の腹側領域は基板 (basal plate)、背側領域は翼板(alar plate)と呼ばれており (図3)、基板には、脳室帯腹側領域から派生した運動ニューロンや介在ニューロンが配置し、翼板には脳室帯背側領域から派生した介在ニューロンが配置する。非対称分裂した神経上皮細胞の娘細胞の片方は、幹細胞として維持されておりグリア細胞(オリゴデンドロサイトやアストロサイト)を順次生み出す[6]。脊髄神経管の内側にはニューロンの細胞体が集まった灰白質が形成され、外側には脊髄を上下に走行する神経軸索や一部のグリア細胞が存在する辺縁層(marginal layer)が形成される(図3)。外套層が厚くなり、脳室帯が薄くなっていく過程において、神経管腹側の正中には前正中裂 (anterior median fissure)、背側の正中には後正中溝 (posterior median sulcus) が形成され、脳室は徐々に神経管の中心に位置するようになる。最終的に、脳室帯の細胞は上衣細胞へと変化し、中心管を構成する細胞として機能する (図3)[7]。
神経管閉鎖不全
神経管の背側閉鎖 (dorsal closure) 不全によって、脊椎二分症や外脳症、無脳症などの神経管形成異常 (neural tube defects: NTSs) が生じることが知られている。この閉鎖不全は、神経板の湾曲ができない、または神経板の縁の隆起が融合できないことが原因であることが多い。神経上皮細胞におけるアクチン骨格の収縮は、平面極性 (planar cell polarity: PCP) 形成に関わるカドヘリン関連分子Cadherin EGF LAG seven-pass G-type receptor 1 (Celsr1)の作用により引き起こされることがニワトリ胚を用いた実験により明らかとなっている[8]。
また、NTDsの多くは、Wnt シグナルや平面極性に関わる遺伝子の変異が原因である[9]。両生類を用いた実験から、神経板細胞における微小管骨格が上皮の形態変化を制御し[10] [11]、また、神経板が管状へ変化するためには、神経板の近傍の細胞の移動が必要とされる[12]。左右の神経板が癒合する際には、神経隆起においてプログラム細胞死(アポトーシス)が高頻度に観察される。実際にアポトーシスを起こさないようにすると、神経管閉鎖異常が誘導されることから、アポトーシスの正確な制御が神経管形成の最終段階に重要であると考えられている[13]。
関連項目
参考文献
- ↑ 1.0 1.1
Lowery, L.A., & Sive, H. (2004).
Strategies of vertebrate neurulation and a re-evaluation of teleost neural tube formation. Mechanisms of development, 121(10), 1189-97. [PubMed:15327780] [WorldCat] [DOI] - ↑ 佐藤&大隅
脳の領域化と転写因子
脳神経科学入門講座 下、2002 - ↑
Kiecker, C., & Lumsden, A. (2005).
Compartments and their boundaries in vertebrate brain development. Nature reviews. Neuroscience, 6(7), 553-64. [PubMed:15959467] [WorldCat] [DOI] - ↑
Miyata, T. (2008).
Development of three-dimensional architecture of the neuroepithelium: role of pseudostratification and cellular 'community'. Development, growth & differentiation, 50 Suppl 1, S105-12. [PubMed:18070110] [WorldCat] [DOI] - ↑
Le Dréau, G., & Martí, E. (2012).
Dorsal-ventral patterning of the neural tube: a tale of three signals. Developmental neurobiology, 72(12), 1471-81. [PubMed:22821665] [WorldCat] [DOI] - ↑
Rowitch, D.H., & Kriegstein, A.R. (2010).
Developmental genetics of vertebrate glial-cell specification. Nature, 468(7321), 214-22. [PubMed:21068830] [WorldCat] [DOI] - ↑
Hamilton, L.K., Truong, M.K., Bednarczyk, M.R., Aumont, A., & Fernandes, K.J. (2009).
Cellular organization of the central canal ependymal zone, a niche of latent neural stem cells in the adult mammalian spinal cord. Neuroscience, 164(3), 1044-56. [PubMed:19747531] [WorldCat] [DOI] - ↑
Nishimura, T., Honda, H., & Takeichi, M. (2012).
Planar cell polarity links axes of spatial dynamics in neural-tube closure. Cell, 149(5), 1084-97. [PubMed:22632972] [WorldCat] [DOI] - ↑
Wu, G., Huang, X., Hua, Y., & Mu, D. (2011).
Roles of planar cell polarity pathways in the development of neural [correction of neutral] tube defects. Journal of biomedical science, 18, 66. [PubMed:21864354] [PMC] [WorldCat] [DOI] - ↑
Suzuki, M., Hara, Y., Takagi, C., Yamamoto, T.S., & Ueno, N. (2010).
MID1 and MID2 are required for Xenopus neural tube closure through the regulation of microtubule organization. Development (Cambridge, England), 137(14), 2329-39. [PubMed:20534674] [WorldCat] [DOI] - ↑
Suzuki, M., Morita, H., & Ueno, N. (2012).
Molecular mechanisms of cell shape changes that contribute to vertebrate neural tube closure. Development, growth & differentiation, 54(3), 266-76. [PubMed:22524600] [WorldCat] [DOI] - ↑
Morita, H., Kajiura-Kobayashi, H., Takagi, C., Yamamoto, T.S., Nonaka, S., & Ueno, N. (2012).
Cell movements of the deep layer of non-neural ectoderm underlie complete neural tube closure in Xenopus. Development (Cambridge, England), 139(8), 1417-26. [PubMed:22378637] [WorldCat] [DOI] - ↑
Yamaguchi, Y., Shinotsuka, N., Nonomura, K., Takemoto, K., Kuida, K., Yosida, H., & Miura, M. (2011).
Live imaging of apoptosis in a novel transgenic mouse highlights its role in neural tube closure. The Journal of cell biology, 195(6), 1047-60. [PubMed:22162136] [PMC] [WorldCat] [DOI]