「細胞分化」の版間の差分
Kinichinakashima (トーク | 投稿記録) 細編集の要約なし |
細編集の要約なし |
||
| (3人の利用者による、間の30版が非表示) | |||
| 1行目: | 1行目: | ||
<div align="right"> | |||
<font size="+1">中嶋 秀行、[http://researchmap.jp/kinichinakashima 中島 欽一]</font><br> | |||
''奈良先端科学技術大学院大学 バイオサイエンス研究科''<br> | |||
DOI:<selfdoi /> 原稿受付日:2012年10月1日 原稿完成日:2012年10月2日<br> | |||
担当編集委員:[http://researchmap.jp/fujiomurakami 村上 富士夫](大阪大学 大学院生命機能研究科)<br> | |||
</div> | |||
英語名:Cell differentiation | 英語名:Cell differentiation | ||
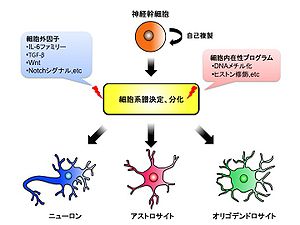
[[Image:H-nakashima-fig-1.jpg|thumb| | [[Image:H-nakashima-fig-1.jpg|thumb|300px|<b>図1:神経幹細胞の分化制御</b><br />神経幹細胞は自己複製能を持つだけでなく、中枢神経系を構成する主要な細胞種であるニューロン、アストロサイト、オリゴデンドロサイトのいずれにも分化する多分化能を有している。神経幹細胞の運命決定はサイトカインなどの細胞外因子とエピジェネティックな制御に代表される細胞内在性プログラムによりコントロールされている。]] | ||
{{box|text= | |||
発生の過程で細胞が形態的、機能的に特殊性を獲得していく過程。[[中枢神経系]]を構成する主要な細胞種である[[ニューロン]]、[[アストロサイト]]、[[オリゴデンドロサイト]]は、共通の[[神経幹細胞]]から分化・産生される。しかし神経幹細胞は、発生初期からこれら細胞への多分化能を持っているわけではなく、胎生中期においてまずニューロンのみへの分化能を獲得し、発生が進行した胎生後期にようやく[[グリア細胞]]への分化能も獲得して多分化能を持った細胞となる。神経幹細胞の分化は[[サイトカイン]]などの細胞外因子等のクロストークのみならず、[[エピジェネティック]]なゲノム修飾等の細胞内在性プログラムにより時空間的に制御されている(図1)。 | |||
}} | |||
== 神経幹細胞の分化制御機構 == | == 神経幹細胞の分化制御機構 == | ||
| 11行目: | 18行目: | ||
=== ニューロン分化制御 === | === ニューロン分化制御 === | ||
骨格筋、心筋、骨、血液、皮膚など種々の組織における[[細胞系譜]]の制御に関与する[[bHLH因子|塩基性ヘリックス−ループ−ヘリックス(basic helix-loop-helix : bHLH)]]型転写因子は、神経系においてはプロニューラル遺伝子としてニューロン分化に関与する。神経系に発現しニューロン分化を促進するbHLH型転写因子として[[Mammalian achaete-scute homolog 1]](Mash1)、[[Neurogenin(Neurog)1]]、[[Neurog2]]、[[Mammalian atonal homolog 1]](Math1)、[[Neurogenic differentiation]](NeuroD)などが同定されている。Mash1はショウジョウバエで同定されたプロニューラル遺伝子群[[Achaete-scute complex]](AS-C) の哺乳類ホモログで、胎生期に一部の[[ニューロン前駆体]]において一過性な発現が観られ、中枢神経系では腹側のニューロン分化に、末梢神経系では交感神経や嗅神経の分化に深く関与する<ref name="ref1"><pubmed>8221886</pubmed></ref>。Neurog1、Neurog2は中枢神経系でMash1と相補的な部位に発現し、主に背側のニューロン分化に寄与する<ref name="ref2"><pubmed>10640277</pubmed></ref>。Math1は[[小脳外顆粒層]]の分化に<ref name="ref3"><pubmed>9367153</pubmed></ref>、NeuroDはニューロンの成熟において重要な働きを示すことが知られている<ref name="ref2"><pubmed>10640277</pubmed></ref>。 | |||
ニューロン分化を抑制するHLH型因子としては、ショウジョウバエで同定された[[hairy and enhancer of split]]の哺乳類ホモログ[[Hes]]、[[extramacrochaetae]]の哺乳類ホモログ[[inhibitor of differentiation]](Id)が同定されている<ref name="ref4"><pubmed>9388783</pubmed></ref>。Hes因子群は、ニューロンへの分化を促進するプロニューラル遺伝子プロモーター上に結合して発現を抑制したり、Mash1などのプロニューラル因子と直接結合しその機能を阻害することによってニューロンへの分化を抑制する<ref name="ref5"><pubmed>1340473</pubmed></ref>。IdはbHLH型転写因子に加え、Eタンパク質群等とヘテロ2量体を形成し、様々な細胞分化を抑制する<ref name="ref6"><pubmed>9695810</pubmed></ref>。また[[骨形成因子]](bone morphogenetic protein; BMP)や[[Notch]]シグナルはこれらの因子の発現を誘導することでニューロン分化を抑制し、神経幹細胞の分化状態をコントロールしている<ref name="ref7"><pubmed>11331769</pubmed></ref><ref name="ref8"><pubmed>10205173</pubmed></ref>。 | |||
ところで、DNAとともに[[クロマチン]]を構成する[[ヒストン]]の修飾が遺伝子発現に大きな影響を与えるため、細胞分化においても重要な働きを示すものと考えられる。これに関連して神経幹細胞では、ヒストン[[アセチル化|脱アセチル化酵素]]([[histone deacetylase]]; HDAC)阻害剤でありかつ長らく[[てんかん|抗てんかん薬]]として利用されてきたバルプロ酸(VPA)の処理により、神経幹細胞内のヒストンアセチル化が亢進し、ニューロン分化が促進されることが報告された<ref name="ref9"><pubmed>15537713</pubmed></ref>。この際、前述のNeuroDの発現亢進が見られ、これによりVPAはニューロン分化を促進できるのではないかと推察されている。 | |||
=== アストロサイト分化制御 === | === アストロサイト分化制御 === | ||
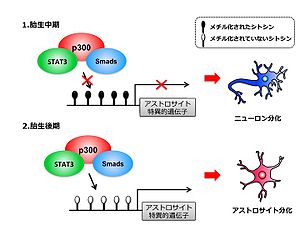
[[Image:H-nakashima-fig-2.jpg|thumb|300px|<b>図2:DNA脱メチル化による神経幹細胞のアストロサイト分可能獲得機構</b><br />胎生中期の神経幹細胞は、アストロサイト特異的遺伝子のプロモーター領域はメチル化を受けており遺伝子の発現が抑制されているが、胎生後期以降になるとそのプロモーター領域の脱メチル化が生じ、アストロサイトへの分化能を獲得する。]] 神経幹細胞からのアストロサイトへの分化誘導には[[白血病阻害因子]](leukemia inhibitory factor ; LIF)や[[毛様体神経栄養因子]](ciliary neurotrophic factor; CNTF)などの[[IL-6]]ファミリーとBMP2等のBMPファミリーに属するサイトカインが重要な役割を担っている<ref name="ref10"><pubmed>8893018</pubmed></ref><ref name="ref11"><pubmed>9334309</pubmed></ref>。IL-6ファミリーサイトカインは共通の受容体コンポーネント[[gp130]]のホモ2量体形成あるいはgp130とLIF受容体のヘテロ2量対形成を誘導する。この2量体形成により相互に隣接した[[Janusキナーゼ]](JAK)が自己リン酸化することで活性化され、活性化されたJAKは受容体細胞内領域のチロシン残基をリン酸化する。リン酸化されたチロシン残基には[[STAT3|signal transducer and activator of transcription 3]](STAT3)が自身の[[Src homology 2]](SH2)ドメインを介して結合し、近接したJAKによりチロシンリン酸化を受け活性化される。活性化されたSTAT3はホモダイマーを形成後、核へ移行し標的遺伝子の発現を誘導する。BMPは[[transforming growth factorβ]](TGFβ)スーパーファミリーに属するサイトカインで、Ⅰ型およびⅡ型BMP受容体が2分子ずつ会合したヘテロ4量体を介して細胞内にシグナルを伝達する。BMP-2等のリガンドの結合によって活性化された受容体は転写因子[[Smad1]]、[[Smad5]]あるいは[[Smad8]]のセリン残基をリン酸化することによってそれらを活性化する。活性化されたSmad1/5/8はSmad4とヘテロオリゴマーを形成した後に核へ移行し、標的遺伝子の転写を誘導する。これら2つのサイトカインファミリーによるシグナル伝達経路の下流で活性化されるSTAT3とSmad1は転写共役因子[[p300]]を介して複合体を形成することでアストロサイト特異的遺伝子の相乗的な転写活性化を誘導する<ref name="ref12"><pubmed>10205054</pubmed></ref>。近年、[[レチノイン酸]](RA)がアストロサイト分化誘導因子であるLIFと相乗的に働くことで、神経幹細胞のアストロサイト分化を促進することが見出された<ref name="ref13"><pubmed>19609931</pubmed></ref>。RAはヒストンアセチル化の亢進によるクロマチン構造の脱凝縮を誘導し、LIFによって活性化されたSTAT3のアストロサイト特異的遺伝子[[Glial fibrillary acidic protein]](GFAP)[[プロモーター]]への結合を増強させることにより、神経幹細胞のアストロサイト分化を促進する。 | |||
神経幹細胞は胎生初期には自己複製のみを繰り返すが、胎生中期になるとニューロンへの分化能を獲得し、胎生後期以降はアストロサイトやオリゴデンドロサイトへの分化能を獲得することで多分化能をもった神経幹細胞として成熟する。このような発生段階依存的な神経幹細胞の分化制御はDNAの[[メチル化]]が重要な役割を果たしている。胎生期神経幹細胞は発生段階に応じてアストロサイト特異的遺伝子プロモーターが脱メチル化を受けることによりアストロサイト分化誘導性サイトカインに対する応答性を獲得し、胎生後期以降の神経幹細胞ではアストロサイトへの分化が可能となる(図2)<ref name="ref14"><pubmed>11740937</pubmed></ref>。また、プロニューラル遺伝子群の一つであるNuerogはニューロン分化がさかんな胎生中期に高発現しニューロン分化を促進する一方、アストロサイト分化を抑制することが報告されている<ref name="ref15"><pubmed>11239394</pubmed></ref>。NeurogはBMP刺激で活性化され形成されたSmad/p300複合体と会合して、LIFとBMP刺激によるSmad/p300/STAT3複合体形成を阻害することでアストロサイトへの分化を抑制する。 | |||
=== オリゴデンドロサイト分化制御 === | === オリゴデンドロサイト分化制御 === | ||
オリゴデンドロサイトの分化において、[[SHH|sonic hedgehog]](Shh)の中和抗体の投与によりその機能を阻害するとオリゴデンドロサイトの出現が阻害されることや、逆に異所性にShhを発現させることによりオリゴデンドロサイトを誘導できることから、Shhがオリゴデンドロサイトの分化に重要な役割を果たすことが示されている<ref name="ref16"><pubmed>10719353</pubmed></ref>。 | |||
オリゴデンドロサイトへの分化を制御する因子としてbHLH型転写因子である[[Oligodendrocyte transcription factor(Olig)1]]および[[Olig2]]が報告されている<ref name="ref17"><pubmed>10719888</pubmed></ref><ref name="ref18"><pubmed>10719889</pubmed></ref><ref name="ref19"><pubmed>11091082</pubmed></ref>。Olig1あるいはOlig2を強制発現させるとオリゴデンドロサイトの分化が促進し、Olig1およびOlig2両方を欠損したマウスではオリゴデンドロサイトが欠如する。また、Olig1とOlig2の発現はShh欠損マウスでみられなくなることから、Shhにより発現が制御されていると考えられている。これらオリゴデンドロサイト分化を誘導する因子も、ニューロン分化と同様にbHLH型転写因子によって制御されており、HesやIdの発現を誘導するBMPやNotchシグナルはニューロン分化と同様の作用機構によりオリゴデンドロサイト分化も抑制する。ところで近年、神経幹細胞のオリゴデンドロサイトへの分化に必須の因子として[[Yin Yang 1]](YY1)が報告された。これまでオリゴデンドロサイトへの分化を抑制する因子として[[Transcription factor 4]](Tcf4)やId4が知られていたが、YY1はこれらのプロモーターに結合しHDACをリクルートすることによって遺伝子発現を抑制しオリゴデンドロサイトへの分化を促進することが示されている<ref name="ref20"><pubmed>17640524</pubmed></ref>。 | |||
<br> | |||
{| border="1" cellpadding="1" style="width:70%" | |||
|+ '''表1:主な分化制御因子''' | |||
|- | |||
| style="text-align:center" | '''分化''' | |||
| style="text-align:center" | '''因子''' | |||
| style="text-align:center" | '''分子名''' | |||
| style="text-align:center" | '''促進''' | |||
| style="text-align:center" | '''抑制''' | |||
| style="text-align:center" | '''参考文献''' | |||
|- | |||
| rowspan="9" style="text-align:center; width:30%" | '''ニューロン分化''' | |||
| rowspan="3" style="text-align:center" | 細胞外因子 | |||
| [[BMP2]], [[BMP4|4]] | |||
| rowspan="2" | | |||
| style="color:blue; text-align:center" | ● | |||
| style="text-align:center" | <ref name="ref7"><pubmed>11331769</pubmed></ref> | |||
|- | |||
| [[Notch]] | |||
| style="color:blue; text-align:center" | ● | |||
| style="text-align:center" | <ref name="ref8"><pubmed>10205173</pubmed></ref> | |||
|- | |||
| [[Wnt]] | |||
| style="color:red; text-align:center" | ● | |||
| rowspan="5" | | |||
| style="text-align:center" | <ref name="ref27"><pubmed>15142975</pubmed></ref> | |||
|- | |||
| rowspan="6" style="text-align:center" | 転写因子 | |||
| [[Mash1]] | |||
| style="color:red; text-align:center" | ● | |||
| style="text-align:center" | <ref name="ref21"><pubmed>8221886</pubmed></ref> | |||
|- | |||
| [[Neurog]] | |||
| style="color:red; text-align:center" | ● | |||
| style="text-align:center" | <ref name="ref22"><pubmed>9539122</pubmed></ref> | |||
|- | |||
| [[Math1]] | |||
| style="color:red; text-align:center" | ● | |||
| style="text-align:center" | <ref name="ref3"><pubmed>9367153</pubmed></ref> | |||
|- | |||
| [[NeuroD]] | |||
| style="color:red; text-align:center" | ● | |||
| style="text-align:center" | <ref name="ref23"><pubmed>7754368</pubmed></ref> | |||
|- | |||
| [[Hes1]], [[Hes5|5]] | |||
| rowspan="2" | | |||
| style="color:blue; text-align:center" | ● | |||
| style="text-align:center" | <ref name="ref5"><pubmed>1340473</pubmed></ref><ref name="ref24"><pubmed>7909512</pubmed></ref> | |||
|- | |||
| [[Id1]], [[Id3|3]] | |||
| style="color:blue; text-align:center" | ● | |||
| style="text-align:center" | <ref name="ref25"><pubmed>7623812</pubmed></ref><ref name="ref26"><pubmed>10537105</pubmed></ref> | |||
|- | |||
| rowspan="9" style="text-align:center" | '''アストロサイト分化''' | |||
| rowspan="3" style="text-align:center" | 細胞外因子 | |||
| BMP2, 4 | |||
| style="color:red; text-align:center" | ● | |||
| rowspan="6" | | |||
| style="text-align:center" | <ref name="ref10"><pubmed>8893018</pubmed></ref> | |||
|- | |||
| [[LIF]]/[[CNTF]] | |||
| style="color:red; text-align:center" | ● | |||
| style="text-align:center" | <ref name="ref11"><pubmed>9334309</pubmed></ref> | |||
|- | |||
| Retinoic acid (RA) | |||
| style="color:red; text-align:center" | ● | |||
| style="text-align:center" | <ref name="ref13"><pubmed>19609931</pubmed></ref> | |||
|- | |||
| rowspan="6" style="text-align:center" | 転写因子 | |||
| [[Smads]] | |||
| style="color:red; text-align:center" | ● | |||
| style="text-align:center" | <ref name="ref12"><pubmed>10205054</pubmed></ref> | |||
|- | |||
| [[STAT3]] | |||
| style="color:red; text-align:center" | ● | |||
| style="text-align:center" | <ref name="ref12"><pubmed>10205054</pubmed></ref> | |||
|- | |||
| [[p300]]/[[CBP]] | |||
| style="color:red; text-align:center" | ● | |||
| style="text-align:center" | <ref name="ref11"><pubmed>9334309</pubmed></ref><ref name="ref12"><pubmed>10205054</pubmed></ref> | |||
|- | |||
| Neurog | |||
| | |||
| style="color:blue; text-align:center" | ● | |||
| style="text-align:center" | <ref name="ref15"><pubmed>11239394</pubmed></ref> | |||
|- | |||
| Hes5 | |||
| style="color:red; text-align:center" | ● | |||
| rowspan="3" | | |||
| style="text-align:center" | <ref name="ref28"><pubmed>10821751</pubmed></ref> | |||
|- | |||
| [[Id4]] | |||
| style="color:red; text-align:center" | ● | |||
| style="text-align:center" | <ref name="ref29"><pubmed>15469968</pubmed></ref> | |||
|- | |||
| rowspan="9" style="text-align:center" | '''オリゴデンドロサイト分化''' | |||
| rowspan="3" style="text-align:center" | 細胞外因子 | |||
| Shh | |||
| style="color:red; text-align:center" | ● | |||
| style="text-align:center" | <ref name="ref16"><pubmed>10719353</pubmed></ref> | |||
|- | |||
| BMP2, 4 | |||
| rowspan="2" | | |||
| style="color:blue; text-align:center" | ● | |||
| style="text-align:center" | <ref name="ref33"><pubmed>12399304</pubmed></ref> | |||
|- | |||
| Notch | |||
| style="color:blue; text-align:center" | ● | |||
| style="text-align:center" | <ref name="ref34"><pubmed>9697852</pubmed></ref> | |||
|- | |||
| rowspan="6" style="text-align:center" | 転写因子 | |||
| [[Olig1]], [[Olig2|2]] | |||
| style="color:red; text-align:center" | ● | |||
| | |||
| style="text-align:center" | <ref name="ref17"><pubmed>10719888</pubmed></ref><ref name="ref18"><pubmed>10719889</pubmed></ref><ref name="ref19"><pubmed>11091082</pubmed></ref> | |||
|- | |||
| Hes5 | |||
| rowspan="2" | | |||
| style="color:blue; text-align:center" | ● | |||
| style="text-align:center" | <ref name="ref30"><pubmed>10862737</pubmed></ref> | |||
|- | |||
| Id2, 4 | |||
| style="color:blue; text-align:center" | ● | |||
| style="text-align:center" | <ref name="ref31"><pubmed>11301021</pubmed></ref><ref name="ref32"><pubmed>10790366</pubmed></ref> | |||
|- | |||
| [[YY1]] | |||
| style="color:red; text-align:center" | ● | |||
| | |||
| style="text-align:center" | <ref name="ref20"><pubmed>17640524</pubmed></ref> | |||
|- | |||
| [[Tcf4]] | |||
| | |||
| style="color:blue; text-align:center" | ● | |||
| style="text-align:center" | <ref name="ref35"><pubmed>15950605</pubmed></ref> | |||
|- | |||
| [[HDAC]] | |||
| style="color:red; text-align:center" | ● | |||
| | |||
| style="text-align:center" | <ref name="ref20"><pubmed>17640524</pubmed></ref> | |||
|} | |||
== ニューロンへの分化転換 == | == ニューロンへの分化転換 == | ||
細胞分化は緻密なカスケード反応により制御され、一方向性であると考えられてきたが、最近ある種の操作を加えることで、細胞はこのカスケード過程を逆行(脱分化)、あるいは異なる細胞種へ分化転換できることが示されている。ヒト線維芽細胞に[[胚性幹細胞|胚性幹(ES)細胞]]で発現する4つの遺伝子、[[Octamer-binding transcription factor-3/4(Oct3/4)]]、[[Sry-related HMG box transcription factor 2]](Sox2)、[[Kruppel-like factor 4]](Klf4)、[[c-Myc]]あるいはc-Mycを除いた3つの遺伝子を導入することにより、ES細胞様の[[iPS細胞|多能性幹細胞]](induced pluripotent stem cell: iPS cell)を作製できる<ref name="ref36"><pubmed>16904174</pubmed></ref><ref name="ref37"><pubmed>18059259</pubmed></ref>。これらESやiPS細胞などの多能性幹細胞から神経系細胞を分化誘導する方法として、[[胚葉体(EB : Embryoid Body)形成法]]<ref name="ref38"><pubmed>10835609</pubmed></ref>、[[レチノイン酸法]]<ref name="ref39"><pubmed>7729574</pubmed></ref>、[[Stromal Cell-Derived Inducing Activity(SDIA)法]]<ref name="ref40"><pubmed>11086981</pubmed></ref>、[[無血清凝集浮遊培養(SFEBq : Serum-free Floating culture of Embryoid Body-like aggregates with quick reaggregation)法]]<ref name="ref41"><pubmed>15696161</pubmed></ref>など、分化効率や誘導される神経系細胞にそれぞれ特徴のある分化誘導法が現在までに数多く報告されている。近年、ES細胞からニューロンへの分化開始に働く因子としてES細胞で発現する核内タンパク質[[Zinc finger protein 521]](Zfp521)が同定された。Zfp521は転写促進因子として機能し、核の中でDNAに結合しニューロン分化に必要な複数の遺伝子の発現をオンにすることで選択的にニューロン分化を誘導することが示された<ref name="ref42"><pubmed>21326203</pubmed></ref>。また、iPS細胞を介さずに神経系細胞へと直接分化誘導する「ダイレクトリプログラミング」の研究も盛んに行われている。ヒト線維芽細胞に転写因子であるMash1、[[Brn2]]、[[Myelin transcription factor 1-like]](Myt1)、NeuroD1の4つの遺伝子を強制発現させることで、機能的な[[誘導神経(iN)細胞]]へと転換できることが示された<ref name="ref43"><pubmed>21617644</pubmed></ref>。また、Mash1、[[Nurr1]]、[[LIM homeobox transcription factor 1 alpha]](Lmx1a)の3つの遺伝子をヒト線維芽細胞に導入することで、直接的に機能的な[[ドーパミン神経系|ドーパミン作動性細胞]]を生成できることが報告された<ref name="ref44"><pubmed>21725324</pubmed></ref>。さらに、[[miRNA|microRNA(miRNA)]]を用いた分化転換も報告されており、[[miR-9/9*]]と[[miR-124]]を発現させることで、ヒト線維芽細胞からニューロンへ直接的な転換を誘導できることも示されている<ref name="ref45"><pubmed>21753754</pubmed></ref>。 | |||
神経幹細胞の各細胞系譜への分化制御はここ数年急速に解明されつつあり、それを応用した神経幹細胞による再生医療の研究が盛んに行われている。iPS細胞の樹立によって、体細胞からES細胞同様の多能性幹細胞が作製可能となり、免役拒絶反応やヒト胚利用による倫理的問題は回避されつつあるが、未分化細胞による奇形種形成や腫瘍形成等の問題は未だ解決されていない。しかし最近ではiPS細胞を介さない「ダイレクトリプログラミング」による研究成果や、安全性の高いiPS細胞の純化精製法の研究により腫瘍形成リスクの低い新たな治療法の開発も進められており、今後さらなる神経再生医療の実現が期待される。 | |||
== 関連項目 == | == 関連項目 == | ||
*[[神経幹細胞]] | *[[神経幹細胞]] | ||
*[[細胞増殖]] | |||
== 参考文献 == | |||
<references /> | |||
2014年6月9日 (月) 15:02時点における最新版
中嶋 秀行、中島 欽一
奈良先端科学技術大学院大学 バイオサイエンス研究科
DOI:10.14931/bsd.2560 原稿受付日:2012年10月1日 原稿完成日:2012年10月2日
担当編集委員:村上 富士夫(大阪大学 大学院生命機能研究科)
英語名:Cell differentiation
発生の過程で細胞が形態的、機能的に特殊性を獲得していく過程。中枢神経系を構成する主要な細胞種であるニューロン、アストロサイト、オリゴデンドロサイトは、共通の神経幹細胞から分化・産生される。しかし神経幹細胞は、発生初期からこれら細胞への多分化能を持っているわけではなく、胎生中期においてまずニューロンのみへの分化能を獲得し、発生が進行した胎生後期にようやくグリア細胞への分化能も獲得して多分化能を持った細胞となる。神経幹細胞の分化はサイトカインなどの細胞外因子等のクロストークのみならず、エピジェネティックなゲノム修飾等の細胞内在性プログラムにより時空間的に制御されている(図1)。
神経幹細胞の分化制御機構
ニューロン分化制御
骨格筋、心筋、骨、血液、皮膚など種々の組織における細胞系譜の制御に関与する塩基性ヘリックス−ループ−ヘリックス(basic helix-loop-helix : bHLH)型転写因子は、神経系においてはプロニューラル遺伝子としてニューロン分化に関与する。神経系に発現しニューロン分化を促進するbHLH型転写因子としてMammalian achaete-scute homolog 1(Mash1)、Neurogenin(Neurog)1、Neurog2、Mammalian atonal homolog 1(Math1)、Neurogenic differentiation(NeuroD)などが同定されている。Mash1はショウジョウバエで同定されたプロニューラル遺伝子群Achaete-scute complex(AS-C) の哺乳類ホモログで、胎生期に一部のニューロン前駆体において一過性な発現が観られ、中枢神経系では腹側のニューロン分化に、末梢神経系では交感神経や嗅神経の分化に深く関与する[1]。Neurog1、Neurog2は中枢神経系でMash1と相補的な部位に発現し、主に背側のニューロン分化に寄与する[2]。Math1は小脳外顆粒層の分化に[3]、NeuroDはニューロンの成熟において重要な働きを示すことが知られている[2]。
ニューロン分化を抑制するHLH型因子としては、ショウジョウバエで同定されたhairy and enhancer of splitの哺乳類ホモログHes、extramacrochaetaeの哺乳類ホモログinhibitor of differentiation(Id)が同定されている[4]。Hes因子群は、ニューロンへの分化を促進するプロニューラル遺伝子プロモーター上に結合して発現を抑制したり、Mash1などのプロニューラル因子と直接結合しその機能を阻害することによってニューロンへの分化を抑制する[5]。IdはbHLH型転写因子に加え、Eタンパク質群等とヘテロ2量体を形成し、様々な細胞分化を抑制する[6]。また骨形成因子(bone morphogenetic protein; BMP)やNotchシグナルはこれらの因子の発現を誘導することでニューロン分化を抑制し、神経幹細胞の分化状態をコントロールしている[7][8]。
ところで、DNAとともにクロマチンを構成するヒストンの修飾が遺伝子発現に大きな影響を与えるため、細胞分化においても重要な働きを示すものと考えられる。これに関連して神経幹細胞では、ヒストン脱アセチル化酵素(histone deacetylase; HDAC)阻害剤でありかつ長らく抗てんかん薬として利用されてきたバルプロ酸(VPA)の処理により、神経幹細胞内のヒストンアセチル化が亢進し、ニューロン分化が促進されることが報告された[9]。この際、前述のNeuroDの発現亢進が見られ、これによりVPAはニューロン分化を促進できるのではないかと推察されている。
アストロサイト分化制御
神経幹細胞からのアストロサイトへの分化誘導には白血病阻害因子(leukemia inhibitory factor ; LIF)や毛様体神経栄養因子(ciliary neurotrophic factor; CNTF)などのIL-6ファミリーとBMP2等のBMPファミリーに属するサイトカインが重要な役割を担っている[10][11]。IL-6ファミリーサイトカインは共通の受容体コンポーネントgp130のホモ2量体形成あるいはgp130とLIF受容体のヘテロ2量対形成を誘導する。この2量体形成により相互に隣接したJanusキナーゼ(JAK)が自己リン酸化することで活性化され、活性化されたJAKは受容体細胞内領域のチロシン残基をリン酸化する。リン酸化されたチロシン残基にはsignal transducer and activator of transcription 3(STAT3)が自身のSrc homology 2(SH2)ドメインを介して結合し、近接したJAKによりチロシンリン酸化を受け活性化される。活性化されたSTAT3はホモダイマーを形成後、核へ移行し標的遺伝子の発現を誘導する。BMPはtransforming growth factorβ(TGFβ)スーパーファミリーに属するサイトカインで、Ⅰ型およびⅡ型BMP受容体が2分子ずつ会合したヘテロ4量体を介して細胞内にシグナルを伝達する。BMP-2等のリガンドの結合によって活性化された受容体は転写因子Smad1、Smad5あるいはSmad8のセリン残基をリン酸化することによってそれらを活性化する。活性化されたSmad1/5/8はSmad4とヘテロオリゴマーを形成した後に核へ移行し、標的遺伝子の転写を誘導する。これら2つのサイトカインファミリーによるシグナル伝達経路の下流で活性化されるSTAT3とSmad1は転写共役因子p300を介して複合体を形成することでアストロサイト特異的遺伝子の相乗的な転写活性化を誘導する[12]。近年、レチノイン酸(RA)がアストロサイト分化誘導因子であるLIFと相乗的に働くことで、神経幹細胞のアストロサイト分化を促進することが見出された[13]。RAはヒストンアセチル化の亢進によるクロマチン構造の脱凝縮を誘導し、LIFによって活性化されたSTAT3のアストロサイト特異的遺伝子Glial fibrillary acidic protein(GFAP)プロモーターへの結合を増強させることにより、神経幹細胞のアストロサイト分化を促進する。
神経幹細胞は胎生初期には自己複製のみを繰り返すが、胎生中期になるとニューロンへの分化能を獲得し、胎生後期以降はアストロサイトやオリゴデンドロサイトへの分化能を獲得することで多分化能をもった神経幹細胞として成熟する。このような発生段階依存的な神経幹細胞の分化制御はDNAのメチル化が重要な役割を果たしている。胎生期神経幹細胞は発生段階に応じてアストロサイト特異的遺伝子プロモーターが脱メチル化を受けることによりアストロサイト分化誘導性サイトカインに対する応答性を獲得し、胎生後期以降の神経幹細胞ではアストロサイトへの分化が可能となる(図2)[14]。また、プロニューラル遺伝子群の一つであるNuerogはニューロン分化がさかんな胎生中期に高発現しニューロン分化を促進する一方、アストロサイト分化を抑制することが報告されている[15]。NeurogはBMP刺激で活性化され形成されたSmad/p300複合体と会合して、LIFとBMP刺激によるSmad/p300/STAT3複合体形成を阻害することでアストロサイトへの分化を抑制する。
オリゴデンドロサイト分化制御
オリゴデンドロサイトの分化において、sonic hedgehog(Shh)の中和抗体の投与によりその機能を阻害するとオリゴデンドロサイトの出現が阻害されることや、逆に異所性にShhを発現させることによりオリゴデンドロサイトを誘導できることから、Shhがオリゴデンドロサイトの分化に重要な役割を果たすことが示されている[16]。
オリゴデンドロサイトへの分化を制御する因子としてbHLH型転写因子であるOligodendrocyte transcription factor(Olig)1およびOlig2が報告されている[17][18][19]。Olig1あるいはOlig2を強制発現させるとオリゴデンドロサイトの分化が促進し、Olig1およびOlig2両方を欠損したマウスではオリゴデンドロサイトが欠如する。また、Olig1とOlig2の発現はShh欠損マウスでみられなくなることから、Shhにより発現が制御されていると考えられている。これらオリゴデンドロサイト分化を誘導する因子も、ニューロン分化と同様にbHLH型転写因子によって制御されており、HesやIdの発現を誘導するBMPやNotchシグナルはニューロン分化と同様の作用機構によりオリゴデンドロサイト分化も抑制する。ところで近年、神経幹細胞のオリゴデンドロサイトへの分化に必須の因子としてYin Yang 1(YY1)が報告された。これまでオリゴデンドロサイトへの分化を抑制する因子としてTranscription factor 4(Tcf4)やId4が知られていたが、YY1はこれらのプロモーターに結合しHDACをリクルートすることによって遺伝子発現を抑制しオリゴデンドロサイトへの分化を促進することが示されている[20]。
| 分化 | 因子 | 分子名 | 促進 | 抑制 | 参考文献 |
| ニューロン分化 | 細胞外因子 | BMP2, 4 | ● | [7] | |
| Notch | ● | [8] | |||
| Wnt | ● | [21] | |||
| 転写因子 | Mash1 | ● | [22] | ||
| Neurog | ● | [23] | |||
| Math1 | ● | [3] | |||
| NeuroD | ● | [24] | |||
| Hes1, 5 | ● | [5][25] | |||
| Id1, 3 | ● | [26][27] | |||
| アストロサイト分化 | 細胞外因子 | BMP2, 4 | ● | [10] | |
| LIF/CNTF | ● | [11] | |||
| Retinoic acid (RA) | ● | [13] | |||
| 転写因子 | Smads | ● | [12] | ||
| STAT3 | ● | [12] | |||
| p300/CBP | ● | [11][12] | |||
| Neurog | ● | [15] | |||
| Hes5 | ● | [28] | |||
| Id4 | ● | [29] | |||
| オリゴデンドロサイト分化 | 細胞外因子 | Shh | ● | [16] | |
| BMP2, 4 | ● | [30] | |||
| Notch | ● | [31] | |||
| 転写因子 | Olig1, 2 | ● | [17][18][19] | ||
| Hes5 | ● | [32] | |||
| Id2, 4 | ● | [33][34] | |||
| YY1 | ● | [20] | |||
| Tcf4 | ● | [35] | |||
| HDAC | ● | [20] |
ニューロンへの分化転換
細胞分化は緻密なカスケード反応により制御され、一方向性であると考えられてきたが、最近ある種の操作を加えることで、細胞はこのカスケード過程を逆行(脱分化)、あるいは異なる細胞種へ分化転換できることが示されている。ヒト線維芽細胞に胚性幹(ES)細胞で発現する4つの遺伝子、Octamer-binding transcription factor-3/4(Oct3/4)、Sry-related HMG box transcription factor 2(Sox2)、Kruppel-like factor 4(Klf4)、c-Mycあるいはc-Mycを除いた3つの遺伝子を導入することにより、ES細胞様の多能性幹細胞(induced pluripotent stem cell: iPS cell)を作製できる[36][37]。これらESやiPS細胞などの多能性幹細胞から神経系細胞を分化誘導する方法として、胚葉体(EB : Embryoid Body)形成法[38]、レチノイン酸法[39]、Stromal Cell-Derived Inducing Activity(SDIA)法[40]、無血清凝集浮遊培養(SFEBq : Serum-free Floating culture of Embryoid Body-like aggregates with quick reaggregation)法[41]など、分化効率や誘導される神経系細胞にそれぞれ特徴のある分化誘導法が現在までに数多く報告されている。近年、ES細胞からニューロンへの分化開始に働く因子としてES細胞で発現する核内タンパク質Zinc finger protein 521(Zfp521)が同定された。Zfp521は転写促進因子として機能し、核の中でDNAに結合しニューロン分化に必要な複数の遺伝子の発現をオンにすることで選択的にニューロン分化を誘導することが示された[42]。また、iPS細胞を介さずに神経系細胞へと直接分化誘導する「ダイレクトリプログラミング」の研究も盛んに行われている。ヒト線維芽細胞に転写因子であるMash1、Brn2、Myelin transcription factor 1-like(Myt1)、NeuroD1の4つの遺伝子を強制発現させることで、機能的な誘導神経(iN)細胞へと転換できることが示された[43]。また、Mash1、Nurr1、LIM homeobox transcription factor 1 alpha(Lmx1a)の3つの遺伝子をヒト線維芽細胞に導入することで、直接的に機能的なドーパミン作動性細胞を生成できることが報告された[44]。さらに、microRNA(miRNA)を用いた分化転換も報告されており、miR-9/9*とmiR-124を発現させることで、ヒト線維芽細胞からニューロンへ直接的な転換を誘導できることも示されている[45]。
神経幹細胞の各細胞系譜への分化制御はここ数年急速に解明されつつあり、それを応用した神経幹細胞による再生医療の研究が盛んに行われている。iPS細胞の樹立によって、体細胞からES細胞同様の多能性幹細胞が作製可能となり、免役拒絶反応やヒト胚利用による倫理的問題は回避されつつあるが、未分化細胞による奇形種形成や腫瘍形成等の問題は未だ解決されていない。しかし最近ではiPS細胞を介さない「ダイレクトリプログラミング」による研究成果や、安全性の高いiPS細胞の純化精製法の研究により腫瘍形成リスクの低い新たな治療法の開発も進められており、今後さらなる神経再生医療の実現が期待される。
関連項目
参考文献
- ↑
Guillemot, F., Lo, L.C., Johnson, J.E., Auerbach, A., Anderson, D.J., & Joyner, A.L. (1993).
Mammalian achaete-scute homolog 1 is required for the early development of olfactory and autonomic neurons. Cell, 75(3), 463-76. [PubMed:8221886] [WorldCat] [DOI] - ↑ 2.0 2.1
Fode, C., Ma, Q., Casarosa, S., Ang, S.L., Anderson, D.J., & Guillemot, F. (2000).
A role for neural determination genes in specifying the dorsoventral identity of telencephalic neurons. Genes & development, 14(1), 67-80. [PubMed:10640277] [PMC] [WorldCat] - ↑ 3.0 3.1
Ben-Arie, N., Bellen, H.J., Armstrong, D.L., McCall, A.E., Gordadze, P.R., Guo, Q., ..., & Zoghbi, H.Y. (1997).
Math1 is essential for genesis of cerebellar granule neurons. Nature, 390(6656), 169-72. [PubMed:9367153] [WorldCat] [DOI] - ↑
Kageyama, R., & Nakanishi, S. (1997).
Helix-loop-helix factors in growth and differentiation of the vertebrate nervous system. Current opinion in genetics & development, 7(5), 659-65. [PubMed:9388783] [WorldCat] [DOI] - ↑ 5.0 5.1
Sasai, Y., Kageyama, R., Tagawa, Y., Shigemoto, R., & Nakanishi, S. (1992).
Two mammalian helix-loop-helix factors structurally related to Drosophila hairy and Enhancer of split. Genes & development, 6(12B), 2620-34. [PubMed:1340473] [WorldCat] [DOI] - ↑
Norton, J.D., Deed, R.W., Craggs, G., & Sablitzky, F. (1998).
Id helix-loop-helix proteins in cell growth and differentiation. Trends in cell biology, 8(2), 58-65. [PubMed:9695810] [WorldCat] - ↑ 7.0 7.1
Nakashima, K., Takizawa, T., Ochiai, W., Yanagisawa, M., Hisatsune, T., Nakafuku, M., ..., & Taga, T. (2001).
BMP2-mediated alteration in the developmental pathway of fetal mouse brain cells from neurogenesis to astrocytogenesis. Proceedings of the National Academy of Sciences of the United States of America, 98(10), 5868-73. [PubMed:11331769] [PMC] [WorldCat] [DOI] - ↑ 8.0 8.1
Ohtsuka, T., Ishibashi, M., Gradwohl, G., Nakanishi, S., Guillemot, F., & Kageyama, R. (1999).
Hes1 and Hes5 as notch effectors in mammalian neuronal differentiation. The EMBO journal, 18(8), 2196-207. [PubMed:10205173] [PMC] [WorldCat] [DOI] - ↑
Hsieh, J., Nakashima, K., Kuwabara, T., Mejia, E., & Gage, F.H. (2004).
Histone deacetylase inhibition-mediated neuronal differentiation of multipotent adult neural progenitor cells. Proceedings of the National Academy of Sciences of the United States of America, 101(47), 16659-64. [PubMed:15537713] [PMC] [WorldCat] [DOI] - ↑ 10.0 10.1
Gross, R.E., Mehler, M.F., Mabie, P.C., Zang, Z., Santschi, L., & Kessler, J.A. (1996).
Bone morphogenetic proteins promote astroglial lineage commitment by mammalian subventricular zone progenitor cells. Neuron, 17(4), 595-606. [PubMed:8893018] [WorldCat] [DOI] - ↑ 11.0 11.1 11.2
Bonni, A., Sun, Y., Nadal-Vicens, M., Bhatt, A., Frank, D.A., Rozovsky, I., ..., & Greenberg, M.E. (1997).
Regulation of gliogenesis in the central nervous system by the JAK-STAT signaling pathway. Science (New York, N.Y.), 278(5337), 477-83. [PubMed:9334309] [WorldCat] [DOI] - ↑ 12.0 12.1 12.2 12.3
Nakashima, K., Yanagisawa, M., Arakawa, H., Kimura, N., Hisatsune, T., Kawabata, M., ..., & Taga, T. (1999).
Synergistic signaling in fetal brain by STAT3-Smad1 complex bridged by p300. Science (New York, N.Y.), 284(5413), 479-82. [PubMed:10205054] [WorldCat] [DOI] - ↑ 13.0 13.1
Asano, H., Aonuma, M., Sanosaka, T., Kohyama, J., Namihira, M., & Nakashima, K. (2009).
Astrocyte differentiation of neural precursor cells is enhanced by retinoic acid through a change in epigenetic modification. Stem cells (Dayton, Ohio), 27(11), 2744-52. [PubMed:19609931] [WorldCat] [DOI] - ↑
Takizawa, T., Nakashima, K., Namihira, M., Ochiai, W., Uemura, A., Yanagisawa, M., ..., & Taga, T. (2001).
DNA methylation is a critical cell-intrinsic determinant of astrocyte differentiation in the fetal brain. Developmental cell, 1(6), 749-58. [PubMed:11740937] [WorldCat] - ↑ 15.0 15.1
Sun, Y., Nadal-Vicens, M., Misono, S., Lin, M.Z., Zubiaga, A., Hua, X., ..., & Greenberg, M.E. (2001).
Neurogenin promotes neurogenesis and inhibits glial differentiation by independent mechanisms. Cell, 104(3), 365-76. [PubMed:11239394] [WorldCat] [DOI] - ↑ 16.0 16.1
Lee, J.C., Mayer-Proschel, M., & Rao, M.S. (2000).
Gliogenesis in the central nervous system. Glia, 30(2), 105-21. [PubMed:10719353] [WorldCat] - ↑ 17.0 17.1
Lu, Q.R., Yuk, D., Alberta, J.A., Zhu, Z., Pawlitzky, I., Chan, J., ..., & Rowitch, D.H. (2000).
Sonic hedgehog--regulated oligodendrocyte lineage genes encoding bHLH proteins in the mammalian central nervous system. Neuron, 25(2), 317-29. [PubMed:10719888] [WorldCat] [DOI] - ↑ 18.0 18.1
Zhou, Q., Wang, S., & Anderson, D.J. (2000).
Identification of a novel family of oligodendrocyte lineage-specific basic helix-loop-helix transcription factors. Neuron, 25(2), 331-43. [PubMed:10719889] [WorldCat] [DOI] - ↑ 19.0 19.1
Takebayashi, H., Yoshida, S., Sugimori, M., Kosako, H., Kominami, R., Nakafuku, M., & Nabeshima, Y. (2000).
Dynamic expression of basic helix-loop-helix Olig family members: implication of Olig2 in neuron and oligodendrocyte differentiation and identification of a new member, Olig3. Mechanisms of development, 99(1-2), 143-8. [PubMed:11091082] [WorldCat] [DOI] - ↑ 20.0 20.1 20.2
He, Y., Dupree, J., Wang, J., Sandoval, J., Li, J., Liu, H., ..., & Casaccia-Bonnefil, P. (2007).
The transcription factor Yin Yang 1 is essential for oligodendrocyte progenitor differentiation. Neuron, 55(2), 217-30. [PubMed:17640524] [PMC] [WorldCat] [DOI] - ↑
Hirabayashi, Y., Itoh, Y., Tabata, H., Nakajima, K., Akiyama, T., Masuyama, N., & Gotoh, Y. (2004).
The Wnt/beta-catenin pathway directs neuronal differentiation of cortical neural precursor cells. Development (Cambridge, England), 131(12), 2791-801. [PubMed:15142975] [WorldCat] [DOI] - ↑
Guillemot, F., Lo, L.C., Johnson, J.E., Auerbach, A., Anderson, D.J., & Joyner, A.L. (1993).
Mammalian achaete-scute homolog 1 is required for the early development of olfactory and autonomic neurons. Cell, 75(3), 463-76. [PubMed:8221886] [WorldCat] [DOI] - ↑
Ma, Q., Chen, Z., del Barco Barrantes, I., de la Pompa, J.L., & Anderson, D.J. (1998).
neurogenin1 is essential for the determination of neuronal precursors for proximal cranial sensory ganglia. Neuron, 20(3), 469-82. [PubMed:9539122] [WorldCat] [DOI] - ↑
Lee, J.E., Hollenberg, S.M., Snider, L., Turner, D.L., Lipnick, N., & Weintraub, H. (1995).
Conversion of Xenopus ectoderm into neurons by NeuroD, a basic helix-loop-helix protein. Science (New York, N.Y.), 268(5212), 836-44. [PubMed:7754368] [WorldCat] [DOI] - ↑
Ishibashi, M., Moriyoshi, K., Sasai, Y., Shiota, K., Nakanishi, S., & Kageyama, R. (1994).
Persistent expression of helix-loop-helix factor HES-1 prevents mammalian neural differentiation in the central nervous system. The EMBO journal, 13(8), 1799-805. [PubMed:7909512] [PMC] [WorldCat] - ↑
Einarson, M.B., & Chao, M.V. (1995).
Regulation of Id1 and its association with basic helix-loop-helix proteins during nerve growth factor-induced differentiation of PC12 cells. Molecular and cellular biology, 15(8), 4175-83. [PubMed:7623812] [PMC] [WorldCat] [DOI] - ↑
Lyden, D., Young, A.Z., Zagzag, D., Yan, W., Gerald, W., O'Reilly, R., ..., & Benezra, R. (1999).
Id1 and Id3 are required for neurogenesis, angiogenesis and vascularization of tumour xenografts. Nature, 401(6754), 670-7. [PubMed:10537105] [WorldCat] [DOI] - ↑
Hojo, M., Ohtsuka, T., Hashimoto, N., Gradwohl, G., Guillemot, F., & Kageyama, R. (2000).
Glial cell fate specification modulated by the bHLH gene Hes5 in mouse retina. Development (Cambridge, England), 127(12), 2515-22. [PubMed:10821751] [WorldCat] - ↑
Yun, K., Mantani, A., Garel, S., Rubenstein, J., & Israel, M.A. (2004).
Id4 regulates neural progenitor proliferation and differentiation in vivo. Development (Cambridge, England), 131(21), 5441-8. [PubMed:15469968] [WorldCat] [DOI] - ↑
Mekki-Dauriac, S., Agius, E., Kan, P., & Cochard, P. (2002).
Bone morphogenetic proteins negatively control oligodendrocyte precursor specification in the chick spinal cord. Development (Cambridge, England), 129(22), 5117-30. [PubMed:12399304] [WorldCat] - ↑
Wang, S., Sdrulla, A.D., diSibio, G., Bush, G., Nofziger, D., Hicks, C., ..., & Barres, B.A. (1998).
Notch receptor activation inhibits oligodendrocyte differentiation. Neuron, 21(1), 63-75. [PubMed:9697852] [WorldCat] [DOI] - ↑
Kondo, T., & Raff, M. (2000).
Basic helix-loop-helix proteins and the timing of oligodendrocyte differentiation. Development (Cambridge, England), 127(14), 2989-98. [PubMed:10862737] [WorldCat] - ↑
Wang, S., Sdrulla, A., Johnson, J.E., Yokota, Y., & Barres, B.A. (2001).
A role for the helix-loop-helix protein Id2 in the control of oligodendrocyte development. Neuron, 29(3), 603-14. [PubMed:11301021] [WorldCat] [DOI] - ↑
Kondo, T., & Raff, M. (2000).
The Id4 HLH protein and the timing of oligodendrocyte differentiation. The EMBO journal, 19(9), 1998-2007. [PubMed:10790366] [PMC] [WorldCat] [DOI] - ↑
Shimizu, T., Kagawa, T., Wada, T., Muroyama, Y., Takada, S., & Ikenaka, K. (2005).
Wnt signaling controls the timing of oligodendrocyte development in the spinal cord. Developmental biology, 282(2), 397-410. [PubMed:15950605] [WorldCat] [DOI] - ↑
Takahashi, K., & Yamanaka, S. (2006).
Induction of pluripotent stem cells from mouse embryonic and adult fibroblast cultures by defined factors. Cell, 126(4), 663-76. [PubMed:16904174] [WorldCat] [DOI] - ↑
Nakagawa, M., Koyanagi, M., Tanabe, K., Takahashi, K., Ichisaka, T., Aoi, T., ..., & Yamanaka, S. (2008).
Generation of induced pluripotent stem cells without Myc from mouse and human fibroblasts. Nature biotechnology, 26(1), 101-6. [PubMed:18059259] [WorldCat] [DOI] - ↑
Lee, S.H., Lumelsky, N., Studer, L., Auerbach, J.M., & McKay, R.D. (2000).
Efficient generation of midbrain and hindbrain neurons from mouse embryonic stem cells. Nature biotechnology, 18(6), 675-9. [PubMed:10835609] [WorldCat] [DOI] - ↑
Bain, G., Kitchens, D., Yao, M., Huettner, J.E., & Gottlieb, D.I. (1995).
Embryonic stem cells express neuronal properties in vitro. Developmental biology, 168(2), 342-57. [PubMed:7729574] [WorldCat] [DOI] - ↑
Kawasaki, H., Mizuseki, K., Nishikawa, S., Kaneko, S., Kuwana, Y., Nakanishi, S., ..., & Sasai, Y. (2000).
Induction of midbrain dopaminergic neurons from ES cells by stromal cell-derived inducing activity. Neuron, 28(1), 31-40. [PubMed:11086981] [WorldCat] [DOI] - ↑
Watanabe, K., Kamiya, D., Nishiyama, A., Katayama, T., Nozaki, S., Kawasaki, H., ..., & Sasai, Y. (2005).
Directed differentiation of telencephalic precursors from embryonic stem cells. Nature neuroscience, 8(3), 288-96. [PubMed:15696161] [WorldCat] [DOI] - ↑
Kamiya, D., Banno, S., Sasai, N., Ohgushi, M., Inomata, H., Watanabe, K., ..., & Sasai, Y. (2011).
Intrinsic transition of embryonic stem-cell differentiation into neural progenitors. Nature, 470(7335), 503-9. [PubMed:21326203] [WorldCat] [DOI] - ↑
Pang, Z.P., Yang, N., Vierbuchen, T., Ostermeier, A., Fuentes, D.R., Yang, T.Q., ..., & Wernig, M. (2011).
Induction of human neuronal cells by defined transcription factors. Nature, 476(7359), 220-3. [PubMed:21617644] [PMC] [WorldCat] [DOI] - ↑
Caiazzo, M., Dell'Anno, M.T., Dvoretskova, E., Lazarevic, D., Taverna, S., Leo, D., ..., & Broccoli, V. (2011).
Direct generation of functional dopaminergic neurons from mouse and human fibroblasts. Nature, 476(7359), 224-7. [PubMed:21725324] [WorldCat] [DOI] - ↑
Yoo, A.S., Sun, A.X., Li, L., Shcheglovitov, A., Portmann, T., Li, Y., ..., & Crabtree, G.R. (2011).
MicroRNA-mediated conversion of human fibroblasts to neurons. Nature, 476(7359), 228-31. [PubMed:21753754] [PMC] [WorldCat] [DOI]