「細胞外記録」の版間の差分
細編集の要約なし |
細編集の要約なし |
||
| (3人の利用者による、間の11版が非表示) | |||
| 1行目: | 1行目: | ||
<div align="right"> | |||
<font size="+1">[http://researchmap.jp/akikosaiki 齊木 愛希子]、[http://researchmap.jp/yoshikazuisomura 礒村 宜和]</font><br> | |||
''玉川大学''<br> | |||
DOI:<selfdoi /> 原稿受付日:2012年5月16日 原稿完成日:2012年5月30日<br> | |||
担当編集委員:[http://researchmap.jp/haruokasai 河西 春郎](東京大学 大学院医学系研究科)<br> | |||
</div> | |||
英:extracellular recording | 英:extracellular recording | ||
同義語:ユニット記録 | 同義語:ユニット記録 | ||
細胞外記録とは、広義には[[神経細胞]]の近傍に生じる微弱な電気的あるいは電気化学的変化を調べる記録法の総称であり、狭義には[[ユニット活動]]の記録を指す。実験目的や記録対象に応じて、[[局所フィールド記録]]、[[単一ユニット記録]]、[[マルチユニット記録]]、[[ジャクスタセルラー記録]]、[[ | {{box|text= | ||
細胞外記録とは、広義には[[神経細胞]]の近傍に生じる微弱な電気的あるいは電気化学的変化を調べる記録法の総称であり、狭義には[[ユニット活動]]の記録を指す。実験目的や記録対象に応じて、[[局所フィールド記録]]、[[単一ユニット記録]]、[[マルチユニット記録]]、[[ジャクスタセルラー記録]]、[[ボルタンメトリー]]などの記録方法と、それに最適な[[電極]]や計測装置を選択する。総じて時間分解能が高く、脳内の信号処理の仕組みを解明するための有力な研究手法の一つである。 | |||
}} | |||
==細胞外記録とは== | ==細胞外記録とは== | ||
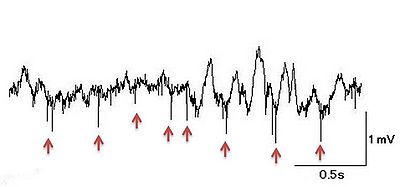
[[ファイル: | [[ファイル:trace_arrow.jpg|thumb|400px|'''図1.細胞外記録の一例'''<br>[[ラット]][[大脳皮質]]における局所フィールド電位とユニット活動の記録。矢印が主なユニットでそれ以外の成分が局所フィールド電位。]] [[脳]]や[[脊髄]]などの組織内の細胞間隙に電極を配置して、あるいは培養細胞などに電極を接触させて、神経細胞の近傍に生じる微弱な電気的あるいは電気化学的変化を増幅し記録する方法を細胞外記録という。 | ||
細胞集団全体の活動を調べる局所フィールド電位記録、個々の神経細胞の発火活動を調べる単一ユニット記録とマルチユニット記録、記録細胞の形態を可視化できる[[ジャクスタセルラー記録]]、細胞外液中の特定の[[生理活性物質]] | 細胞集団全体の活動を調べる局所フィールド電位記録、個々の神経細胞の発火活動を調べる単一ユニット記録とマルチユニット記録、記録細胞の形態を可視化できる[[ジャクスタセルラー記録]]、細胞外液中の特定の[[生理活性物質]]の濃度変化を調べるボルタンメトリーなどに分類される。いずれも高い時間精度で神経活動を計測することができるが、脳組織や神経細胞群に電極を配置するため若干の侵襲は避けられない。 | ||
==細胞外記録に用いられる電極== | ==細胞外記録に用いられる電極== | ||
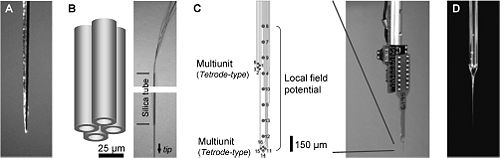
[[ファイル:electrode.jpg|thumb|500px|'''図2.細胞外記録で使われる電極の例'''<br>A. 金属微小電極(タングステン電極)、B. テトロード、C. シリコンプローブ、D. ガラス電極(ジャクスタセルラー記録電極)]] 細胞外記録用の電極には、[[wikipedia:jp:タングステン|タングステン]]や[[wikipedia:jp:銀|銀]]などをガラスや[[wikipedia:jp:テフロン|テフロン]]など[[wikipedia:ja:絶縁材料|絶縁材料]]で被覆した金属電極、ガラス管の先端を熱で加工し[[wikipedia:jp:電解質|電解質]]を内部に充填したガラス電極、[[wikipedia:jp:半導体|半導体]]技術を応用して複数の電極を配置した[[シリコンプローブ]]、イオン選択性交換剤をガラス管に詰めた[[イオン(イオン選択性)電極]]やボルタンメトリーに使用する[[カーボンファイバー電極]]などがある。 | |||
通常、1本の電極を[[マイクロドライブ]]や[[ | 通常、1本の電極を[[マイクロドライブ]]や[[マニピュレータ]]をもちいて脳内の目的部位に正確に刺入するが、複数本の電極をワイヤ束状、櫛の歯状、あるいは剣山状に並べて刺入することも可能である。動きやすい神経細胞や組織には、軽い陰圧をかけて記録対象を機械的に保持する[[吸引電極]]が用いられる。柔らかい電極材料を脳内に慢性的に埋め込んで脳の機械的な変位に柔軟に対応する[[フローティング電極]]も開発が試みられている。[[脳スライス標本]]や[[初代培養|分散培養]]した神経細胞には、碁盤の目状に電極を配置した[[マルチ電極アレー]]が用いられることもある。 | ||
===金属電極=== | |||
金属電極には、銀、タングステン、エルジロイ、ニクロムなどの材料が用いられる。テフロン被覆された銀線はニッパーなどで切断し、切断面に銀-塩化銀 (Ag-AgCl)膜を形成させてから局所フィールド電位記録に使用される。タングステンは電解研磨により先端を鋭くし、ガラスなどで絶縁コーティングすることにより単一ユニット記録用の金属微小電極として使用される。このタングステン電極は霊長類の硬膜を突き抜けるのに十分な強度を有する。エルジロイ合金もタングステンと同様の目的に使用されるが、電流を流すことで鉄イオンが組織中に沈着するため、記録部位のマーキングが可能である。またワイヤ・テトロードにはポリイミドなどで被覆された極細のニクロム線が多用されており、4本を撚り合わせることで強度を保っている。これは切断面を金メッキ処理することもある。 | |||
==細胞外記録の種類== | ==細胞外記録の種類== | ||
| 39行目: | 52行目: | ||
目的とする脳部位に測定電極(関電極)を刺入し、十分に離れて電気的変動の少ない部位に基準電極(不関電極)を設けると、神経細胞の集団活動の結果生じる局所フィールド電位 local field potential (LFP)を記録することができる。一般には、低い[[wikipedia:jp:インピーダンス|インピーダンス]](数百kΩ程度)の金属電極やガラス電極を使用し、1Hz以下から数百Hzまでの成分を含む、数~数百μV程度の振幅の電位変化を観測の対象とする。機械的変位に強く、行動中の動物から長期間にわたって記録することが可能である。大脳皮質の局所フィールド電位を頭皮上または[[硬膜]]下から間接的に測定したものが、それぞれ[[脳波]](electroencephalogram, EEG)、[[皮質脳波]](electrocoticogram, ECoG)である。そこで局所フィールド電位を[[深部脳波]]と呼ぶこともある。 | 目的とする脳部位に測定電極(関電極)を刺入し、十分に離れて電気的変動の少ない部位に基準電極(不関電極)を設けると、神経細胞の集団活動の結果生じる局所フィールド電位 local field potential (LFP)を記録することができる。一般には、低い[[wikipedia:jp:インピーダンス|インピーダンス]](数百kΩ程度)の金属電極やガラス電極を使用し、1Hz以下から数百Hzまでの成分を含む、数~数百μV程度の振幅の電位変化を観測の対象とする。機械的変位に強く、行動中の動物から長期間にわたって記録することが可能である。大脳皮質の局所フィールド電位を頭皮上または[[硬膜]]下から間接的に測定したものが、それぞれ[[脳波]](electroencephalogram, EEG)、[[皮質脳波]](electrocoticogram, ECoG)である。そこで局所フィールド電位を[[深部脳波]]と呼ぶこともある。 | ||
大脳皮質などで観測される局所フィールド電位は、主に[[錐体細胞]]群への集団的な[[シナプス]] | 大脳皮質などで観測される局所フィールド電位は、主に[[錐体細胞]]群への集団的な[[シナプス]]入力によって発生すると説明される([[フィールドEPSP|フィールドfield EPSP]])。例えば、大脳皮質の錐体細胞の尖頭[[樹状突起]]の遠位部(皮質浅層に相当)に興奮性の[[グルタミン酸]]作動性のシナプス入力が来た場合、[[グルタミン酸受容体]]を介して[[wikipedia:ja:陽イオン|陽イオン]](つまり電流)が細胞内へ流れ込む(吸い込み、シンクsink)。この電流は樹状突起内を流れて近位部などから細胞外へ流れ出る(湧き出し、ソースsource)。局所フィールド電位は、シンク付近でマイナス、ソース付近でプラスの極性を示し、このシンクとソースの対を[[wikipedia:ja:双極子|双極子]]dipoleと呼ぶ。双極子の方向に沿って等間隔の部位から得られた局所フィールド電位を使って[[電流源密度解析]] current source density (CSD) analysisをおこなうと、記録部位に沿ったシンクとソースの時間的、空間的分布を調べることができる。なお、海馬の錐体細胞層など神経細胞の細胞体が密に分布する部位においては、細胞集団の発火活動の総和である[[集合スパイク]] population spikeが観測される。脳スライス標本や分散培養した神経細胞からも、シリコンプローブやマルチ電極アレーをもちいて、局所フィールド電位(脳スライス標本:フィールドEPSPと集合スパイク、分散培養:集合スパイクのみ)を計測することが可能である。 | ||
===単一ユニット記録=== | ===単一ユニット記録=== | ||
高いインピーダンス(数MΩ程度)の金属微小電極などを単一の神経細胞に接近させて、その記録細胞に発生する活動電位を反映した細胞外の微弱な電位変化(ユニットunit。スパイクspike、発火discharge/firingとも呼ぶ)を測定することを単一ユニット記録single unit recordingと呼ぶ。このユニット活動の記録を(狭義の)細胞外記録と称することも多い。通常、ユニット活動は数百μVまでの一定振幅の陰性ピークとして観測される。細胞内記録と異なり、[[シナプス後電位]]など[[閾値]]下の[[膜電位]]変化は観察できない。行動中の動物から安定して記録し、およその記録部位をマークすることもできるが、記録細胞を可視化することは困難である。各ユニットの発生時間を時間軸上にプロットしたものを[[ラスタープロット]] raster plot、ある事象に関連したユニットの発生確率を示す[[wikipedia:ja:|ヒストグラム]]を[[peri-stimulus time histogram]] (PSTH)または[[peri-event time histogram]] (PETH)と呼び、記録細胞の発火特性や機能を表現する図として多用される。単一ユニット記録を使った先駆的な研究例として、[[wikipedia:David H. Hubel|D. H. Hubel]]と[[wikipedia:Torsten Wiesel|T. N. Wiesel]]によるネコの[[視覚野]]の研究<ref><pubmed> 14403679 </pubmed></ref>やE. V. Evartsによるサルの運動野の研究<ref><pubmed> 14283057 </pubmed></ref>が挙げられる。 | 高いインピーダンス(数MΩ程度)の金属微小電極などを単一の神経細胞に接近させて、その記録細胞に発生する活動電位を反映した細胞外の微弱な電位変化(ユニットunit。スパイクspike、発火discharge/firingとも呼ぶ)を測定することを単一ユニット記録single unit recordingと呼ぶ。このユニット活動の記録を(狭義の)細胞外記録と称することも多い。通常、ユニット活動は数百μVまでの一定振幅の陰性ピークとして観測される。細胞内記録と異なり、[[シナプス後電位]]など[[閾値]]下の[[膜電位]]変化は観察できない。行動中の動物から安定して記録し、およその記録部位をマークすることもできるが、記録細胞を可視化することは困難である。各ユニットの発生時間を時間軸上にプロットしたものを[[ラスタープロット]] raster plot、ある事象に関連したユニットの発生確率を示す[[wikipedia:ja:ヒストグラム|ヒストグラム]]を[[peri-stimulus time histogram]] (PSTH)または[[peri-event time histogram]] (PETH)と呼び、記録細胞の発火特性や機能を表現する図として多用される。単一ユニット記録を使った先駆的な研究例として、[[wikipedia:David H. Hubel|D. H. Hubel]]と[[wikipedia:Torsten Wiesel|T. N. Wiesel]]によるネコの[[視覚野]]の研究<ref><pubmed> 14403679 </pubmed></ref>やE. V. Evartsによるサルの運動野の研究<ref><pubmed> 14283057 </pubmed></ref>が挙げられる。 | ||
注)同時に記録する細胞の数(単一か複数か)にかかわらず、個別の細胞由来に分離した(isolated)ユニット活動を単一ユニット活動single unit activity (SUA)と称して、集合的な(分離しない)ユニット活動multi-unit activity (MUA)と区別する場合もある。しかし、ここでは分離の有無にかかわらず、複数の細胞からの同時記録は次のマルチユニット記録に含めることとする。 | 注)同時に記録する細胞の数(単一か複数か)にかかわらず、個別の細胞由来に分離した(isolated)ユニット活動を単一ユニット活動single unit activity (SUA)と称して、集合的な(分離しない)ユニット活動multi-unit activity (MUA)と区別する場合もある。しかし、ここでは分離の有無にかかわらず、複数の細胞からの同時記録は次のマルチユニット記録に含めることとする。 | ||
===マルチユニット記録=== | ===マルチユニット記録=== | ||
同一個体の脳などから、同時に複数の神経細胞のユニット活動を記録することをマルチユニット記録multi-unit | 同一個体の脳などから、同時に複数の神経細胞のユニット活動を記録することをマルチユニット記録multi-unit recording([[マルチニューロン記録]]multi-neuronal recording、[[多細胞同時記録]]などともいう)と呼ぶ。最も単純なマルチユニット記録は、1本(1チャンネル)の電極から数細胞のユニット活動を同時に記録し、波形の違いをもとに個別の数細胞のユニット活動に分離する方法である(1電極-数細胞)。なお、1電極における多細胞のユニット活動を集合的に(分離せずに)解析したものは、[[マルチプルユニット]]multiple unit活動(またはmulti-unit activity (MUA))と称する。一方、櫛状や剣山状にした複数の電極(数百ミクロン~数ミリ間隔)を使って、各電極から単一ユニット活動をそれぞれ同時に記録する方法は、特に広範囲の脳領域の活動を調べるのに適している(多電極-各1細胞)。また、複数の電極を近接配置(約25~50ミクロン間隔)したワイヤ・[[テトロード]]や[[シリコンプローブ]]をもちいると、多数の細胞のユニット活動を効率的に分離することができ、局所回路内の細胞間相互作用を詳細に解析することができる(多電極-多細胞)<ref><pubmed> 8351520 </pubmed></ref>。 | ||
近接電極から記録した多数の細胞のユニット活動を分離するためには、[[スパイク・ソーティング]]spike sortingという解析技術をもちいる。一般に、スパイク・ソーティングでは、スパイク検出、特徴抽出、クラスタリングの3過程を経て、個別の細胞に由来するスパイク群(クラスターcluster)に分類していく。スパイク検出では、記録トレースにおいて基準を超える電位変化をスパイク候補として選び出す。特徴抽出では、[[主成分分析]] principal component analysis (PCA)や[[ウェーブレット変換]]などをもちいて、各チャンネルのスパイク波形の特徴情報を算出する。最後に、多次元の特徴空間におけるスパイクの分布に基づいて、[[classification EM]] (CEM)法や[[変分ベイズ]]varietional Bayes法などにより、個々のスパイクをクラスターに分類する。クラスタリングには米国で開発された[http://osiris.rutgers.edu/frontmid/indexmid.html KlustaKwik]や我が国の[http://etos.sourceforge.net/ EToS]などの無料ソフトウェアが公開されている。また、複数の重複したスパイクを分離するために、[[独立成分分析]] independent component analysis (ICA)が用いられることもある。 | |||
===ジャクスタセルラー記録=== | ===ジャクスタセルラー記録=== | ||
ジャクスタセルラー記録juxtacellular | ジャクスタセルラー記録juxtacellular recording(傍細胞記録ともいう)とは、単一の神経細胞の[[細胞膜]]にガラス電極(10MΩ程度)の先端を押し当ててユニット活動を記録した後に、細胞内に可視化色素([[バイオサイチン]]や[[ニューロビオチン]]など)や[[wikipedia:ja:核酸|核酸]]などを電気浸透的に付加することにより、その記録細胞の形態を可視化することができる方法である<ref><pubmed> 8740589 </pubmed></ref>。従来の単一ユニット記録法とは、スパイク波形が数mV程度の陽性となる点と、記録細胞のサブタイプ([[錐体細胞]]か[[介在細胞]]か、[[興奮性]]か[[抑制性]]か、など)や存在部位(大脳皮質の第何層か)や[[軸索]]結合(シナプス部位や軸索[[投射]]先)などを同定できる点で異なる。また、数nA程度の微弱電流によって記録細胞に特異的に発火を誘発することができる(ナノ刺激nano-stimulation)<ref><pubmed> 19955285 </pubmed></ref>。単一ユニット記録法と同様に、行動中の動物の脳からも安定して記録することが可能である。 | ||
注)[[パッチクランプ記録]] | 注)[[パッチクランプ記録]]の一形態である[[セル・アタッチ法|セル・アタッチcell-attached法]]は、概念上、細胞外からの単一神経細胞の電気的活動の記録法であるといえる。詳細は[[パッチクランプ法]]の項目参照。 | ||
=== | ===ボルタンメトリー・アンペロメトリー=== | ||
ボルタンメトリーvoltammetryとアンペロメトリーamperometry(アンペロメトリック電気化学検出法)は、酸化還元反応を利用して細胞外に存在する特定の化学物質を測定する方法である。検出できる物質は酸化されやすい[[ドーパミン]]などの[[カテコールアミン]]や[[セロトニン]]などに限られているが、近年ではそれ以外の物質も検出できるよう電極などの改良が進められている<ref><pubmed> 20926669 </pubmed></ref>。微小[[カーボン電極]]を脳内に刺入して特定の電圧をかけると、化学物質が電極に接近したときに酸化され、その結果電子の放出が起きて電流変化を引き起こす。電流変化は酸化された物質の数に依存するため、化学物質の相対的な濃度を調べることができる。 | |||
もっとも一般的なボルタンメトリーはfast-scan cyclic voltammetry (FSCV) で、与える電位を変化させることで化学物質の特定を可能にしている <ref><pubmed> 20484639 </pubmed></ref>。また、アンペロメトリーもボルタンメトリーの一種であるが、こちらは与える電位を一定にすることで時間分解能を高くしている。そのかわり、化学物質の特定はFSCVより難しい。アンペロメトリーはin vitroにおいては細胞における開口分泌の研究に用いられ、パッチクランプ法と組み合わせたパッチアンペロメトリーという方法も開発されている<ref><pubmed> 9333242 </pubmed></ref>。 | |||
==関連項目== | ==関連項目== | ||
| 63行目: | 77行目: | ||
*[[細胞内記録]] | *[[細胞内記録]] | ||
*[[パッチクランプ記録]] | *[[パッチクランプ記録]] | ||
*[[ | *[[ボルタンメトリー]] | ||
==参考文献== | ==参考文献== | ||
<references /> | <references /> | ||
2014年6月2日 (月) 16:11時点における最新版
齊木 愛希子、礒村 宜和
玉川大学
DOI:10.14931/bsd.1566 原稿受付日:2012年5月16日 原稿完成日:2012年5月30日
担当編集委員:河西 春郎(東京大学 大学院医学系研究科)
英:extracellular recording
同義語:ユニット記録
細胞外記録とは、広義には神経細胞の近傍に生じる微弱な電気的あるいは電気化学的変化を調べる記録法の総称であり、狭義にはユニット活動の記録を指す。実験目的や記録対象に応じて、局所フィールド記録、単一ユニット記録、マルチユニット記録、ジャクスタセルラー記録、ボルタンメトリーなどの記録方法と、それに最適な電極や計測装置を選択する。総じて時間分解能が高く、脳内の信号処理の仕組みを解明するための有力な研究手法の一つである。
細胞外記録とは
脳や脊髄などの組織内の細胞間隙に電極を配置して、あるいは培養細胞などに電極を接触させて、神経細胞の近傍に生じる微弱な電気的あるいは電気化学的変化を増幅し記録する方法を細胞外記録という。
細胞集団全体の活動を調べる局所フィールド電位記録、個々の神経細胞の発火活動を調べる単一ユニット記録とマルチユニット記録、記録細胞の形態を可視化できるジャクスタセルラー記録、細胞外液中の特定の生理活性物質の濃度変化を調べるボルタンメトリーなどに分類される。いずれも高い時間精度で神経活動を計測することができるが、脳組織や神経細胞群に電極を配置するため若干の侵襲は避けられない。
細胞外記録に用いられる電極
細胞外記録用の電極には、タングステンや銀などをガラスやテフロンなど絶縁材料で被覆した金属電極、ガラス管の先端を熱で加工し電解質を内部に充填したガラス電極、半導体技術を応用して複数の電極を配置したシリコンプローブ、イオン選択性交換剤をガラス管に詰めたイオン(イオン選択性)電極やボルタンメトリーに使用するカーボンファイバー電極などがある。
通常、1本の電極をマイクロドライブやマニピュレータをもちいて脳内の目的部位に正確に刺入するが、複数本の電極をワイヤ束状、櫛の歯状、あるいは剣山状に並べて刺入することも可能である。動きやすい神経細胞や組織には、軽い陰圧をかけて記録対象を機械的に保持する吸引電極が用いられる。柔らかい電極材料を脳内に慢性的に埋め込んで脳の機械的な変位に柔軟に対応するフローティング電極も開発が試みられている。脳スライス標本や分散培養した神経細胞には、碁盤の目状に電極を配置したマルチ電極アレーが用いられることもある。
金属電極
金属電極には、銀、タングステン、エルジロイ、ニクロムなどの材料が用いられる。テフロン被覆された銀線はニッパーなどで切断し、切断面に銀-塩化銀 (Ag-AgCl)膜を形成させてから局所フィールド電位記録に使用される。タングステンは電解研磨により先端を鋭くし、ガラスなどで絶縁コーティングすることにより単一ユニット記録用の金属微小電極として使用される。このタングステン電極は霊長類の硬膜を突き抜けるのに十分な強度を有する。エルジロイ合金もタングステンと同様の目的に使用されるが、電流を流すことで鉄イオンが組織中に沈着するため、記録部位のマーキングが可能である。またワイヤ・テトロードにはポリイミドなどで被覆された極細のニクロム線が多用されており、4本を撚り合わせることで強度を保っている。これは切断面を金メッキ処理することもある。
細胞外記録の種類
| 記録方法 | 電極 | インピーダンス | 測定事象 |
|---|---|---|---|
| 局所フィールド電位記録 | 金属電極、ガラス電極 | 数百kΩ | フィールドEPSP、集合スパイク |
| 単一ユニット記録 | 金属微小電極 | 数MΩ | ユニット活動 |
| マルチユニット記録 | 櫛状・剣山状電極、ワイヤ・テトロード、シリコンプローブ | 数MΩ | ユニット活動 |
| ジャクスタセルラー記録 | ガラス電極 | 10 MΩ程度 | ユニット活動 |
| アンペロメトリー | 微小カーボン電極 | 化学物質の濃度変化 |
局所フィールド電位記録
目的とする脳部位に測定電極(関電極)を刺入し、十分に離れて電気的変動の少ない部位に基準電極(不関電極)を設けると、神経細胞の集団活動の結果生じる局所フィールド電位 local field potential (LFP)を記録することができる。一般には、低いインピーダンス(数百kΩ程度)の金属電極やガラス電極を使用し、1Hz以下から数百Hzまでの成分を含む、数~数百μV程度の振幅の電位変化を観測の対象とする。機械的変位に強く、行動中の動物から長期間にわたって記録することが可能である。大脳皮質の局所フィールド電位を頭皮上または硬膜下から間接的に測定したものが、それぞれ脳波(electroencephalogram, EEG)、皮質脳波(electrocoticogram, ECoG)である。そこで局所フィールド電位を深部脳波と呼ぶこともある。
大脳皮質などで観測される局所フィールド電位は、主に錐体細胞群への集団的なシナプス入力によって発生すると説明される(フィールドfield EPSP)。例えば、大脳皮質の錐体細胞の尖頭樹状突起の遠位部(皮質浅層に相当)に興奮性のグルタミン酸作動性のシナプス入力が来た場合、グルタミン酸受容体を介して陽イオン(つまり電流)が細胞内へ流れ込む(吸い込み、シンクsink)。この電流は樹状突起内を流れて近位部などから細胞外へ流れ出る(湧き出し、ソースsource)。局所フィールド電位は、シンク付近でマイナス、ソース付近でプラスの極性を示し、このシンクとソースの対を双極子dipoleと呼ぶ。双極子の方向に沿って等間隔の部位から得られた局所フィールド電位を使って電流源密度解析 current source density (CSD) analysisをおこなうと、記録部位に沿ったシンクとソースの時間的、空間的分布を調べることができる。なお、海馬の錐体細胞層など神経細胞の細胞体が密に分布する部位においては、細胞集団の発火活動の総和である集合スパイク population spikeが観測される。脳スライス標本や分散培養した神経細胞からも、シリコンプローブやマルチ電極アレーをもちいて、局所フィールド電位(脳スライス標本:フィールドEPSPと集合スパイク、分散培養:集合スパイクのみ)を計測することが可能である。
単一ユニット記録
高いインピーダンス(数MΩ程度)の金属微小電極などを単一の神経細胞に接近させて、その記録細胞に発生する活動電位を反映した細胞外の微弱な電位変化(ユニットunit。スパイクspike、発火discharge/firingとも呼ぶ)を測定することを単一ユニット記録single unit recordingと呼ぶ。このユニット活動の記録を(狭義の)細胞外記録と称することも多い。通常、ユニット活動は数百μVまでの一定振幅の陰性ピークとして観測される。細胞内記録と異なり、シナプス後電位など閾値下の膜電位変化は観察できない。行動中の動物から安定して記録し、およその記録部位をマークすることもできるが、記録細胞を可視化することは困難である。各ユニットの発生時間を時間軸上にプロットしたものをラスタープロット raster plot、ある事象に関連したユニットの発生確率を示すヒストグラムをperi-stimulus time histogram (PSTH)またはperi-event time histogram (PETH)と呼び、記録細胞の発火特性や機能を表現する図として多用される。単一ユニット記録を使った先駆的な研究例として、D. H. HubelとT. N. Wieselによるネコの視覚野の研究[1]やE. V. Evartsによるサルの運動野の研究[2]が挙げられる。
注)同時に記録する細胞の数(単一か複数か)にかかわらず、個別の細胞由来に分離した(isolated)ユニット活動を単一ユニット活動single unit activity (SUA)と称して、集合的な(分離しない)ユニット活動multi-unit activity (MUA)と区別する場合もある。しかし、ここでは分離の有無にかかわらず、複数の細胞からの同時記録は次のマルチユニット記録に含めることとする。
マルチユニット記録
同一個体の脳などから、同時に複数の神経細胞のユニット活動を記録することをマルチユニット記録multi-unit recording(マルチニューロン記録multi-neuronal recording、多細胞同時記録などともいう)と呼ぶ。最も単純なマルチユニット記録は、1本(1チャンネル)の電極から数細胞のユニット活動を同時に記録し、波形の違いをもとに個別の数細胞のユニット活動に分離する方法である(1電極-数細胞)。なお、1電極における多細胞のユニット活動を集合的に(分離せずに)解析したものは、マルチプルユニットmultiple unit活動(またはmulti-unit activity (MUA))と称する。一方、櫛状や剣山状にした複数の電極(数百ミクロン~数ミリ間隔)を使って、各電極から単一ユニット活動をそれぞれ同時に記録する方法は、特に広範囲の脳領域の活動を調べるのに適している(多電極-各1細胞)。また、複数の電極を近接配置(約25~50ミクロン間隔)したワイヤ・テトロードやシリコンプローブをもちいると、多数の細胞のユニット活動を効率的に分離することができ、局所回路内の細胞間相互作用を詳細に解析することができる(多電極-多細胞)[3]。
近接電極から記録した多数の細胞のユニット活動を分離するためには、スパイク・ソーティングspike sortingという解析技術をもちいる。一般に、スパイク・ソーティングでは、スパイク検出、特徴抽出、クラスタリングの3過程を経て、個別の細胞に由来するスパイク群(クラスターcluster)に分類していく。スパイク検出では、記録トレースにおいて基準を超える電位変化をスパイク候補として選び出す。特徴抽出では、主成分分析 principal component analysis (PCA)やウェーブレット変換などをもちいて、各チャンネルのスパイク波形の特徴情報を算出する。最後に、多次元の特徴空間におけるスパイクの分布に基づいて、classification EM (CEM)法や変分ベイズvarietional Bayes法などにより、個々のスパイクをクラスターに分類する。クラスタリングには米国で開発されたKlustaKwikや我が国のEToSなどの無料ソフトウェアが公開されている。また、複数の重複したスパイクを分離するために、独立成分分析 independent component analysis (ICA)が用いられることもある。
ジャクスタセルラー記録
ジャクスタセルラー記録juxtacellular recording(傍細胞記録ともいう)とは、単一の神経細胞の細胞膜にガラス電極(10MΩ程度)の先端を押し当ててユニット活動を記録した後に、細胞内に可視化色素(バイオサイチンやニューロビオチンなど)や核酸などを電気浸透的に付加することにより、その記録細胞の形態を可視化することができる方法である[4]。従来の単一ユニット記録法とは、スパイク波形が数mV程度の陽性となる点と、記録細胞のサブタイプ(錐体細胞か介在細胞か、興奮性か抑制性か、など)や存在部位(大脳皮質の第何層か)や軸索結合(シナプス部位や軸索投射先)などを同定できる点で異なる。また、数nA程度の微弱電流によって記録細胞に特異的に発火を誘発することができる(ナノ刺激nano-stimulation)[5]。単一ユニット記録法と同様に、行動中の動物の脳からも安定して記録することが可能である。
注)パッチクランプ記録の一形態であるセル・アタッチcell-attached法は、概念上、細胞外からの単一神経細胞の電気的活動の記録法であるといえる。詳細はパッチクランプ法の項目参照。
ボルタンメトリー・アンペロメトリー
ボルタンメトリーvoltammetryとアンペロメトリーamperometry(アンペロメトリック電気化学検出法)は、酸化還元反応を利用して細胞外に存在する特定の化学物質を測定する方法である。検出できる物質は酸化されやすいドーパミンなどのカテコールアミンやセロトニンなどに限られているが、近年ではそれ以外の物質も検出できるよう電極などの改良が進められている[6]。微小カーボン電極を脳内に刺入して特定の電圧をかけると、化学物質が電極に接近したときに酸化され、その結果電子の放出が起きて電流変化を引き起こす。電流変化は酸化された物質の数に依存するため、化学物質の相対的な濃度を調べることができる。 もっとも一般的なボルタンメトリーはfast-scan cyclic voltammetry (FSCV) で、与える電位を変化させることで化学物質の特定を可能にしている [7]。また、アンペロメトリーもボルタンメトリーの一種であるが、こちらは与える電位を一定にすることで時間分解能を高くしている。そのかわり、化学物質の特定はFSCVより難しい。アンペロメトリーはin vitroにおいては細胞における開口分泌の研究に用いられ、パッチクランプ法と組み合わせたパッチアンペロメトリーという方法も開発されている[8]。
関連項目
参考文献
- ↑
HUBEL, D.H., & WIESEL, T.N. (1959).
Receptive fields of single neurones in the cat's striate cortex. The Journal of physiology, 148, 574-91. [PubMed:14403679] [PMC] [WorldCat] [DOI] - ↑
EVARTS, E.V. (1965).
RELATION OF DISCHARGE FREQUENCY TO CONDUCTION VELOCITY IN PYRAMIDAL TRACT NEURONS. Journal of neurophysiology, 28, 216-28. [PubMed:14283057] [WorldCat] [DOI] - ↑
Wilson, M.A., & McNaughton, B.L. (1993).
Dynamics of the hippocampal ensemble code for space. Science (New York, N.Y.), 261(5124), 1055-8. [PubMed:8351520] [WorldCat] [DOI] - ↑
Pinault, D. (1996).
A novel single-cell staining procedure performed in vivo under electrophysiological control: morpho-functional features of juxtacellularly labeled thalamic cells and other central neurons with biocytin or Neurobiotin. Journal of neuroscience methods, 65(2), 113-36. [PubMed:8740589] [WorldCat] [DOI] - ↑
Houweling, A.R., Doron, G., Voigt, B.C., Herfst, L.J., & Brecht, M. (2010).
Nanostimulation: manipulation of single neuron activity by juxtacellular current injection. Journal of neurophysiology, 103(3), 1696-704. [PubMed:19955285] [WorldCat] [DOI] - ↑
Zhang, H., Lin, S.C., & Nicolelis, M.A. (2010).
Spatiotemporal coupling between hippocampal acetylcholine release and theta oscillations in vivo. The Journal of neuroscience : the official journal of the Society for Neuroscience, 30(40), 13431-40. [PubMed:20926669] [PMC] [WorldCat] [DOI] - ↑
Ford, C.P., Gantz, S.C., Phillips, P.E., & Williams, J.T. (2010).
Control of extracellular dopamine at dendrite and axon terminals. The Journal of neuroscience : the official journal of the Society for Neuroscience, 30(20), 6975-83. [PubMed:20484639] [PMC] [WorldCat] [DOI] - ↑
Albillos, A., Dernick, G., Horstmann, H., Almers, W., Alvarez de Toledo, G., & Lindau, M. (1997).
The exocytotic event in chromaffin cells revealed by patch amperometry. Nature, 389(6650), 509-12. [PubMed:9333242] [WorldCat] [DOI]