「縫線核」の版間の差分
細編集の要約なし |
細編集の要約なし |
||
| 2行目: | 2行目: | ||
<font size="+1">[http://researchmap.jp/kaenakamura 中村 加枝]</font><br> | <font size="+1">[http://researchmap.jp/kaenakamura 中村 加枝]</font><br> | ||
''関西医科大学 医学部''<br> | ''関西医科大学 医学部''<br> | ||
DOI XXXX/ | DOI XXXX/XXXX 原稿受付日:2012年12月10日 原稿完成日:2012年12月13日<br> | ||
担当編集委員:[http://researchmap.jp/read0080380 上口 裕之](独立行政法人理化学研究所 脳科学総合研究センター)<br> | 担当編集委員:[http://researchmap.jp/read0080380 上口 裕之](独立行政法人理化学研究所 脳科学総合研究センター)<br> | ||
</div> | </div> | ||
2014年12月26日 (金) 09:52時点における版
中村 加枝
関西医科大学 医学部
DOI XXXX/XXXX 原稿受付日:2012年12月10日 原稿完成日:2012年12月13日
担当編集委員:上口 裕之(独立行政法人理化学研究所 脳科学総合研究センター)
英語名:raphe nuclei 羅:nuclei raphe 独:Raphe-Kerne 仏:noyaux du raphé
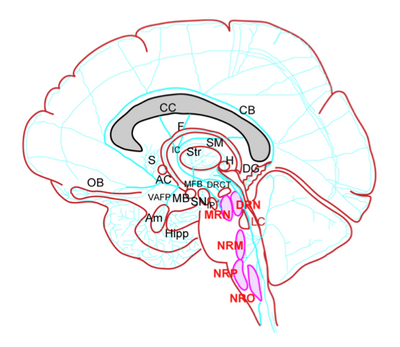
DRN: 背側縫線核 (dorsal raphe nucleus); MRN: 内側縫線核 (median raphe nucleus); NRM: 大縫線核 (nucleus raphe magnus); NRP: 淡蒼縫線核 (nucleus raphe pallidus); NRO: 不確縫線核(nucleus raphe obscures)
AC: 前交連 (anterior commissure); CC: 脳梁 (corpus callosum); Am: 扁桃体 (amygdala); CB: 帯状束 (cingulum bundle); DG: 歯状回 (dentate gyrus); DRCT: 背側縫線核皮質路 (dorsal raphe cortical tract); F: 脳弓 (fornix); H: 視床下部 (hypothalamus); Hipp: 海馬 (hippocampus); IC: 内包 (internal capsule); IP: 脚間核 (interpeduncular nucleus); LC: 青斑核 (locus coeruleus); MB: 乳頭体 (mammillary body); MFB: 内側前脳束 (medial forebrain bundle); OB: 嗅球 (olfactory bulb); S: 中隔 (septum); SM: 髄条 (stria medullaris); Str: 線条体 (striatum); SN: 黒質 (substantia nigra); VAFP; 腹側扁桃体遠心路 (ventroamygdalofugal pathway)
[1]より改変
縫線核は中脳から脳幹の内側部に分布する細胞集団で、複数の核よりなる縫線核「群」である。縫線核は元々ニッスル染色により同定されたが、後に免疫組織学的手法によりセロトニン細胞の分布とほぼ重なることが判明し、Dahlström とFuxe(1964)によって9つの神経核B1-B9の集合体として記載された。ただし、セロトニン細胞は縫線核外の近傍領域にも存在し、逆に、縫線核にはセロトニン以外の伝達物質を含む神経細胞も存在する。異なる縫線核は、菱脳節(rhombomere)の異なる領域から発生し、マウスでは吻側のrhombomere1(r1)からB4,6,7、その後さらに尾側のr2からB5,8,9, r5-8からB1,2,3が発生する。
縫線核は脳のほぼ全域へ投射するが、縫線核内の起始部位によって投射先が異なる。入力元は主に辺縁系に属する前頭葉皮質や皮質下領域である。縫線核ニューロンの発火は睡眠覚醒リズム・歩行・呼吸などのパターン的な運動のみならず、注意・報酬などの情動や認知機能にも関与する。
縫線核とは
中脳・脳幹を中心に、尾側から吻側へ9つの神経核B1-B9が分布する。尾側核群は橋、延髄腹側に分布し、淡蒼縫線核(nucleus raphe pallidus, NRP, B1)・不確縫線核(nucleus raphe obscures, NRO, B2)・大縫線核(nucleus raphe magnus ,B3)が含まれる。これらの核からは脊髄や脳幹内に投射している。吻側核群は中脳に分布し、そのうち最大の核B7とその尾側につながるやや小さいB6は合わせて背側縫線核(dorsal raphe nucleus, DRN)と呼ばれる。背側縫線核は中心灰白質の腹側、吻側は動眼神経核レベルから第4脳室尾側端まで分布する。
背側縫線核はさらにinterfascicular、ventromedial, ventrolateral (いわゆるlateral wings)、caudal・rostral componentsに分けられ、それぞれからの入出力も異なる[2] [3]。特に外側のwingsと呼ばれる部位は、ヒトやサルでは滑車神経周辺によく発達している。B8とB5は内側縫線核(median raphe)または上中心核(nucleus centralis superior)と呼ばれ、吻側は上小脳脚交叉レベル、尾側は顔面神経丘の吻側レベルまで分布する。これら吻側核群からの軸索は小脳、中脳、間脳、辺縁系、大脳皮質に投射する。また、内側縫線核から背側縫線核への、または背側縫線核内のセロトニン細胞間の相互連絡が豊富であり、セロトニン細胞の自己受容体を介した自己の発火率の調節の制御にかかわっている可能性がある。
縫線核からの投射
吻側核群からの投射
背側縫線核・内側縫線核からの投射線維はともに視床下部内を上行する内側前脳束(medial forebrain bundle, MFB)の一部となって前脳領域に投射する。霊長類では約25%の線維は有髄で[1], 背側縫線核から内包を通って皮質へ投射する経路が最大のものである。縫線核からの投射先は、ドーパミン系のそれに比べると広汎で脳のほとんどの部位に投射しているが、一定の規則性はあり、例えば核の吻側の細胞は脳の吻側に、外側の細胞は外側に投射する。
縫線核細胞の前頭への投射線維の形態学的特徴や投射先はその起源核によって異なる[4]。背側縫線核からの投射線維は小さな結節状構造varicosityを 持つ細い軸索が広汎に微細に分岐し、小型の多形性のsynaptic bouton を有し、大脳基底核や前頭皮質、外側中隔核、扁桃体、腹側海馬に投射する。内側縫線核からの投射線維は比較的太く結節状構造は有さず、分岐は短く細く、大きい球形のsynaptic bouton を有し、背側海馬や内側中隔核、視床下部に投射する。この形態学的差異はアンフェタミン誘導体である神経毒 PCA(parachloroamphetamine) やMDMA (3,4-methylenedioxymethamphetamine, 通称‘ecstasy’)に対するぜい弱性とも関連がある可能性があり、投与後、内側縫線核からの投射線維は保存されている一方背側縫線核からの投射線維は障害される[5]。神経毒への感受性の差は、投射先のserotonin transporter (SERT)の分布の差とも関連があり、背側縫線核から微細な投射を受ける側坐核のほとんどの部位はSERT濃度が高く、内側縫線核から球状のシナプス投射を受ける尾側の側坐核shellではSERT濃度が非常に低い。
一つの縫線核ニューロンからは複数の領域に枝分かれして投射するいわゆるcollateral projectionが報告されている。例えば、線条体と黒質、中隔野と嗅内野、前頭葉と側坐核、扁桃体中心核と視床下部室傍核、外側膝状体と上丘などがあるがその機能的意義は不明である。
背側縫線核からの投射
背側縫線核のうち腹内側部Ventromedial cluster(ventromedial cluster)は主に前頭葉皮質、外側部(Lateral wings)は主に線条体に投射する。その他、背側縫線核からは黒質網様体・淡蒼球・扁桃体・腹側海馬・視床下部への投射がある。
線条体への投射は側坐核を含めた腹側に特に強い。黒質網様体・緻密部への投射も存在し、特に黒質網様体への投射は背側縫線核からの投射が最も強い。扁桃体ではすべての領域への投射があり、作用はおおむね抑制性である[6]。
すべての皮質領域への投射があるが、その強度は感覚野>運動野であり、感覚野内では視覚・聴覚野>体性感覚野である。サルでは視覚野と海馬以外の領野ではbeaded axonはⅠ層、微細なaxon はⅡ-Ⅴ層に投射する傾向にある。背側縫線核からの各領域への投射は荒いトポグラフィカルな投射形式を持つ。運動野や前頭前野へ投射する細胞群に比べて視覚野へ投射する細胞は外側に分布する傾向にある。
尾側核群からの投射
淡蒼縫線核・不確縫線核・大縫線核からは脊髄や脳幹内に投射している。脊髄への投射においては、すべてのレベルの脊髄において、後角表層部(痛覚伝導の中継点)、前角内側部(体幹部筋群を支配する運動ニューロンが分布する)に投射が強い。前者はセロトニンの内在性鎮痛作用、後者は運動機能との関連を示唆する。
延髄への投射では、孤束核(内臓からの求心性神経が投射する)に密な投射があり、嘔吐調節に関与している。疑核(呼吸中枢の一部)にも投射がある。
縫線核への入力
縫線核には前頭葉を中心とした皮質と辺縁系に属する皮質下領域からの投射があり、一定のトポグラフィを保っている。皮質では前頭眼窩皮質(orbital cortex), 帯状回皮質(cingulate cortex), 下辺縁皮質(infralimbic cortex), 島皮質(insular cortices)、内側前頭野 (medial prefrontal cortex)からの投射がある。内側前頭野から背側・内側縫線核のセロトニン細胞への投射は、直接投射と、縫線核内のGABAニューロンを介した抑制性の投射がある[7] [8] [9]。
皮質下領域では扁桃体(amygdala)、黒質網状体(substantia nigra reticulata , SNr)、黒質緻密部(substantia nigra compacta , SNc)、腹側淡蒼球(ventral pallidum), 視索前野(preoptic area)、前障(calustrum)、分界条床核(the bed nucleus of the stria terminalis, BNST)、不確帯(zona incerta)、視床下部(hypothalamus)、外側手綱核(lateral habenula nucleus)、青斑核(Locus coeluleus)からのものがある。特に外側手綱核からの投射は強力で、fasciculus retroflexusを介した入力である。その効果は抑制または興奮と見解が異なる。外側手綱核の破壊で、嫌悪刺激に応じて増加するセロトニンの分泌が抑制される[10]。
化学的特徴
セロトニン細胞の大半が縫線核に存在し、特に背側縫線核の多くの細胞はセロトニン細胞である。核内の細胞に占めるセロトニン細胞の割合は報告にもよるが、ラットの約30%, ネコのmedium-sized neuronの70 %, ヒトでは70 %[11]がセロトニン細胞であると報告されている。吻側核群のほうがこの割合は高い。その他GABA・ドーパミン・ノルアドレナリン、一酸化窒素・さまざまなペプチドやアセチルコリンなどを含む細胞がある。
個々の縫線核細胞の化学的特性とその機能を明らかにするためには、細胞の発火パターンなどの電気生理学的な特性から細胞の化学的特性が推測できたら便利である。しかしこれまでのところ信頼できる電気生理学的な特性は特定されていない。例えば、活動電位の形状が幅広で、基底の発火頻度が低頻度(<3Hz)かつ発火パターンがメトロノームのように一定のものはセロトニン細胞であるとされたが、最近の研究結果では否定的である。例えば低頻度発火の縫線核細胞のうち半数はセロトニン細胞ではなく、高頻度発火の細胞のうち20%はセロトニン細胞であった[12] [13]。徐波睡眠(slow-wave sleep)の際発火頻度が低下しないセロトニン細胞は22%にも及んだ[14]。また、自己受容体である5-HT1A受容体はセロトニン細胞のみでなく非セロトニン細胞にも存在すること、5-HT1A作用薬に対する縫線核細胞の反応は一様でないことから[15]、5-HT1A作用薬により発火が抑制される細胞はセロトニン細胞であるという薬理学的な同定も十分とはいえない[16]。
一方でセロトニン細胞の発火パターンの違いは機能の違いを反映している可能性がある。低頻度・regularな発火パターンを示すセロトニン細胞は海馬のθリズムとの同期は認められないが、高頻度・バースト状の発火パターンを示すセロトニン細胞は海馬のθリズムと同期が認められ、記憶の形成などにかかわっている可能性がある[13]。
機能
縫線核細胞の発火は睡眠覚醒リズムや歩行・呼吸、さらに、注意・報酬やストレス反応などの情動や認知機能にも関連する。
尾側核群
尾側核群からは脳幹や脊髄に強い投射があり、これらの投射源の大半(>85%)はセロトニン細胞である[17]。NRP, NRO の電気刺激、セロトニンによる刺激は腰神経や横隔神経細胞に興奮性に働く。単一の細胞が複数の運動に反応すること、反応形式が持続的(tonic)であることから、運動全般のgain setterであるという考えがある[18]。
歩行
ネコの歩行運動では、開始直後から持続的な発火率の上昇が開始し、歩行中止直後に停止する。発火パターンは歩行運動と同期しているものと、同期せず持続的に発火しているものとがある。
呼吸中枢への興奮性入力
延髄に分布する淡蒼縫線核, 不確縫線核には高二酸化炭素状態で発火率が上昇する細胞がある。このような細胞のすべてが歩行によっても発火率が上昇した。これらの核からのセロトニンの投射は、呼吸中枢である疑核や舌下神経へ興奮性に働く。
摂食
淡蒼縫線核, 不確縫線核細胞は摂食行動そのものに反応し、中でも咀嚼や嚥下に関与するもの、持続的に発火するので消化管の運動に関与している可能性があるものがある。
吻側部
睡眠覚醒レベルの調節
背側縫線核はおそらくノルアドレナリン、アセチルコリン系との相互作用により睡眠覚醒レベルの調節に関与している。背側縫線核細胞は覚醒時に発火頻度が上昇し、徐波睡眠・REM睡眠時に低下する。ただし、背側縫線核細胞の一部は睡眠による発火率の低下が見られず、逆に上昇するものも報告されている。
注意
背側縫線核細胞の活動は注意を促す定位反応により抑制される。覚醒ネコではドアの開閉に対して眼球運動が起き、それに同期して数分の発火抑制が起きる。感覚刺激への応答は、視覚・聴覚刺激両方に反応するというbimodalである点、habituateしない点、phasicな興奮に引き続く200ms 以上の長い抑制が見られることが報告されている。phasic な興奮は発火率の上昇というよりは発火のタイミングが刺激入力にロックした結果であり、潜時は40-50ms と非常に短い。
ストレス反応
縫線核群はストレス、特に回避できないストレス負荷時に応答し[19]、背側縫線核やその投射先である扁桃体や中心灰白質でセロトニン放出が増加し、ストレス反応を修飾する[20]。このメカニズムには手綱核から縫線核群への投射や前頭葉内側部から縫線核への投射が関与しており、この系を破壊すると回避可能か否かによる行動の差が減弱する[10]。ストレス反応において中心的な役割を果たす視床下部・下垂体・副腎系と縫線核群との相互関係も重要で、背側縫線核に見られるcorticotropin-releasing factor(CRF)陽性の細胞はセロトニン細胞でもある[21]。セロトニン細胞は大きさがホルモンによって影響を受ける。ステロイドホルモンの一つである糖質コルチコイドの量が減少すると細胞サイズが小さくなる。その他、エストロゲン、テストステロン、コレステロール、インターロイキンなどが細胞の大きさに影響を及ぼす。縫線核群からは視索上核へも強い投射があるが、これは視床下部からのCRFの投射を介して、視床下部・下垂体・副腎系を亢進させる。従って、 縫線核からのセロトニン投射は神経伝達物質としてのみならず神経内分泌系の一部としても理解されなければいけない。
報酬
背側縫線核における報酬関連の応答も報告されている。報酬の遅延[22]、期待または得られた報酬量に応じた持続的な発火[23]が報告されている。他にも背側縫線核細胞の活動は多様で、認知行動課題の様々な因子に反応する[24]。
関連項目
参考文献
- ↑ 1.0 1.1
Azmitia, E.C., & Gannon, P.J. (1986).
The primate serotonergic system: a review of human and animal studies and a report on Macaca fascicularis. Advances in neurology, 43, 407-68. [PubMed:2418648] [WorldCat] - ↑
Vertes, R.P. (1991).
A PHA-L analysis of ascending projections of the dorsal raphe nucleus in the rat. The Journal of comparative neurology, 313(4), 643-68. [PubMed:1783685] [WorldCat] [DOI] - ↑
Peyron, C., Petit, J.M., Rampon, C., Jouvet, M., & Luppi, P.H. (1998).
Forebrain afferents to the rat dorsal raphe nucleus demonstrated by retrograde and anterograde tracing methods. Neuroscience, 82(2), 443-68. [PubMed:9466453] [WorldCat] [DOI] - ↑
Hensler, J.G. (2006).
Serotonergic modulation of the limbic system. Neuroscience and biobehavioral reviews, 30(2), 203-14. [PubMed:16157378] [WorldCat] [DOI] - ↑
Molliver, M.E. (1987).
Serotonergic neuronal systems: what their anatomic organization tells us about function. Journal of clinical psychopharmacology, 7(6 Suppl), 3S-23S. [PubMed:3323265] [WorldCat] - ↑
Wang, R.Y., & Aghajanian, G.K. (1977).
Inhibiton of neurons in the amygdala by dorsal raphe stimulation: mediation through a direct serotonergic pathway. Brain research, 120(1), 85-102. [PubMed:137766] [WorldCat] [DOI] - ↑
Arnsten, A.F., & Goldman-Rakic, P.S. (1984).
Selective prefrontal cortical projections to the region of the locus coeruleus and raphe nuclei in the rhesus monkey. Brain research, 306(1-2), 9-18. [PubMed:6466989] [WorldCat] [DOI] - ↑
Hajós, M., Richards, C.D., Székely, A.D., & Sharp, T. (1998).
An electrophysiological and neuroanatomical study of the medial prefrontal cortical projection to the midbrain raphe nuclei in the rat. Neuroscience, 87(1), 95-108. [PubMed:9722144] [WorldCat] [DOI] - ↑
Varga, V., Kocsis, B., & Sharp, T. (2003).
Electrophysiological evidence for convergence of inputs from the medial prefrontal cortex and lateral habenula on single neurons in the dorsal raphe nucleus. The European journal of neuroscience, 17(2), 280-6. [PubMed:12542664] [WorldCat] [DOI] - ↑ 10.0 10.1
Amat, J., Sparks, P.D., Matus-Amat, P., Griggs, J., Watkins, L.R., & Maier, S.F. (2001).
The role of the habenular complex in the elevation of dorsal raphe nucleus serotonin and the changes in the behavioral responses produced by uncontrollable stress. Brain research, 917(1), 118-26. [PubMed:11602236] [WorldCat] [DOI] - ↑
Baker, K.G., Halliday, G.M., Hornung, J.P., Geffen, L.B., Cotton, R.G., & Törk, I. (1991).
Distribution, morphology and number of monoamine-synthesizing and substance P-containing neurons in the human dorsal raphe nucleus. Neuroscience, 42(3), 757-75. [PubMed:1720227] [WorldCat] [DOI] - ↑
Allers, K.A., & Sharp, T. (2003).
Neurochemical and anatomical identification of fast- and slow-firing neurones in the rat dorsal raphe nucleus using juxtacellular labelling methods in vivo. Neuroscience, 122(1), 193-204. [PubMed:14596860] [WorldCat] [DOI] - ↑ 13.0 13.1
Kocsis, B., Varga, V., Dahan, L., & Sik, A. (2006).
Serotonergic neuron diversity: identification of raphe neurons with discharges time-locked to the hippocampal theta rhythm. Proceedings of the National Academy of Sciences of the United States of America, 103(4), 1059-64. [PubMed:16418294] [PMC] [WorldCat] [DOI] - ↑
Urbain, N., Creamer, K., & Debonnel, G. (2006).
Electrophysiological diversity of the dorsal raphe cells across the sleep-wake cycle of the rat. The Journal of physiology, 573(Pt 3), 679-95. [PubMed:16613874] [PMC] [WorldCat] [DOI] - ↑
Fornal, C.A., Litto, W.J., Metzler, C.W., Marrosu, F., Tada, K., & Jacobs, B.L. (1994).
Single-unit responses of serotonergic dorsal raphe neurons to 5-HT1A agonist and antagonist drug administration in behaving cats. The Journal of pharmacology and experimental therapeutics, 270(3), 1345-58. [PubMed:7932189] [WorldCat] - ↑
Kirby, L.G., Pernar, L., Valentino, R.J., & Beck, S.G. (2003).
Distinguishing characteristics of serotonin and non-serotonin-containing cells in the dorsal raphe nucleus: electrophysiological and immunohistochemical studies. Neuroscience, 116(3), 669-83. [PubMed:12573710] [PMC] [WorldCat] [DOI] - ↑
Bowker, R.M., & Morrison, A.R. (1976).
The startle reflex and PGO spikes. Brain research, 102(1), 185-90. [PubMed:1247878] [WorldCat] [DOI] - ↑
Veasey, S.C., Fornal, C.A., Metzler, C.W., & Jacobs, B.L. (1995).
Response of serotonergic caudal raphe neurons in relation to specific motor activities in freely moving cats. The Journal of neuroscience : the official journal of the Society for Neuroscience, 15(7 Pt 2), 5346-59. [PubMed:7623157] [WorldCat] - ↑
Maier, S.F., & Watkins, L.R. (2005).
Stressor controllability and learned helplessness: the roles of the dorsal raphe nucleus, serotonin, and corticotropin-releasing factor. Neuroscience and biobehavioral reviews, 29(4-5), 829-41. [PubMed:15893820] [WorldCat] [DOI] - ↑
Amat, J., Matus-Amat, P., Watkins, L.R., & Maier, S.F. (1998).
Escapable and inescapable stress differentially and selectively alter extracellular levels of 5-HT in the ventral hippocampus and dorsal periaqueductal gray of the rat. Brain research, 797(1), 12-22. [PubMed:9630480] [WorldCat] [DOI] - ↑
Commons, K.G., Connolley, K.R., & Valentino, R.J. (2003).
A neurochemically distinct dorsal raphe-limbic circuit with a potential role in affective disorders. Neuropsychopharmacology : official publication of the American College of Neuropsychopharmacology, 28(2), 206-15. [PubMed:12589373] [WorldCat] [DOI] - ↑
Miyazaki, K.W., Miyazaki, K., & Doya, K. (2011).
Activation of the central serotonergic system in response to delayed but not omitted rewards. The European journal of neuroscience, 33(1), 153-60. [PubMed:21070390] [PMC] [WorldCat] [DOI] - ↑
Nakamura, K., Matsumoto, M., & Hikosaka, O. (2008).
Reward-dependent modulation of neuronal activity in the primate dorsal raphe nucleus. The Journal of neuroscience : the official journal of the Society for Neuroscience, 28(20), 5331-43. [PubMed:18480289] [PMC] [WorldCat] [DOI] - ↑
Ranade, S.P., & Mainen, Z.F. (2009).
Transient firing of dorsal raphe neurons encodes diverse and specific sensory, motor, and reward events. Journal of neurophysiology, 102(5), 3026-37. [PubMed:19710375] [WorldCat] [DOI]