脳回と脳溝
河崎 洋志
金沢大学 医学系 脳神経医学教室
DOI:10.14931/bsd.9278 原稿受付日:2020年7月25日 原稿完成日:2020年9月19日
担当編集委員:山形 方人(ハーバード大学・脳科学センター)
英:gyrus and sulcus (複数形:gyri and sulci) 独:Gyrus und Sulcus 仏:gyrus/circonvolution cérébrale et sulcus/sillon
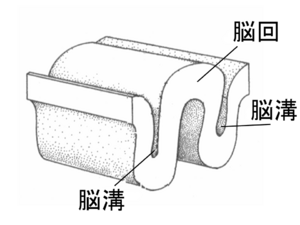
哺乳類の大脳半球の表面には『しわ』すなわち凹凸(おうとつ)が存在するが、その『しわ』の隆起部分を脳回といい、脳回の横にある陥凹(かんおう)部分を脳溝という。
構造的特徴
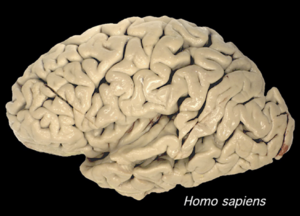
哺乳類の大脳の表面には『しわ』すなわち凹凸が存在するが(図1)、その『しわ』の隆起部分を脳回といい、また脳回の横にある陥凹部分を脳溝という(図2)。脳回を持つ脳を皺脳 (gyrencephalic)、持たない脳を滑脳 (lissencephalic)と表現する。脳回は一般的に、ヒト、サル、ウシ、ゾウ、クジラなどの大きな大脳を持つ動物種には見られるのに対して、ラットやマウスなどの大脳が小さい動物種は脳回を持たないことが多い[1] 。
大脳半球は、6層構造を持ち神経細胞が密集している灰白質と、主に神経線維やミエリンからなる白質で構成される。脳回を持つ大脳では灰白質の6つの層はすべて弯曲している。一方、白質は灰白質との境界でのみ弯曲に対応し、白質の側脳室側は平滑であり弯曲は見られないという特徴がある。
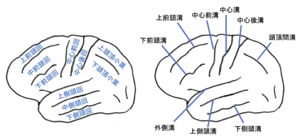
脳回と脳溝の空間的分布は、動物種ごとにある一定のパターンが存在し、主な脳回と脳溝には名称がつけられている(図3)。しかし、個体差もあり完全には一致しないことも多い[1] 。異なる個体の間で、脳回のパターンの相関性が最も高いのは一卵性双生児の間である[2] 。従って、脳回のパターンは遺伝的要因と発生過程における何らかの別の要因によって規定されると考えられている。
形成過程
発生過程において、まず早期に深い溝である一次脳溝が作られ、その後に二次脳溝、三次脳溝の順に作られていく。ヒトよりも単純な脳回のパターンを有する動物では一次脳溝のみが発達しており、異なる動物個体間でも一次脳溝の位置は保存され一定である傾向がある[1] 。二次脳溝の位置は必ずしも一定ではなく、高次な脳溝の位置はさらに多様に見えることから遺伝的な影響は限定的であると考えられる。従って、大脳皮質の一次脳溝のパターンは遺伝的要因により規定されているが、高次になれば遺伝的要因の関与は少ないと考えられる。
脳回異常疾患
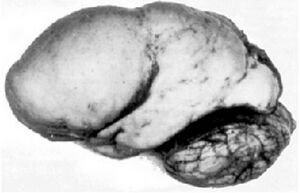
正常よりも多数の脳回がある大脳の状態は多小脳回症(polymicrogyria)、また大脳表面の隆起がなくなり平らな状態は滑脳症(lissencephaly)と言われ(図4)、いずれも重篤な脳機能障害を呈する[3] 。また自閉症や統合失調症でも脳回異常が報告されている[4]。
形成メカニズム
脳回の形成機構として様々な仮説が提唱されている。限られた容積の頭蓋のなかで大脳皮質が拡大したために物理的な圧が生じて脳回ができたとの仮説、外側脳室下帯と呼ばれる神経前駆細胞層が脳回形成に重要であるとの仮説、近隣の大脳皮質領域間の線維連絡が生み出す張力が脳回を作り出すとの仮説、大脳の表面と深部との比率の差が脳回形成につながるとの仮説などである[5][6][7][8] 。
これまでに滑脳症の原因遺伝子の解析から、脳回形成機構の一端が明らかになっている。一部の滑脳症の原因遺伝子は複数判明しており、微小管結合タンパク質DCX、細胞外分泌因子リーリン、リン酸化酵素CDK5などがその代表である[6]。これらの遺伝子機能の解析から、神経細胞の移動が脳回形成に必須であると考えられている。このように脳回異常疾患の原因として報告されている遺伝子などは脳回形成に関わる可能性が高いと考えられており、フェレットなどの大脳に脳回を持つ動物を用いた実験的検証が進められている[6][9] 。実際にナトリウムチャネルSCN3A、転写因子Tbr2、Cdk5、線維芽細胞増殖因子 (FGF)シグナル、ソニックヘッジホッグ (sonic hedgehog)シグナルなどが脳回形成に関わると報告されている[10][11][12][13] 。
参考文献
- ↑ 1.0 1.1 1.2 Welker W. (1990).
Why does cerebral cortex fissure and fold?
In: Jones EG, Peters A, editors. Cereb Cortex. 8B. Boston, MA: Springer; pp. 3-136. - ↑
Lohmann, G., von Cramon, D.Y., & Steinmetz, H. (1999).
Sulcal variability of twins. Cerebral cortex (New York, N.Y. : 1991), 9(7), 754-63. [PubMed:10554998] [WorldCat] [DOI] - ↑
Ross, M.E., & Walsh, C.A. (2001).
Human brain malformations and their lessons for neuronal migration. Annual review of neuroscience, 24, 1041-70. [PubMed:11520927] [WorldCat] [DOI] - ↑
Kroenke, C.D., & Bayly, P.V. (2018).
How Forces Fold the Cerebral Cortex. The Journal of neuroscience : the official journal of the Society for Neuroscience, 38(4), 767-775. [PubMed:29367287] [PMC] [WorldCat] [DOI] - ↑
Florio, M., & Huttner, W.B. (2014).
Neural progenitors, neurogenesis and the evolution of the neocortex. Development (Cambridge, England), 141(11), 2182-94. [PubMed:24866113] [WorldCat] [DOI] - ↑ 6.0 6.1 6.2
Llinares-Benadero, C., & Borrell, V. (2019).
Deconstructing cortical folding: genetic, cellular and mechanical determinants. Nature reviews. Neuroscience, 20(3), 161-176. [PubMed:30610227] [WorldCat] [DOI] - ↑
Lui, J.H., Hansen, D.V., & Kriegstein, A.R. (2011).
Development and evolution of the human neocortex. Cell, 146(1), 18-36. [PubMed:21729779] [PMC] [WorldCat] [DOI] - ↑
Sun, T., & Hevner, R.F. (2014).
Growth and folding of the mammalian cerebral cortex: from molecules to malformations. Nature reviews. Neuroscience, 15(4), 217-32. [PubMed:24646670] [PMC] [WorldCat] [DOI] - ↑ 河崎洋志 (2018).
フェレットを用いた大脳の脳回形成の分子機構解析
生化学 90:683-9 - ↑
Matsumoto, N., Shinmyo, Y., Ichikawa, Y., & Kawasaki, H. (2017).
Gyrification of the cerebral cortex requires FGF signaling in the mammalian brain. eLife, 6. [PubMed:29132503] [PMC] [WorldCat] [DOI] - ↑
Matsumoto, N., Tanaka, S., Horiike, T., Shinmyo, Y., & Kawasaki, H. (2020).
A discrete subtype of neural progenitor crucial for cortical folding in the gyrencephalic mammalian brain. eLife, 9. [PubMed:32312384] [PMC] [WorldCat] [DOI] - ↑
Shinmyo, Y., Terashita, Y., Dinh Duong, T.A., Horiike, T., Kawasumi, M., Hosomichi, K., ..., & Kawasaki, H. (2017).
Folding of the Cerebral Cortex Requires Cdk5 in Upper-Layer Neurons in Gyrencephalic Mammals. Cell reports, 20(9), 2131-2143. [PubMed:28854363] [WorldCat] [DOI] - ↑
Smith, R.S., Kenny, C.J., Ganesh, V., Jang, A., Borges-Monroy, R., Partlow, J.N., ..., & Lehtinen, M.K. (2018).
Sodium Channel SCN3A (NaV1.3) Regulation of Human Cerebral Cortical Folding and Oral Motor Development. Neuron, 99(5), 905-913.e7. [PubMed:30146301] [PMC] [WorldCat] [DOI]