「遅いシナプス後電位」の版間の差分
Taroishikawa (トーク | 投稿記録) 細編集の要約なし |
Taroishikawa (トーク | 投稿記録) 細編集の要約なし |
||
| 1行目: | 1行目: | ||
同義語:slow postsynaptic potential、遅いシナプス(後)電位、緩徐シナプス(後)電位 類義語:slow (post-)synaptic current、slow synaptic transmission, slow EPSP, slow IPSP | 同義語:slow postsynaptic potential、遅いシナプス(後)電位、緩徐シナプス(後)電位<BR> | ||
類義語:slow (post-)synaptic current、slow synaptic transmission, slow EPSP, slow IPSP<BR> | |||
[[wikipedia:ja:受容体#イオンチャネル型受容体|イオンチャネル型受容体]]([[wikipedia:ionotropic receptors|ionotropic receptors]])を介して数ミリ秒~数10ミリ秒の時間経過で発生する「速いシナプス電位(fast [[wikipedia:synaptic potential|synaptic potential]])」に対して、[[wikipedia:ja:受容体#代謝型受容体|代謝型受容体]]([[代謝活性型受容体]])([[wikipedia:metabotropic receptor|metabotropic receptors]])を介して数100ミリ秒~数分の時間経過で発生するシナプス電位を「遅いシナプス電位(slow synaptic potential)」と呼ぶ。遅いシナプス電位には興奮性([[wikipedia:ja:活動電位#脱分極|脱分極]]性)と抑制性([[wikipedia:ja:活動電位#過分極|過分極]]性)のものがあり、様々な[[wikipedia:ja:神経伝達物質|神経伝達物質]]によって伝達されている。 | |||
<div><div><div> | |||
<br> | <br> | ||
== 先駆的研究について == | == 先駆的研究について == | ||
[[Image:Taroishikawa fig 1.jpg|thumb|right|400px|'''ウシガエル交感神経節における4種類のシナプス応答'''<BR> A. (左)速い興奮性シナプス後電位、(右)閾値を超えて活動電位を発火している。B. 遅い抑制性シナプス後電位。 C. 遅いシナプス後電位。D. 後期の遅いシナプス電位。Kuffler(1980)<ref name=ref12/>より許可を得て転載。]] 遅いシナプス電位については、1950年代から1980年代にかけて、[[wikipedia:ja:ウシガエル|ウシガエル]]の交感神経節([[wikipedia:Sympathetic ganglion|Sympathetic ganglion]])を用いた研究で多くの事実が明らかにされた。このシナプスでは、ニコチン型[[wikipedia:jp:アセチルコリン受容体|アセチルコリン受容体]]を介した速い興奮性シナプス電位の他に、ムスカリン型アセチルコリン受容体を介した遅い抑制性電位と興奮性電位があり、さらに、LHRH-like peptideによる後期の遅いシナプス電位late slow synaptic potentialがあることが明らかにされた<ref><pubmed>35789</pubmed></ref><ref name="ref12"><pubmed>6110694</pubmed></ref>。これらの発見の経緯は久場による総説<ref>'''久場健司'''<BR>興奮膜とシナプス生理学の黎明の頃―纐纈教三先生の研究史を辿りながら<BR>''日本生理学雑誌'': 2007, 69(12): 362-377[http://physiology.jp/exec/nisseishi/backnumber/151 日本生理学雑誌 第69巻 12号]</ref>に詳しい。 | |||
</div><div> | |||
<br> | |||
<br> | <br> | ||
<br> | <br> | ||
<div><br></div> | |||
== 伝達物質と受容体の種類 == | == 伝達物質と受容体の種類 == | ||
速いシナプス伝達を担うイオンチャネル共役型受容体はそれ自体にイオンが透過する孔(pore)を持っているのに対し、遅いシナプス伝達を担う代謝型受容体はそれ自体にはイオンチャンネルとしての機能はなく、細胞内シグナル伝達を介してイオンチャンネルに働きかけることによって膜電位に影響を与える。神経系において遅いシナプス伝達を担う代謝型受容体の殆どは[[wikipedia:ja:Gタンパク質共役受容体|Gタンパク質共役受容体]](G-protein coupled receptors <ref>'''Bertil Hille'''<BR>G protein-coupled receptor<BR>''Scholarpedia'': 2009, 4(12):8214 [http://www.scholarpedia.org/article/G_protein-coupled_receptor Scholarpedia]</ref>)である。 神経系に存在する主なGタンパク質共役受容体としては、代謝型グルタミン酸受容体、GABA受容体(B型)、ドーパミン受容体、セロトニン(5-HT)受容体(3型を除く)、アドレナリン受容体、アデノシン受容体、ムスカリン性アセチルコリン受容体、カンナビノイド受容体 、ヒスタミン受容体、P2Y受容体(ATPなどプリンヌクレオチドの受容体)があり、各々のリガンドにより活性化される。 また、神経栄養因子(BDNF等)がその受容体(TrkB等)を介した細胞内シグナル伝達によって膜電位を変化させることもある<ref><pubmed>12671646</pubmed></ref>。<br> | |||
<br> | <br> | ||
| 25行目: | 24行目: | ||
== イオンチャンネルの種類 == | == イオンチャンネルの種類 == | ||
Gタンパクシグナリングによって影響を受けるイオンチャンネルは数多いが、その中でシナプス電位として観察される電位変化をもたらすイオンチャンネルはGタンパク質共役型内向き整流性カリウムチャネルG protein-coupled inwardly-rectifying potassium channel(GIRKチャンネル、別名:Kir3)<ref name="ref3"><pubmed>20389305</pubmed></ref>、KCNQチャンネル(別名:KvLQT、 Kv7またはM channel)<ref name="ref4"><pubmed>19298256</pubmed></ref>、およびTransient receptor potential (TRP)チャンネル<ref name="ref5"><pubmed>15194117</pubmed></ref><ref name="ref6"><pubmed>18701065</pubmed></ref>等である。GIRKチャンネルやKCNQチャンネルのようにカリウムイオンをほぼ選択的に透過するチャンネルの場合は、開口により膜電位は過分極し、閉口により脱分極する。TRPチャンネルのような非選択的陽イオンチャンネルの場合は、開口により膜電位は脱分極し、閉口により再分極する。 GIRKチャンネルはGタンパク質共役受容体のGβγ サブユニットにより活性化されるのに加え、Protein kinase A(PKA)依存的リン酸化によって活性化され、Protein kinase C(PKC)依存的リン酸化で阻害される。また、phospholipase C (PLC) | Gタンパクシグナリングによって影響を受けるイオンチャンネルは数多いが、その中でシナプス電位として観察される電位変化をもたらすイオンチャンネルはGタンパク質共役型内向き整流性カリウムチャネルG protein-coupled inwardly-rectifying potassium channel(GIRKチャンネル、別名:Kir3)<ref name="ref3"><pubmed>20389305</pubmed></ref>、KCNQチャンネル(別名:KvLQT、 Kv7またはM channel)<ref name="ref4"><pubmed>19298256</pubmed></ref>、およびTransient receptor potential (TRP)チャンネル<ref name="ref5"><pubmed>15194117</pubmed></ref><ref name="ref6"><pubmed>18701065</pubmed></ref>等である。GIRKチャンネルやKCNQチャンネルのようにカリウムイオンをほぼ選択的に透過するチャンネルの場合は、開口により膜電位は過分極し、閉口により脱分極する。TRPチャンネルのような非選択的陽イオンチャンネルの場合は、開口により膜電位は脱分極し、閉口により再分極する。 GIRKチャンネルはGタンパク質共役受容体のGβγ サブユニットにより活性化されるのに加え、Protein kinase A(PKA)依存的リン酸化によって活性化され、Protein kinase C(PKC)依存的リン酸化で阻害される。また、phospholipase C (PLC)の活性化により細胞膜の[[ホスファチジルイノシトール#PI(4,5)P2|phosphatidylinositol-4,5-bisphosphate (PI(4,5)P<sub>2</sub>)]]が枯渇するとGIRKチャンネルおよびKCNQチャンネルは阻害される<ref name="ref3" /><ref name="ref4" />。TRPチャンネルの活性化もPLCの活性化により誘導される<ref name="ref11"><pubmed>16133266</pubmed></ref>。 | ||
<br> | <br> | ||
| 31行目: | 30行目: | ||
== 受容体の局在と伝達様式 == | == 受容体の局在と伝達様式 == | ||
速いシナプス電位はシナプス前線維を一回刺激することで惹起できるが、遅いシナプス電位を惹起するためにはシナプス前線維を高頻度で連続刺激する必要があることが初期の研究から知られていた。このことから、遅いシナプス電位を惹起するためにはより多量の伝達物質の放出と伝達物質の細胞外蓄積が必要であることが示唆された。このため、速いシナプス電位を担う受容体はシナプスに存在するのに対し、遅いシナプス電位を担う受容体はシナプス周辺やシナプス外に存在することが推定されていた<ref name="ref3"/><ref><pubmed>10774734</pubmed></ref>。実際、近年の免疫標識法による研究によって、代謝型受容体がシナプス外に多く存在することが示されている<ref><pubmed>14657159</pubmed></ref>。ただし、どの程度の割合で受容体がシナプス外に存在するかは、受容体の種類や細胞の種類によって様々である。 受容体がシナプス外に多く局在している場合の伝達様式は、シナプス前膜とシナプス後膜の間において1対1で伝達が行われる「シナプス伝達(synaptic transmission)」の原則から外れ、むしろ複数のシナプス前終末から放出された伝達物質の総和をシナプス外において感受している様式(多数対1の関係)や、1のシナプス前終末から放出された伝達物質が周辺の複数の細胞の受容体に作用する様式(1対多数の関係、spill-over)、もしくはこれらの組み合わせによる多数対多数の伝達様式になっていると考えられる。このような伝達様式は「シナプス伝達」と言うよりも、むしろ「総量的伝達(volume transmission)」<ref><pubmed>8596642</pubmed></ref>や「神経修飾(neuromodulation)」と呼ぶ方が適している。 | |||
<br> | <br> | ||
| 39行目: | 38行目: | ||
一般的に遅いシナプス電位の振幅は小さく、興奮性伝達の場合においても、それ自体で閾値に達し活動電位の発火を引き起こすことは殆どないと考えられる。むしろ、持続的な膜電位変化をもたらすことで、速いシナプス伝達による発火のしやすさを調節したり、自発発火に影響を与えたりするなど、修飾的な役割が主である。カルシウム透過性のあるTRPチャンネルが開口すれば、細胞内カルシウム濃度の上昇を引き起こし、細胞内シグナリングに影響をあたえる。 なお、代謝型受容体の活性化により引き起こされるのは電位の変化(遅いシナプス電位)だけではなく、これと平行して、細胞内カルシウム濃度の変化を含む様々な細胞内シグナルカスケードが活性化されて、細胞内タンパク質のリン酸化や遺伝子発現が引き起こされ、シナプス電位の持続時間以上の長期的な影響を与え得ることに注意すべきである。 | 一般的に遅いシナプス電位の振幅は小さく、興奮性伝達の場合においても、それ自体で閾値に達し活動電位の発火を引き起こすことは殆どないと考えられる。むしろ、持続的な膜電位変化をもたらすことで、速いシナプス伝達による発火のしやすさを調節したり、自発発火に影響を与えたりするなど、修飾的な役割が主である。カルシウム透過性のあるTRPチャンネルが開口すれば、細胞内カルシウム濃度の上昇を引き起こし、細胞内シグナリングに影響をあたえる。 なお、代謝型受容体の活性化により引き起こされるのは電位の変化(遅いシナプス電位)だけではなく、これと平行して、細胞内カルシウム濃度の変化を含む様々な細胞内シグナルカスケードが活性化されて、細胞内タンパク質のリン酸化や遺伝子発現が引き起こされ、シナプス電位の持続時間以上の長期的な影響を与え得ることに注意すべきである。 | ||
<br> 参考文献 <references /> | <br> | ||
== 参考文献 == | |||
<references /> | |||
<br> | |||
</div></div></div> | |||
2012年9月7日 (金) 01:28時点における版
同義語:slow postsynaptic potential、遅いシナプス(後)電位、緩徐シナプス(後)電位
類義語:slow (post-)synaptic current、slow synaptic transmission, slow EPSP, slow IPSP
イオンチャネル型受容体(ionotropic receptors)を介して数ミリ秒~数10ミリ秒の時間経過で発生する「速いシナプス電位(fast synaptic potential)」に対して、代謝型受容体(代謝活性型受容体)(metabotropic receptors)を介して数100ミリ秒~数分の時間経過で発生するシナプス電位を「遅いシナプス電位(slow synaptic potential)」と呼ぶ。遅いシナプス電位には興奮性(脱分極性)と抑制性(過分極性)のものがあり、様々な神経伝達物質によって伝達されている。
先駆的研究について
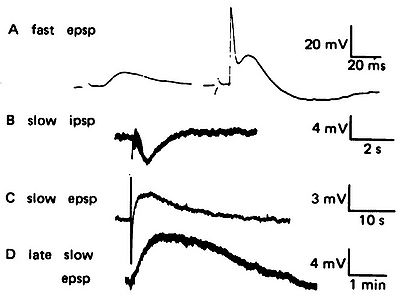
A. (左)速い興奮性シナプス後電位、(右)閾値を超えて活動電位を発火している。B. 遅い抑制性シナプス後電位。 C. 遅いシナプス後電位。D. 後期の遅いシナプス電位。Kuffler(1980)[1]より許可を得て転載。
伝達物質と受容体の種類
速いシナプス伝達を担うイオンチャネル共役型受容体はそれ自体にイオンが透過する孔(pore)を持っているのに対し、遅いシナプス伝達を担う代謝型受容体はそれ自体にはイオンチャンネルとしての機能はなく、細胞内シグナル伝達を介してイオンチャンネルに働きかけることによって膜電位に影響を与える。神経系において遅いシナプス伝達を担う代謝型受容体の殆どはGタンパク質共役受容体(G-protein coupled receptors [4])である。 神経系に存在する主なGタンパク質共役受容体としては、代謝型グルタミン酸受容体、GABA受容体(B型)、ドーパミン受容体、セロトニン(5-HT)受容体(3型を除く)、アドレナリン受容体、アデノシン受容体、ムスカリン性アセチルコリン受容体、カンナビノイド受容体 、ヒスタミン受容体、P2Y受容体(ATPなどプリンヌクレオチドの受容体)があり、各々のリガンドにより活性化される。 また、神経栄養因子(BDNF等)がその受容体(TrkB等)を介した細胞内シグナル伝達によって膜電位を変化させることもある[5]。
イオンチャンネルの種類
Gタンパクシグナリングによって影響を受けるイオンチャンネルは数多いが、その中でシナプス電位として観察される電位変化をもたらすイオンチャンネルはGタンパク質共役型内向き整流性カリウムチャネルG protein-coupled inwardly-rectifying potassium channel(GIRKチャンネル、別名:Kir3)[6]、KCNQチャンネル(別名:KvLQT、 Kv7またはM channel)[7]、およびTransient receptor potential (TRP)チャンネル[8][9]等である。GIRKチャンネルやKCNQチャンネルのようにカリウムイオンをほぼ選択的に透過するチャンネルの場合は、開口により膜電位は過分極し、閉口により脱分極する。TRPチャンネルのような非選択的陽イオンチャンネルの場合は、開口により膜電位は脱分極し、閉口により再分極する。 GIRKチャンネルはGタンパク質共役受容体のGβγ サブユニットにより活性化されるのに加え、Protein kinase A(PKA)依存的リン酸化によって活性化され、Protein kinase C(PKC)依存的リン酸化で阻害される。また、phospholipase C (PLC)の活性化により細胞膜のphosphatidylinositol-4,5-bisphosphate (PI(4,5)P2)が枯渇するとGIRKチャンネルおよびKCNQチャンネルは阻害される[6][7]。TRPチャンネルの活性化もPLCの活性化により誘導される[10]。
受容体の局在と伝達様式
速いシナプス電位はシナプス前線維を一回刺激することで惹起できるが、遅いシナプス電位を惹起するためにはシナプス前線維を高頻度で連続刺激する必要があることが初期の研究から知られていた。このことから、遅いシナプス電位を惹起するためにはより多量の伝達物質の放出と伝達物質の細胞外蓄積が必要であることが示唆された。このため、速いシナプス電位を担う受容体はシナプスに存在するのに対し、遅いシナプス電位を担う受容体はシナプス周辺やシナプス外に存在することが推定されていた[6][11]。実際、近年の免疫標識法による研究によって、代謝型受容体がシナプス外に多く存在することが示されている[12]。ただし、どの程度の割合で受容体がシナプス外に存在するかは、受容体の種類や細胞の種類によって様々である。 受容体がシナプス外に多く局在している場合の伝達様式は、シナプス前膜とシナプス後膜の間において1対1で伝達が行われる「シナプス伝達(synaptic transmission)」の原則から外れ、むしろ複数のシナプス前終末から放出された伝達物質の総和をシナプス外において感受している様式(多数対1の関係)や、1のシナプス前終末から放出された伝達物質が周辺の複数の細胞の受容体に作用する様式(1対多数の関係、spill-over)、もしくはこれらの組み合わせによる多数対多数の伝達様式になっていると考えられる。このような伝達様式は「シナプス伝達」と言うよりも、むしろ「総量的伝達(volume transmission)」[13]や「神経修飾(neuromodulation)」と呼ぶ方が適している。
生理的意義
一般的に遅いシナプス電位の振幅は小さく、興奮性伝達の場合においても、それ自体で閾値に達し活動電位の発火を引き起こすことは殆どないと考えられる。むしろ、持続的な膜電位変化をもたらすことで、速いシナプス伝達による発火のしやすさを調節したり、自発発火に影響を与えたりするなど、修飾的な役割が主である。カルシウム透過性のあるTRPチャンネルが開口すれば、細胞内カルシウム濃度の上昇を引き起こし、細胞内シグナリングに影響をあたえる。 なお、代謝型受容体の活性化により引き起こされるのは電位の変化(遅いシナプス電位)だけではなく、これと平行して、細胞内カルシウム濃度の変化を含む様々な細胞内シグナルカスケードが活性化されて、細胞内タンパク質のリン酸化や遺伝子発現が引き起こされ、シナプス電位の持続時間以上の長期的な影響を与え得ることに注意すべきである。
参考文献
- ↑ 1.0 1.1
Kuffler, S.W. (1980).
Slow synaptic responses in autonomic ganglia and the pursuit of a peptidergic transmitter. The Journal of experimental biology, 89, 257-86. [PubMed:6110694] [WorldCat] - ↑
Jan, Y.N., Jan, L.Y., & Kuffler, S.W. (1979).
A peptide as a possible transmitter in sympathetic ganglia of the frog. Proceedings of the National Academy of Sciences of the United States of America, 76(3), 1501-5. [PubMed:35789] [PMC] [WorldCat] [DOI] - ↑ 久場健司
興奮膜とシナプス生理学の黎明の頃―纐纈教三先生の研究史を辿りながら
日本生理学雑誌: 2007, 69(12): 362-377日本生理学雑誌 第69巻 12号 - ↑ Bertil Hille
G protein-coupled receptor
Scholarpedia: 2009, 4(12):8214 Scholarpedia - ↑
Chao, M.V. (2003).
Neurotrophins and their receptors: a convergence point for many signalling pathways. Nature reviews. Neuroscience, 4(4), 299-309. [PubMed:12671646] [WorldCat] [DOI] - ↑ 6.0 6.1 6.2
Lüscher, C., & Slesinger, P.A. (2010).
Emerging roles for G protein-gated inwardly rectifying potassium (GIRK) channels in health and disease. Nature reviews. Neuroscience, 11(5), 301-15. [PubMed:20389305] [PMC] [WorldCat] [DOI] - ↑ 7.0 7.1
Brown, D.A., & Passmore, G.M. (2009).
Neural KCNQ (Kv7) channels. British journal of pharmacology, 156(8), 1185-95. [PubMed:19298256] [PMC] [WorldCat] [DOI] - ↑
Moran, M.M., Xu, H., & Clapham, D.E. (2004).
TRP ion channels in the nervous system. Current opinion in neurobiology, 14(3), 362-9. [PubMed:15194117] [WorldCat] [DOI] - ↑
Hartmann, J., Dragicevic, E., Adelsberger, H., Henning, H.A., Sumser, M., Abramowitz, J., ..., & Konnerth, A. (2008).
TRPC3 channels are required for synaptic transmission and motor coordination. Neuron, 59(3), 392-8. [PubMed:18701065] [PMC] [WorldCat] [DOI] - ↑
Putney, J.W. (2005).
Physiological mechanisms of TRPC activation. Pflugers Archiv : European journal of physiology, 451(1), 29-34. [PubMed:16133266] [WorldCat] [DOI] - ↑
Scanziani, M. (2000).
GABA spillover activates postsynaptic GABA(B) receptors to control rhythmic hippocampal activity. Neuron, 25(3), 673-81. [PubMed:10774734] [WorldCat] [DOI] - ↑
Kulik, A., Vida, I., Luján, R., Haas, C.A., López-Bendito, G., Shigemoto, R., & Frotscher, M. (2003).
Subcellular localization of metabotropic GABA(B) receptor subunits GABA(B1a/b) and GABA(B2) in the rat hippocampus. The Journal of neuroscience : the official journal of the Society for Neuroscience, 23(35), 11026-35. [PubMed:14657159] [PMC] [WorldCat] - ↑
Agnati, L.F., Zoli, M., Strömberg, I., & Fuxe, K. (1995).
Intercellular communication in the brain: wiring versus volume transmission. Neuroscience, 69(3), 711-26. [PubMed:8596642] [WorldCat] [DOI]