「長期抑圧」の版間の差分
(ページの作成:「<div align="right"> <font size="+1">[http://researchmap.jp/read0164591 松田 信爾]</font><br> ''電気通信大学大学院 情報理工学研究科 先進理工...」) |
細編集の要約なし |
||
| 2行目: | 2行目: | ||
<font size="+1">[http://researchmap.jp/read0164591 松田 信爾]</font><br> | <font size="+1">[http://researchmap.jp/read0164591 松田 信爾]</font><br> | ||
''電気通信大学大学院 情報理工学研究科 先進理工学専攻''<br> | ''電気通信大学大学院 情報理工学研究科 先進理工学専攻''<br> | ||
DOI:<selfdoi /> | DOI:<selfdoi /> 原稿受付日:2015年7月17日 原稿完成日:2015年月日<br> | ||
担当編集委員:[http://researchmap.jp/michisukeyuzaki 柚崎 通介](慶應義塾大学 医学部生理学)<br> | 担当編集委員:[http://researchmap.jp/michisukeyuzaki 柚崎 通介](慶應義塾大学 医学部生理学)<br> | ||
</div> | </div> | ||
| 18行目: | 18行目: | ||
[[小脳]]の長期[[抑圧]]は小脳皮質の平行線維と[[プルキンエ細胞]]間の[[シナプス]]の伝達効率が長期(数十分間以上)に渡って低下する現象である。プルキンエ細胞への2つの[[興奮性]]の入力である平行線維と登上線維を同時に刺激することで引き起こされる。 | [[小脳]]の長期[[抑圧]]は小脳皮質の平行線維と[[プルキンエ細胞]]間の[[シナプス]]の伝達効率が長期(数十分間以上)に渡って低下する現象である。プルキンエ細胞への2つの[[興奮性]]の入力である平行線維と登上線維を同時に刺激することで引き起こされる。 | ||
小脳長期抑圧の分子実体は、ポストシナプスにおけるAMPA型[[グルタミン酸受容体]](AMPA受容体)の数がエンドサイトーシスによって減少することであることが知られている | 小脳長期抑圧の分子実体は、ポストシナプスにおけるAMPA型[[グルタミン酸受容体]](AMPA受容体)の数がエンドサイトーシスによって減少することであることが知られている<ref name=ref1><pubmed>20559335</pubmed></ref>(図1)。平行線維からの入力による代謝型[[グルタミン酸]]受容体mGuR1の活性化と、登上線維からの入力による脱分極に依存するプルキンエ細胞内の[[カルシウム]]濃度の上昇によってPKCが活性化することが長期抑圧の誘導に必須であることが分かっている。活性化されたPKCはAMPA受容体のGluA2サブユニットのC末細胞内領域の[[セリン]]残基(S880)をリン酸化し、このリン酸化によってAMPA受容体はアンカータンパク質であるGRIPから解離する<ref name=ref2><pubmed>10856222</pubmed></ref>。GRIPから解離したAMPA受容体はPICK1と結合し、クラスリン依存性のエンドサイトーシスによって細胞内へ取り込まれることで、細胞表面の数が減少すると考えられている<ref name=ref3><pubmed>12805550</pubmed></ref>。また、プルキンエ細胞に存在するδ2グルタミン酸受容体を欠損した[[マウス]]では長期抑圧が引き起こされない<ref name=ref4><pubmed>7736576</pubmed></ref>ため、この受容体も長期抑圧に必須の働きを持っていることが知られている。δ2グルタミン酸受容体は[[チロシン]]脱リン酸化酵素PTPMEGを介してAMPA受容体GluA2サブユニットのチロシンのリン酸化状態を制御して小脳長期抑圧に関与していることが報告されている<ref name=ref5><pubmed>23431139</pubmed></ref>。さらに顆粒細胞から放出されるCbln1というタンパク質<ref name=ref6><pubmed>16234806</pubmed></ref>や[[一酸化窒素]]<ref name=ref7><pubmed>7646893</pubmed></ref>の重要性も指摘されている。 | ||
===小脳長期抑圧の生理的機能=== | ===小脳長期抑圧の生理的機能=== | ||
小脳長期抑圧は意図した運動と実際に起こっている運動とのずれを、末梢からのフィードバックを利用して補正することで運動学習に重要な働きを持っていると考えられている。多くの長期抑圧の誘導に異常のある遺伝子改変マウスでは実際に運動学習が障害されている。たとえば上述のδ2グルタミン酸受容体を欠損したマウスでは、小脳長期抑圧は誘導されず、同時に瞬目条件反射の学習が阻害されていることが知られている | 小脳長期抑圧は意図した運動と実際に起こっている運動とのずれを、末梢からのフィードバックを利用して補正することで運動学習に重要な働きを持っていると考えられている。多くの長期抑圧の誘導に異常のある遺伝子改変マウスでは実際に運動学習が障害されている。たとえば上述のδ2グルタミン酸受容体を欠損したマウスでは、小脳長期抑圧は誘導されず、同時に瞬目条件反射の学習が阻害されていることが知られている<ref name=ref4 />。またプルキンエ細胞特異的にPKCの阻害ペプチドを発現させたマウスでも、長期抑圧の誘導が阻害されるのと同時に運動学習の1つである[[前庭動眼反射]]が引き起こされないことも知られている<ref name=ref8><pubmed>9539124</pubmed></ref>。これらのことから小脳長期抑圧はある種の運動学習の基盤となるメカニズムであると考えられている。一方、長期抑圧が引き起こされない遺伝子改変[[動物]]でも運動学習が可能であることも報告されており<ref name=ref9><pubmed>21482355</pubmed></ref>、更なる研究が待たれる状況である。 | ||
==海馬長期抑圧== | ==海馬長期抑圧== | ||
| 27行目: | 27行目: | ||
[[image:長期抑圧2.png|thumb|350px|'''図2.NMDA受容体依存型の海馬長期抑圧の分子機構''']] | [[image:長期抑圧2.png|thumb|350px|'''図2.NMDA受容体依存型の海馬長期抑圧の分子機構''']] | ||
[[海馬]]における長期抑圧は小脳と同様に代謝型グルタミン酸受容体の依存するものとNMDA型グルタミン酸受容体(NMDA受容体)に依存するものが存在する。どちらの場合も、小脳と同様にポストシナプスにおけるAMPA受容体のクラスリン依存性のエンドサイトーシスがその分子実体の1つであるが、そこにいたる過程には違いがある。NMDA受容体依存性の長期抑圧にはNMDA受容体からのカルシウム流入、脱リン酸化酵素である[[カルシニューリン]]、AMPA受容体に強固に結合するタンパク質であるTARP(Transmembrane AMPA receptor Regulatory Protein)、[[ホスファチジルイノシトール]]2リン酸(PIP2)を合成する酵素であるPIP5Kγが必須の働きを持っていることが知られている | [[海馬]]における長期抑圧は小脳と同様に代謝型グルタミン酸受容体の依存するものとNMDA型グルタミン酸受容体(NMDA受容体)に依存するものが存在する。どちらの場合も、小脳と同様にポストシナプスにおけるAMPA受容体のクラスリン依存性のエンドサイトーシスがその分子実体の1つであるが、そこにいたる過程には違いがある。NMDA受容体依存性の長期抑圧にはNMDA受容体からのカルシウム流入、脱リン酸化酵素である[[カルシニューリン]]、AMPA受容体に強固に結合するタンパク質であるTARP(Transmembrane AMPA receptor Regulatory Protein)、[[ホスファチジルイノシトール]]2リン酸(PIP2)を合成する酵素であるPIP5Kγが必須の働きを持っていることが知られている<ref name=ref1 /> <ref name=ref10><pubmed> 24217640</pubmed></ref> <ref name=ref11><pubmed>22243752</pubmed></ref>(図2)。NMDA受容体から[[CA2|Ca2]]+が流入すると脱リン酸化酵素であるカルシニューリンが活性化される。この活性化されたカルシニューリンがPIP5KγやTARPを脱リン酸化する。脱リン酸化されたPIP5Kγは活性化され[[細胞膜]]上にPIP2を合成する。このPIP2はクラスリン依存性のエンドサイトーシスに必須の脂質であり、PIP2に引き寄せられる形でまずアダプタータンパク質複合体の1つであるAP-2が細胞膜上に集積し、このAP-2に引き寄せられてクラスリンが集積しクラスリン被覆ピットが形成されて、エンドサイトーシスが誘導される<ref name=ref11 />。また脱リン酸化されたTARPはAP-2に結合するようになり、クラスリン被覆ピットに集積し効率的にエンドサイトーシスによって細胞内へと取り込まれていくと考えられている<ref name=ref10 />。また脱リン酸化型のTARPは特定の脂質分子に対しても結合力を持つようになる<ref name=ref12><pubmed>20547132</pubmed></ref>。この結合によりTARPをシナプスに繋ぎとめるタンパク質である[[PSD-95]]との相互作用が変化して長期抑圧の誘導に寄与することも知られている。一方、代謝型グルタミン酸受容体依存性の長期抑圧は[[低分子量Gタンパク質]]のARF6およびその活性化因子(GEF)であるBRAG2が重要な働きをしていることが報告されている<ref name=ref13><pubmed> 20547133</pubmed></ref>。 | ||
また、海馬の長期抑圧は[[シナプス前部]]からのグルタミン酸の放出量の低下によって引き起こされる場合もある。この現象はシナプス後部から放出される逆行性シグナルによって引き起こされる。NDMA受容体依存型の長期抑圧では一酸化窒素 | また、海馬の長期抑圧は[[シナプス前部]]からのグルタミン酸の放出量の低下によって引き起こされる場合もある。この現象はシナプス後部から放出される逆行性シグナルによって引き起こされる。NDMA受容体依存型の長期抑圧では一酸化窒素<ref name=ref14><pubmed>12843298</pubmed></ref>が、代謝型グルタミン酸受容体依存性の長期抑圧ではリポキシゲナーゼが逆行性シグナルとして機能し<ref name=ref15><pubmed>14673007</pubmed></ref>、グルタミン酸の放出量を減少させることが報告されている。 | ||
===海馬長期抑圧の生理的機能=== | ===海馬長期抑圧の生理的機能=== | ||
海馬における長期抑圧は海馬依存的な記憶および行動の柔軟性に寄与していると考えられている。例えば、NMDA型グルタミン酸受容体が欠損した海馬の[[CA1]]錘体細胞ではNMDA依存的な長期抑圧が阻害されており、このマウスで[[モリス水迷路テスト]]等の海馬依存的な記憶・学習タスクに異常が見られることが報告されている | 海馬における長期抑圧は海馬依存的な記憶および行動の柔軟性に寄与していると考えられている。例えば、NMDA型グルタミン酸受容体が欠損した海馬の[[CA1]]錘体細胞ではNMDA依存的な長期抑圧が阻害されており、このマウスで[[モリス水迷路テスト]]等の海馬依存的な記憶・学習タスクに異常が見られることが報告されている<ref name=ref16><pubmed>20357110</pubmed></ref>。また、[[前脳]]特異的にカルシニューリンが欠損したマウスの海馬ではLTDが障害されており、また八方[[迷路]][[テスト]]等の海馬依存的な記憶に異常が見られることが報告されている<ref name=ref17><pubmed>11733061</pubmed></ref>。さらに前脳でプロテインホスファターゼ2A(PP2A)の活性を阻害した[[トランスジェニックマウス]](SV40のT抗原断片のトランスジェニックマウス)ではNMDA依存的長期抑圧が特異的に阻害されているが、このマウスでは一度記憶した内容を変更する能力が低下していることが明らかになった<ref name=ref18><pubmed>18400167</pubmed></ref>。具体的には[[水迷路]]テスト等において一度学習したプ[[ラット]]フォームの位置を変更すると、野生型マウスに比べてトランスジェニックマウスでは新しい位置を覚える能力が低下していた。このことからNMDA依存的長期抑圧は行動の柔軟性に重要な働きを持っていることが明らかにされている。 | ||
==参考文献== | ==参考文献== | ||
<references /> | <references /> | ||
2015年7月17日 (金) 11:51時点における版
松田 信爾
電気通信大学大学院 情報理工学研究科 先進理工学専攻
DOI:10.14931/bsd.6195 原稿受付日:2015年7月17日 原稿完成日:2015年月日
担当編集委員:柚崎 通介(慶應義塾大学 医学部生理学)
英語名:Long Term Depression 英略語:LTD
神経活動に依存してシナプスにおける神経細胞間の情報伝達効率が変化するシナプス可塑性の1種である。長期抑圧が誘導されたシナプスでは神経細胞間の情報伝達効率が長期に渡って低下する。記憶や学習といった高次脳機能の細胞レベルでの基盤ではないかと考えられている。そのメカニズムはプレシナプス(シナプスの軸索側)からの伝達物質の放出量が低下する場合と、ポストシナプス(シナプスの樹状突起側)の神経伝達物質受容体のイオン透過性やその数が減少する場合がある。小脳で最初に発見された現象であるが、海馬等、他の領域にも広く存在する。
小脳長期抑圧
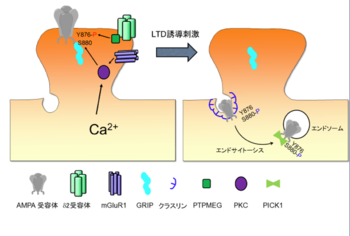
小脳長期抑圧の分子機構
小脳の長期抑圧は小脳皮質の平行線維とプルキンエ細胞間のシナプスの伝達効率が長期(数十分間以上)に渡って低下する現象である。プルキンエ細胞への2つの興奮性の入力である平行線維と登上線維を同時に刺激することで引き起こされる。
小脳長期抑圧の分子実体は、ポストシナプスにおけるAMPA型グルタミン酸受容体(AMPA受容体)の数がエンドサイトーシスによって減少することであることが知られている[1](図1)。平行線維からの入力による代謝型グルタミン酸受容体mGuR1の活性化と、登上線維からの入力による脱分極に依存するプルキンエ細胞内のカルシウム濃度の上昇によってPKCが活性化することが長期抑圧の誘導に必須であることが分かっている。活性化されたPKCはAMPA受容体のGluA2サブユニットのC末細胞内領域のセリン残基(S880)をリン酸化し、このリン酸化によってAMPA受容体はアンカータンパク質であるGRIPから解離する[2]。GRIPから解離したAMPA受容体はPICK1と結合し、クラスリン依存性のエンドサイトーシスによって細胞内へ取り込まれることで、細胞表面の数が減少すると考えられている[3]。また、プルキンエ細胞に存在するδ2グルタミン酸受容体を欠損したマウスでは長期抑圧が引き起こされない[4]ため、この受容体も長期抑圧に必須の働きを持っていることが知られている。δ2グルタミン酸受容体はチロシン脱リン酸化酵素PTPMEGを介してAMPA受容体GluA2サブユニットのチロシンのリン酸化状態を制御して小脳長期抑圧に関与していることが報告されている[5]。さらに顆粒細胞から放出されるCbln1というタンパク質[6]や一酸化窒素[7]の重要性も指摘されている。
小脳長期抑圧の生理的機能
小脳長期抑圧は意図した運動と実際に起こっている運動とのずれを、末梢からのフィードバックを利用して補正することで運動学習に重要な働きを持っていると考えられている。多くの長期抑圧の誘導に異常のある遺伝子改変マウスでは実際に運動学習が障害されている。たとえば上述のδ2グルタミン酸受容体を欠損したマウスでは、小脳長期抑圧は誘導されず、同時に瞬目条件反射の学習が阻害されていることが知られている[4]。またプルキンエ細胞特異的にPKCの阻害ペプチドを発現させたマウスでも、長期抑圧の誘導が阻害されるのと同時に運動学習の1つである前庭動眼反射が引き起こされないことも知られている[8]。これらのことから小脳長期抑圧はある種の運動学習の基盤となるメカニズムであると考えられている。一方、長期抑圧が引き起こされない遺伝子改変動物でも運動学習が可能であることも報告されており[9]、更なる研究が待たれる状況である。
海馬長期抑圧
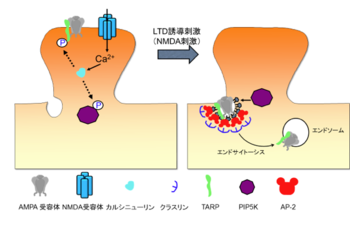
海馬長期抑圧の分子機構
海馬における長期抑圧は小脳と同様に代謝型グルタミン酸受容体の依存するものとNMDA型グルタミン酸受容体(NMDA受容体)に依存するものが存在する。どちらの場合も、小脳と同様にポストシナプスにおけるAMPA受容体のクラスリン依存性のエンドサイトーシスがその分子実体の1つであるが、そこにいたる過程には違いがある。NMDA受容体依存性の長期抑圧にはNMDA受容体からのカルシウム流入、脱リン酸化酵素であるカルシニューリン、AMPA受容体に強固に結合するタンパク質であるTARP(Transmembrane AMPA receptor Regulatory Protein)、ホスファチジルイノシトール2リン酸(PIP2)を合成する酵素であるPIP5Kγが必須の働きを持っていることが知られている[1] [10] [11](図2)。NMDA受容体からCa2+が流入すると脱リン酸化酵素であるカルシニューリンが活性化される。この活性化されたカルシニューリンがPIP5KγやTARPを脱リン酸化する。脱リン酸化されたPIP5Kγは活性化され細胞膜上にPIP2を合成する。このPIP2はクラスリン依存性のエンドサイトーシスに必須の脂質であり、PIP2に引き寄せられる形でまずアダプタータンパク質複合体の1つであるAP-2が細胞膜上に集積し、このAP-2に引き寄せられてクラスリンが集積しクラスリン被覆ピットが形成されて、エンドサイトーシスが誘導される[11]。また脱リン酸化されたTARPはAP-2に結合するようになり、クラスリン被覆ピットに集積し効率的にエンドサイトーシスによって細胞内へと取り込まれていくと考えられている[10]。また脱リン酸化型のTARPは特定の脂質分子に対しても結合力を持つようになる[12]。この結合によりTARPをシナプスに繋ぎとめるタンパク質であるPSD-95との相互作用が変化して長期抑圧の誘導に寄与することも知られている。一方、代謝型グルタミン酸受容体依存性の長期抑圧は低分子量Gタンパク質のARF6およびその活性化因子(GEF)であるBRAG2が重要な働きをしていることが報告されている[13]。
また、海馬の長期抑圧はシナプス前部からのグルタミン酸の放出量の低下によって引き起こされる場合もある。この現象はシナプス後部から放出される逆行性シグナルによって引き起こされる。NDMA受容体依存型の長期抑圧では一酸化窒素[14]が、代謝型グルタミン酸受容体依存性の長期抑圧ではリポキシゲナーゼが逆行性シグナルとして機能し[15]、グルタミン酸の放出量を減少させることが報告されている。
海馬長期抑圧の生理的機能
海馬における長期抑圧は海馬依存的な記憶および行動の柔軟性に寄与していると考えられている。例えば、NMDA型グルタミン酸受容体が欠損した海馬のCA1錘体細胞ではNMDA依存的な長期抑圧が阻害されており、このマウスでモリス水迷路テスト等の海馬依存的な記憶・学習タスクに異常が見られることが報告されている[16]。また、前脳特異的にカルシニューリンが欠損したマウスの海馬ではLTDが障害されており、また八方迷路テスト等の海馬依存的な記憶に異常が見られることが報告されている[17]。さらに前脳でプロテインホスファターゼ2A(PP2A)の活性を阻害したトランスジェニックマウス(SV40のT抗原断片のトランスジェニックマウス)ではNMDA依存的長期抑圧が特異的に阻害されているが、このマウスでは一度記憶した内容を変更する能力が低下していることが明らかになった[18]。具体的には水迷路テスト等において一度学習したプラットフォームの位置を変更すると、野生型マウスに比べてトランスジェニックマウスでは新しい位置を覚える能力が低下していた。このことからNMDA依存的長期抑圧は行動の柔軟性に重要な働きを持っていることが明らかにされている。
参考文献
- ↑ 1.0 1.1
Collingridge, G.L., Peineau, S., Howland, J.G., & Wang, Y.T. (2010).
Long-term depression in the CNS. Nature reviews. Neuroscience, 11(7), 459-73. [PubMed:20559335] [WorldCat] [DOI] - ↑
Matsuda, S., Launey, T., Mikawa, S., & Hirai, H. (2000).
Disruption of AMPA receptor GluR2 clusters following long-term depression induction in cerebellar Purkinje neurons. The EMBO journal, 19(12), 2765-74. [PubMed:10856222] [PMC] [WorldCat] [DOI] - ↑
Chung, H.J., Steinberg, J.P., Huganir, R.L., & Linden, D.J. (2003).
Requirement of AMPA receptor GluR2 phosphorylation for cerebellar long-term depression. Science (New York, N.Y.), 300(5626), 1751-5. [PubMed:12805550] [WorldCat] [DOI] - ↑ 4.0 4.1
Kashiwabuchi, N., Ikeda, K., Araki, K., Hirano, T., Shibuki, K., Takayama, C., ..., & Kang, Y. (1995).
Impairment of motor coordination, Purkinje cell synapse formation, and cerebellar long-term depression in GluR delta 2 mutant mice. Cell, 81(2), 245-52. [PubMed:7736576] [WorldCat] [DOI] - ↑
Kohda, K., Kakegawa, W., Matsuda, S., Yamamoto, T., Hirano, H., & Yuzaki, M. (2013).
The δ2 glutamate receptor gates long-term depression by coordinating interactions between two AMPA receptor phosphorylation sites. Proceedings of the National Academy of Sciences of the United States of America, 110(10), E948-57. [PubMed:23431139] [PMC] [WorldCat] [DOI] - ↑
Hirai, H., Pang, Z., Bao, D., Miyazaki, T., Li, L., Miura, E., ..., & Morgan, J.I. (2005).
Cbln1 is essential for synaptic integrity and plasticity in the cerebellum. Nature neuroscience, 8(11), 1534-41. [PubMed:16234806] [WorldCat] [DOI] - ↑
Lev-Ram, V., Makings, L.R., Keitz, P.F., Kao, J.P., & Tsien, R.Y. (1995).
Long-term depression in cerebellar Purkinje neurons results from coincidence of nitric oxide and depolarization-induced Ca2+ transients. Neuron, 15(2), 407-15. [PubMed:7646893] [WorldCat] [DOI] - ↑
De Zeeuw, C.I., Hansel, C., Bian, F., Koekkoek, S.K., van Alphen, A.M., Linden, D.J., & Oberdick, J. (1998).
Expression of a protein kinase C inhibitor in Purkinje cells blocks cerebellar LTD and adaptation of the vestibulo-ocular reflex. Neuron, 20(3), 495-508. [PubMed:9539124] [WorldCat] [DOI] - ↑
Schonewille, M., Gao, Z., Boele, H.J., Veloz, M.F., Amerika, W.E., Simek, A.A., ..., & De Zeeuw, C.I. (2011).
Reevaluating the role of LTD in cerebellar motor learning. Neuron, 70(1), 43-50. [PubMed:21482355] [PMC] [WorldCat] [DOI] - ↑ 10.0 10.1
Matsuda, S., Kakegawa, W., Budisantoso, T., Nomura, T., Kohda, K., & Yuzaki, M. (2013).
Stargazin regulates AMPA receptor trafficking through adaptor protein complexes during long-term depression. Nature communications, 4, 2759. [PubMed:24217640] [WorldCat] [DOI] - ↑ 11.0 11.1
Unoki, T., Matsuda, S., Kakegawa, W., Van, N.T., Kohda, K., Suzuki, A., ..., & Kanaho, Y. (2012).
NMDA receptor-mediated PIP5K activation to produce PI(4,5)P₂ is essential for AMPA receptor endocytosis during LTD. Neuron, 73(1), 135-48. [PubMed:22243752] [WorldCat] [DOI] - ↑
Sumioka, A., Yan, D., & Tomita, S. (2010).
TARP phosphorylation regulates synaptic AMPA receptors through lipid bilayers. Neuron, 66(5), 755-67. [PubMed:20547132] [PMC] [WorldCat] [DOI] - ↑
Scholz, R., Berberich, S., Rathgeber, L., Kolleker, A., Köhr, G., & Kornau, H.C. (2010).
AMPA receptor signaling through BRAG2 and Arf6 critical for long-term synaptic depression. Neuron, 66(5), 768-80. [PubMed:20547133] [WorldCat] [DOI] - ↑
Stanton, P.K., Winterer, J., Bailey, C.P., Kyrozis, A., Raginov, I., Laube, G., ..., & Müller, W. (2003).
Long-term depression of presynaptic release from the readily releasable vesicle pool induced by NMDA receptor-dependent retrograde nitric oxide. The Journal of neuroscience : the official journal of the Society for Neuroscience, 23(13), 5936-44. [PubMed:12843298] [PMC] [WorldCat] - ↑
Feinmark, S.J., Begum, R., Tsvetkov, E., Goussakov, I., Funk, C.D., Siegelbaum, S.A., & Bolshakov, V.Y. (2003).
12-lipoxygenase metabolites of arachidonic acid mediate metabotropic glutamate receptor-dependent long-term depression at hippocampal CA3-CA1 synapses. The Journal of neuroscience : the official journal of the Society for Neuroscience, 23(36), 11427-35. [PubMed:14673007] [PMC] [WorldCat] - ↑
Brigman, J.L., Wright, T., Talani, G., Prasad-Mulcare, S., Jinde, S., Seabold, G.K., ..., & Holmes, A. (2010).
Loss of GluN2B-containing NMDA receptors in CA1 hippocampus and cortex impairs long-term depression, reduces dendritic spine density, and disrupts learning. The Journal of neuroscience : the official journal of the Society for Neuroscience, 30(13), 4590-600. [PubMed:20357110] [PMC] [WorldCat] [DOI] - ↑
Zeng, H., Chattarji, S., Barbarosie, M., Rondi-Reig, L., Philpot, B.D., Miyakawa, T., ..., & Tonegawa, S. (2001).
Forebrain-specific calcineurin knockout selectively impairs bidirectional synaptic plasticity and working/episodic-like memory. Cell, 107(5), 617-29. [PubMed:11733061] [WorldCat] [DOI] - ↑
Nicholls, R.E., Alarcon, J.M., Malleret, G., Carroll, R.C., Grody, M., Vronskaya, S., & Kandel, E.R. (2008).
Transgenic mice lacking NMDAR-dependent LTD exhibit deficits in behavioral flexibility. Neuron, 58(1), 104-17. [PubMed:18400167] [WorldCat] [DOI]