「電気けいれん療法」の版間の差分
Nagahisaokamoto (トーク | 投稿記録) 細編集の要約なし |
細 (→作用機序) |
||
| (5人の利用者による、間の61版が非表示) | |||
| 1行目: | 1行目: | ||
<div align="right"> | <div align="right"> | ||
<font size="+1">野田 | <font size="+1">岡本 長久</font><br> | ||
''札幌鈴木病院''<br> | |||
<font size="+1">野田 隆政</font><br> | |||
''国立精神・神経医療研究センター''<br> | ''国立精神・神経医療研究センター''<br> | ||
DOI:<selfdoi /> | DOI:<selfdoi /> 原稿受付日:2016年1月23日 原稿完成日:2017年2月16日<br> | ||
担当編集委員:[http://researchmap.jp/tadafumikato 加藤 忠史](独立行政法人理化学研究所 脳科学総合研究センター)<br> | 担当編集委員:[http://researchmap.jp/tadafumikato 加藤 忠史](独立行政法人理化学研究所 脳科学総合研究センター)<br> | ||
</div> | </div> | ||
英語名:electroconvulsive therapy 英略称:ECT 独:Elektrokrampftherapie, Elektrokonvulsiontherapie 仏:électroconvulsivothérapie | |||
== | {{box|text= 電気けいれん療法は、経皮的に頭部に通電を行い脳に人工的なけいれんを誘発することで治療効果を得る精神神経疾患に用いられる治療法で、特に重症うつ病、薬物治療抵抗性ないし重症躁病、またはカタトニア(緊張病)に高い治療効果を持つ。ECT手技は、従来型ECTから修正型ECTへ、さらはサイン波治療器を用いたECTからパルス波治療器を用いたECTへと発展してきており、その安全性は向上しているものの、現在もその作用機序が未解明であることやわが国でのECT手技の標準化がまだ十分でないことなどの課題があり、作用機序に関する研究や精神科関連学会を中心としたECTの標準化がすすめられている。}} | ||
==歴史== | |||
===従来型ECTの誕生=== | ===従来型ECTの誕生=== | ||
電気けいれん療法は経皮的に頭部に通電を行うことで脳に人工的なけいれんを誘発し、治療効果を得ようとする治療法であり、[[精神神経疾患]]に古くから広く用いられてきた。 | |||
1952年に世界初の[[抗精神病薬]]である[[クロルプロマジン]]が発見される前の精神疾患に有効な薬物がまだ発見されていなかった時代から、[[てんかん]]による[[けいれん発作]]があった後に[[統合失調症]]患者の精神症状が改善することがあることが知られていた。 | |||
このため人工的にけいれんを誘発して精神疾患を治療しようとする試みが行われるようになり、1934年に[[wj:ハンガリー|ハンガリー]]の精神科医[[w:Ladislas J. Meduna|Meduna]]は、統合失調症とてんかんの拮抗仮説に基づき、[[早発性痴呆]](現在の統合失調症)の患者に[[カルジオゾール]]で誘発したけいれんによる治療を実施し、その精神症状への有効性が確認された<ref name=ref1><pubmed> 6147103 </pubmed></ref>。 | |||
その後、統合失調症患者への薬剤誘発けいれんによる治療が試みられ、けいれん誘発物質として初期には[[カンフル]]([[樟脳]])やカルジオゾールがよく用いられた。なお、当時の統合失調症概念は幅広く、近年Baranらは、これらの統合失調症の薬剤誘発によるけいれん療法が行われた23症例の報告について、現在の診断基準から診断の見直しを行ったところ、[[統合失調感情障害]]、精神病性の特徴を持つ[[気分障害]]などが含まれており、統合失調症よりもそれらの疾患に有効性が高かった可能性が推察されている<ref name=ref2><pubmed>22230354</pubmed></ref>。 | |||
2 | |||
精神症状に対し治療効果のある確実なけいれんを誘発するために、けいれんを惹起する薬剤ではなく電気刺激による脳への通電を用いる方法は、1938年にイタリアの[[wj:ウーゴ・チェルレッティ|Cerletti]]らによりはじめて報告された。彼らは通電することにより動物にけいれんが誘発されることからアイデアを得て、統合失調症患者に対して電気による脳への通電を行うことでけいれんを誘発したところ、10~20回の通電治療の後で精神症状に有効であることを確認し、これにより精神疾患治療としてのECTが見出された<ref name=ref3><pubmed>15432756</pubmed></ref>。 | |||
このように統合失調症患者に対して、経皮的な脳への通電によるけいれん誘発が施行され治療効果を認めたことから、欧米では精神科治療として1940~60年代にかけてECTが広く行われるようになり、同時に[[うつ病]]への治療効果も多く報告されるようになった。 | |||
本邦では、1939年に九州大学の安河内と向笠により統合失調症に対するECTが報告<ref name=ref4>'''安河内五郎、向笠広次'''<br>精神分離症の電撃痙攣療法について<br>''福岡医大誌'' 1939 ;32:1437-1440</ref>されると、薬物療法など精神疾患への確実な治療法がない時代だったこともあり、本邦でも急速にECTが普及していった。 | |||
===従来型ECTから修正型ECTへの発展=== | |||
[[麻酔]]や[[筋弛緩薬]]を使用せず施行する従来型ECTでは、施行前に患者に恐怖感を与えることや全身の[[強直間代けいれん]]に伴う骨折、呼吸器系・循環器系の副作用が少なからず起こることが問題であった。 | |||
施行前の患者の恐怖感に対しては、徐々に[[チオペンタール]]や[[アモバルビタール]]等の[[バルビツール系]]の[[静脈麻酔薬]]が用いられるようになり、またけいれん発作時の骨折事故を減らす工夫として、通電後の脳のけいれん波と同期した体の全身けいれんが起こらないようにするために筋弛緩薬が用いられるようになったことで、静脈麻酔薬と筋弛緩薬を併用する修正型ECT(modified electroconvulsive therapy; mECT)の基盤が完成した。 | |||
筋弛緩薬については、1940年代には南米の原住民が狩猟に用いていた筋弛緩作用を持つ毒物[[クラーレ]]が使用されていたが<ref name=ref5>'''Bennet AE'''<br>Preventing traumatic complications in convulsive therapy by curare. <br>''JAMA'' 1940 ; 114 :322-324</ref>、作用時間が長いことが問題であったため、1952年HolmbergとThesleffzらが、より安全性の高い[[サクシニルコリン]]の使用を提唱し<ref name=ref6><pubmed>14923897</pubmed></ref>、以後サクシニルコリンが現在まで修正型ECTの代表的な筋弛緩薬として用いられている。 | |||
本邦でも1958年、[[wj:島薗安雄|島薗]]らにより筋弛緩薬を使用したECTの報告がなされた<ref name=ref7>'''島薗安雄、森温理、徳田良仁'''<br>電撃療法時におけるSuccinylcholine Chloride (S. C. C.)の使用経験<br>''脳と神経'' 1958 ; 10 : 183-193</ref>が、その後の安全面を含めた評価や一般化が不十分で、またECT自体が患者に強制的に行う負のイメージが強かったため、この時代の反精神医学の潮流や薬物療法の発展に伴い1970年代には本邦では次第に第一線の治療から後退していった。 | |||
しかし、1980年代になると、[[リエゾン精神医学]]の進展に伴い、本邦でも精神科が総合病院の一つの科として位置づけられるようになり、麻酔科医と連携して行う修正型ECTが総合病院や大学病院を中心に普及し、同時に手術に準じた患者や家族への[[インフォームドコンセント]]を行うことが一般的になったことで、ECTの安全性が高まり、従来の負のイメージは徐々に払拭されていった。 | |||
米国では、1975年に[[wj:アメリカ精神医学会|米国精神医学会]]([[wj:アメリカ精神医学会|American Psychiatric Association]] ; APA)がECTに関する専門委員会を設置し、1990年、2001年にECT全体を網羅するガイドライン「APAタスクフォースレポートECT実践ガイド」<ref name=ref8>'''American Psychiatric Association'''<br>Task Force on Electroconvulsive therapy : The Practice of Electroconvulsive therapy : Recommendations for Treatment, Training, and Privileging 2nd. <br>''APA'' 2001</ref>が刊行され、英国でもECTに関するガイドラインが刊行された<ref name=ref9>'''Royal College of Psychiatrists'''<br>The ECT Handbook : The Second Report of the Royal College of Psychiatrists’<br>Special Committee on ECT, Royal College of Psychiatrists, London 1995</ref>。 | |||
本邦では、2000年、本橋により本邦で初めてのECTマニュアルが出版され<ref name=ref10>'''本橋伸高''' <br>ECTマニュアル~科学的精神医学を目指して <br>''医学書院'' 2000</ref>、2002年、日本精神神経学会の「電気けいれん療法の手技と適応基準検討小委員会」により、「APAタスクフォースレポートECT実践ガイド」<ref name=ref8 />が翻訳刊行され、本邦の現状を考慮した「ECT推奨事項」も報告された。同時期、全国自治体病院協議会はECTの使用に関する提言を行い、修正型での運用とインフォームドコンセントの取得を強く推奨することとなった。 | |||
現在は、このような流れを汲んで、インフォームドコンセントを取得し、麻酔科医と連携した呼吸循環管理のもとで、十分な酸素化と筋弛緩薬と静脈麻酔薬を用いて行う修正型ECTが推奨される標準的治療となっている。 | |||
===サイン波治療器からパルス波治療器への発展=== | |||
[[image:ect-1.png|thumb|350px|'''写真1.従来使用されていたサイン波治療器''']][[image:ect-2.png|thumb|350px|'''写真2.パルス波治療器の米国ソマティックス社サイマトロン''']] | |||
通電のためのECT機器として、従来は交流[[wj:正弦波|正弦波]]([[wj:サイン波|サイン波]])治療器が用いられてきた。サイン波治療器は通常電源から交流正弦波の電圧変換を行う機器で、2本の電気通電用の棒の先についている布部分を[[wj:生理食塩水|生理食塩水]]で湿らせ、医療者が両手で2本の電気通電用の棒を持ち、棒の先の布部分を患者の両側の前頭部に当てながら通電ボタンを押し、正弦波(サイン波)を105V程度で5秒間程度通電することで脳のけいれんを誘発する機器('''写真1''')であった。 | |||
1976年、定電流短パルス矩形波治療器(パルス波治療器)が開発されると、欧米では1980年代より、サイン波治療器より少ない電気量での発作誘発が可能<ref name=ref11><pubmed>889985</pubmed></ref>なパルス波治療器が用いられるようになり、本邦でも2002年にパルス波治療器が医療機器として承認された。 | |||
パルス波治療器は短パルス[[wj:矩形波|矩形波]]([[wj:パルス波|パルス波]])を通電に用いることで、従来の刺激装置であるサイン波治療器の約1/3程度のエネルギー量で神経細胞の脱分極を起こすことができるため、効率的にけいれん閾値に達して発作誘発ができることに加え、個人の電気抵抗値によらずに定電流を通電できる特徴がある。このため、サイン波治療器よりも通電後の認知機能障害が少なく<ref name=ref12><pubmed>3963246</pubmed></ref>、パルス波治療器を用いることで更にECTの安全性が向上するとされる。 | |||
加えて、パルス幅の選択、刺激プログラムの設定、静的インピーダンスと通電時の動的インピーダンスの測定、[[脳波]]・[[wj:心電図|心電図]]・[[筋電図]]のモニター、測定データの解析などが可能で、臨床的な利便性もサイン波治療器よりも向上している。 | |||
現在医療機器として使用されているパルス波治療器は、米国ソマティックス社のサイマトロン(Thymatron®)と呼ばれるものである('''写真2''')。 | |||
近年は、ECTの手順の標準化や安全性のさらなる向上のため、サイマトロンの使用にあたり、[[wj:日本精神神経学会|日本精神神経学会]]、[[wj:日本生物学的精神医学会|日本生物学的精神医学会]]、[[wj:日本総合病院精神医学会|日本総合病院精神医学会]]で行われる ECTトレーニングセミナーの受講が義務付けられ、使用法についても標準化されてきていることで、高齢者や身体合併症のある精神疾患患者にもECTがより安全に行われるようになっている。 | |||
==作用機序== | |||
ECTの作用機序は未解明であるが、多くの研究が行われている。 | |||
ECTに関する[[脳画像研究]]では、[[単一光子放射断層撮影法]]([[single photon emission tomography]])、[[ポジトロン断層法]]([[positron emission tomography]])、[[磁気共鳴画像]]([[magnetic resonance imaging]])、[[磁気共鳴分光法]]([[magnetic resonance spectroscopy]])、[[定量脳波]]([[quantitative electroencephalography]])などによる多くの研究が行われている。 | |||
脳画像研究の知見からは、従来通電によるけいれん発作時は脳血流や脳代謝が増加し、発作後の数日間は逆にそれらが抑制されるなど、ECTによるけいれん発作の前後に脳血流や脳代謝の変化が起きることが知られていた。 | |||
ECTは、臨床的に治療回数を重ねるごとに、多くの患者にけいれん持続時間の減少やけいれん[[閾値]]の上昇(必要刺激用量の増大)を認めるようになる。これらの事象は、けいれんが起きることによって、抑制性神経伝達が促進されるためであると考えられる。近年の磁気共鳴分光法を用いた研究では、ECT後に[[γ-aminobutyric acid]]([[GABA]])の増加が示されており<ref name=ref13><pubmed>16137698</pubmed></ref>、ECTの持つ抑制性神経伝達促進の背景として、脳内GABA輸送の増加と[[受容体]]刺激の増加が関係している可能性が指摘されている。 | |||
また、従来は抗うつ効果との関連から、ECTが神経伝達物質やその受容体へ与える影響や[[細胞内情報伝達系]]に与える影響が注目され、[[モノアミン]]、[[コルチゾール]]、[[副腎皮質刺激ホルモン]]、[[コルチコトロピン放出因子]]、[[甲状腺刺激ホルモン]]、[[プロラクチン]]、[[オキシトシン]]、[[バソプレッシン]]、[[デヒドロエピアンドロステロン硫酸エステル]]、[[腫瘍壊死因子α]] ([[tumor necrosis factor α]], [[TNFα]])等の生体内物質のECTによる変化が注目されてきた。 | |||
近年では、ECT後の血液中[[脳由来神経栄養因子]] ([[brain-derived neurotrophic factor]], [[BDNF]])の増加が報告され<ref name=ref14><pubmed> 17474805</pubmed></ref>、ECTが神経細胞の[[可塑性]]、再生、維持に関わる[[神経栄養因子]]を強化し、[[海馬]]を主体とする内側[[側頭葉]]を中心として神経栄養効果を持つ可能性が指摘されるようになった<ref name=ref15><pubmed>18580563</pubmed></ref>。うつ病患者では[[メタ解析]]でもECT治療後のBDNFの増加が確認されており<ref name=ref16><pubmed>27552533</pubmed></ref>、BDNF増加と[[HAM-D]]総得点減少が相関するという報告もある。また[[霊長類]]を対象にした[[動物実験]]では、ECTにより海馬での[[神経新生]]が促進されたことが報告されている<ref name=ref17><pubmed>17475797</pubmed></ref>。 | |||
これらを踏まえた仮説としては、ECTが脳の異常な[[機能的結合]]を一度リセットして、病態に関連する脳領域で新しい健康的な機能的結合の生成を促進することで治療の有効性を発揮している<ref name=ref18><pubmed>24810774</pubmed></ref>という仮説が提示されており、その機序としてはECTの前頭葉を主体とする抗けいれん作用による抑制性神経伝達の促進<ref name=ref19><pubmed>9773356</pubmed></ref> <ref name=ref21><pubmed>24381234</pubmed></ref>、内側側頭葉・海馬を主体とした神経栄養効果を介した細胞新生や神経回路成長促進への影響、及びその複合的要因<ref name=ref18 /> <ref name=ref19 /> <ref name=ref20><pubmed>24800687</pubmed></ref>が示唆されている。 | |||
このようにECTの有効性における作用機序について、いくつかの仮説は提示されているものの、現在までECTの明確な作用機序は明らかにされていない。 | |||
==適応と禁忌== | |||
===適応=== | |||
2015年米国米国精神医学会は「ECTは、安全かつ有効なエビデンスに基づく医療であり、適切に適応を選択された患者のために、適切な資格のある精神科医によって行われるとき、ECTは米国精神医学会によって支持される」という声明を発表している。 | |||
米国精神医学会によるECTの適応<ref name=ref8 />は比較的幅広く、本邦においても2013年に日本精神神経学会ECT検討委員会および日本総合病院精神医学会ECT委員会によりまとめられ本橋らにより報告された「ECTの推奨事項改定版」<ref name=ref22>'''本橋伸高、粟田主一、一瀬邦弘ほか'''<br>電気けいれん療法(ECT)推奨事項 改訂版<br>''精神神経学雑誌'' 115: 586-600, 2013. </ref>においても比較的幅広い適応となる診断と状況が記載されているが、[[wj:英国国立医療技術評価機構|英国国立医療技術評価機構]]([[wj:英国国立医療技術評価機構|The National Institute of Health and Clinical Excellence]], NICE)ガイドラインでは、ECTは重症うつ病、薬物治療抵抗性ないし重症[[躁病]]、または[[カタトニア]]([[緊張病]])のみに用いられるべきであり、うつ病の予防のための長期治療や統合失調症の一般管理には用いられるべきではないとしている<ref name=ref23>'''NICE'''<br>Guidance on the use of electroconvulsive therapy<br>Technology appraisal guidance [TA59]<br>Published date: 26 April 2003 Last updated: 01 October 2009</ref>。 | |||
また、まだ十分なエビデンスは確立しておらず研究的な一面が存在するものの、難治性[[強迫性障害]]、治療抵抗性で緊急性を要する[[パーキンソン病]]、身体疾患による精神障害、治療抵抗性[[悪性症候群]]、[[慢性疼痛]]の治療にも臨床的に用いられることがあり有効性を認めることがある。 | |||
臨床的には、適応となる診断とその症状特性や重症度などの状態像からECTの適応を判断することになる。 | |||
たとえば、うつ病はECTの主要な適応となる疾患であるが、軽症であれば基本的にECTが選択されることはない。ECTの一次的適応が考慮される状態として、食事摂取困難や[[拒食]]による低栄養・脱水が進行し生命にかかわる可能性がある場合、[[自殺]]企図など患者に生命の危険の差し迫った重篤な症状が存在し迅速な症状改善を要する場合など、[[抗うつ薬]]が効いてくるまでの時間的余裕がない場合にはECTの優先順位は高くなりECTは切り札的な治療として一次的に実施されることがある。また、薬物療法のリスクや催奇形性が問題となる妊娠、薬物忍容性の乏しい高齢者、薬物療法の副作用や身体合併症などから他の治療よりECTのほうが高い安全性があると個別に判断される場合もECTが考慮されることがある。 | |||
米国精神医学会によるECTの二次的な適応<ref name=ref8 />としては、薬物療法への強い治療抵抗性があり遷延している場合、薬物治療の忍容性が低く十分な薬物療法が行えずECTの忍容性が優れる場合、薬物治療中の精神症状や身体状態の悪化により迅速で確実な治療反応が必要な場合などが挙げられており、薬物治療抵抗性または不忍容のうつ病、躁病、統合失調症でもECTの適応が検討されることがある。 | |||
統合失調症では、同様に治療抵抗性で生命にかかわるような緊張病や[[昏迷状態]]、精神症状による著しい焦燥感・興奮・[[錯乱]]がある場合、強い[[自殺|希死念慮]]がある場合等に適応が検討されることがある。 | |||
また、いずれの疾患でもECTが効果的であった過去の治療歴、患者本人のECTの希望は治療方針の決定において重要となる。 | |||
===禁忌=== | |||
米国精神医学会は、ECT導入に際しての絶対的禁忌はないとしながらも、リスクが増す状態として相対的禁忌を定義している<ref name=ref8 />。 | |||
パルス波治療器であるサイマトロンの添付文書では、これらが反映され原則として禁忌となる疾患や状態として、 | |||
* 最近起きた[[wj:心筋梗塞|心筋梗塞]]、[[wj:不安定狭心症|不安定狭心症]]、[[wj:非代償性うっ血性心不全|非代償性うっ血性心不全]]、重度の[[wj:心臓弁膜症|心臓弁膜症]]のような不安定で重度の[[wj:心血管系疾患|心血管系疾患]] | |||
* 血圧上昇により破裂する可能性のある[[wj:動脈瘤|動脈瘤]]または[[wj:血管奇形|血管奇形]] | |||
* [[脳腫瘍]]その他の脳占拠性病変により生じる頭蓋内圧亢進、 | |||
* 最近起きた[[脳梗塞]] | |||
* 重度の[[wj:慢性閉塞性肺疾患|慢性閉塞性肺疾患]]、[[wj:喘息|喘息]]、[[wj:肺炎|肺炎]]のような呼吸器系疾患 | |||
* 米国麻酔学会水準4または5と評価される状態(ECTにより脳出血後まもない患者では再出血の危険性がある、発作による[[交感神経系]]の活性化に伴う血圧上昇、頻脈により最近起きた心筋梗塞患者では[[wj:心室性不整脈|心室性不整脈]]や[[wj:心破裂|心破裂]]の危険性がある、修正型ECTは麻酔下において治療が行われるため麻酔危険度を設定する必要がある) | |||
が挙げられている。 | |||
またECTとの併用禁忌として近年パーキンソン病治療などに用いられている[[深部脳刺激]]([[deep brain stimulation]]: [[DBS]])装置が埋め込まれている場合が挙げられている。 | |||
==有効性とその特徴== | |||
===各疾患への有効性=== | |||
近年は精神科領域でもevidence-based medicineの観点から、各国で精神科治療アルゴリズムが作成され、治療抵抗性うつ病や重症うつ病へのECTの治療的位置付けが明確化されてきている。 | |||
=== | うつ病に対するECTの効果のメタ解析では、[[プラセボ]]、模擬ECT、[[経頭蓋磁気刺激]]([[transcranial magnetic stimulation]]: [[TMS]])、抗うつ薬のいずれと比較しても、ECTの有効性が勝っていることが示されている<ref name=ref24><pubmed>3882006</pubmed></ref> <ref name=ref25><pubmed>15087991</pubmed></ref> <ref name=ref26><pubmed>12642045 </pubmed></ref> <ref name=ref27><pubmed>25143831</pubmed></ref>。 | ||
各抗うつ薬との比較では、ECTと[[三環系抗うつ薬]]([[tricyclic antidepressant]]s : TCA)や[[モノアミン酸化酵素阻害剤]] ([[monoamine oxidase inhibitor]]s, [[MAOI]])を比較した研究でTCAやMAOIよりECTの有効性が高いことが示されている。新規抗うつ薬とECTを比較した研究はまだ少ないが、Folkertsらによる治療抵抗性うつ病患者を対象としたECTと新規抗うつ薬の[[パロキセチン]]を比較した研究では、ECT群で59%、パロキセチン群で29% のうつ状態の改善を認め、ECT群でより高い反応率(71%でHAM-D総得点の50%減少)を認めている<ref name=ref28><pubmed>9395150</pubmed></ref>。 | |||
薬物治療抵抗性うつ病に対しての有効性も確立しており<ref name=ref29><pubmed>426143</pubmed></ref> <ref name=ref30><pubmed>15555704</pubmed></ref> <ref name=ref31><pubmed>15232331</pubmed></ref>、抑うつ症状の改善に加えてECTが社会機能やQOLも改善させる<ref name=ref32><pubmed>27668944</pubmed></ref>ことが報告されている。また、一般に抗うつ薬に対して治療反応の乏しい精神病像を伴う重症うつ病への有効性も報告されている<ref name=ref33><pubmed>1562861</pubmed></ref> <ref name=ref34><pubmed>7790678</pubmed></ref> <ref name=ref35><pubmed>8879718</pubmed></ref>。 | |||
=== | ECTは[[単極性うつ病]]、[[双極性うつ病]]の双方のうつ状態に有効であり、その寛解率はともにほぼ同等で約50%と報告されている<ref name=ref36><pubmed>22420590</pubmed></ref>。Keitnerらのメタ解析<ref name=ref37><pubmed>17017828</pubmed></ref>では、うつ病へのECTの反応率は53~80%、寛解率は27~56%と推定されている。ECTの施行方法が報告によって異なるため、有効性や有害事象に施行方法による差異が出やすく、有効率にばらつきが出ている<ref name=ref38><pubmed>17989386</pubmed></ref>ことが指摘されている。 | ||
== | このようにECTは気分障害のうつ状態に対し高い有効性を持つが、同時に双極性障害の躁状態への有効性も知られている。躁状態への比較対照研究は少ないものの、ECTの抗躁効果は確立しており、Mckherjeeらは過去50年間にECTを施行された約600例の急性躁病患者の転機を調査し、約80%が著明改善または完全寛解したことを報告しており<ref name=ref39><pubmed>8296883</pubmed></ref>、躁鬱混合状態への有効性も報告されている<ref name=ref40><pubmed>10735329</pubmed></ref>。ECTが抗躁効果を示すためにはうつ状態より時間がかかり両側性でうつ病より多い治療回数が必要とされている<ref name=ref43>'''Grunze H, Erfurth A, Schafer M et al'''<br>Elektrokonvulsiontherapie in der Behandlung der schweren Manie: Kasuistik und Wissensstand<br>''Nervenarzt'', 70 : 662-667, 1999</ref>。 | ||
重症躁病や薬物治療抵抗性の遷延性躁状態ではECTの適応がある<ref name=ref41><pubmed>23773266</pubmed></ref> <ref name=ref42><pubmed>22986995</pubmed></ref>が、躁状態では意識障害、頭部外傷、[[wj:HIV|HIV]]感染等の器質疾患のECT前の鑑別に十分な注意を要する。躁状態に対して施行する問題点としては、患者本人からの同意が得られにくいこと<ref name=ref44><pubmed>7694934</pubmed></ref>、覚醒状態でECT施行室に搬送することが困難であることが挙げられる。 | |||
またECTはカタトニアへの高い効果も知られている。カタトニアを呈する疾患として、統合失調症の緊張病型がよく知られるが、カタトニアは様々な疾患で起きうる症候群であり、躁状態やうつ状態、[[抗NMDA受容体抗体脳炎]]などの器質性精神疾患<ref name=ref45><pubmed>19884605</pubmed></ref>、[[自閉症スペクトラム障害]]<ref name=ref48><pubmed>24643578 </pubmed></ref>などでも起こりうる。カタトニアの[[ロラゼパム]]での寛解率は80~100%と高いため<ref name=ref45 />、通常のカタトニアではロラゼパム等の[[ベンゾジアゼピン系]]薬剤が優先して使用され、治療抵抗性の場合にECTが検討されるが、生命に危険の高い悪性緊張病ではECTは一時的治療選択になりうる<ref name=ref46><pubmed>25538636</pubmed></ref>。5つの研究でのECTにおけるカタトニアの寛解率は82~96%と報告されており<ref name=ref45 />、統合失調症、気分障害、[[統合失調感情障害]]、[[器質性精神障害]]を含む28例のカタトニアにECT<ref name=ref47><pubmed>8126312</pubmed></ref>を行った研究では、93%が緊張病症状消失がみられ、特に気分障害におけるカタトニアの寛解率は96%と高かったと報告されている。自閉症スペクトラム障害に伴うカタトニア<ref name=ref48 />や抗NMDA受容体抗体脳炎に伴うカタトニアへのECTの有効性の知見の蓄積はまだ乏しい。 | |||
統合失調症では前述のように緊張病症状を伴うものには著効することが多く、また精神運動興奮や昏迷を伴う場合も興奮や意思発動性低下が改善・軽減することが多い。一部のアルゴリズムには薬物治療抵抗性統合失調症の治療として、ECTが位置づけられるようになっているが、慢性的な幻覚妄想や陰性症状および認知機能低下には効果が乏しいことが多い。 | |||
== | ===早期の効果発現=== | ||
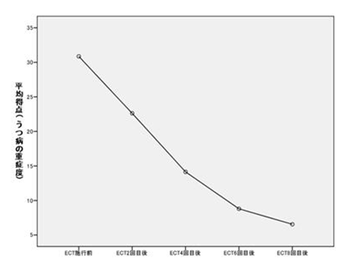
[[image:ect-図.png|thumb|350px|'''図1.修正型ECT治療によるハミルトンうつ病評価尺度総得点の推移(31名)'''<br>パルス波治療器を用い週2回の両側性ECTを行った場合(国立精神・神経センター病院)]] | |||
ECTの効果発現の特徴として、発現が早いことがあげられる。 | |||
= | 米国で行われた大規模臨床試験STAR*D研究(Systematic Treatment Alternatives to Relieve Depression)では、増強療法や併用療法を含めた薬物療法による最終段階までの累積寛解率は67%で、4段階の薬物治療戦略を試みても[[寛解]]に至らないうつ病が約3分の1存在することが示されている<ref name=ref49>'''岡本長久 坂本広太 長房裕子'''<br>Star-D研究から得られるもの―アメリカでのうつ病のsequential treatmentを知る<br>''精神科治療学'' 23巻3,4号2008年</ref>。初回の抗うつ薬で改善したとしても、抗うつ薬の効果発現には十分量に増量後2~4週間かかり、一般的に寛解に至るには少なくとも4~8週間を必要とする。1剤目が無効や効果が乏しかった場合、次の薬剤選択を行い、再び同様に治療に時間がかかることになる。 | ||
一方、ECTについて、Folkertsらは、治療抵抗性うつ病患者でECTとparoxetineの効果発現の早さについて比較検討し、ECT群ではパロキセチン群と比較し、治療1週間後よりうつ状態の有意な改善を認めている<ref name=ref28 />。 | |||
= | またHusainらはうつ病の患者に対し週3回のECTを施行し反応や寛解のスピードを検討したところ、54%が1週目3回目のセッションまでに治療反応がみられ、2週目6回目のセッションまでに34%が寛解し3-4週目10回目のセッションまでに65%が寛解したことを示している<ref name=ref50><pubmed>15119910</pubmed></ref>。 | ||
国立精神神経センター病院うつストレスケア病棟に入院し、週2回の両側性修正型ECTを行った31名のうつ病患者での、うつ病評価尺度平均得点のECT回数による経時的な改善を('''図1''')に示す。 | |||
このようにECTは早期の症状改善効果を持ち、早急な抗うつ効果が必要とされる症例に有用であり、特に、深刻な[[自殺|自殺念慮]]があり自殺が切迫している状態の早期改善を要する場合<ref name=ref51><pubmed>15863801</pubmed></ref>、精神症状から食事摂取が困難で栄養の維持が困難な場合、全身状態が悪化してきており早期の症状改善を要す場合等には、薬物療法より効果発現や寛解に至るまでが早いECTが選択されうる。ECTの迅速で高い治療効果は、医療経済の観点からも費用対効果比が高いことも示されている<ref name=ref52><pubmed>15774232</pubmed></ref>。さらに、近年は麻酔として、低用量で抗うつ作用が報告されている[[ケタミン]]を用いることによって、ECTの効果発現をさらに加速させる試みも行われている<ref name=ref53><pubmed>19935085</pubmed></ref>。 | |||
===効果の長期的維持に関する限界、維持薬物療法と維持ECT=== | |||
ECTは高い急性期効果を示す一方で、継続療法を行わない場合は高い再燃率を示すことが知られている。 | |||
ECT後6ヶ月の間にうつ病の3分の1から約半数が再発し<ref name=ref54><pubmed>26529118</pubmed></ref> <ref name=ref55><pubmed>22016123</pubmed></ref>、1年以内の再燃率は30~60%と報告されており<ref name=ref56><pubmed>10735328</pubmed></ref>、ECTによる急性期症状改善後にも、その後の再燃・再発を予防する維持薬物療法により再燃・再発率を減少させる必要がある<ref name=ref57><pubmed>11255384</pubmed></ref>。ECT後再発のリスクファクターとしては、薬物治療への抵抗性や、精神病症状の合併、[[double depression]](気分変調症にうつ病が重なること)などが報告されている<ref name=ref56 />が、再燃予測因子は明確にはなっていない。 | |||
うつ病におけるECT後の再燃予防には、一般的に抗うつ薬や[[リチウム]]などの[[気分安定薬]]による維持療法が行われる。維持薬物療法の種類によって再燃予防効果に差異があるかは明確になっていないが、うつ病ではいくつかの薬剤の優越性を示す研究が報告されている。 | |||
= | LauritzenらはECT後の維持療法としてプラセボと[[イミプラミン]] 、パロキセチンを比較し、6ヵ月以内の再燃はプラセボ群65%に対し、イミプラミン群30%、パロキセチン群10%で、維持療法の薬剤により差を認めたことを報告している<ref name=ref58><pubmed>8911559</pubmed></ref>。 | ||
ECT施行前に効果を認めなかった薬剤は維持療法としての効果も乏しいという報告<ref name=ref56 />がある一方で、van den Broekらは、三環系抗うつ剤やリチウム、モノアミン酸化酵素阻害剤などの薬剤に治療抵抗性のある患者に対しECT施行後の維持療法としてイミプラミンを使用したRCTを行ったところ、24週後にプラセボ群は80%が再発したのに対して、imipramine群は18%で有意に再発率が低かったと報告しており<ref name=ref59><pubmed>16566622</pubmed></ref>、ECTにより従前の治療抵抗性が改善する可能性も示されている。またSackeimらは、ECT施行後6ヶ月後にプラセボ群では84%が再発したのに対して、[[ノルトリプチリン]]群は60%、ノルトリプチリンとリチウム併用群が39%と有意に低く、抗うつ薬の単剤投与よりリチウムの併用が維持療法として有効であったことを報告している<ref name=ref57 />。 | |||
また、ECTにより急性期症状が寛解した後の維持療法として、安全にECTを行うことができる環境がある場合に限って、薬物療法に加えて、もしくは単独で、間隔を空けつつ、継続してECTが行われることがある。 | |||
=== | 一般的に、症状寛解に達してから再燃予防を目的に実施される6ヶ月以内の治療は継続ECT(continuation ECT)、再発予防を目的に行われる6ヶ月以上にわたる治療は維持ECT(maintenance ECT)と呼ばれる。 | ||
( | |||
継続・維持ECTの目的は、定期的な低頻度のECTを行うことで症状の寛解状態を保つことであり、ECTの治療反応性が良く、薬物療法や認知行動療法などの心理社会的治療に抵抗性または忍容性が低いために再燃・再発を繰り返す症例に適している。 | |||
維持ECTは、症状寛解後、最初は1週間に1回からはじめ、4回行ったところで症状が再燃しなければ、徐々に4週間に1回まで間隔を広げていく方法<ref name=ref60>'''Kellner CH, Pritchett JT, Beale MD et al''' <br>Handbook of ECT. <br>''American Psychiatric Press'', Washington DC, 1997</ref>が良く用いられており、初めの1ヶ月は週に1回、次の1~2ヶ月は2週に1回、それ以後は月に1回で継続する<ref name=ref61><pubmed>17146008</pubmed></ref> <ref name=ref62><pubmed>18515694</pubmed></ref>。継続・維持ECTでの治療中に再燃・再発の兆候がみられた場合は、維持ECTの予定を早めることで対応が可能である。 | |||
Kellerらはうつ病の維持療法として、維持継続ECT群と、ノルトリプチリン、ノルトリプチリンとリチウムの併用をした薬物療法群とを比較した研究<ref name=ref61 />を行い、6ヶ月後、維持ECT群では46.1%、薬物療法群では46.3%が寛解を維持し、プラセボ群に比べ有意に再燃率が低かったことを示している。 | |||
Gagneらは、急性期にECTを使用し寛解に至った治療抵抗性うつ病患者に対して、維持ECTと薬物療法の併用群と薬物療法単独群とを比較する[[後ろ向き症例対照研究]]<ref name=ref63><pubmed>11097961</pubmed></ref>を行い、抗うつ薬と維持ECTの併用群での寛解維持率は2年後、5年後それぞれ93%、73%と良好であったが、抗うつ薬単独群では52%、18%と低かったことを示した。この研究においては、維持ECT群の方が過去の薬物療法抵抗性レベルが高かったが、維持ECT群のほうが抗うつ薬単独群よりも高い寛解維持率を示していた。 | |||
Navarro らは、急性期にECTが有効であった高齢者の精神病像を伴う治療抵抗性うつ病患者に対し、維持ECTとノルトリプチリンの併用群とノルトリプチリン単独群を比較し、2年目の時点で、併用群では65%が、ノルトリプチリン群では29%が寛解を維持し、60歳以上の高齢者でも併用群が薬物療法単独群より有効で有害な副作用は認めなかったことを示している<ref name=ref62 />。これらの結果からは維持ECTを行う場合でも、薬物療法を併用した方が寛解を維持できる可能性が高いことが示唆された。 | |||
Frederikseらは、維持ECTの有効性についてまとめて、抗うつ薬の効果が不十分な場合などではECT維持継続を行うことを推奨している<ref name=ref64><pubmed>16633200</pubmed></ref>。APAガイドラインや本邦でも継続・維持ECTに関する適応基準<ref name=ref8 /> <ref name=ref22 /> <ref name=ref65>'''粟田主一'''<br>電気けいれん療法の適応.「適応となる診断」と「適応となる状況」<br>''精神科治療学'', 18:1267-1274,2003.</ref>が示されているが、一度継続・維持ECTに導入すると、定期的なECTのための入院加療を要し、またECT治療からの離脱が困難となるため、安易な維持ECT導入は避け、症例ごとに十分に適応を判断しインフォームドコンセントを行い慎重に適応を検討することが望ましい。 | |||
===脳波上の発作とECTの効果に影響を与える実施方法=== | |||
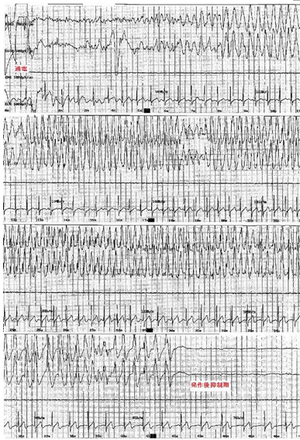
[[image:ect-3.png|thumb|300px|'''写真3.ECTによる脳波上の発作波と発作後抑制''']] | |||
ECTの効果は電流通電そのものの効果ではなく、脳波上の発作を誘発することに起因している。パルス波治療器でのECTは標準的施行方法では約8秒間の通電を行い、通電により脳神経細胞の脱分極を生じさせ、全般発作が誘発される。脳波上の発作はてんかんの強直間代けいれんの脳波に類似し、発作初期は、[[多棘波]]と低電位[[速波]]が出現し、徐々に全体に高電位[[多棘徐波]]が律動的に出現する('''写真3''')。発作が終了すると脳波は一時的に平坦化し発作後抑制期に移行する。ECTクール終了後1ヶ月程度の全般性の徐波化を認めることがあるが通常は徐々に正常化する。 | |||
ECTの治療効果につながる有効な脳波上の発作の性質は、規則的で対称性の高振幅棘徐波、良好な発作後抑制(脳波平坦化)、一定以上の発作時間(運動発作20秒または脳波上の発作25秒以上、65歳以上ではそれぞれ15秒と20秒)があり、参考事項として[[wj:心拍|心拍]]、[[wj:血圧|血圧]]の急上昇など交感神経系の興奮があげられている<ref name=ref22 />。発作時間に関しては25秒以上のけいれん誘発は必須とされる一方で、けいれん時間と効果は比例しないことが分かっており、むしろ十分な効果のあるエネルギー量ではけいれん時間は減少することが多いため、脳波上の発作がより長ければ効果的というわけではない。 | |||
この発作誘発の実施方法により、ECTの効果は影響を受ける。ECTの効果に影響を与える主要な実施方法での因子としては、刺激強度(最大刺激の何%で刺激するか)、電極配置部位(両側性か右片側性か)、治療波の波形(サイン波かパルス波か)がある。 | |||
刺激強度は高いほど効果があるが、副作用である[[認知機能障害]]を起こす確率は高くなる<ref name=ref66><pubmed>12642045 </pubmed></ref>。 | |||
初回治療の刺激強度の設定方法には、半年齢法(加齢により発作閾値が上昇するため例えば60歳であれば30%など年齢の半分程度の電気量で初回の通電を行う)と閾値滴定法(徐々に刺激強度を上げてけいれん閾値を決定してからさらに刺激強度を上げて通電する)がある。発作閾値は、サイマトロンでは最大用量の100%に対して何%の設定にするかで定義される脳波上の全般けいれんを起こすための最小限の電気用量であるが、臨床的効果のある発作を起こすためには両側性では閾値の1.5~2.5倍、右片側性ではより高い閾値の2.5~6倍が必要である。本邦では、発作閾値の滴定は行わず半年齢法による刺激強度で開始し、発作波の質や治療効果、治療継続に伴うけいれん閾値の上昇を鑑みて漸次調整していくことが多い。 | |||
電極配置は、両側性と片側性があり、両側性の場合は左右半球に通電され、片側性の場合は通常右半球に行われ右半球だけに通電されるが、共に通電による脳全体の発作誘発が可能である。両側性の方が片側性よりも効果が高いとする報告が多く、現在は世界的に両側性ECTが主流を占める。しかし十分な刺激用量での右片側性ECTは両側性と比較し効果に差がなく、[[認知機能]]への影響が少ないのでより望ましいという報告もある<ref name=ref67><pubmed>10807482</pubmed></ref>。 | |||
波形については、パルス波刺激とサイン波刺激の両者で効果に有意な差を認めなかったとする[[メタ解析]]があるが<ref name=ref66 />、ECT麻酔薬として良く用いられているチオペンタールなどのバルビツレート系麻酔薬はもちろん、[[プロポフォール]]などの非バルビツレート系麻酔薬も少なからず抗けいれん作用を持ち、パルス波治療器の普及とともに、パルス波治療器の最大刺激電流量を用いても脳波上のけいれん波が誘発されない症例が少なからず存在することが分かってきた。バルビツレート系麻酔薬である[[メトヘキシタール]]でECTを受けた患者の15%は最大刺激強度を必要とし、最大刺激強度でもその中の33%は発作持続時間が足りないか、不発であったという報告がある<ref name=ref68><pubmed>10831477</pubmed></ref>。このような症例では内服している抗けいれん作用のあるベンゾジアゼピンや抗けいれん薬の見直し、[[フルマゼニル]]のECT通電前の使用、ECT通電前の過換気、ケタミン麻酔などへの変更<ref name=ref69><pubmed>12556568</pubmed></ref>などを考慮する必要がある。 | |||
==副作用== | |||
===致死的副作用=== | |||
ECTによる最も重篤な副作用は死亡であり、その死亡率についていくつかの検討が行われた<ref name=ref70><pubmed> 3898873</pubmed></ref> <ref name=ref71><pubmed>10614030</pubmed></ref> <ref name=ref72><pubmed>9342128</pubmed></ref> <ref name=ref73><pubmed>11474057</pubmed></ref>。 | |||
現在のECT治療による死亡率は概ね5~8万治療回数に1回程度の頻度で非常にまれで<ref name=ref8 /> <ref name=ref10 /> <ref name=ref22 />、これは小規模な外科手術や歯科麻酔の危険率にほぼ相当し、ECTは安全な治療法とされる。もし1クールで計5~8回の治療を受けると仮定すると、1クールを施行することでの死亡リスクは1万クールに1回程度と推測される。 | |||
近年の研究でもECT治療1日以内での死亡は10万治療回数に2.4回と低いが、事故や自殺を含むECTとの因果関係のない全ての死亡も含めた14日以内の死亡は10万治療回数に18回と報告<ref name=ref74><pubmed>27428480</pubmed></ref>されており、ECT中のみならずECT後も慎重な精神・身体症状の管理と医療安全管理を要することが示唆される。 | |||
主な死因はけいれん直後や回復期の心血管系合併症<ref name=ref75><pubmed>9349071</pubmed></ref> <ref name=ref76>'''Levin L, Wambold D, Viguera A et al.'''<br>Hemodynamic responses to ECT in a patient to critical aortic stenosis. <br>''J ECT'', 52 : 884-885, 1997</ref>や嘔吐に伴う窒息<ref name=ref77><pubmed>9711067</pubmed></ref>によると考えられ、ECT前のリスク評価や絶食などのECT前管理の徹底が重要となる。 | |||
また修正型ECTにて通電1分後よりwide QRS頻拍が出現し、[[リドカイン]]の投与で頻拍が停止せず直流通電により停止させた症例<ref name=ref78>'''小田切 史徳、関田 学、小松 さやか、杉原 匡美、平野 景子、小松 かおる、林 英守、戸叶 隆司、住吉 正孝、中里 祐二、代田 浩之'''<br>うつ病に対する修正型電気けいれん療法によって誘発されたwide QRS頻拍の1例<br> | |||
''心臓'' Vol. 44 (2012) No. SUPPL.2 p. S2_56-S2_62</ref>も報告されており、緊急時の対応を想定しておき、ECT処置室には[[wj:除細動器|除細動器]]などの準備が必要である。 | |||
===心血管系合併症=== | |||
通電中と通電直後には、通電による[[迷走神経]]の直接刺激から[[副交感神経]]が優位となり、発作中は[[交感神経]]が、発作終了後には再び副交感神経優位となる。通電直後の副交感神経優位状態では[[wj:徐脈|徐脈]]、[[wj:洞停止|洞停止]]、血圧低下が、発作中の交感神経優位状態では[[wj:頻脈|頻脈]]・[[wj:高血圧|高血圧]]が、発作終了後には再び徐脈や[[wj:不整脈|不整脈]]が一過性に出現しやすい。このような短時間の内に急激に生じる生理学的変化に対して、ECT中は麻酔科医による呼吸循環モニターと全身管理が必要になる。また、ECT中の徐脈性不整脈、血圧低下、口腔内分泌の増大などの副交感神経反応を抑制するためには、[[抗コリン薬]]である[[硫酸アトロピン]]の麻酔導入直前の静脈内投与が有用なことがある。高血圧症合併症のある患者では朝の降圧剤を服用し、必要に応じて[[ジルチアゼム]]、[[ニカルジピン]]等の[[カルシウム拮抗薬]]をECT直前か直後に静注し管理する。特に従来からの心血管系合併症を持つ患者では死亡例も報告されており、十分な管理が必要である。 | |||
===認知機能障害=== | |||
ECTの副作用として出現する認知機能障害には[[発作後錯乱]]、[[発作間せん妄]]、健忘がある<ref name=ref79>'''Beyer JL, Weiner RD, Glenn MD'''<br>Electroconvulsive therapy. A programmed test 2 nd, <br>''American Psychiatric Press'', Washington DC, 1998</ref>。 | |||
発作後錯乱([[発作後せん妄]])は、通常ECT麻酔覚醒後数分以内に簡単な従命や会話が可能となるところ、ECT麻酔覚醒時に数分から数時間の[[精神運動性興奮]]や[[失見当識]]を伴う[[錯乱]]状態を示すもので、安心できる声かけや静かな環境でのリカバリーが重要である。発作後錯乱ではリカバリー時の慎重な観察と安全管理を要すが、著しく興奮が強い場合は、静脈麻酔薬の再投与や[[ミダゾラム]]、[[ジアゼパム]]等の[[ベンゾジアゼピン]]の追加投与が必要となる場合がある。 | |||
発作間せん妄は、各ECT治療の間の期間にせん妄状態を呈すものであるが、一般的には治療終了とともに速やかに消失する。ECTの継続が望ましい場合は、治療間隔をあける、刺激用量を下げる、右片側性に変更するなどの対策をとるか、やむを得ない場合は抗精神病薬などによるせん妄治療を行う必要がある。 | |||
健忘は前向性健忘と逆行性健忘があり、共にECT終了後数日から数週で消失することが多いが、前向性健忘は速やかに回復するのに対し、逆行性健忘は回復に比較的時間がかかることがあり、時にECT治療中や開始直前の記憶は欠けたままのこともある。逆行性健忘は、ECT施行前に全般的な認知機能障害を伴う場合や、ECT施行直後の失見当識の持続時間が長いほど起こりやすいとされる<ref name=ref80><pubmed>7793470</pubmed></ref>。また、[[エピソード記憶]]より[[意味記憶]]のほうが、[[遠隔記憶]]より[[近時記憶]]のほうが障害されやすい<ref name=ref81><pubmed>10839336</pubmed></ref>ことが知られている。 | |||
認知機能障害の頻度は、片側性より両側性が、刺激強度が低用量より高用量の方が、パルス波よりサイン波の方が、頻度が高いとされる<ref name=ref26 /> <ref name=ref82><pubmed>3458412</pubmed></ref>。その他、治療回数が多い、治療間隔が短い、患者年齢が高いことは認知機能障害のリスクの増加に関連する。 | |||
認知機能障害が出現した時は、治療の中断、両側性から右片側性への電極配置の変更、治療頻度の引き下げ、治療有効性を損ねない程度の刺激強度の引き下げ、認知障害に関与している併用薬剤の見直し等の対策<ref name=ref8 /> <ref name=ref10 /> <ref name=ref60 />が行われることが望ましい。 | |||
記憶障害はECT中の低酸素とも関係があり、ECT刺激前の十分な酸素化が重要である<ref name=ref83><pubmed>8010381</pubmed></ref>。またケタミン麻酔は神経保護作用を持ち認知機能障害を低減する可能性が示唆されている<ref name=ref84><pubmed>16801824</pubmed></ref> <ref name=ref85><pubmed>18379336</pubmed></ref>。 | |||
認知機能障害はECT経過中に生じやすいが、一方でECTを終了後約2週間経過した時の認知機能は、治療前よりも改善している、という報告<ref name=ref86><pubmed>20673880 </pubmed></ref>もある。うつ病の精神運動抑制による認知機能障害は、ECTによるうつ症状の改善とともに回復するため、疾患の症状とECTの副作用を鑑別しなければならない。 | |||
副作用としての認知障害を正しく評価するためには、ECT前の認知症などの認知機能障害の合併を把握しておく必要があり、ECT施行前の脳画像評価と認知機能評価が重要である。 | |||
ECTの反復施行により認知機能障害が進行するのかという懸念があったが、現在では否定的と考えられており<ref name=ref87><pubmed> 9229039</pubmed></ref>、MRIやCTを用いたECTによる脳構造への障害についてのメタ解析でも、脳構造への障害は示されていない<ref name=ref83 />。 | |||
またサイン波治療器で100回以上の両側性修正型ECTを受けた8名の患者とECTとECTを受けたことのない患者の比較研究では、認知機能に有意な差はなかったと報告されている<ref name=ref88><pubmed> 2053635</pubmed></ref>。 | |||
===その他の合併症=== | |||
ECTの通電直後のその他の副作用として、[[遷延性けいれん]]、[[けいれん重積]]、[[遷延性無呼吸]]が、ECTからの覚醒後に出現し数時間持続することがある副作用として、[[頭痛]]、筋肉痛、嘔気がある<ref name=ref8 /> <ref name=ref10 /> <ref name=ref79 />。 | |||
== | 遷延性けいれんは、通常2分未満で終了するけいれんが2分以上<ref name=ref8 />ないし3分以上<ref name=ref60 />続く場合で、筋弛緩薬により運動成分が目立たない場合は脳波モニターで判断する。[[テオフィリン]]などのけいれん誘発物質やリチウムの使用、電解質異常、1回の治療内での複数回の刺激、若年者、初回治療(投与電気量が不明)などではより出現しやすいとされる。処置としては、マスク換気での酸素投与を続け、麻酔薬を追加するか抗けいれん作用のあるミダゾラムやジアゼパム等を静脈内投与する。 | ||
遅発性けいれんは稀であり、ECT終了後の自発的なけいれんの頻度は一般人口と差がないとされる。 | |||
遷延性無呼吸は、サクシニルコリンの代謝障害などに関連するまれな副作用である。患者の自発呼吸が回復し安定するまでの間のマスク換気や[[wj:気管内挿管|気管内挿管]]が必要となる。 | |||
頭痛は、ECT後約半数弱が自覚する最も頻度の多い副作用で、[[wj:側頭筋|側頭筋]]や[[wj:咬筋|咬筋]]の通電による収縮や脳循環動態変化による疼痛と考えられ、[[wj:非ステロイド系消炎鎮痛剤|非ステロイド系消炎鎮痛剤]]を用いる。 | |||
筋肉痛は通電による筋肉の収縮やサクシニルコリンによる[[筋線維束攣縮]]によると考えられる。ほとんどが一過性であるが、持続性のものではサクシニルコリンの量を減量するか、筋弛緩薬をベクロニウムなどに変更する。 | |||
嘔気は、麻酔薬、けいれん発作、手動換気時に胃内に流入した空気による胃内圧上昇などの影響によると考えられ、嘔気が強い場合は[[メトクロプラミド]]、[[ドンペリドン]]や制吐作用のある[[フェノチアジン]]系抗精神病薬を使用する。 | |||
歯科的損傷は、咬筋の収縮、人工換気、[[wj:バイトブロック|バイトブロック]]の挿入により起こりうる。ECTの術前検査として口腔内診察を行い、ぐらつきの強い歯や孤立した尖った歯がある場合は麻酔科医や歯科にコンサルトする必要がある。また咬傷の予防にバイトブロックを使用することが重要である。 | |||
うつ状態に対するECT治療中に躁転が出現することがある<ref name=ref89><pubmed>3338979</pubmed></ref>。この場合、ECTの抗躁効果を期待してさらにECTを継続する場合と、ECTを終了し[[躁状態]]に対する薬物療法を行う場合がある。ただし躁転は、ECT後の軽度の意識障害による脱抑制との鑑別が難しいことがあり、認知機能や脳波の評価が重要である。 | |||
==修正型ECTの実際== | |||
===同意=== | |||
精神医学的病歴および過去の治療抵抗性と現在の精神症状の十分な評価に基づき、ECT適応の判断が慎重に行われその適応が確認された場合、ECTが実施できる全身状態を確認し、患者および家族へのインフォームドコンセントを行う。 | |||
ECTのインフォームドコンセントに関し、2005年[[wj:世界保健機関|世界保健機関]]([[wj:WHO|WHO]])は、ECTは患者本人からのインフォームドコンセント、あるいは同意能力の欠如が明らかな場合は保護者からのインフォームドコンセントを得た場合のみに使用されるべきであると勧告しており、これらが欠如した状態でECTを施行してはならない。 | |||
手術同意と同様に文書を用いて、本人および保護者に口頭で説明し、署名による同意を得る。医療保護入院や措置入院等で本人に同意能力がない場合は、保護者に説明して同意を得ることになるが、病状の回復とともに同意能力が回復した場合には、本人にも十分な説明をすることが望ましい。 | |||
説明すべき重要な点には、臨床経過とECTの適応理由、現在の状態に対するECTの想定される有効性と限界、ECT以外の代替治療の可能性、ECT後の薬物療法などの継続治療の必要性、ECTの手順、副作用および生命への危険性とその際の緊急的処置と行動制限の可能性、同意撤回の自由がある。 | |||
===前日までの術前検査・前処置=== | ===前日までの術前検査・前処置=== | ||
術前検査として、既往歴やアレルギーの問診、内科学的診察、口腔や歯科的診察、神経学的診察、簡単な認知機能検査に加え、血算・一般生化学検査、心電図、胸腹部レントゲン、頭部画像検査、脳波検査を行い、既往歴や合併症に応じてさらに追加検査を実施する。麻酔科医による問診と麻酔リスク評価を行っておく。 | |||
またECT導入前には内服している[[向精神薬]]を調整しておく必要がある。 | |||
= | リチウムに関しては、APAガイドライン<ref name=ref8 />はリチウムとECTは併用しないように推奨している。安全にリチウムとECTを併用できるという報告も存在するため明確な禁忌ではないが、ECTとの併用でサクシニルコリンの作用延長による遷延性無呼吸の可能性が指摘され、ECT後の認知機能障害やせん妄の増加、遷延性発作や[[セロトニン症候群]]などの発生が報告されていることからECT前に中止し、ECTクール終了後必要であれば再開することが望ましい。[[抗てんかん薬]]やベンゾジアゼピン系薬剤は、ECTとの併用禁忌ではないが抗けいれん作用によりけいれんを生じにくくし発作不発や不適切な脳波上のけいれんを招きやすくするためECT前に漸減中止することが望ましい。 | ||
= | また嘔吐による誤嚥や窒息を予防するため、ECT治療開始の少なくとも6時間前からの固形物の中止、少量の水と必要な薬物以外の2時間前からの中止が推奨<ref name=ref22 />されており、例えば午前中施行する場合は前日夜から、午後に施行する場合は当日朝からの絶食とするなどの処置の徹底が必要である。当日朝薬は[[wj:降圧剤|降圧剤]]など必要最小限に留め、必要に応じて施行前に胃酸の誤嚥防止のため[[wj:H2ブロッカー|H2ブロッカー]]などの[[wj:制酸剤|制酸剤]]内服等を行う。 | ||
== | ===パスル波治療器での修正型ECTの手順=== | ||
[[image:ect-4.png|thumb|300px|'''写真4.ECTユニットの例''']] | |||
ECTを施行するためには、精神科関連学会の推奨事項<ref name=ref22 />を参照し、ECT施行施設ごとにマニュアルを作成し各施設内でのECT手順が標準化されている必要がある。 | |||
ECT施行場所は修正型ECTの普及とともに、手術室やECT専用ユニット('''写真4''')で実施される施設が一般的となっており、ECT専用ユニットでは、ECT前室、ECT処置室、ECTリカバリー室などが設置されることがある。ECT処置室には、100%酸素で陽圧換気が行うことのできる麻酔器、バイタルサイン、[[wj:心電図|心電図]]、[[wj:酸素飽和度|酸素飽和度]]の自動モニター、ECT治療器、気管内挿管や万一の急変時に備える除細動器などが配置されている。 | |||
当日は、手術に準じた本人確認、ECT同意書の確認、前処置が適切に行われたかの確認を行い、病棟で排尿とバイタルサインの測定、バイトブロックや換気で危険を伴うと予測される口腔内異物や歯の再確認、[[wj:義歯|義歯]]・[[wj:コンタクトレンズ|コンタクトレンズ]]・貴金属装飾品などを装着していないかの確認を行ってから、ストレッチャーでECT処置室へ移動する。 | |||
ECT処置室では、精神科医師、麻酔科医師、看護師が協働しそれぞれの処置を行う。 | |||
[[wj:乳酸リンゲル液|乳酸リンゲル液]]などを用いて静脈ルートを確保し、呼吸循環モニターのため血圧計、心電図電極、パルスオキシメーターを装着しバイタルサインや酸素飽和度を確認し、通電後の発作を確認するためパルス波治療器の脳波電極、筋電図電極を装着する。 | |||
通電刺激電極シール(サイマパッド)を装着する電極配置予定部位の皮膚は生理食塩水で湿らせたガーゼで良く拭いて乾かし、同部に通電を行うためのサイマパッドを付着させる。サイマトロンのセルフテストで静的インピーダンスの適切性(3000Ω以上では熱傷の可能性があり通電ができない)を確認し、脳波、筋電図が適切に記録されるか確認する。刺激強度であるサイマトロンの%を症例にあわせて設定しておく。サイマトロンでは、パルス幅、周波数の刺激変数の設定も可能だが、通常はプリセットされている刺激プログラムで行なわれている。 | |||
麻酔科医は、100%酸素による十分な酸素投与を行いながら、麻酔導入を開始し、短時間作用型のチオペンタールやプロポフォール等の静脈麻酔薬を投与して麻酔導入を行い、必要に応じて副交感神経反応抑制のための硫酸アトロピンの静脈投与を行う。麻酔効果出現後、マスク換気などの人工換気に切り替え、サクシニルコリンまたはベクロニウム等の筋弛緩薬を投与し、サクシニルコリンを用いた場合では筋線維束攣縮の出現を確認する。筋弛緩と十分な酸素化が確認された後、咬傷の予防のためマウスガード(バイトブロック)を口内に挿入し、口腔内での安全な固定を確認する。 | |||
再度インピーダンスが3000Ω以下であることを確認してから、一時的に人工換気を中断し、精神科医が通電ボタンを押し通電を開始する。通電終了後、サイマトロンによる自動的な脳波記録が開始され、麻酔科医は人工換気を再開する。 | |||
運動性のけいれんと脳波上のけいれん('''写真3''')を確認し、けいれんの持続時間と波形の適切性を確認する。運動性のけいれんは、筋弛緩作用のため軽微かほぼ認めないこともあるが、片下肢にターニケットを巻いて実施することで筋電図上のけいれんを計測することができる。 | |||
通電後は、麻酔科医は十分なマスク換気での酸素投与の継続とともに、交感神経、副交感神経反応による脈拍や血圧変化等の全身反応に対し必要な処置を行う。 | |||
筋弛緩薬と静脈麻酔薬の効果が消失し、自発呼吸再開後、十分な酸素投与を継続し、バイタルサインの正常化、簡単な会話など意識レベルの回復を確認したのち、ECT回復室にストレッチャーで移動する。意識レベルやバイタルサインが安定していることを確認した後に医師や看護師が付き添い酸素投与を継続しながら病棟に戻る。 | |||
病棟に帰棟後も慎重なバイタルサインと意識状態の観察を要すが、通常1時間程度で、酸素投与は終了し静脈留置針を抜去する。嚥下状態や歩行状態を確認し、問題がなければ、服薬や食事を再開し、ベッド上安静を解除する。 | |||
通常ECTは週に2回ないし3回の頻度で行い、一連の治療セッション(1クール)は6~10回、最大12回行われる。完全な寛解が得られるか、過去数回の治療で効果が頭打ちになったところでECTを中止する。 | |||
==ECTを取り巻く課題と今後== | |||
従来型ECTは過去には電気ショック療法と呼ばれ、社会的な負のイメージが強かった。その背景には、薬物療法が開発される以前の時代から薬物療法の黎明期にかけて、適応を選ばないECTの乱用が少なからずあったと考えられることや、十分なインフォームドコンセントを得ずにECTが行われていた経緯がある。 | |||
1975年に米国で公開された映画「[[wJ:カッコーの巣の上で|カッコーの巣の上で]]」( [[wJ:カッコーの巣の上で|One Flew Over the Cuckoo's Nest]])には、精神病院入院中の患者に従来型ECTが行われ強直間代けいれんする様子や患者側の恐怖が描かれており、この時代のECTはインフォームドコンセントが十分でなく、ECTを病院が患者の管理手段として乱用していた傾向があったことは否めない。 | |||
また、本邦でも松本昭夫の手記「精神病棟の二十年」<ref name=ref100>'''松本昭夫'''<br>精神病棟の二十年―付・分裂病の治癒史<br>''新潮文庫'', 2001 ISBN 4062646897</ref>に、1960年代の精神病院の無麻酔でのサイン波治療器でのECTの様子が描写されている。 | |||
現在は、米国APAをはじめ各国の精神科学会や多くの精神科医が、「適切な適応の患者に十分なインフォームドコンセントを行い、トレーニングされた精神科医が適切な方法で行うECTはエビデンスに基づく治療である」と考えている。未だ様々な領域でECTへの反対意見を持つ人は少なからずおり、一部の精神科医もECTに対して否定的な態度を示す場合があるが、治療ガイドラインに位置づけられている重要な治療法であることから、状況に応じて治療の一選択肢として患者に提示することは医師として必要であろう。 | |||
ECTは従来型ECTから修正型ECTへ、そしてパルス波治療器を用いたECTへと発展してきており、現在のECTは、静脈麻酔薬の使用、筋弛緩薬の使用、ECT中の十分な酸素化と呼吸循環モニターの使用が標準的になってきている。しかし、本邦での課題として、修正型ECTおよびパルス波治療器の普及がまだ不十分であることがあげられる。 | |||
1991年に中島らにより行われたECTに関する精神神経学会に所属する精神科医への全国アンケート調査<ref name=ref90>'''中島一憲、山崎久美子、守屋裕文'''<br>「電気けいれん療法(ECT)をめぐる諸問題」についてアンケート調査<br>''精神経誌''95;537-554,1993</ref>では、約4割の精神科医が現在ECTを実施していたが、修正型ECTを施行している精神科医は15%程度で、インフォームドコンセントの取得も不十分であった。 | |||
1997年~1999年に本橋らが行った、大学病院・国立病院を対象にしたアンケート調査<ref name=ref91><pubmed>15087992</pubmed></ref>では、65%の施設でECTが行われ、修正型ECTを行っている施設は80%であったが、修正型ECTのみを行っている施設は33%で、約3分の2の施設で従来型ECTが用いられていた。また本調査では大学病院・国立病院へのアンケート調査で調査対象が本邦の精神科医療機関を網羅しておらず、従来型ECTの正確な使用割合は不明であった。 | |||
2009年に日本精神神経学会精神科専門医制度研修施設を対象に行われた一瀬らの調査<ref name=ref92>'''一瀬 邦弘、鮫島 達夫、粟田 主一'''<br>わが国の電気けいれん療法(ECT)の現況 : 日本精神神経学会ECT検討委員会の全国実態調査から<br>''精神神經學雜誌''. 113, (9), pp. 939-951, 2011-09-25. 日本精神神経学会</ref>では、ECTを行っている施設は40%で、修正型ECTのみを実施している施設は37.9%、静脈麻酔薬は使用するが筋弛緩薬は使用しないECTを行っている施設は44.9%で、静脈麻酔薬も使用しないECTを行っている施設も3.7%存在していた。 | |||
治療器に関しては、パルス波治療器のみを使用している施設は24%で、パルス波とサイン波治療器の双方を使用している施設は20.8%、サイン波治療器のみを使用している施設は51%だった。 | |||
修正型ECTは麻酔科医の配置や手術室に準じた施設が必要となるために限られた医療機関でしか行えない治療であり、地域の精神病院と麻酔科医の配置が可能な総合病院との医療連携強化の必要性が指摘されている<ref name=ref92 />。 | |||
これらの調査からは、修正型ECTが行われる割合やパルス波治療器が用いられる割合は年々増加しているものの、本邦での普及はまだ不十分であると言わざるを得ず、ECTの標準化は以前からの大きな課題であったことから各関連学会がECT講習会を定期的に開催し均てん化が行われている。 | |||
臨床的な課題としては、先述した100%での刺激強度でも発作が不発または発作不十分な症例が存在することがある。現在は、手技的な工夫や麻酔薬の変更などの個々の施設の工夫で対処されているが、ECTを必要とし希望している患者に対し臨床的効果のあるECTを提供できない場合があり解決が求められている。 | |||
また、これも先述したとおり、ECTによる急性期症状改善後の長期的効果維持に関する限界があり、ECTによる急性期症状改善後の再燃・再発を予防する最適な維持療法についての模索も大きな課題となっている。 | |||
研究面におけるECTにおける最大の課題は先述したECTの作用機序である。ECT前後での[[脳画像研究]]、生体内物質の変化、遺伝子発現の変化など、作用機序について世界各国で研究がされているが、未だ作用機序は未解明のままである。ECTの作用機序を解明することは、うつ病の本質的な病態の解明につながる可能性もあり非常に重要な課題である。 | |||
ECTのアクセシビリティの課題としては、ECTは現在のところ入院治療による管理が必要であり、継続・維持ECT施行の際もその都度入院管理が必要となるため、アクセシビリティが良いとは言えず、今後アクセシビリティの高い外来ECTを行うことが特に安全面において可能であるかという検討が求められる。 | |||
ECTの発展形として直接的に電気を用いないけいれん療法も提案されてきている。磁気によってけいれんを誘発し認知機能障害がより少ないとされる[[磁気けいれん療法]]([[magnetic seizure therapy]]: MST)や焦点を絞った通電が可能となる[[focal electrically administered seizure therapy]](FEAST)などが開発され研究段階にある。 | |||
== | ==参考文献== | ||
<references /> | |||
2021年10月28日 (木) 20:58時点における最新版
岡本 長久
札幌鈴木病院
野田 隆政
国立精神・神経医療研究センター
DOI:10.14931/bsd.4610 原稿受付日:2016年1月23日 原稿完成日:2017年2月16日
担当編集委員:加藤 忠史(独立行政法人理化学研究所 脳科学総合研究センター)
英語名:electroconvulsive therapy 英略称:ECT 独:Elektrokrampftherapie, Elektrokonvulsiontherapie 仏:électroconvulsivothérapie
電気けいれん療法は、経皮的に頭部に通電を行い脳に人工的なけいれんを誘発することで治療効果を得る精神神経疾患に用いられる治療法で、特に重症うつ病、薬物治療抵抗性ないし重症躁病、またはカタトニア(緊張病)に高い治療効果を持つ。ECT手技は、従来型ECTから修正型ECTへ、さらはサイン波治療器を用いたECTからパルス波治療器を用いたECTへと発展してきており、その安全性は向上しているものの、現在もその作用機序が未解明であることやわが国でのECT手技の標準化がまだ十分でないことなどの課題があり、作用機序に関する研究や精神科関連学会を中心としたECTの標準化がすすめられている。
歴史
従来型ECTの誕生
電気けいれん療法は経皮的に頭部に通電を行うことで脳に人工的なけいれんを誘発し、治療効果を得ようとする治療法であり、精神神経疾患に古くから広く用いられてきた。
1952年に世界初の抗精神病薬であるクロルプロマジンが発見される前の精神疾患に有効な薬物がまだ発見されていなかった時代から、てんかんによるけいれん発作があった後に統合失調症患者の精神症状が改善することがあることが知られていた。
このため人工的にけいれんを誘発して精神疾患を治療しようとする試みが行われるようになり、1934年にハンガリーの精神科医Medunaは、統合失調症とてんかんの拮抗仮説に基づき、早発性痴呆(現在の統合失調症)の患者にカルジオゾールで誘発したけいれんによる治療を実施し、その精神症状への有効性が確認された[1]。
その後、統合失調症患者への薬剤誘発けいれんによる治療が試みられ、けいれん誘発物質として初期にはカンフル(樟脳)やカルジオゾールがよく用いられた。なお、当時の統合失調症概念は幅広く、近年Baranらは、これらの統合失調症の薬剤誘発によるけいれん療法が行われた23症例の報告について、現在の診断基準から診断の見直しを行ったところ、統合失調感情障害、精神病性の特徴を持つ気分障害などが含まれており、統合失調症よりもそれらの疾患に有効性が高かった可能性が推察されている[2]。
精神症状に対し治療効果のある確実なけいれんを誘発するために、けいれんを惹起する薬剤ではなく電気刺激による脳への通電を用いる方法は、1938年にイタリアのCerlettiらによりはじめて報告された。彼らは通電することにより動物にけいれんが誘発されることからアイデアを得て、統合失調症患者に対して電気による脳への通電を行うことでけいれんを誘発したところ、10~20回の通電治療の後で精神症状に有効であることを確認し、これにより精神疾患治療としてのECTが見出された[3]。
このように統合失調症患者に対して、経皮的な脳への通電によるけいれん誘発が施行され治療効果を認めたことから、欧米では精神科治療として1940~60年代にかけてECTが広く行われるようになり、同時にうつ病への治療効果も多く報告されるようになった。
本邦では、1939年に九州大学の安河内と向笠により統合失調症に対するECTが報告[4]されると、薬物療法など精神疾患への確実な治療法がない時代だったこともあり、本邦でも急速にECTが普及していった。
従来型ECTから修正型ECTへの発展
麻酔や筋弛緩薬を使用せず施行する従来型ECTでは、施行前に患者に恐怖感を与えることや全身の強直間代けいれんに伴う骨折、呼吸器系・循環器系の副作用が少なからず起こることが問題であった。
施行前の患者の恐怖感に対しては、徐々にチオペンタールやアモバルビタール等のバルビツール系の静脈麻酔薬が用いられるようになり、またけいれん発作時の骨折事故を減らす工夫として、通電後の脳のけいれん波と同期した体の全身けいれんが起こらないようにするために筋弛緩薬が用いられるようになったことで、静脈麻酔薬と筋弛緩薬を併用する修正型ECT(modified electroconvulsive therapy; mECT)の基盤が完成した。
筋弛緩薬については、1940年代には南米の原住民が狩猟に用いていた筋弛緩作用を持つ毒物クラーレが使用されていたが[5]、作用時間が長いことが問題であったため、1952年HolmbergとThesleffzらが、より安全性の高いサクシニルコリンの使用を提唱し[6]、以後サクシニルコリンが現在まで修正型ECTの代表的な筋弛緩薬として用いられている。
本邦でも1958年、島薗らにより筋弛緩薬を使用したECTの報告がなされた[7]が、その後の安全面を含めた評価や一般化が不十分で、またECT自体が患者に強制的に行う負のイメージが強かったため、この時代の反精神医学の潮流や薬物療法の発展に伴い1970年代には本邦では次第に第一線の治療から後退していった。
しかし、1980年代になると、リエゾン精神医学の進展に伴い、本邦でも精神科が総合病院の一つの科として位置づけられるようになり、麻酔科医と連携して行う修正型ECTが総合病院や大学病院を中心に普及し、同時に手術に準じた患者や家族へのインフォームドコンセントを行うことが一般的になったことで、ECTの安全性が高まり、従来の負のイメージは徐々に払拭されていった。
米国では、1975年に米国精神医学会(American Psychiatric Association ; APA)がECTに関する専門委員会を設置し、1990年、2001年にECT全体を網羅するガイドライン「APAタスクフォースレポートECT実践ガイド」[8]が刊行され、英国でもECTに関するガイドラインが刊行された[9]。
本邦では、2000年、本橋により本邦で初めてのECTマニュアルが出版され[10]、2002年、日本精神神経学会の「電気けいれん療法の手技と適応基準検討小委員会」により、「APAタスクフォースレポートECT実践ガイド」[8]が翻訳刊行され、本邦の現状を考慮した「ECT推奨事項」も報告された。同時期、全国自治体病院協議会はECTの使用に関する提言を行い、修正型での運用とインフォームドコンセントの取得を強く推奨することとなった。
現在は、このような流れを汲んで、インフォームドコンセントを取得し、麻酔科医と連携した呼吸循環管理のもとで、十分な酸素化と筋弛緩薬と静脈麻酔薬を用いて行う修正型ECTが推奨される標準的治療となっている。
サイン波治療器からパルス波治療器への発展
通電のためのECT機器として、従来は交流正弦波(サイン波)治療器が用いられてきた。サイン波治療器は通常電源から交流正弦波の電圧変換を行う機器で、2本の電気通電用の棒の先についている布部分を生理食塩水で湿らせ、医療者が両手で2本の電気通電用の棒を持ち、棒の先の布部分を患者の両側の前頭部に当てながら通電ボタンを押し、正弦波(サイン波)を105V程度で5秒間程度通電することで脳のけいれんを誘発する機器(写真1)であった。
1976年、定電流短パルス矩形波治療器(パルス波治療器)が開発されると、欧米では1980年代より、サイン波治療器より少ない電気量での発作誘発が可能[11]なパルス波治療器が用いられるようになり、本邦でも2002年にパルス波治療器が医療機器として承認された。
パルス波治療器は短パルス矩形波(パルス波)を通電に用いることで、従来の刺激装置であるサイン波治療器の約1/3程度のエネルギー量で神経細胞の脱分極を起こすことができるため、効率的にけいれん閾値に達して発作誘発ができることに加え、個人の電気抵抗値によらずに定電流を通電できる特徴がある。このため、サイン波治療器よりも通電後の認知機能障害が少なく[12]、パルス波治療器を用いることで更にECTの安全性が向上するとされる。
加えて、パルス幅の選択、刺激プログラムの設定、静的インピーダンスと通電時の動的インピーダンスの測定、脳波・心電図・筋電図のモニター、測定データの解析などが可能で、臨床的な利便性もサイン波治療器よりも向上している。
現在医療機器として使用されているパルス波治療器は、米国ソマティックス社のサイマトロン(Thymatron®)と呼ばれるものである(写真2)。
近年は、ECTの手順の標準化や安全性のさらなる向上のため、サイマトロンの使用にあたり、日本精神神経学会、日本生物学的精神医学会、日本総合病院精神医学会で行われる ECTトレーニングセミナーの受講が義務付けられ、使用法についても標準化されてきていることで、高齢者や身体合併症のある精神疾患患者にもECTがより安全に行われるようになっている。
作用機序
ECTの作用機序は未解明であるが、多くの研究が行われている。
ECTに関する脳画像研究では、単一光子放射断層撮影法(single photon emission tomography)、ポジトロン断層法(positron emission tomography)、磁気共鳴画像(magnetic resonance imaging)、磁気共鳴分光法(magnetic resonance spectroscopy)、定量脳波(quantitative electroencephalography)などによる多くの研究が行われている。
脳画像研究の知見からは、従来通電によるけいれん発作時は脳血流や脳代謝が増加し、発作後の数日間は逆にそれらが抑制されるなど、ECTによるけいれん発作の前後に脳血流や脳代謝の変化が起きることが知られていた。
ECTは、臨床的に治療回数を重ねるごとに、多くの患者にけいれん持続時間の減少やけいれん閾値の上昇(必要刺激用量の増大)を認めるようになる。これらの事象は、けいれんが起きることによって、抑制性神経伝達が促進されるためであると考えられる。近年の磁気共鳴分光法を用いた研究では、ECT後にγ-aminobutyric acid(GABA)の増加が示されており[13]、ECTの持つ抑制性神経伝達促進の背景として、脳内GABA輸送の増加と受容体刺激の増加が関係している可能性が指摘されている。
また、従来は抗うつ効果との関連から、ECTが神経伝達物質やその受容体へ与える影響や細胞内情報伝達系に与える影響が注目され、モノアミン、コルチゾール、副腎皮質刺激ホルモン、コルチコトロピン放出因子、甲状腺刺激ホルモン、プロラクチン、オキシトシン、バソプレッシン、デヒドロエピアンドロステロン硫酸エステル、腫瘍壊死因子α (tumor necrosis factor α, TNFα)等の生体内物質のECTによる変化が注目されてきた。
近年では、ECT後の血液中脳由来神経栄養因子 (brain-derived neurotrophic factor, BDNF)の増加が報告され[14]、ECTが神経細胞の可塑性、再生、維持に関わる神経栄養因子を強化し、海馬を主体とする内側側頭葉を中心として神経栄養効果を持つ可能性が指摘されるようになった[15]。うつ病患者ではメタ解析でもECT治療後のBDNFの増加が確認されており[16]、BDNF増加とHAM-D総得点減少が相関するという報告もある。また霊長類を対象にした動物実験では、ECTにより海馬での神経新生が促進されたことが報告されている[17]。
これらを踏まえた仮説としては、ECTが脳の異常な機能的結合を一度リセットして、病態に関連する脳領域で新しい健康的な機能的結合の生成を促進することで治療の有効性を発揮している[18]という仮説が提示されており、その機序としてはECTの前頭葉を主体とする抗けいれん作用による抑制性神経伝達の促進[19] [20]、内側側頭葉・海馬を主体とした神経栄養効果を介した細胞新生や神経回路成長促進への影響、及びその複合的要因[18] [19] [21]が示唆されている。
このようにECTの有効性における作用機序について、いくつかの仮説は提示されているものの、現在までECTの明確な作用機序は明らかにされていない。
適応と禁忌
適応
2015年米国米国精神医学会は「ECTは、安全かつ有効なエビデンスに基づく医療であり、適切に適応を選択された患者のために、適切な資格のある精神科医によって行われるとき、ECTは米国精神医学会によって支持される」という声明を発表している。
米国精神医学会によるECTの適応[8]は比較的幅広く、本邦においても2013年に日本精神神経学会ECT検討委員会および日本総合病院精神医学会ECT委員会によりまとめられ本橋らにより報告された「ECTの推奨事項改定版」[22]においても比較的幅広い適応となる診断と状況が記載されているが、英国国立医療技術評価機構(The National Institute of Health and Clinical Excellence, NICE)ガイドラインでは、ECTは重症うつ病、薬物治療抵抗性ないし重症躁病、またはカタトニア(緊張病)のみに用いられるべきであり、うつ病の予防のための長期治療や統合失調症の一般管理には用いられるべきではないとしている[23]。
また、まだ十分なエビデンスは確立しておらず研究的な一面が存在するものの、難治性強迫性障害、治療抵抗性で緊急性を要するパーキンソン病、身体疾患による精神障害、治療抵抗性悪性症候群、慢性疼痛の治療にも臨床的に用いられることがあり有効性を認めることがある。
臨床的には、適応となる診断とその症状特性や重症度などの状態像からECTの適応を判断することになる。
たとえば、うつ病はECTの主要な適応となる疾患であるが、軽症であれば基本的にECTが選択されることはない。ECTの一次的適応が考慮される状態として、食事摂取困難や拒食による低栄養・脱水が進行し生命にかかわる可能性がある場合、自殺企図など患者に生命の危険の差し迫った重篤な症状が存在し迅速な症状改善を要する場合など、抗うつ薬が効いてくるまでの時間的余裕がない場合にはECTの優先順位は高くなりECTは切り札的な治療として一次的に実施されることがある。また、薬物療法のリスクや催奇形性が問題となる妊娠、薬物忍容性の乏しい高齢者、薬物療法の副作用や身体合併症などから他の治療よりECTのほうが高い安全性があると個別に判断される場合もECTが考慮されることがある。
米国精神医学会によるECTの二次的な適応[8]としては、薬物療法への強い治療抵抗性があり遷延している場合、薬物治療の忍容性が低く十分な薬物療法が行えずECTの忍容性が優れる場合、薬物治療中の精神症状や身体状態の悪化により迅速で確実な治療反応が必要な場合などが挙げられており、薬物治療抵抗性または不忍容のうつ病、躁病、統合失調症でもECTの適応が検討されることがある。
統合失調症では、同様に治療抵抗性で生命にかかわるような緊張病や昏迷状態、精神症状による著しい焦燥感・興奮・錯乱がある場合、強い希死念慮がある場合等に適応が検討されることがある。
また、いずれの疾患でもECTが効果的であった過去の治療歴、患者本人のECTの希望は治療方針の決定において重要となる。
禁忌
米国精神医学会は、ECT導入に際しての絶対的禁忌はないとしながらも、リスクが増す状態として相対的禁忌を定義している[8]。
パルス波治療器であるサイマトロンの添付文書では、これらが反映され原則として禁忌となる疾患や状態として、
- 最近起きた心筋梗塞、不安定狭心症、非代償性うっ血性心不全、重度の心臓弁膜症のような不安定で重度の心血管系疾患
- 血圧上昇により破裂する可能性のある動脈瘤または血管奇形
- 脳腫瘍その他の脳占拠性病変により生じる頭蓋内圧亢進、
- 最近起きた脳梗塞
- 重度の慢性閉塞性肺疾患、喘息、肺炎のような呼吸器系疾患
- 米国麻酔学会水準4または5と評価される状態(ECTにより脳出血後まもない患者では再出血の危険性がある、発作による交感神経系の活性化に伴う血圧上昇、頻脈により最近起きた心筋梗塞患者では心室性不整脈や心破裂の危険性がある、修正型ECTは麻酔下において治療が行われるため麻酔危険度を設定する必要がある)
が挙げられている。
またECTとの併用禁忌として近年パーキンソン病治療などに用いられている深部脳刺激(deep brain stimulation: DBS)装置が埋め込まれている場合が挙げられている。
有効性とその特徴
各疾患への有効性
近年は精神科領域でもevidence-based medicineの観点から、各国で精神科治療アルゴリズムが作成され、治療抵抗性うつ病や重症うつ病へのECTの治療的位置付けが明確化されてきている。
うつ病に対するECTの効果のメタ解析では、プラセボ、模擬ECT、経頭蓋磁気刺激(transcranial magnetic stimulation: TMS)、抗うつ薬のいずれと比較しても、ECTの有効性が勝っていることが示されている[24] [25] [26] [27]。
各抗うつ薬との比較では、ECTと三環系抗うつ薬(tricyclic antidepressants : TCA)やモノアミン酸化酵素阻害剤 (monoamine oxidase inhibitors, MAOI)を比較した研究でTCAやMAOIよりECTの有効性が高いことが示されている。新規抗うつ薬とECTを比較した研究はまだ少ないが、Folkertsらによる治療抵抗性うつ病患者を対象としたECTと新規抗うつ薬のパロキセチンを比較した研究では、ECT群で59%、パロキセチン群で29% のうつ状態の改善を認め、ECT群でより高い反応率(71%でHAM-D総得点の50%減少)を認めている[28]。
薬物治療抵抗性うつ病に対しての有効性も確立しており[29] [30] [31]、抑うつ症状の改善に加えてECTが社会機能やQOLも改善させる[32]ことが報告されている。また、一般に抗うつ薬に対して治療反応の乏しい精神病像を伴う重症うつ病への有効性も報告されている[33] [34] [35]。
ECTは単極性うつ病、双極性うつ病の双方のうつ状態に有効であり、その寛解率はともにほぼ同等で約50%と報告されている[36]。Keitnerらのメタ解析[37]では、うつ病へのECTの反応率は53~80%、寛解率は27~56%と推定されている。ECTの施行方法が報告によって異なるため、有効性や有害事象に施行方法による差異が出やすく、有効率にばらつきが出ている[38]ことが指摘されている。
このようにECTは気分障害のうつ状態に対し高い有効性を持つが、同時に双極性障害の躁状態への有効性も知られている。躁状態への比較対照研究は少ないものの、ECTの抗躁効果は確立しており、Mckherjeeらは過去50年間にECTを施行された約600例の急性躁病患者の転機を調査し、約80%が著明改善または完全寛解したことを報告しており[39]、躁鬱混合状態への有効性も報告されている[40]。ECTが抗躁効果を示すためにはうつ状態より時間がかかり両側性でうつ病より多い治療回数が必要とされている[41]。
重症躁病や薬物治療抵抗性の遷延性躁状態ではECTの適応がある[42] [43]が、躁状態では意識障害、頭部外傷、HIV感染等の器質疾患のECT前の鑑別に十分な注意を要する。躁状態に対して施行する問題点としては、患者本人からの同意が得られにくいこと[44]、覚醒状態でECT施行室に搬送することが困難であることが挙げられる。
またECTはカタトニアへの高い効果も知られている。カタトニアを呈する疾患として、統合失調症の緊張病型がよく知られるが、カタトニアは様々な疾患で起きうる症候群であり、躁状態やうつ状態、抗NMDA受容体抗体脳炎などの器質性精神疾患[45]、自閉症スペクトラム障害[46]などでも起こりうる。カタトニアのロラゼパムでの寛解率は80~100%と高いため[45]、通常のカタトニアではロラゼパム等のベンゾジアゼピン系薬剤が優先して使用され、治療抵抗性の場合にECTが検討されるが、生命に危険の高い悪性緊張病ではECTは一時的治療選択になりうる[47]。5つの研究でのECTにおけるカタトニアの寛解率は82~96%と報告されており[45]、統合失調症、気分障害、統合失調感情障害、器質性精神障害を含む28例のカタトニアにECT[48]を行った研究では、93%が緊張病症状消失がみられ、特に気分障害におけるカタトニアの寛解率は96%と高かったと報告されている。自閉症スペクトラム障害に伴うカタトニア[46]や抗NMDA受容体抗体脳炎に伴うカタトニアへのECTの有効性の知見の蓄積はまだ乏しい。
統合失調症では前述のように緊張病症状を伴うものには著効することが多く、また精神運動興奮や昏迷を伴う場合も興奮や意思発動性低下が改善・軽減することが多い。一部のアルゴリズムには薬物治療抵抗性統合失調症の治療として、ECTが位置づけられるようになっているが、慢性的な幻覚妄想や陰性症状および認知機能低下には効果が乏しいことが多い。
早期の効果発現
ECTの効果発現の特徴として、発現が早いことがあげられる。
米国で行われた大規模臨床試験STAR*D研究(Systematic Treatment Alternatives to Relieve Depression)では、増強療法や併用療法を含めた薬物療法による最終段階までの累積寛解率は67%で、4段階の薬物治療戦略を試みても寛解に至らないうつ病が約3分の1存在することが示されている[49]。初回の抗うつ薬で改善したとしても、抗うつ薬の効果発現には十分量に増量後2~4週間かかり、一般的に寛解に至るには少なくとも4~8週間を必要とする。1剤目が無効や効果が乏しかった場合、次の薬剤選択を行い、再び同様に治療に時間がかかることになる。
一方、ECTについて、Folkertsらは、治療抵抗性うつ病患者でECTとparoxetineの効果発現の早さについて比較検討し、ECT群ではパロキセチン群と比較し、治療1週間後よりうつ状態の有意な改善を認めている[28]。
またHusainらはうつ病の患者に対し週3回のECTを施行し反応や寛解のスピードを検討したところ、54%が1週目3回目のセッションまでに治療反応がみられ、2週目6回目のセッションまでに34%が寛解し3-4週目10回目のセッションまでに65%が寛解したことを示している[50]。
国立精神神経センター病院うつストレスケア病棟に入院し、週2回の両側性修正型ECTを行った31名のうつ病患者での、うつ病評価尺度平均得点のECT回数による経時的な改善を(図1)に示す。
このようにECTは早期の症状改善効果を持ち、早急な抗うつ効果が必要とされる症例に有用であり、特に、深刻な自殺念慮があり自殺が切迫している状態の早期改善を要する場合[51]、精神症状から食事摂取が困難で栄養の維持が困難な場合、全身状態が悪化してきており早期の症状改善を要す場合等には、薬物療法より効果発現や寛解に至るまでが早いECTが選択されうる。ECTの迅速で高い治療効果は、医療経済の観点からも費用対効果比が高いことも示されている[52]。さらに、近年は麻酔として、低用量で抗うつ作用が報告されているケタミンを用いることによって、ECTの効果発現をさらに加速させる試みも行われている[53]。
効果の長期的維持に関する限界、維持薬物療法と維持ECT
ECTは高い急性期効果を示す一方で、継続療法を行わない場合は高い再燃率を示すことが知られている。 ECT後6ヶ月の間にうつ病の3分の1から約半数が再発し[54] [55]、1年以内の再燃率は30~60%と報告されており[56]、ECTによる急性期症状改善後にも、その後の再燃・再発を予防する維持薬物療法により再燃・再発率を減少させる必要がある[57]。ECT後再発のリスクファクターとしては、薬物治療への抵抗性や、精神病症状の合併、double depression(気分変調症にうつ病が重なること)などが報告されている[56]が、再燃予測因子は明確にはなっていない。
うつ病におけるECT後の再燃予防には、一般的に抗うつ薬やリチウムなどの気分安定薬による維持療法が行われる。維持薬物療法の種類によって再燃予防効果に差異があるかは明確になっていないが、うつ病ではいくつかの薬剤の優越性を示す研究が報告されている。
LauritzenらはECT後の維持療法としてプラセボとイミプラミン 、パロキセチンを比較し、6ヵ月以内の再燃はプラセボ群65%に対し、イミプラミン群30%、パロキセチン群10%で、維持療法の薬剤により差を認めたことを報告している[58]。
ECT施行前に効果を認めなかった薬剤は維持療法としての効果も乏しいという報告[56]がある一方で、van den Broekらは、三環系抗うつ剤やリチウム、モノアミン酸化酵素阻害剤などの薬剤に治療抵抗性のある患者に対しECT施行後の維持療法としてイミプラミンを使用したRCTを行ったところ、24週後にプラセボ群は80%が再発したのに対して、imipramine群は18%で有意に再発率が低かったと報告しており[59]、ECTにより従前の治療抵抗性が改善する可能性も示されている。またSackeimらは、ECT施行後6ヶ月後にプラセボ群では84%が再発したのに対して、ノルトリプチリン群は60%、ノルトリプチリンとリチウム併用群が39%と有意に低く、抗うつ薬の単剤投与よりリチウムの併用が維持療法として有効であったことを報告している[57]。
また、ECTにより急性期症状が寛解した後の維持療法として、安全にECTを行うことができる環境がある場合に限って、薬物療法に加えて、もしくは単独で、間隔を空けつつ、継続してECTが行われることがある。
一般的に、症状寛解に達してから再燃予防を目的に実施される6ヶ月以内の治療は継続ECT(continuation ECT)、再発予防を目的に行われる6ヶ月以上にわたる治療は維持ECT(maintenance ECT)と呼ばれる。
継続・維持ECTの目的は、定期的な低頻度のECTを行うことで症状の寛解状態を保つことであり、ECTの治療反応性が良く、薬物療法や認知行動療法などの心理社会的治療に抵抗性または忍容性が低いために再燃・再発を繰り返す症例に適している。
維持ECTは、症状寛解後、最初は1週間に1回からはじめ、4回行ったところで症状が再燃しなければ、徐々に4週間に1回まで間隔を広げていく方法[60]が良く用いられており、初めの1ヶ月は週に1回、次の1~2ヶ月は2週に1回、それ以後は月に1回で継続する[61] [62]。継続・維持ECTでの治療中に再燃・再発の兆候がみられた場合は、維持ECTの予定を早めることで対応が可能である。
Kellerらはうつ病の維持療法として、維持継続ECT群と、ノルトリプチリン、ノルトリプチリンとリチウムの併用をした薬物療法群とを比較した研究[61]を行い、6ヶ月後、維持ECT群では46.1%、薬物療法群では46.3%が寛解を維持し、プラセボ群に比べ有意に再燃率が低かったことを示している。
Gagneらは、急性期にECTを使用し寛解に至った治療抵抗性うつ病患者に対して、維持ECTと薬物療法の併用群と薬物療法単独群とを比較する後ろ向き症例対照研究[63]を行い、抗うつ薬と維持ECTの併用群での寛解維持率は2年後、5年後それぞれ93%、73%と良好であったが、抗うつ薬単独群では52%、18%と低かったことを示した。この研究においては、維持ECT群の方が過去の薬物療法抵抗性レベルが高かったが、維持ECT群のほうが抗うつ薬単独群よりも高い寛解維持率を示していた。
Navarro らは、急性期にECTが有効であった高齢者の精神病像を伴う治療抵抗性うつ病患者に対し、維持ECTとノルトリプチリンの併用群とノルトリプチリン単独群を比較し、2年目の時点で、併用群では65%が、ノルトリプチリン群では29%が寛解を維持し、60歳以上の高齢者でも併用群が薬物療法単独群より有効で有害な副作用は認めなかったことを示している[62]。これらの結果からは維持ECTを行う場合でも、薬物療法を併用した方が寛解を維持できる可能性が高いことが示唆された。
Frederikseらは、維持ECTの有効性についてまとめて、抗うつ薬の効果が不十分な場合などではECT維持継続を行うことを推奨している[64]。APAガイドラインや本邦でも継続・維持ECTに関する適応基準[8] [22] [65]が示されているが、一度継続・維持ECTに導入すると、定期的なECTのための入院加療を要し、またECT治療からの離脱が困難となるため、安易な維持ECT導入は避け、症例ごとに十分に適応を判断しインフォームドコンセントを行い慎重に適応を検討することが望ましい。
脳波上の発作とECTの効果に影響を与える実施方法
ECTの効果は電流通電そのものの効果ではなく、脳波上の発作を誘発することに起因している。パルス波治療器でのECTは標準的施行方法では約8秒間の通電を行い、通電により脳神経細胞の脱分極を生じさせ、全般発作が誘発される。脳波上の発作はてんかんの強直間代けいれんの脳波に類似し、発作初期は、多棘波と低電位速波が出現し、徐々に全体に高電位多棘徐波が律動的に出現する(写真3)。発作が終了すると脳波は一時的に平坦化し発作後抑制期に移行する。ECTクール終了後1ヶ月程度の全般性の徐波化を認めることがあるが通常は徐々に正常化する。
ECTの治療効果につながる有効な脳波上の発作の性質は、規則的で対称性の高振幅棘徐波、良好な発作後抑制(脳波平坦化)、一定以上の発作時間(運動発作20秒または脳波上の発作25秒以上、65歳以上ではそれぞれ15秒と20秒)があり、参考事項として心拍、血圧の急上昇など交感神経系の興奮があげられている[22]。発作時間に関しては25秒以上のけいれん誘発は必須とされる一方で、けいれん時間と効果は比例しないことが分かっており、むしろ十分な効果のあるエネルギー量ではけいれん時間は減少することが多いため、脳波上の発作がより長ければ効果的というわけではない。
この発作誘発の実施方法により、ECTの効果は影響を受ける。ECTの効果に影響を与える主要な実施方法での因子としては、刺激強度(最大刺激の何%で刺激するか)、電極配置部位(両側性か右片側性か)、治療波の波形(サイン波かパルス波か)がある。
刺激強度は高いほど効果があるが、副作用である認知機能障害を起こす確率は高くなる[66]。
初回治療の刺激強度の設定方法には、半年齢法(加齢により発作閾値が上昇するため例えば60歳であれば30%など年齢の半分程度の電気量で初回の通電を行う)と閾値滴定法(徐々に刺激強度を上げてけいれん閾値を決定してからさらに刺激強度を上げて通電する)がある。発作閾値は、サイマトロンでは最大用量の100%に対して何%の設定にするかで定義される脳波上の全般けいれんを起こすための最小限の電気用量であるが、臨床的効果のある発作を起こすためには両側性では閾値の1.5~2.5倍、右片側性ではより高い閾値の2.5~6倍が必要である。本邦では、発作閾値の滴定は行わず半年齢法による刺激強度で開始し、発作波の質や治療効果、治療継続に伴うけいれん閾値の上昇を鑑みて漸次調整していくことが多い。
電極配置は、両側性と片側性があり、両側性の場合は左右半球に通電され、片側性の場合は通常右半球に行われ右半球だけに通電されるが、共に通電による脳全体の発作誘発が可能である。両側性の方が片側性よりも効果が高いとする報告が多く、現在は世界的に両側性ECTが主流を占める。しかし十分な刺激用量での右片側性ECTは両側性と比較し効果に差がなく、認知機能への影響が少ないのでより望ましいという報告もある[67]。 波形については、パルス波刺激とサイン波刺激の両者で効果に有意な差を認めなかったとするメタ解析があるが[66]、ECT麻酔薬として良く用いられているチオペンタールなどのバルビツレート系麻酔薬はもちろん、プロポフォールなどの非バルビツレート系麻酔薬も少なからず抗けいれん作用を持ち、パルス波治療器の普及とともに、パルス波治療器の最大刺激電流量を用いても脳波上のけいれん波が誘発されない症例が少なからず存在することが分かってきた。バルビツレート系麻酔薬であるメトヘキシタールでECTを受けた患者の15%は最大刺激強度を必要とし、最大刺激強度でもその中の33%は発作持続時間が足りないか、不発であったという報告がある[68]。このような症例では内服している抗けいれん作用のあるベンゾジアゼピンや抗けいれん薬の見直し、フルマゼニルのECT通電前の使用、ECT通電前の過換気、ケタミン麻酔などへの変更[69]などを考慮する必要がある。
副作用
致死的副作用
ECTによる最も重篤な副作用は死亡であり、その死亡率についていくつかの検討が行われた[70] [71] [72] [73]。
現在のECT治療による死亡率は概ね5~8万治療回数に1回程度の頻度で非常にまれで[8] [10] [22]、これは小規模な外科手術や歯科麻酔の危険率にほぼ相当し、ECTは安全な治療法とされる。もし1クールで計5~8回の治療を受けると仮定すると、1クールを施行することでの死亡リスクは1万クールに1回程度と推測される。
近年の研究でもECT治療1日以内での死亡は10万治療回数に2.4回と低いが、事故や自殺を含むECTとの因果関係のない全ての死亡も含めた14日以内の死亡は10万治療回数に18回と報告[74]されており、ECT中のみならずECT後も慎重な精神・身体症状の管理と医療安全管理を要することが示唆される。
主な死因はけいれん直後や回復期の心血管系合併症[75] [76]や嘔吐に伴う窒息[77]によると考えられ、ECT前のリスク評価や絶食などのECT前管理の徹底が重要となる。
また修正型ECTにて通電1分後よりwide QRS頻拍が出現し、リドカインの投与で頻拍が停止せず直流通電により停止させた症例[78]も報告されており、緊急時の対応を想定しておき、ECT処置室には除細動器などの準備が必要である。
心血管系合併症
通電中と通電直後には、通電による迷走神経の直接刺激から副交感神経が優位となり、発作中は交感神経が、発作終了後には再び副交感神経優位となる。通電直後の副交感神経優位状態では徐脈、洞停止、血圧低下が、発作中の交感神経優位状態では頻脈・高血圧が、発作終了後には再び徐脈や不整脈が一過性に出現しやすい。このような短時間の内に急激に生じる生理学的変化に対して、ECT中は麻酔科医による呼吸循環モニターと全身管理が必要になる。また、ECT中の徐脈性不整脈、血圧低下、口腔内分泌の増大などの副交感神経反応を抑制するためには、抗コリン薬である硫酸アトロピンの麻酔導入直前の静脈内投与が有用なことがある。高血圧症合併症のある患者では朝の降圧剤を服用し、必要に応じてジルチアゼム、ニカルジピン等のカルシウム拮抗薬をECT直前か直後に静注し管理する。特に従来からの心血管系合併症を持つ患者では死亡例も報告されており、十分な管理が必要である。
認知機能障害
ECTの副作用として出現する認知機能障害には発作後錯乱、発作間せん妄、健忘がある[79]。
発作後錯乱(発作後せん妄)は、通常ECT麻酔覚醒後数分以内に簡単な従命や会話が可能となるところ、ECT麻酔覚醒時に数分から数時間の精神運動性興奮や失見当識を伴う錯乱状態を示すもので、安心できる声かけや静かな環境でのリカバリーが重要である。発作後錯乱ではリカバリー時の慎重な観察と安全管理を要すが、著しく興奮が強い場合は、静脈麻酔薬の再投与やミダゾラム、ジアゼパム等のベンゾジアゼピンの追加投与が必要となる場合がある。
発作間せん妄は、各ECT治療の間の期間にせん妄状態を呈すものであるが、一般的には治療終了とともに速やかに消失する。ECTの継続が望ましい場合は、治療間隔をあける、刺激用量を下げる、右片側性に変更するなどの対策をとるか、やむを得ない場合は抗精神病薬などによるせん妄治療を行う必要がある。
健忘は前向性健忘と逆行性健忘があり、共にECT終了後数日から数週で消失することが多いが、前向性健忘は速やかに回復するのに対し、逆行性健忘は回復に比較的時間がかかることがあり、時にECT治療中や開始直前の記憶は欠けたままのこともある。逆行性健忘は、ECT施行前に全般的な認知機能障害を伴う場合や、ECT施行直後の失見当識の持続時間が長いほど起こりやすいとされる[80]。また、エピソード記憶より意味記憶のほうが、遠隔記憶より近時記憶のほうが障害されやすい[81]ことが知られている。
認知機能障害の頻度は、片側性より両側性が、刺激強度が低用量より高用量の方が、パルス波よりサイン波の方が、頻度が高いとされる[26] [82]。その他、治療回数が多い、治療間隔が短い、患者年齢が高いことは認知機能障害のリスクの増加に関連する。
認知機能障害が出現した時は、治療の中断、両側性から右片側性への電極配置の変更、治療頻度の引き下げ、治療有効性を損ねない程度の刺激強度の引き下げ、認知障害に関与している併用薬剤の見直し等の対策[8] [10] [60]が行われることが望ましい。
記憶障害はECT中の低酸素とも関係があり、ECT刺激前の十分な酸素化が重要である[83]。またケタミン麻酔は神経保護作用を持ち認知機能障害を低減する可能性が示唆されている[84] [85]。
認知機能障害はECT経過中に生じやすいが、一方でECTを終了後約2週間経過した時の認知機能は、治療前よりも改善している、という報告[86]もある。うつ病の精神運動抑制による認知機能障害は、ECTによるうつ症状の改善とともに回復するため、疾患の症状とECTの副作用を鑑別しなければならない。
副作用としての認知障害を正しく評価するためには、ECT前の認知症などの認知機能障害の合併を把握しておく必要があり、ECT施行前の脳画像評価と認知機能評価が重要である。
ECTの反復施行により認知機能障害が進行するのかという懸念があったが、現在では否定的と考えられており[87]、MRIやCTを用いたECTによる脳構造への障害についてのメタ解析でも、脳構造への障害は示されていない[83]。
またサイン波治療器で100回以上の両側性修正型ECTを受けた8名の患者とECTとECTを受けたことのない患者の比較研究では、認知機能に有意な差はなかったと報告されている[88]。
その他の合併症
ECTの通電直後のその他の副作用として、遷延性けいれん、けいれん重積、遷延性無呼吸が、ECTからの覚醒後に出現し数時間持続することがある副作用として、頭痛、筋肉痛、嘔気がある[8] [10] [79]。
遷延性けいれんは、通常2分未満で終了するけいれんが2分以上[8]ないし3分以上[60]続く場合で、筋弛緩薬により運動成分が目立たない場合は脳波モニターで判断する。テオフィリンなどのけいれん誘発物質やリチウムの使用、電解質異常、1回の治療内での複数回の刺激、若年者、初回治療(投与電気量が不明)などではより出現しやすいとされる。処置としては、マスク換気での酸素投与を続け、麻酔薬を追加するか抗けいれん作用のあるミダゾラムやジアゼパム等を静脈内投与する。
遅発性けいれんは稀であり、ECT終了後の自発的なけいれんの頻度は一般人口と差がないとされる。
遷延性無呼吸は、サクシニルコリンの代謝障害などに関連するまれな副作用である。患者の自発呼吸が回復し安定するまでの間のマスク換気や気管内挿管が必要となる。
頭痛は、ECT後約半数弱が自覚する最も頻度の多い副作用で、側頭筋や咬筋の通電による収縮や脳循環動態変化による疼痛と考えられ、非ステロイド系消炎鎮痛剤を用いる。
筋肉痛は通電による筋肉の収縮やサクシニルコリンによる筋線維束攣縮によると考えられる。ほとんどが一過性であるが、持続性のものではサクシニルコリンの量を減量するか、筋弛緩薬をベクロニウムなどに変更する。
嘔気は、麻酔薬、けいれん発作、手動換気時に胃内に流入した空気による胃内圧上昇などの影響によると考えられ、嘔気が強い場合はメトクロプラミド、ドンペリドンや制吐作用のあるフェノチアジン系抗精神病薬を使用する。
歯科的損傷は、咬筋の収縮、人工換気、バイトブロックの挿入により起こりうる。ECTの術前検査として口腔内診察を行い、ぐらつきの強い歯や孤立した尖った歯がある場合は麻酔科医や歯科にコンサルトする必要がある。また咬傷の予防にバイトブロックを使用することが重要である。
うつ状態に対するECT治療中に躁転が出現することがある[89]。この場合、ECTの抗躁効果を期待してさらにECTを継続する場合と、ECTを終了し躁状態に対する薬物療法を行う場合がある。ただし躁転は、ECT後の軽度の意識障害による脱抑制との鑑別が難しいことがあり、認知機能や脳波の評価が重要である。
修正型ECTの実際
同意
精神医学的病歴および過去の治療抵抗性と現在の精神症状の十分な評価に基づき、ECT適応の判断が慎重に行われその適応が確認された場合、ECTが実施できる全身状態を確認し、患者および家族へのインフォームドコンセントを行う。
ECTのインフォームドコンセントに関し、2005年世界保健機関(WHO)は、ECTは患者本人からのインフォームドコンセント、あるいは同意能力の欠如が明らかな場合は保護者からのインフォームドコンセントを得た場合のみに使用されるべきであると勧告しており、これらが欠如した状態でECTを施行してはならない。
手術同意と同様に文書を用いて、本人および保護者に口頭で説明し、署名による同意を得る。医療保護入院や措置入院等で本人に同意能力がない場合は、保護者に説明して同意を得ることになるが、病状の回復とともに同意能力が回復した場合には、本人にも十分な説明をすることが望ましい。
説明すべき重要な点には、臨床経過とECTの適応理由、現在の状態に対するECTの想定される有効性と限界、ECT以外の代替治療の可能性、ECT後の薬物療法などの継続治療の必要性、ECTの手順、副作用および生命への危険性とその際の緊急的処置と行動制限の可能性、同意撤回の自由がある。
前日までの術前検査・前処置
術前検査として、既往歴やアレルギーの問診、内科学的診察、口腔や歯科的診察、神経学的診察、簡単な認知機能検査に加え、血算・一般生化学検査、心電図、胸腹部レントゲン、頭部画像検査、脳波検査を行い、既往歴や合併症に応じてさらに追加検査を実施する。麻酔科医による問診と麻酔リスク評価を行っておく。
またECT導入前には内服している向精神薬を調整しておく必要がある。
リチウムに関しては、APAガイドライン[8]はリチウムとECTは併用しないように推奨している。安全にリチウムとECTを併用できるという報告も存在するため明確な禁忌ではないが、ECTとの併用でサクシニルコリンの作用延長による遷延性無呼吸の可能性が指摘され、ECT後の認知機能障害やせん妄の増加、遷延性発作やセロトニン症候群などの発生が報告されていることからECT前に中止し、ECTクール終了後必要であれば再開することが望ましい。抗てんかん薬やベンゾジアゼピン系薬剤は、ECTとの併用禁忌ではないが抗けいれん作用によりけいれんを生じにくくし発作不発や不適切な脳波上のけいれんを招きやすくするためECT前に漸減中止することが望ましい。
また嘔吐による誤嚥や窒息を予防するため、ECT治療開始の少なくとも6時間前からの固形物の中止、少量の水と必要な薬物以外の2時間前からの中止が推奨[22]されており、例えば午前中施行する場合は前日夜から、午後に施行する場合は当日朝からの絶食とするなどの処置の徹底が必要である。当日朝薬は降圧剤など必要最小限に留め、必要に応じて施行前に胃酸の誤嚥防止のためH2ブロッカーなどの制酸剤内服等を行う。
パスル波治療器での修正型ECTの手順
ECTを施行するためには、精神科関連学会の推奨事項[22]を参照し、ECT施行施設ごとにマニュアルを作成し各施設内でのECT手順が標準化されている必要がある。
ECT施行場所は修正型ECTの普及とともに、手術室やECT専用ユニット(写真4)で実施される施設が一般的となっており、ECT専用ユニットでは、ECT前室、ECT処置室、ECTリカバリー室などが設置されることがある。ECT処置室には、100%酸素で陽圧換気が行うことのできる麻酔器、バイタルサイン、心電図、酸素飽和度の自動モニター、ECT治療器、気管内挿管や万一の急変時に備える除細動器などが配置されている。
当日は、手術に準じた本人確認、ECT同意書の確認、前処置が適切に行われたかの確認を行い、病棟で排尿とバイタルサインの測定、バイトブロックや換気で危険を伴うと予測される口腔内異物や歯の再確認、義歯・コンタクトレンズ・貴金属装飾品などを装着していないかの確認を行ってから、ストレッチャーでECT処置室へ移動する。
ECT処置室では、精神科医師、麻酔科医師、看護師が協働しそれぞれの処置を行う。
乳酸リンゲル液などを用いて静脈ルートを確保し、呼吸循環モニターのため血圧計、心電図電極、パルスオキシメーターを装着しバイタルサインや酸素飽和度を確認し、通電後の発作を確認するためパルス波治療器の脳波電極、筋電図電極を装着する。
通電刺激電極シール(サイマパッド)を装着する電極配置予定部位の皮膚は生理食塩水で湿らせたガーゼで良く拭いて乾かし、同部に通電を行うためのサイマパッドを付着させる。サイマトロンのセルフテストで静的インピーダンスの適切性(3000Ω以上では熱傷の可能性があり通電ができない)を確認し、脳波、筋電図が適切に記録されるか確認する。刺激強度であるサイマトロンの%を症例にあわせて設定しておく。サイマトロンでは、パルス幅、周波数の刺激変数の設定も可能だが、通常はプリセットされている刺激プログラムで行なわれている。
麻酔科医は、100%酸素による十分な酸素投与を行いながら、麻酔導入を開始し、短時間作用型のチオペンタールやプロポフォール等の静脈麻酔薬を投与して麻酔導入を行い、必要に応じて副交感神経反応抑制のための硫酸アトロピンの静脈投与を行う。麻酔効果出現後、マスク換気などの人工換気に切り替え、サクシニルコリンまたはベクロニウム等の筋弛緩薬を投与し、サクシニルコリンを用いた場合では筋線維束攣縮の出現を確認する。筋弛緩と十分な酸素化が確認された後、咬傷の予防のためマウスガード(バイトブロック)を口内に挿入し、口腔内での安全な固定を確認する。
再度インピーダンスが3000Ω以下であることを確認してから、一時的に人工換気を中断し、精神科医が通電ボタンを押し通電を開始する。通電終了後、サイマトロンによる自動的な脳波記録が開始され、麻酔科医は人工換気を再開する。
運動性のけいれんと脳波上のけいれん(写真3)を確認し、けいれんの持続時間と波形の適切性を確認する。運動性のけいれんは、筋弛緩作用のため軽微かほぼ認めないこともあるが、片下肢にターニケットを巻いて実施することで筋電図上のけいれんを計測することができる。
通電後は、麻酔科医は十分なマスク換気での酸素投与の継続とともに、交感神経、副交感神経反応による脈拍や血圧変化等の全身反応に対し必要な処置を行う。
筋弛緩薬と静脈麻酔薬の効果が消失し、自発呼吸再開後、十分な酸素投与を継続し、バイタルサインの正常化、簡単な会話など意識レベルの回復を確認したのち、ECT回復室にストレッチャーで移動する。意識レベルやバイタルサインが安定していることを確認した後に医師や看護師が付き添い酸素投与を継続しながら病棟に戻る。
病棟に帰棟後も慎重なバイタルサインと意識状態の観察を要すが、通常1時間程度で、酸素投与は終了し静脈留置針を抜去する。嚥下状態や歩行状態を確認し、問題がなければ、服薬や食事を再開し、ベッド上安静を解除する。
通常ECTは週に2回ないし3回の頻度で行い、一連の治療セッション(1クール)は6~10回、最大12回行われる。完全な寛解が得られるか、過去数回の治療で効果が頭打ちになったところでECTを中止する。
ECTを取り巻く課題と今後
従来型ECTは過去には電気ショック療法と呼ばれ、社会的な負のイメージが強かった。その背景には、薬物療法が開発される以前の時代から薬物療法の黎明期にかけて、適応を選ばないECTの乱用が少なからずあったと考えられることや、十分なインフォームドコンセントを得ずにECTが行われていた経緯がある。
1975年に米国で公開された映画「カッコーの巣の上で」( One Flew Over the Cuckoo's Nest)には、精神病院入院中の患者に従来型ECTが行われ強直間代けいれんする様子や患者側の恐怖が描かれており、この時代のECTはインフォームドコンセントが十分でなく、ECTを病院が患者の管理手段として乱用していた傾向があったことは否めない。
また、本邦でも松本昭夫の手記「精神病棟の二十年」[90]に、1960年代の精神病院の無麻酔でのサイン波治療器でのECTの様子が描写されている。
現在は、米国APAをはじめ各国の精神科学会や多くの精神科医が、「適切な適応の患者に十分なインフォームドコンセントを行い、トレーニングされた精神科医が適切な方法で行うECTはエビデンスに基づく治療である」と考えている。未だ様々な領域でECTへの反対意見を持つ人は少なからずおり、一部の精神科医もECTに対して否定的な態度を示す場合があるが、治療ガイドラインに位置づけられている重要な治療法であることから、状況に応じて治療の一選択肢として患者に提示することは医師として必要であろう。
ECTは従来型ECTから修正型ECTへ、そしてパルス波治療器を用いたECTへと発展してきており、現在のECTは、静脈麻酔薬の使用、筋弛緩薬の使用、ECT中の十分な酸素化と呼吸循環モニターの使用が標準的になってきている。しかし、本邦での課題として、修正型ECTおよびパルス波治療器の普及がまだ不十分であることがあげられる。 1991年に中島らにより行われたECTに関する精神神経学会に所属する精神科医への全国アンケート調査[91]では、約4割の精神科医が現在ECTを実施していたが、修正型ECTを施行している精神科医は15%程度で、インフォームドコンセントの取得も不十分であった。
1997年~1999年に本橋らが行った、大学病院・国立病院を対象にしたアンケート調査[92]では、65%の施設でECTが行われ、修正型ECTを行っている施設は80%であったが、修正型ECTのみを行っている施設は33%で、約3分の2の施設で従来型ECTが用いられていた。また本調査では大学病院・国立病院へのアンケート調査で調査対象が本邦の精神科医療機関を網羅しておらず、従来型ECTの正確な使用割合は不明であった。
2009年に日本精神神経学会精神科専門医制度研修施設を対象に行われた一瀬らの調査[93]では、ECTを行っている施設は40%で、修正型ECTのみを実施している施設は37.9%、静脈麻酔薬は使用するが筋弛緩薬は使用しないECTを行っている施設は44.9%で、静脈麻酔薬も使用しないECTを行っている施設も3.7%存在していた。
治療器に関しては、パルス波治療器のみを使用している施設は24%で、パルス波とサイン波治療器の双方を使用している施設は20.8%、サイン波治療器のみを使用している施設は51%だった。
修正型ECTは麻酔科医の配置や手術室に準じた施設が必要となるために限られた医療機関でしか行えない治療であり、地域の精神病院と麻酔科医の配置が可能な総合病院との医療連携強化の必要性が指摘されている[93]。
これらの調査からは、修正型ECTが行われる割合やパルス波治療器が用いられる割合は年々増加しているものの、本邦での普及はまだ不十分であると言わざるを得ず、ECTの標準化は以前からの大きな課題であったことから各関連学会がECT講習会を定期的に開催し均てん化が行われている。
臨床的な課題としては、先述した100%での刺激強度でも発作が不発または発作不十分な症例が存在することがある。現在は、手技的な工夫や麻酔薬の変更などの個々の施設の工夫で対処されているが、ECTを必要とし希望している患者に対し臨床的効果のあるECTを提供できない場合があり解決が求められている。
また、これも先述したとおり、ECTによる急性期症状改善後の長期的効果維持に関する限界があり、ECTによる急性期症状改善後の再燃・再発を予防する最適な維持療法についての模索も大きな課題となっている。
研究面におけるECTにおける最大の課題は先述したECTの作用機序である。ECT前後での脳画像研究、生体内物質の変化、遺伝子発現の変化など、作用機序について世界各国で研究がされているが、未だ作用機序は未解明のままである。ECTの作用機序を解明することは、うつ病の本質的な病態の解明につながる可能性もあり非常に重要な課題である。
ECTのアクセシビリティの課題としては、ECTは現在のところ入院治療による管理が必要であり、継続・維持ECT施行の際もその都度入院管理が必要となるため、アクセシビリティが良いとは言えず、今後アクセシビリティの高い外来ECTを行うことが特に安全面において可能であるかという検討が求められる。
ECTの発展形として直接的に電気を用いないけいれん療法も提案されてきている。磁気によってけいれんを誘発し認知機能障害がより少ないとされる磁気けいれん療法(magnetic seizure therapy: MST)や焦点を絞った通電が可能となるfocal electrically administered seizure therapy(FEAST)などが開発され研究段階にある。
参考文献
- ↑
Fink, M. (1984).
Meduna and the origins of convulsive therapy. The American journal of psychiatry, 141(9), 1034-41. [PubMed:6147103] [WorldCat] [DOI] - ↑
Baran, B., Bitter, I., Ungvari, G.S., & Gazdag, G. (2012).
The birth of convulsive therapy revisited: a reappraisal of László Meduna's first cohort of patients. Journal of affective disorders, 136(3), 1179-82. [PubMed:22230354] [WorldCat] [DOI] - ↑
CERLETTI, U. (1950).
Old and new information about electroshock. The American journal of psychiatry, 107(2), 87-94. [PubMed:15432756] [WorldCat] [DOI] - ↑ 安河内五郎、向笠広次
精神分離症の電撃痙攣療法について
福岡医大誌 1939 ;32:1437-1440 - ↑ Bennet AE
Preventing traumatic complications in convulsive therapy by curare.
JAMA 1940 ; 114 :322-324 - ↑
HOLMBERG, G., & THESLEFF, S. (1952).
Succinyl-choline-iodide as a muscular relaxant in electroshock therapy. The American journal of psychiatry, 108(11), 842-6. [PubMed:14923897] [WorldCat] [DOI] - ↑ 島薗安雄、森温理、徳田良仁
電撃療法時におけるSuccinylcholine Chloride (S. C. C.)の使用経験
脳と神経 1958 ; 10 : 183-193 - ↑ 8.00 8.01 8.02 8.03 8.04 8.05 8.06 8.07 8.08 8.09 8.10 American Psychiatric Association
Task Force on Electroconvulsive therapy : The Practice of Electroconvulsive therapy : Recommendations for Treatment, Training, and Privileging 2nd.
APA 2001 - ↑ Royal College of Psychiatrists
The ECT Handbook : The Second Report of the Royal College of Psychiatrists’
Special Committee on ECT, Royal College of Psychiatrists, London 1995 - ↑ 10.0 10.1 10.2 10.3 本橋伸高
ECTマニュアル~科学的精神医学を目指して
医学書院 2000 - ↑
Weaver, L.A., Ives, J.O., Williams, R., & Nies, A. (1977).
A comparison of standard alternating current and low-energy brief-pulse electrotherapy. Biological psychiatry, 12(4), 525-43. [PubMed:889985] [WorldCat] - ↑
Squire, L.R., & Zouzounis, J.A. (1986).
ECT and memory: brief pulse versus sine wave. The American journal of psychiatry, 143(5), 596-601. [PubMed:3963246] [WorldCat] [DOI] - ↑
Bajbouj, M., Lang, U.E., Niehaus, L., Hellen, F.E., Heuser, I., & Neu, P. (2006).
Effects of right unilateral electroconvulsive therapy on motor cortical excitability in depressive patients. Journal of psychiatric research, 40(4), 322-7. [PubMed:16137698] [WorldCat] [DOI] - ↑
Marano, C.M., Phatak, P., Vemulapalli, U.R., Sasan, A., Nalbandyan, M.R., Ramanujam, S., ..., & Regenold, W.T. (2007).
Increased plasma concentration of brain-derived neurotrophic factor with electroconvulsive therapy: a pilot study in patients with major depression. The Journal of clinical psychiatry, 68(4), 512-7. [PubMed:17474805] [WorldCat] [DOI] - ↑
Taylor, S.M. (2008).
Electroconvulsive therapy, brain-derived neurotrophic factor, and possible neurorestorative benefit of the clinical application of electroconvulsive therapy. The journal of ECT, 24(2), 160-5. [PubMed:18580563] [WorldCat] [DOI] - ↑
Rocha, R.B., Dondossola, E.R., Grande, A.J., Colonetti, T., Ceretta, L.B., Passos, I.C., ..., & da Rosa, M.I. (2016).
Increased BDNF levels after electroconvulsive therapy in patients with major depressive disorder: A meta-analysis study. Journal of psychiatric research, 83, 47-53. [PubMed:27552533] [WorldCat] [DOI] - ↑
Perera, T.D., Coplan, J.D., Lisanby, S.H., Lipira, C.M., Arif, M., Carpio, C., ..., & Dwork, A.J. (2007).
Antidepressant-induced neurogenesis in the hippocampus of adult nonhuman primates. The Journal of neuroscience : the official journal of the Society for Neuroscience, 27(18), 4894-901. [PubMed:17475797] [PMC] [WorldCat] [DOI] - ↑ 18.0 18.1
Farzan, F., Boutros, N.N., Blumberger, D.M., & Daskalakis, Z.J. (2014).
What does the electroencephalogram tell us about the mechanisms of action of ECT in major depressive disorders? The journal of ECT, 30(2), 98-106. [PubMed:24810774] [WorldCat] [DOI] - ↑ 19.0 19.1
Mann, J.J. (1998).
Neurobiological correlates of the antidepressant action of electroconvulsive therapy. The journal of ECT, 14(3), 172-80. [PubMed:9773356] [WorldCat] - ↑
Abbott, C.C., Gallegos, P., Rediske, N., Lemke, N.T., & Quinn, D.K. (2014).
A review of longitudinal electroconvulsive therapy: neuroimaging investigations. Journal of geriatric psychiatry and neurology, 27(1), 33-46. [PubMed:24381234] [PMC] [WorldCat] [DOI] - ↑
Bolwig, T.G. (2014).
Neuroimaging and electroconvulsive therapy: a review. The journal of ECT, 30(2), 138-42. [PubMed:24800687] [WorldCat] [DOI] - ↑ 22.0 22.1 22.2 22.3 22.4 22.5 本橋伸高、粟田主一、一瀬邦弘ほか
電気けいれん療法(ECT)推奨事項 改訂版
精神神経学雑誌 115: 586-600, 2013. - ↑ NICE
Guidance on the use of electroconvulsive therapy
Technology appraisal guidance [TA59]
Published date: 26 April 2003 Last updated: 01 October 2009 - ↑
Janicak, P.G., Davis, J.M., Gibbons, R.D., Ericksen, S., Chang, S., & Gallagher, P. (1985).
Efficacy of ECT: a meta-analysis. The American journal of psychiatry, 142(3), 297-302. [PubMed:3882006] [WorldCat] [DOI] - ↑
Pagnin, D., de Queiroz, V., Pini, S., & Cassano, G.B. (2004).
Efficacy of ECT in depression: a meta-analytic review. The journal of ECT, 20(1), 13-20. [PubMed:15087991] [WorldCat] - ↑ 26.0 26.1
UK ECT Review Group (2003).
Efficacy and safety of electroconvulsive therapy in depressive disorders: a systematic review and meta-analysis. Lancet (London, England), 361(9360), 799-808. [PubMed:12642045] [WorldCat] [DOI] - ↑
Micallef-Trigona, B. (2014).
Comparing the effects of repetitive transcranial magnetic stimulation and electroconvulsive therapy in the treatment of depression: a systematic review and meta-analysis. Depression research and treatment, 2014, 135049. [PubMed:25143831] [PMC] [WorldCat] [DOI] - ↑ 28.0 28.1
Folkerts, H.W., Michael, N., Tölle, R., Schonauer, K., Mücke, S., & Schulze-Mönking, H. (1997).
Electroconvulsive therapy vs. paroxetine in treatment-resistant depression -- a randomized study. Acta psychiatrica Scandinavica, 96(5), 334-42. [PubMed:9395150] [WorldCat] [DOI] - ↑
Avery, D., & Lubrano, A. (1979).
Depression treated with imipramine and ECT: the DeCarolis study reconsidered. The American journal of psychiatry, 136(4B), 559-62. [PubMed:426143] [WorldCat] - ↑
Husain, S.S., Kevan, I.M., Linnell, R., & Scott, A.I. (2004).
Electroconvulsive therapy in depressive illness that has not responded to drug treatment. Journal of affective disorders, 83(2-3), 121-6. [PubMed:15555704] [WorldCat] [DOI] - ↑
van den Broek, W.W., de Lely, A., Mulder, P.G., Birkenhäger, T.K., & Bruijn, J.A. (2004).
Effect of antidepressant medication resistance on short-term response to electroconvulsive therapy. Journal of clinical psychopharmacology, 24(4), 400-3. [PubMed:15232331] [WorldCat] [DOI] - ↑
Huang, C.J., Huang, Y.H., & Lin, C.H. (2017).
Factors Related to the Changes in Quality of Life for Patients With Depression After an Acute Course of Electroconvulsive Therapy. The journal of ECT, 33(2), 126-133. [PubMed:27668944] [WorldCat] [DOI] - ↑
Buchan, H., Johnstone, E., McPherson, K., Palmer, R.L., Crow, T.J., & Brandon, S. (1992).
Who benefits from electroconvulsive therapy? Combined results of the Leicester and Northwick Park trials. The British journal of psychiatry : the journal of mental science, 160, 355-9. [PubMed:1562861] [WorldCat] [DOI] - ↑
O'Leary, D., Gill, D., Gregory, S., & Shawcross, C. (1995).
Which depressed patients respond to ECT? The Nottingham results. Journal of affective disorders, 33(4), 245-50. [PubMed:7790678] [WorldCat] [DOI] - ↑
Sobin, C., Prudic, J., Devanand, D.P., Nobler, M.S., & Sackeim, H.A. (1996).
Who responds to electroconvulsive therapy? A comparison of effective and ineffective forms of treatment. The British journal of psychiatry : the journal of mental science, 169(3), 322-8. [PubMed:8879718] [WorldCat] [DOI] - ↑
Dierckx, B., Heijnen, W.T., van den Broek, W.W., & Birkenhäger, T.K. (2012).
Efficacy of electroconvulsive therapy in bipolar versus unipolar major depression: a meta-analysis. Bipolar disorders, 14(2), 146-50. [PubMed:22420590] [WorldCat] [DOI] - ↑
Keitner, G.I., Ryan, C.E., & Solomon, D.A. (2006).
Realistic expectations and a disease management model for depressed patients with persistent symptoms. The Journal of clinical psychiatry, 67(9), 1412-21. [PubMed:17017828] [WorldCat] [DOI] - ↑
Lisanby, S.H. (2007).
Electroconvulsive therapy for depression. The New England journal of medicine, 357(19), 1939-45. [PubMed:17989386] [WorldCat] [DOI] - ↑
Mukherjee, S., Sackeim, H.A., & Schnur, D.B. (1994).
Electroconvulsive therapy of acute manic episodes: a review of 50 years' experience. The American journal of psychiatry, 151(2), 169-76. [PubMed:8296883] [WorldCat] [DOI] - ↑
Devanand, D.P., Polanco, P., Cruz, R., Shah, S., Paykina, N., Singh, K., & Majors, L. (2000).
The efficacy of ECT in mixed affective states. The journal of ECT, 16(1), 32-7. [PubMed:10735329] [WorldCat] - ↑ Grunze H, Erfurth A, Schafer M et al
Elektrokonvulsiontherapie in der Behandlung der schweren Manie: Kasuistik und Wissensstand
Nervenarzt, 70 : 662-667, 1999 - ↑
Kanba, S., Kato, T., Terao, T., Yamada, K., & Committee for Treatment Guidelines of Mood Disorders, Japanese Society of Mood Disorders, 2012 (2013).
Guideline for treatment of bipolar disorder by the Japanese Society of Mood Disorders, 2012. Psychiatry and clinical neurosciences, 67(5), 285-300. [PubMed:23773266] [WorldCat] [DOI] - ↑
Malhi, G.S., Tanious, M., & Berk, M. (2012).
Mania: diagnosis and treatment recommendations. Current psychiatry reports, 14(6), 676-86. [PubMed:22986995] [WorldCat] [DOI] - ↑
Miller, M.C. (1995).
ECT and mania. The American journal of psychiatry, 152(4), 654. [PubMed:7694934] [WorldCat] [DOI] - ↑ 45.0 45.1 45.2
Fink, M., & Taylor, M.A. (2009).
The catatonia syndrome: forgotten but not gone. Archives of general psychiatry, 66(11), 1173-7. [PubMed:19884605] [WorldCat] [DOI] - ↑ 46.0 46.1
DeJong, H., Bunton, P., & Hare, D.J. (2014).
A systematic review of interventions used to treat catatonic symptoms in people with autistic spectrum disorders. Journal of autism and developmental disorders, 44(9), 2127-36. [PubMed:24643578] [WorldCat] [DOI] - ↑
Sienaert, P., Dhossche, D.M., Vancampfort, D., De Hert, M., & Gazdag, G. (2014).
A clinical review of the treatment of catatonia. Frontiers in psychiatry, 5, 181. [PubMed:25538636] [PMC] [WorldCat] [DOI] - ↑
Rohland, B.M., Carroll, B.T., & Jacoby, R.G. (1993).
ECT in the treatment of the catatonic syndrome. Journal of affective disorders, 29(4), 255-61. [PubMed:8126312] [WorldCat] [DOI] - ↑ 岡本長久 坂本広太 長房裕子
Star-D研究から得られるもの―アメリカでのうつ病のsequential treatmentを知る
精神科治療学 23巻3,4号2008年 - ↑
Husain, M.M., Rush, A.J., Fink, M., Knapp, R., Petrides, G., Rummans, T., ..., & Kellner, C.H. (2004).
Speed of response and remission in major depressive disorder with acute electroconvulsive therapy (ECT): a Consortium for Research in ECT (CORE) report. The Journal of clinical psychiatry, 65(4), 485-91. [PubMed:15119910] [WorldCat] [DOI] - ↑
Kellner, C.H., Fink, M., Knapp, R., Petrides, G., Husain, M., Rummans, T., ..., & Malur, C. (2005).
Relief of expressed suicidal intent by ECT: a consortium for research in ECT study. The American journal of psychiatry, 162(5), 977-82. [PubMed:15863801] [PMC] [WorldCat] [DOI] - ↑
Greenhalgh, J., Knight, C., Hind, D., Beverley, C., & Walters, S. (2005).
Clinical and cost-effectiveness of electroconvulsive therapy for depressive illness, schizophrenia, catatonia and mania: systematic reviews and economic modelling studies. Health technology assessment (Winchester, England), 9(9), 1-156, iii-iv. [PubMed:15774232] [WorldCat] - ↑
Okamoto, N., Nakai, T., Sakamoto, K., Nagafusa, Y., Higuchi, T., & Nishikawa, T. (2010).
Rapid antidepressant effect of ketamine anesthesia during electroconvulsive therapy of treatment-resistant depression: comparing ketamine and propofol anesthesia. The journal of ECT, 26(3), 223-7. [PubMed:19935085] [WorldCat] [DOI] - ↑
Martiny, K., Larsen, E.R., Licht, R.W., Nielsen, C.T., Damkier, P., Refsgaard, E., ..., & Danish University Antidepressant Group (DUAG*) (2015).
Relapse Prevention in Major Depressive Disorder After Successful Acute Electroconvulsive Treatment: a 6-month Double-blind Comparison of Three Fixed Dosages of Escitalopram and a Fixed Dose of Nortriptyline - Lessons from a Failed Randomised Trial of the Danish University Antidepressant Group (DUAG-7). Pharmacopsychiatry, 48(7), 274-8. [PubMed:26529118] [WorldCat] [DOI] - ↑
Moksnes, K.M. (2011).
Relapse following electroconvulsive therapy. Tidsskrift for den Norske laegeforening : tidsskrift for praktisk medicin, ny raekke, 131(20), 1991-3. [PubMed:22016123] [WorldCat] [DOI] - ↑ 56.0 56.1 56.2
Bourgon, L.N., & Kellner, C.H. (2000).
Relapse of depression after ECT: a review. The journal of ECT, 16(1), 19-31. [PubMed:10735328] [WorldCat] - ↑ 57.0 57.1
Sackeim, H.A., Haskett, R.F., Mulsant, B.H., Thase, M.E., Mann, J.J., Pettinati, H.M., ..., & Prudic, J. (2001).
Continuation pharmacotherapy in the prevention of relapse following electroconvulsive therapy: a randomized controlled trial. JAMA, 285(10), 1299-307. [PubMed:11255384] [WorldCat] [DOI] - ↑
Lauritzen, L., Odgaard, K., Clemmesen, L., Lunde, M., Ohrström, J., Black, C., & Bech, P. (1996).
Relapse prevention by means of paroxetine in ECT-treated patients with major depression: a comparison with imipramine and placebo in medium-term continuation therapy. Acta psychiatrica Scandinavica, 94(4), 241-51. [PubMed:8911559] [WorldCat] [DOI] - ↑
van den Broek, W.W., Birkenhäger, T.K., Mulder, P.G., Bruijn, J.A., & Moleman, P. (2006).
Imipramine is effective in preventing relapse in electroconvulsive therapy-responsive depressed inpatients with prior pharmacotherapy treatment failure: a randomized, placebo-controlled trial. The Journal of clinical psychiatry, 67(2), 263-8. [PubMed:16566622] [WorldCat] [DOI] - ↑ 60.0 60.1 60.2 Kellner CH, Pritchett JT, Beale MD et al
Handbook of ECT.
American Psychiatric Press, Washington DC, 1997 - ↑ 61.0 61.1
Kellner, C.H., Knapp, R.G., Petrides, G., Rummans, T.A., Husain, M.M., Rasmussen, K., ..., & Fink, M. (2006).
Continuation electroconvulsive therapy vs pharmacotherapy for relapse prevention in major depression: a multisite study from the Consortium for Research in Electroconvulsive Therapy (CORE). Archives of general psychiatry, 63(12), 1337-44. [PubMed:17146008] [PMC] [WorldCat] [DOI] - ↑ 62.0 62.1
Navarro, V., Gastó, C., Torres, X., Masana, G., Penadés, R., Guarch, J., ..., & Catalán, R. (2008).
Continuation/maintenance treatment with nortriptyline versus combined nortriptyline and ECT in late-life psychotic depression: a two-year randomized study. The American journal of geriatric psychiatry : official journal of the American Association for Geriatric Psychiatry, 16(6), 498-505. [PubMed:18515694] [WorldCat] [DOI] - ↑
Gagné, G.G., Furman, M.J., Carpenter, L.L., & Price, L.H. (2000).
Efficacy of continuation ECT and antidepressant drugs compared to long-term antidepressants alone in depressed patients. The American journal of psychiatry, 157(12), 1960-5. [PubMed:11097961] [WorldCat] [DOI] - ↑
Frederikse, M., Petrides, G., & Kellner, C. (2006).
Continuation and maintenance electroconvulsive therapy for the treatment of depressive illness: a response to the National Institute for Clinical Excellence report. The journal of ECT, 22(1), 13-7. [PubMed:16633200] [WorldCat] - ↑ 粟田主一
電気けいれん療法の適応.「適応となる診断」と「適応となる状況」
精神科治療学, 18:1267-1274,2003. - ↑ 66.0 66.1
UK ECT Review Group (2003).
Efficacy and safety of electroconvulsive therapy in depressive disorders: a systematic review and meta-analysis. Lancet (London, England), 361(9360), 799-808. [PubMed:12642045] [WorldCat] [DOI] - ↑
Sackeim, H.A., Prudic, J., Devanand, D.P., Nobler, M.S., Lisanby, S.H., Peyser, S., ..., & Clark, J. (2000).
A prospective, randomized, double-blind comparison of bilateral and right unilateral electroconvulsive therapy at different stimulus intensities. Archives of general psychiatry, 57(5), 425-34. [PubMed:10807482] [WorldCat] [DOI] - ↑
Krystal, A.D., Dean, M.D., Weiner, R.D., Tramontozzi, L.A., Connor, K.M., Lindahl, V.H., & Massie, R.W. (2000).
ECT stimulus intensity: are present ECT devices too limited? The American journal of psychiatry, 157(6), 963-7. [PubMed:10831477] [WorldCat] [DOI] - ↑
Krystal, A.D., Weiner, R.D., Dean, M.D., Lindahl, V.H., Tramontozzi, L.A., Falcone, G., & Coffey, C.E. (2003).
Comparison of seizure duration, ictal EEG, and cognitive effects of ketamine and methohexital anesthesia with ECT. The Journal of neuropsychiatry and clinical neurosciences, 15(1), 27-34. [PubMed:12556568] [WorldCat] [DOI] - ↑
Kramer, B.A. (1985).
Use of ECT in California, 1977-1983. The American journal of psychiatry, 142(10), 1190-2. [PubMed:3898873] [WorldCat] [DOI] - ↑
Kramer, B.A. (1999).
Use of ECT in California, revisited: 1984-1994. The journal of ECT, 15(4), 245-51. [PubMed:10614030] [WorldCat] - ↑
Abrams, R. (1997).
The mortality rate with ECT. Convulsive therapy, 13(3), 125-7. [PubMed:9342128] [WorldCat] - ↑
Shiwach, R.S., Reid, W.H., & Carmody, T.J. (2001).
An analysis of reported deaths following electroconvulsive therapy in Texas, 1993-1998. Psychiatric services (Washington, D.C.), 52(8), 1095-7. [PubMed:11474057] [WorldCat] [DOI] - ↑
Dennis, N.M., Dennis, P.A., Shafer, A., Weiner, R.D., & Husain, M.M. (2017).
Electroconvulsive Therapy and All-Cause Mortality in Texas, 1998-2013. The journal of ECT, 33(1), 22-25. [PubMed:27428480] [WorldCat] [DOI] - ↑
Ali, P.B., & Tidmarsh, M.D. (1997).
Cardiac rupture during electroconvulsive therapy. Anaesthesia, 52(9), 884-6. [PubMed:9349071] [WorldCat] [DOI] - ↑ Levin L, Wambold D, Viguera A et al.
Hemodynamic responses to ECT in a patient to critical aortic stenosis.
J ECT, 52 : 884-885, 1997 - ↑
Zhu, B.L., Ishida, K., Oritani, S., Fujita, M.Q., Maeda, H., Tanaka, T., & Tanaka, N. (1998).
Sudden death following psychiatric electroconvulsive therapy: a case report. Nihon hoigaku zasshi = The Japanese journal of legal medicine, 52(2), 149-52. [PubMed:9711067] [WorldCat] - ↑ 小田切 史徳、関田 学、小松 さやか、杉原 匡美、平野 景子、小松 かおる、林 英守、戸叶 隆司、住吉 正孝、中里 祐二、代田 浩之
うつ病に対する修正型電気けいれん療法によって誘発されたwide QRS頻拍の1例
心臓 Vol. 44 (2012) No. SUPPL.2 p. S2_56-S2_62 - ↑ 79.0 79.1 Beyer JL, Weiner RD, Glenn MD
Electroconvulsive therapy. A programmed test 2 nd,
American Psychiatric Press, Washington DC, 1998 - ↑
Sobin, C., Sackeim, H.A., Prudic, J., Devanand, D.P., Moody, B.J., & McElhiney, M.C. (1995).
Predictors of retrograde amnesia following ECT. The American journal of psychiatry, 152(7), 995-1001. [PubMed:7793470] [WorldCat] [DOI] - ↑
Lisanby, S.H., Maddox, J.H., Prudic, J., Devanand, D.P., & Sackeim, H.A. (2000).
The effects of electroconvulsive therapy on memory of autobiographical and public events. Archives of general psychiatry, 57(6), 581-90. [PubMed:10839336] [WorldCat] [DOI] - ↑
Weiner, R.D., Rogers, H.J., Davidson, J.R., & Squire, L.R. (1986).
Effects of stimulus parameters on cognitive side effects. Annals of the New York Academy of Sciences, 462, 315-25. [PubMed:3458412] [WorldCat] [DOI] - ↑ 83.0 83.1
Devanand, D.P., Dwork, A.J., Hutchinson, E.R., Bolwig, T.G., & Sackeim, H.A. (1994).
Does ECT alter brain structure? The American journal of psychiatry, 151(7), 957-70. [PubMed:8010381] [WorldCat] [DOI] - ↑
McDaniel, W.W., Sahota, A.K., Vyas, B.V., Laguerta, N., Hategan, L., & Oswald, J. (2006).
Ketamine appears associated with better word recall than etomidate after a course of 6 electroconvulsive therapies. The journal of ECT, 22(2), 103-6. [PubMed:16801824] [WorldCat] - ↑
MacPherson, R.D., & Loo, C.K. (2008).
Cognitive impairment following electroconvulsive therapy--does the choice of anesthetic agent make a difference? The journal of ECT, 24(1), 52-6. [PubMed:18379336] [WorldCat] [DOI] - ↑
Semkovska, M., & McLoughlin, D.M. (2010).
Objective cognitive performance associated with electroconvulsive therapy for depression: a systematic review and meta-analysis. Biological psychiatry, 68(6), 568-77. [PubMed:20673880] [WorldCat] [DOI] - ↑
Barnes, R.C., Hussein, A., Anderson, D.N., & Powell, D. (1997).
Maintenance electroconvulsive therapy and cognitive function. The British journal of psychiatry : the journal of mental science, 170, 285-7. [PubMed:9229039] [WorldCat] [DOI] - ↑
Devanand, D.P., Verma, A.K., Tirumalasetti, F., & Sackeim, H.A. (1991).
Absence of cognitive impairment after more than 100 lifetime ECT treatments. The American journal of psychiatry, 148(7), 929-32. [PubMed:2053635] [WorldCat] [DOI] - ↑
Devanand, D.P., Sackeim, H.A., Decina, P., & Prudic, J. (1988).
The development of mania and organic euphoria during ECT. The Journal of clinical psychiatry, 49(2), 69-71. [PubMed:3338979] [WorldCat] - ↑ 松本昭夫
精神病棟の二十年―付・分裂病の治癒史
新潮文庫, 2001 ISBN 4062646897 - ↑ 中島一憲、山崎久美子、守屋裕文
「電気けいれん療法(ECT)をめぐる諸問題」についてアンケート調査
精神経誌95;537-554,1993 - ↑
Motohashi, N., Awata, S., & Higuchi, T. (2004).
A questionnaire survey of ECT practice in university hospitals and national hospitals in Japan. The journal of ECT, 20(1), 21-3. [PubMed:15087992] [WorldCat] - ↑ 93.0 93.1 一瀬 邦弘、鮫島 達夫、粟田 主一
わが国の電気けいれん療法(ECT)の現況 : 日本精神神経学会ECT検討委員会の全国実態調査から
精神神經學雜誌. 113, (9), pp. 939-951, 2011-09-25. 日本精神神経学会