Förster共鳴エネルギー移動
フェルスター共鳴エネルギー移動(FRET) 英:Förster resonance energy transfer 英略称:FRET、独:仏:
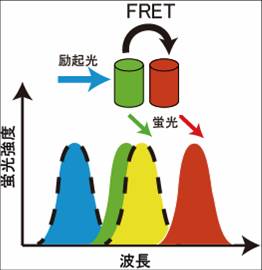
FRETは、1946年、Theodor Försterによって報告された現象である[1]。Donor となる蛍光体の蛍光スペクトルとAcceptorとなる蛍光体の励起スペクトルに重なりがあるときに、DonorからAcceptorへのエネルギー移動が起きる。蛍光を伴わないエネルギー移動であることから、FRETは、一般的にFluorescence resonance energy transferとして用いられるがFörster resonance energy transferが正しい。GFPの改良に伴うバイオイメージングの発展によって、FRETを基にした細胞内シグナル伝達分子の可視化検出に用いられ、脳神経研究においても、細胞、スライスなどの組織、個体レベルで応用されている。
原理
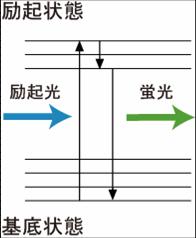
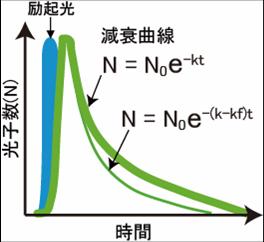
図1のヤブロンスキーダイヤグラムのように、Donorの蛍光団の電子が、励起光により基底状態から励起状態に励起される。励起された電子は、回転エネルギーや振動エネルギーを失いながら、励起状態の底まで行き着く。その後、基底状態に戻る際に、蛍光としてエネルギーを放出する。蛍光の減衰曲線は、速度定数をkとして、図2のように表すことができる。今、Donorの近傍(数nmオーダー)に、Donorの蛍光スペクトルと重なる励起スペクトルを持ったAcceptorが存在するとFRETが起きる(図3)。FRETの起きる速度をKfとすると、Donorの蛍光速度はK-Kfとなり、蛍光寿命の減少、Donorの蛍光強度の減少、Acceptorの蛍光の増加などが観察される。
FRETの速度定数Kfは、以下の式で規定される。
ここで、は、Donor蛍光の速度定数、はDonorの蛍光の量子収率、、は、DonorとAcceptorの双極子モーメントの相対的関係、はDonorとAcceptorの距離、N、はアボガドロ数、、は溶媒の屈折率、、は、規格化したDonorの発光強度、はAcceptorのモル吸光係数。
実際に、変数となりうるのは以下の性質である。
1.距離r。式が示すように距離の6乗に反比例する。FRET効率が50%になるときの距離を、フェルスター距離(Förster distance)という。
2.Donorの蛍光の遷移双極子モーメントとAcceptorの遷移励起光のための双極子モーメントの相対配向。フルオレセインなど、等方的に蛍光の放射が起きる場合には、=2/3であるが、GFPをはじめとした配向の定まった蛍光タンパク質などは、各々の値を取る。
検出
ドナーとアクセプターの蛍光強度を測定する方法
FRETが起きると、Donorの蛍光強度が減少し、Acceptorの蛍光強度が増加する。測定の際には蛍光強度の変化を測定することになるが、細胞などの試料においては、細胞の形状変化に伴う蛍光強度変化などが起きることから、実際にはドナーとアクセプターの蛍光強度のの変化を取得することによって、これらのファクターを除外する。
ドナーの蛍光寿命を測定する方法
近年、時間相関単一光子計数法とpulsing laserの相性の良さから、時間分解能の向上により、蛍光寿命を比較的短時間で取得することが可能となった。 蛍光寿命は、GFPおよびそのcolor variantタンパクでは、1-5 nsec、希土類錯体などは、1µsec、pyren coronenなどは、400, 200 nsecである。上述のように、FRETが起きると蛍光寿命を表す減衰曲線の傾きが変わる。これを基にFRETを観察する。
Anisotropyを測定する方法
一つの蛍光団のストークスシフトが小さい場合、励起スペクトルと蛍光スペクトルの重なりが大きい。このような蛍光団では、同一の蛍光団同士で、Homo-FRETが生じる。Homo-FRETは、蛍光強度および蛍光寿命は変化しないが、異方性が変わる。この原理を用いて、一般的には、分子同士のクラスターの度合いなどに応用されている。
神経科学分野への応用
1992年、緑色蛍光タンパク質(Green fluoresent protein: GFP)のクローニングに始まり、青色蛍光タンパク質CFP、黄色蛍光タンパク質YFPなどの開発以来、FRETは積極的に細胞内イメージングに取り入れられ始めた。1997年、宮脇、Tsienらによって、CFPおよびYFPを利用した、Calcium indicator, Cameleonが開発され[2]、さらに、cAMP, cGMP[3], リン酸化を初めとした主要な細胞内シグナル伝達子のFRETプローブが次々と作製され、細胞内の活性の局在などの解明に大きく貢献した。
脳神経分野においては、高雄、林らが、2000年初期に記憶の形成に必須なシグナル分子、カルシウムカルモデュリンキナーゼII (CaMKII)の活性化プローブ開発し分散培養系にてCaMkIIの可視化に成功した[4]。
1990年代後半、Svobodaらによって、2光子顕微鏡が脳神経科学に導入され、神経回路ネットワークを保持したスライスおよび個体の生きた脳の神経活動を観察可能になった。岡本、林らは、神経細胞の連結部位、シナプスのシナプス後膜(スパイン)において、その形態を制御するactinの重合を可視化するためのFRETプローブを開発した[5]。一方、脳のスライスにおいては、波長依存的な蛍光の吸収が生じるため、DonorとAcceptorの2波長を測定する蛍光強度比を測定するよりも、蛍光の散乱、吸収によって変化しない蛍光寿命測定法が導入された。安田、Svobodaらは、蛍光寿命測定を基に、スパインの構造的変化を誘導するRas,cdc42,RhoAなどのシグナル伝達分子の活性化の変化を観察することに成功している[6][7][8]。
個体においてもFRET測定法が導入されている。神経回路ネットワークにおけるシナプスの役割を解明する目的で、フェレットの大脳皮質視覚野にCaMKIIプローブを発現し、片眼剥奪によって、神経回路ネットワークに変化を起こした時のCaMKIIの活性化の変化を観測している[9]。また、神経活動をモニターする目的で、Knöfelらは、膜電位プローブVSFP2.3/2.42を開発し、マウスのヒゲ刺激の入力先であるbarrel cortexでの入力特異的な神経の活性化を観察している。
病態との関係では、神経細胞内のカルシウム濃度を測定するために、オレゴングリーンの蛍光寿命の変化から、カルシウム濃度を測定し、アストロサイトでのカルシウム濃度が、アルツハイマー様マウスと正常マウスで違うことが報告されている[10]。
Homo-FRETも応用されている。CaMKIIは12量体を形成しているが、異方性の変化を基に、その構造中にdimerの単位が存在し、活性化に伴うdimer同士の位置関係が変化することをvogelらが明らかにしている[11]。
将来展望
脳研究は、生きたままの状態の脳の神経細胞の活動を、広範囲で、より深部で観察したり、逆に神経細胞内の超微細構造を観察する方向に移るであろう。現在、FRETを基にしたin vivoイメージングは、応答の低さ、蛍光の弱さなどの難点はあるものの、蛍光タンパク質の蛍光強度や顕微鏡の性能の改良は日進月歩であり改善されていくであろう。また、神経活動に必要なシグナル伝達を同時に観察するために、マルチカラーイメージングの試みもなされるであろう。その際には、1つの蛍光の寿命を観察するFLIM測定が適している。
参考文献
- ↑
Förster, T. (2012).
Energy migration and fluorescence. 1946. Journal of biomedical optics, 17(1), 011002. [PubMed:22352636] [WorldCat] [DOI] - ↑
Miyawaki, A., Llopis, J., Heim, R., McCaffery, J.M., Adams, J.A., Ikura, M., & Tsien, R.Y. (1997).
Fluorescent indicators for Ca2+ based on green fluorescent proteins and calmodulin. Nature, 388(6645), 882-7. [PubMed:9278050] [WorldCat] [DOI] - ↑
Sato, M., Hida, N., Ozawa, T., & Umezawa, Y. (2000).
Fluorescent indicators for cyclic GMP based on cyclic GMP-dependent protein kinase Ialpha and green fluorescent proteins. Analytical chemistry, 72(24), 5918-24. [PubMed:11140757] [WorldCat] [DOI] - ↑
Takao, K., Okamoto, K., Nakagawa, T., Neve, R.L., Nagai, T., Miyawaki, A., ..., & Hayashi, Y. (2005).
Visualization of synaptic Ca2+ /calmodulin-dependent protein kinase II activity in living neurons. The Journal of neuroscience : the official journal of the Society for Neuroscience, 25(12), 3107-12. [PubMed:15788767] [PMC] [WorldCat] [DOI] - ↑
Okamoto, K., Nagai, T., Miyawaki, A., & Hayashi, Y. (2004).
Rapid and persistent modulation of actin dynamics regulates postsynaptic reorganization underlying bidirectional plasticity. Nature neuroscience, 7(10), 1104-12. [PubMed:15361876] [WorldCat] [DOI] - ↑
Lee, S.J., Escobedo-Lozoya, Y., Szatmari, E.M., & Yasuda, R. (2009).
Activation of CaMKII in single dendritic spines during long-term potentiation. Nature, 458(7236), 299-304. [PubMed:19295602] [PMC] [WorldCat] [DOI] - ↑
Harvey, C.D., Yasuda, R., Zhong, H., & Svoboda, K. (2008).
The spread of Ras activity triggered by activation of a single dendritic spine. Science (New York, N.Y.), 321(5885), 136-40. [PubMed:18556515] [PMC] [WorldCat] [DOI] - ↑
Murakoshi, H., Wang, H., & Yasuda, R. (2011).
Local, persistent activation of Rho GTPases during plasticity of single dendritic spines. Nature, 472(7341), 100-4. [PubMed:21423166] [PMC] [WorldCat] [DOI] - ↑
Mower, A.F., Kwok, S., Yu, H., Majewska, A.K., Okamoto, K., Hayashi, Y., & Sur, M. (2011).
Experience-dependent regulation of CaMKII activity within single visual cortex synapses in vivo. Proceedings of the National Academy of Sciences of the United States of America, 108(52), 21241-6. [PubMed:22160721] [PMC] [WorldCat] [DOI] - ↑
Kuchibhotla, K.V., Lattarulo, C.R., Hyman, B.T., & Bacskai, B.J. (2009).
Synchronous hyperactivity and intercellular calcium waves in astrocytes in Alzheimer mice. Science (New York, N.Y.), 323(5918), 1211-5. [PubMed:19251629] [PMC] [WorldCat] [DOI] - ↑
Thaler, C., Koushik, S.V., Puhl, H.L., Blank, P.S., & Vogel, S.S. (2009).
Structural rearrangement of CaMKIIalpha catalytic domains encodes activation. Proceedings of the National Academy of Sciences of the United States of America, 106(15), 6369-74. [PubMed:19339497] [PMC] [WorldCat] [DOI]