「Gタンパク質共役型受容体」の版間の差分
細 (→Gαシグナリング) |
細 (→パルミトイル化) |
||
| 48行目: | 48行目: | ||
=== パルミトイル化 === | === パルミトイル化 === | ||
多くのGタンパク質共役型受容体では7番目の膜貫通領域直近のC末端側領域に存在する保存されたシステイン残基が | 多くのGタンパク質共役型受容体では7番目の膜貫通領域直近のC末端側領域に存在する保存されたシステイン残基が[[パルミトイル化|S-パルミトイル化]]修飾を受ける。S-パルミトイル化修飾とは[[wj:飽和脂肪酸|飽和脂肪酸]]である[[wj:パルミチン酸|パルミチン酸]]( C<sub>16</sub>H<sub>32</sub>O<sub>2</sub>)がシステイン残基の[[wj:チオール基|チオール基]]に[[wj:チオエステル結合|チオエステル結合]]で付加される可逆的な修飾であり、細胞質側に存在する[[DHHCタンパク質]]ファミリーを介する<ref><pubmed> 20168314 </pubmed></ref>。多くはC末端領域に1~3個のパルミトイル化修飾が見つかっておりパルミトイル化されたC末端領域は新たな細胞内ループを形成する。パルミトイル化修飾によるGタンパク質共役型受容体の機能調節は多岐に渡り、各受容体によって異なるが、受容体の成熟、[[細胞質膜]]へ発現や輸送、Gタンパク質との結合への影響、[[脱感作]]や[[インターナリゼーション]]に関与することが報告されている<ref><pubmed> 19131499 </pubmed></ref>。 | ||
=== リン酸化 === | === リン酸化 === | ||
2016年1月20日 (水) 23:07時点における版
足立 直子、齋藤 尚亮
神戸大学バイオシグナル研究センター
DOI:10.14931/bsd.2332 原稿受付日:2016年1月19日 原稿完成日:2016年月日
担当編集委員:河西 春郎(東京大学 大学院医学系研究科)
英:G protein-coupled receptor 英略称:GPCR 独:G-Protein gekoppelten Rezeptors 仏:récepteur couplé aux protéines G
同義語:7回膜貫通型受容体 (seven transmembrane receptor)
類義語:代謝活性型受容体 (metabotropic receptor)、 代謝型受容体、代謝調節型受容体
代謝活性型受容体とは真核細胞の細胞質膜上もしくは、細胞内部の構成膜上に存在する受容体の一種。神経伝達物質と結合し細胞内に情報伝達を引き起こす受容体には、大きく分けてイオンを直接透過させるイオンチャネル型受容体と代謝活性型受容体の二つがある。ここでは代謝活性型受容体のうち三量体Gタンパク質と共役し細胞内に情報を伝達するGタンパク質共役型受容体(Gタンパク質共役型受容体)に焦点を絞り説明する。(編集部コメント:Gタンパク質共役型受容体に項目名を変えましたので、それに絞った抄録を御記述頂けないでしょうか。1段落程度でお願いいたします。)
Gタンパク質共役型受容体とは
Gタンパク質共役型受容体は別名7回膜貫通型受容体と言われるように、7つのαへリックス構造が細胞質膜を貫通し、N末端は細胞外にC末端領域は細胞内に位置する。細胞外からの様々なシグナル(神経伝達物質、ホルモン、化学物質、光等)を受容すると、Gタンパク質共役型受容体は構造変化を起こし、細胞質側に結合している三量体Gタンパク質に対してグアニンヌクレオチド交換因子(GEF)として働く。
GDP型からGTP型へと変換されたGタンパク質は、つづいて効果器の活性を変化させることで、細胞外シグナルが細胞内へと伝達される。現在使用されている薬剤のおよそ40%がGタンパク質共役型受容体を標的としており、Gタンパク質共役型受容体の機構解明に大きく貢献したBrian K. KobilkaとRobert J. Lefkowitzが2012年にノーベル化学賞を共同受賞した[1]。
分類
ヒトでは800種以上のGタンパク質共役型受容体が見つかっており、その半数は感覚(嗅覚、味覚、視覚、フェロモン)に対する受容体である。残りの半数の内、3分の2はその他の様々な生理機能(神経系、内分泌系)に関与し、3分の1は生理的なリガンドが不明もしくは機能不明なオーファン受容体(orphan receptor)である[2]。これまでに様々な方法で分類が試みられているが、ここでは代表的なクラスの概要を説明する。
クラス A: ロドプシン様受容体
N末端の細胞外領域が比較的短く、複数個の膜貫通領域によってリガンド結合部位が形成される。全Gタンパク質共役型受容体の85%を占める古典的なGタンパク質共役型受容体であり、ロドプシン、アドレナリン受容体、ムスカリン性アセチルコリン受容体、嗅覚受容体などを含む。クラスA受容体はさらにリガンドの種類によってA1-A19のサブグループに分けられている。
クラス A のGタンパク質共役型受容体に保存されているアミノ酸配列として3つ目の膜貫通領域の細胞質側に位置するE/DRY(Asp/Glu, Arg, Tyr)モチーフがある。ロドプシンの結晶構造解析により、E/DRYモチーフのアルギニン(塩基性アミノ酸)は6番目の膜貫通領域の細胞質側に位置する保存された酸性アミノ酸(グルタミン酸/アスパラギン酸)と非共有結合(イオンロック;ionic lock)を作り、不活性型の構造を取ることが報告されている。これらの受容体ではE/DRYモチーフに変異を加えると恒常的に活性化状態を示す。一方で、恒常的活性化状態をとらない受容体も存在し、リガンド結合の変化、Gタンパク質シグナルの変化等を示す受容体も存在するが、E/DRYモチーフが受容体の機能に需要なのには変わりない[3][4]。
クラス B: セクレチン様受容体
N末端側の細胞外領域が長くリガンド結合部位を形成する。セクレチン様とAdhesion型Gタンパク質共役型受容体の2つのサブグループに分けられる。セクレチン様受容体にはセクレチン、グルカゴン、グルカゴン様ペプチド(GLP)、カルシトニン、副甲状腺ホルモン等のペプチドホルモンに結合する受容体がある。一方で、Adhesion型Gタンパク質共役型受容体は巨大なN末端部位に様々なドメイン構造を持ち細胞外マトリックスとの相互作用が示唆されているが、その多くはリガンドが不明である[5]。
クラス C: 代謝型グルタミン酸受容体
代謝型グルタミン酸受容体の他に、GABAB受容体、カルシウム感知受容体、味覚受容体がこのクラスに含まれる。N末端側の細胞外領域にVenus flytrap(VFT)ドメインを持ち[6]、さらに、GABAB受容体以外はシステインリッチ(CRD)ドメイン構造を持つ[7]。細胞外領域に結合する生理的リガンド(orthosteric ligand)に加えて、膜貫通領域部位に結合し受容体の活性状態を変化させるアロステリックリガンド(allosteric ligand)を持つ受容体も報告されている[8]。
クラス F: Frizzled/Smoothened
Wntシグナルを活性化するFrizzledとヘッジホッグシグナルを活性化するSmoothenedが含まれる。
翻訳後修飾による調節
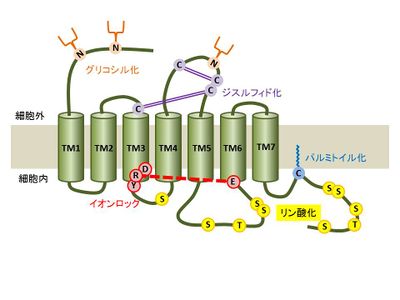
Gタンパク質共役型受容体は細胞質膜を貫通する7つのαへリックス構造をもち、N末端側が細胞外にC末端側が細胞内に存在し、3つの細胞外ループ(Extracellular loop; ECL1/2/3)と3つの細胞内ループ(Intracellular loop; ICL1/2/3)を持つ。数多くの翻訳後修飾によるGタンパク質共役型受容体の機能調節が報告されており、以下に代表的なものをあげる。ただし、800種以上あるGタンパク質共役型受容体の中には例外も存在する。
糖鎖修飾
多くのGタンパク質共役型受容体のN末端領域と細胞外ループは糖鎖修飾を受ける。最もよく知られているのがN型グリコシル化で受容体タンパク質の合成過程において粗面小胞体でオリゴ糖トランスフェラーゼによって付加される。N型グリコシル化のコンセンサス配列はAsn-X-Ser/Thr(XはPro以外のアミノ酸)であり、アスパラギン(Asn)に修飾を受ける[9]。多くのクラスAのGタンパク質共役型受容体では1~複数個の、クラスB及びクラスCのGタンパク質共役型受容体ではそれより多くの糖鎖修飾付加が報告されており[10][11]、細胞質膜上への発現や輸送、リガンドとの結合、Gタンパク質との結合[12]等への影響が報告されている。
ジスルフィド結合
クラスAのGタンパク質共役型受容体ではN末端細胞外領域と細胞外ループに、クラスBやクラスCでは細胞外領域のドメイン内部において2つのシステイン残基間の共有結合(S-S結合)が複数存在する。ジスルフィド結合は小胞体でタンパク質ジスルフィドイソメラーゼを介して行われ、受容体の構造の安定化、細胞外ドメインの形成、リガンドの結合等に関与する[13]。
パルミトイル化
多くのGタンパク質共役型受容体では7番目の膜貫通領域直近のC末端側領域に存在する保存されたシステイン残基がS-パルミトイル化修飾を受ける。S-パルミトイル化修飾とは飽和脂肪酸であるパルミチン酸( C16H32O2)がシステイン残基のチオール基にチオエステル結合で付加される可逆的な修飾であり、細胞質側に存在するDHHCタンパク質ファミリーを介する[14]。多くはC末端領域に1~3個のパルミトイル化修飾が見つかっておりパルミトイル化されたC末端領域は新たな細胞内ループを形成する。パルミトイル化修飾によるGタンパク質共役型受容体の機能調節は多岐に渡り、各受容体によって異なるが、受容体の成熟、細胞質膜へ発現や輸送、Gタンパク質との結合への影響、脱感作やインターナリゼーションに関与することが報告されている[15]。
リン酸化
多くのGタンパク質共役型受容体は細胞内ループと細胞質側に位置するC末端側領域にリン酸化修飾を受けるセリン、スレオニン残基を持つ。リガンドと結合した受容体はGタンパク質または、他の結合タンパク質を介して下流にシグナルを伝達し、活性化したタンパク質リン酸化酵素(タンパク質リン酸化酵素A;PKA、タンパク質リン酸化酵素C;PKC、Gタンパク質共役型受容体キナーゼ;GRK等)によりリン酸化修飾される。
一般的にリン酸化された受容体は構造変化、もしくは、βアレスチンと結合することでGタンパク質との結合を阻害されGタンパク質を介したシグナルは収束し脱感作する。また、βアレスチンと結合した受容体はクラスリンと結合しエンドサイト―シスによって細胞質膜上より取り除かれる。
一つの受容体は、通常複数のリン酸化酵素によって複数の部位にリン酸化修飾を受け、これはリガンドの種類や活性化時間、組織・細胞種によっても大きく異なる。リン酸化修飾を介した受容体の機能調節は多岐に渡り、一か所のリン酸化修飾ではその調節機能の説明が難しく、リン酸化修飾パターンを「バーコード」として認識するモデルが提唱されている[16][17]。
その他
その他にもGタンパク質共役型受容体は多彩な翻訳後修飾が報告されており、ユビキチン化による受容体の分解や細胞内輸送、SUMO化による受容体の安定性の向上等がある。
Gタンパク質共役型受容体シグナル経路
Gタンパク質シグナリング
Gタンパク質共役型受容体に共役しているGタンパク質はα、β、γの三つのサブユニットの複合体であり、βとγサブユニットは常に複合体で挙動する。Gタンパク質共役型受容体が不活性状態であるとき、Gタンパク質は三量体Gαγβとして存在しGαはGDPと結合しており不活性型をとる。Gタンパク質共役型受容体にリガンドが結合し活性化すると、GαはGDPをより高濃度に存在するGTPへ交換し、さらにGβγから解離し活性型となる。解離したGαとGβγはそれぞれの効果器にシグナルを伝える。GαはGTPアーゼ活性を持つため結合したGTPは時間経過と共にGDPに加水分解される。GDP型GαはGβγと再結合し不活性状態三量体Gαγβへと戻る。
Gαシグナリング
Gαには多くの組織に分布する4つのサブクラス(Gαs、Gαi/o、Gαq/11、Gα12/13)と、感覚器に特異的に発現するGαolf(嗅覚ニューロン)、Gαt(トランスデューシン;視細胞網膜桿体・錐体外節)、Gαgust(ガストデューシン;味細胞)がある。下記にアドレナリン受容体とヒスタミン受容体の例をあげているが、このように同じリガンドで活性化される同ファミリー受容体においても、共役するGαタンパク質の違いが細胞応答の違いを生み出す。
| ファミリー | 名称 | 効果器 | 共役する受容体の例 |
|---|---|---|---|
| Gs ファミリー |
Gαs | アデニル酸シクラーゼを活性化させ細胞内のcAMP濃度を上昇させる。 | β1/2/3アドレナリン受容体、ヒスタミンH2受容体 |
| Gαolf | アデニル酸シクラーゼを活性化させ細胞内のcAMP濃度を上昇させる。 | 嗅覚受容体 | |
| Gi/o ファミリー | Gαi/o | アデニル酸シクラーゼの活性を抑制する。 | α2アドレナリン受容体、ヒスタミンH3/4受容体 |
| Gαt | ホスホジエステラーゼを活性化しcGMPの濃度を減少させる | ロドプシン | |
| Gαgust | ホスホジエステラーゼを活性化する。 | 味覚受容体 | |
| Gq/11 ファミリー | Gαq/11 | ホスホリパーゼCを活性化しジアシルグリセロールの産生とIP3を介したCa2+の上昇を引き起こす。 | α1アドレナリン受容体、ヒスタミンH1受容体 |
| G12/13 ファミリー | Gα12/13 | 細胞骨格、細胞間結合などに関与する。 |
Gβγシグナリング
Gβγと結合したGαはGDPとの親和性が上がることから、Gβγの第一の機能はGαβγ三量体を不活性状態に保つことだと考えられる。一方で、Gαi/oと共役するGタンパク質共役型受容体ではGβγのシグナル伝達が重要となる。Gi/oはGsやGqと比較して細胞内に高濃度で存在するため、Gαi/o共役型Gタンパク質共役型受容体が活性化すると放出されるGβγの量は多くなる。GβγはGαi/o共役型Gタンパク質共役型受容体の下流でGタンパク質活性化カリウムチャネル(GIRKチャネル)やP/Q型とN型電位依存性カルシウムチャネル、さらにはホスホリパーゼC、PI3キナーゼなどを活性化することが知られている。
Gタンパク質非依存的シグナリング
リガンド刺激により活性化し細胞内領域をリン酸化された受容体は、βアレスチン1/2と結合することで、
- Gタンパク質シグナルが収束し、
- エンドサイト―シスにより細胞外リガンドのアクセスを阻害する。
一般的にはこの状態を脱感作というが、細胞内小胞に乗った受容体はβアレスチンを介してGタンパク質非依存的に下流にシグナルを伝達する。例えば、β2アドレナリン受容体、アンジオテンシン1a受容体、P2Y2受容体、CB1受容体ではβアレスチンを介してERK1/2(Extracellullar signal-regulated kinase)の経路を活性化する[18]。
関連項目
- ロドプシン
- アドレナリン受容体
- ドーパミン受容体
- GABA受容体
- アデノシン受容体
- セロトニン受容体
- ムスカリン性アセチルコリン受容体
- ヒスタミン受容体
- カルシウム感知受容体
- 嗅覚受容体
- セクレチン受容体
- 三量体Gタンパク質
参考文献
- ↑
Clark, R.B. (2013).
Profile of Brian K. Kobilka and Robert J. Lefkowitz, 2012 Nobel laureates in chemistry. Proceedings of the National Academy of Sciences of the United States of America, 110(14), 5274-5. [PubMed:23412332] [PMC] [WorldCat] [DOI] - ↑
Isberg, V., Mordalski, S., Munk, C., Rataj, K., Harpsøe, K., Hauser, A.S., ..., & Gloriam, D.E. (2016).
GPCRdb: an information system for G protein-coupled receptors. Nucleic acids research, 44(D1), D356-64. [PubMed:26582914] [PMC] [WorldCat] [DOI] - ↑
Mirzadegan, T., Benkö, G., Filipek, S., & Palczewski, K. (2003).
Sequence analyses of G-protein-coupled receptors: similarities to rhodopsin. Biochemistry, 42(10), 2759-67. [PubMed:12627940] [PMC] [WorldCat] [DOI] - ↑
Rovati, G.E., Capra, V., & Neubig, R.R. (2007).
The highly conserved DRY motif of class A G protein-coupled receptors: beyond the ground state. Molecular pharmacology, 71(4), 959-64. [PubMed:17192495] [WorldCat] [DOI] - ↑
Hollenstein, K., Kean, J., Bortolato, A., Cheng, R.K., Doré, A.S., Jazayeri, A., ..., & Marshall, F.H. (2013).
Structure of class B GPCR corticotropin-releasing factor receptor 1. Nature, 499(7459), 438-43. [PubMed:23863939] [WorldCat] [DOI] - ↑
Galvez, T., Parmentier, M.L., Joly, C., Malitschek, B., Kaupmann, K., Kuhn, R., ..., & Pin, J.P. (1999).
Mutagenesis and modeling of the GABAB receptor extracellular domain support a venus flytrap mechanism for ligand binding. The Journal of biological chemistry, 274(19), 13362-9. [PubMed:10224098] [WorldCat] [DOI] - ↑
Geng, Y., Bush, M., Mosyak, L., Wang, F., & Fan, Q.R. (2013).
Structural mechanism of ligand activation in human GABA(B) receptor. Nature, 504(7479), 254-9. [PubMed:24305054] [PMC] [WorldCat] [DOI] - ↑
Wootten, D., Christopoulos, A., & Sexton, P.M. (2013).
Emerging paradigms in GPCR allostery: implications for drug discovery. Nature reviews. Drug discovery, 12(8), 630-44. [PubMed:23903222] [WorldCat] [DOI] - ↑
Bause, E. (1983).
Structural requirements of N-glycosylation of proteins. Studies with proline peptides as conformational probes. The Biochemical journal, 209(2), 331-6. [PubMed:6847620] [PMC] [WorldCat] [DOI] - ↑
Wheatley, M., & Hawtin, S.R. (1999).
Glycosylation of G-protein-coupled receptors for hormones central to normal reproductive functioning: its occurrence and role. Human reproduction update, 5(4), 356-64. [PubMed:10465525] [WorldCat] [DOI] - ↑
Nørskov-Lauritsen, L., & Bräuner-Osborne, H. (2015).
Role of post-translational modifications on structure, function and pharmacology of class C G protein-coupled receptors. European journal of pharmacology, 763(Pt B), 233-40. [PubMed:25981296] [WorldCat] [DOI] - ↑
Soto, A.G., Smith, T.H., Chen, B., Bhattacharya, S., Cordova, I.C., Kenakin, T., ..., & Trejo, J. (2015).
N-linked glycosylation of protease-activated receptor-1 at extracellular loop 2 regulates G-protein signaling bias. Proceedings of the National Academy of Sciences of the United States of America, 112(27), E3600-8. [PubMed:26100877] [PMC] [WorldCat] [DOI] - ↑
Nørskov-Lauritsen, L., & Bräuner-Osborne, H. (2015).
Role of post-translational modifications on structure, function and pharmacology of class C G protein-coupled receptors. European journal of pharmacology, 763(Pt B), 233-40. [PubMed:25981296] [WorldCat] [DOI] - ↑
Fukata, Y., & Fukata, M. (2010).
Protein palmitoylation in neuronal development and synaptic plasticity. Nature reviews. Neuroscience, 11(3), 161-75. [PubMed:20168314] [WorldCat] [DOI] - ↑
Chini, B., & Parenti, M. (2009).
G-protein-coupled receptors, cholesterol and palmitoylation: facts about fats. Journal of molecular endocrinology, 42(5), 371-9. [PubMed:19131499] [WorldCat] [DOI] - ↑
Nobles, K.N., Xiao, K., Ahn, S., Shukla, A.K., Lam, C.M., Rajagopal, S., ..., & Lefkowitz, R.J. (2011).
Distinct phosphorylation sites on the β(2)-adrenergic receptor establish a barcode that encodes differential functions of β-arrestin. Science signaling, 4(185), ra51. [PubMed:21868357] [PMC] [WorldCat] [DOI] - ↑
Butcher, A.J., Prihandoko, R., Kong, K.C., McWilliams, P., Edwards, J.M., Bottrill, A., ..., & Tobin, A.B. (2011).
Differential G-protein-coupled receptor phosphorylation provides evidence for a signaling bar code. The Journal of biological chemistry, 286(13), 11506-18. [PubMed:21177246] [PMC] [WorldCat] [DOI] - ↑
Srivastava, A., Gupta, B., Gupta, C., & Shukla, A.K. (2015).
Emerging Functional Divergence of β-Arrestin Isoforms in GPCR Function. Trends in endocrinology and metabolism: TEM, 26(11), 628-642. [PubMed:26471844] [WorldCat] [DOI]
Gタンパク質共役型受容体