GABA は成熟した中枢神経系における主要な抑制性神経伝達物質で、GABA 受容体にはイオンチャネル内蔵型のGABAA 受容体と代謝型のGABAB 受容体がある。
GABAA 受容体
GABAA受容体には、α1-6、β1-3、γ1-3、δ、ε、θ、πとρ1-3の少なくとも19種類のサブユニットが知られている[1]。これらのサブユニットは、いずれも4回膜貫通型タンパク質であり、グリシン受容体の場合と同様に、各サブユニットは第2膜貫通部位(M2)を中心に向けて5量体を形成し、中心部分に陰イオンチャネルを形成する。GABAA受容体は、脳内では、2α:2β:γ や2α:2β:δなど、さまざまなサブユニットの組み合わせの5量体で機能し、脳内では α1β2γ2 の組み合わせが最も多い。また、脳部位によってGABAA受容体サブユニットの発現量は異なっており、例えば α4サブユニットは視床腹側基底核(Ventrobasal Thalamus)と海馬歯状回(Dentate Gyrus)のニューロンに多く発現し、これらのニューロンでは α4β またはα4βδ という組み合わせで存在している[2]。GABAA受容体を構成するサブユニットの違いにより薬物に対する感受性が異なり、α1β2γ2で構成されるGABA受容体は、ベンゾジアゼピン化合物によってその機能が増強される。一方、α4βδで構成されるGABAA受容体は、GABAに対する感受性がα1β2γ2の場合に比べて高くなるが、ジアゼパム(diazepam)などのベンゾジアゼピン化合物に対して感受性を示さない。ρサブユニットは主として網膜に存在し、5つのρサブユニットで形成される受容体はGABAC受容体とも呼ばれる。このρサブユニットのみで構成される受容体は、ベンゾジアゼピン系薬物に反応せず、ビククリンによってもブロックされないなど他の GABAA受容体とは薬物に対する反応が大きく異なる[3] [4]。
上で述べた視床腹側基底核や海馬歯状回のニューロンには、他のニューロンと同様に α1サブユニットも発現しているが、α1サブユニットは γサブユニットと結合して、α1βγ型の受容体を形成している。このα1βγ受容体は、ベンゾジアゼピン結合部位を有するとともに、細胞内でゲフィリンと結合してシナプス下膜に集合する[5]。γサブユニットをもたないα4β型の受容体やα4βδ受容体はシナプス外に存在して持続性抑制に関与すると考えられているので[6] [7]、サブユニット構成の違いによって、脳部位だけでなく、1つの細胞の中でも局在が異なっていることが示唆され、サブユニットの違いによって生体内での機能的役割が異なると考えられる。
GABAA受容体およびGABAc受容体の応答は内蔵するCl-チャネルの開口によるCl-イオンの細胞内外への流出入によって引き起こされるため、生体内など細胞外Cl-イオン濃度がほぼ一定に保たれている環境下では、GABA受容体応答の変化は細胞内Cl-イオン濃度の変化に依存している。多くの成熟期の神経細胞ではCl-イオンの平衡電位は静止膜電位より過分極側にあるため、GABA受容体応答は過分極性であることが多い。しかし、未熟期や各種急性障害時には脱分極応答、すなわち興奮性作用を示す[8]。このGABAによる脱分極は、未熟期および障害時に神経細胞内Cl-イオン濃度が高いことに起因する。細胞内神経細胞内Cl-イオン濃度調節分子として、Na+-K+-Cl-共役担体(NKCC)、Na+-Cl-共役担体(NCC), K+Cl-共役担体(KCC)、HCO3-Cl-交換輸送体、細胞容積関連Cl-チャネルなど多くの分子・因子が挙げられる。GABA/グリシン受容体応答の過分極―脱分極のシフトはこれらの細胞内Cl-イオン濃度調節機構の変化による。ここでの注意点として、脱分極は必ずしも興奮性ではなく、脱分極でも膜コンダクタンスの増加、いわゆるシャント効果により細胞膜の興奮性を抑制する作用もある。
GABAB受容体
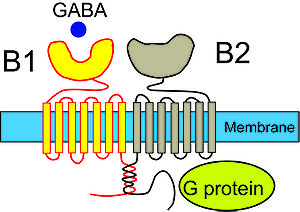
GABAB 受容体はGABAA受容体と異なり、陰イオンチャネルとは全く関連がない代謝型受容体で、Gタンパク質と共役している。GABAB 受容体はGABAB1 およびGABAB2 の2つのサブユニットから成り、それぞれ7回膜貫通型のタンパク質である[9]。GABAB1 サブユニットはアゴニストによる活性化を担い、GABAB2 サブユニットは細胞内のシグナル伝達を担うと考えられている。 GABAB 受容体の機能として、Gタンパク質を介してCa2+ チャネルやK+ チャネルと共役している。GABAB 受容体によるこれらのチャネルの制御は、Gタンパク質が直接行うと考えられており、拡散性のセカンドメッセンジャーを介さないことから、受容体の活性化から数ミリ秒以内にイオンチャネルの活性が変化する。GABA作動性シナプスのシナプス前神経終末部のGABAB 受容体は、Ca2+ チャネルを抑制することにより、神経伝達物質GABAの放出を抑制し、オートレセプターとして働く。シナプス後膜のGABAB受容体は、K+ チャネル(G-protein coupled inward rectifying K+ channel, GIRK チャネル)を活性化して、膜の過分極やシャント効果に寄与する。また、GABAB 受容体はアデニル酸環化酵素(adenylate cyclase)の活性を抑制することにより、細胞内シグナルカスケードに影響を与える。
参考文献
- ↑ http://www.iuphar-db.org/index.jsp IUPHAR data base
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
- ↑ Resource not found in PubMed.
1) IUPHAR data base (http://www.iuphar-db.org/index.jsp)
2) Glykys J and Mody I (2007) Activation of GABAA receptors: Views from outside the synaptic creft. Neuron 56, 763-770.
3) Farrant M and Nusser Z (2005) Variations on an inhibitory theme: phasic and tonic activation of GABAA receptors. Nat Neurosci 6, 215-229.
4) Cope DW, Hughes SW and Crunelli V (2005) GABAA receptor-mediated tonic inhibition in thalamic neurons. J Neurosci 25, 11553-11563.
5) Sassoe-Pognetto M and Fritschy J-M (2000) Gephyrin, a major postsynaptic protein of GABAergic synapses. Eur. J. Neurosci 12, 2205-2210.
6) Bormann J (2000) The ‘ABC’ of GABA receptors. Trends Pharmacol Sci 21, 16-19.
7) Quian H, Ripps H (2001) The GABAC receptors of retinal neurons. Prog Brain Res 131, 295-308.
8) Kakazu et al. (1999) Regulation of intracellular chloride by cotransporters in developing lateral superior olive neurons. J Neurosci 19, 2843-2851.
9) Pin et al. (2009) G-protein-coupled receptor oligomers: two or more for what? Lessons from mGlu and GABAB receptors. J Physiol 587, 5337-5344.
(執筆者:石橋仁、鍋倉淳一 担当編集委員:柚崎通介)