ホスホリパーゼC
少作 隆子
金沢大学 医薬保健研究域 保健学系 医薬保健研究域 保健学系
DOI:10.14931/bsd.490 原稿受付日:2012年1月25日 原稿完成日:2012年1月27日
担当編集委員:林 康紀(独立行政法人理化学研究所 脳科学総合研究センター)
英語名:Phospholipase C 英語略名:PLC
ホスホリパーゼCはリン脂質をグリセロールとリン酸との間のエステル結合を加水分解する酵素である。主な基質であるホスファチジルイノシトール4,5-二リン酸を、イノシトール1,4,5-三リン酸とジアシルグリセロールに分解する。分解によって得られたイノシトール1,4,5-三リン酸とジアシルグリセロールはそれぞれ細胞内情報伝達物質として機能する。
ホスホリパーゼCとは
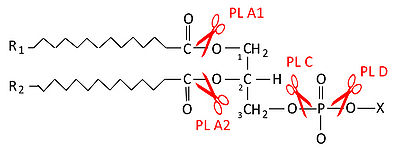
ホスホリパーゼC(phospholipase C、PLC)は、生体膜の主要成分であるリン脂質を加水分解する酵素群(phospholipase)の中の、グリセロールとリン酸の間のエステル結合を加水分解する酵素である。主な基質であるホスファチジルイノシトール4,5-二リン酸(phosphatidylinositol 4,5-bisphosphate, PIP2)を、イノシトール1,4,5-三リン酸(inositol 1,4,5-triphosphate, IP3)とジアシルグリセロール(diacylglycerol, DAG)に分解する。
この反応により生じる
- PIP2低下、
- IP3生成、
- DAG生成、
はそれぞれシグナルとして働き細胞内で多様な反応を引き起こす。例えば、(1)PIP2低下はイオンチャネルの働きを変化させ、(2)IP3はIP3受容体を介する小胞体からのCa2+放出により細胞内Ca2+濃度を局所的に上昇させ、(3) DAGはプロテインキナーゼC(protein kinase C, PKC)やTRPCチャネルを活性化する。
また、DAGがジアシルグリセロールリパーゼ(diacylglycerol lipase, DGL)により分解されると、内因性カンナビノイドである2-アラキドノイルグリセロール(2-arachidonoylglycerol, 2-AG)が生成され、それはさらにカンナビノイド受容体(CB1, CB2)を介して様々な反応を引き起こす。
活性
PLCは、生体膜の主要成分であるリン脂質を加水分解する酵素群の中の、グリセロールとリン酸の間のエステル結合を加水分解する酵素の総称である(図1)。PLCは受容体刺激により活性化され、主な基質であるホスファチジルイノシトール4,5-二リン酸(PIP2)を、イノシトール1,4,5-三リン酸(IP3)とジアシルグリセロール(DAG)に分解する。
分子構造による分類
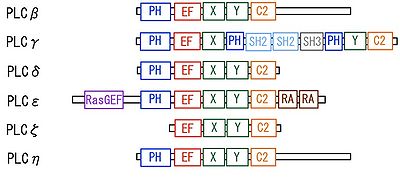
PLCは構造的にβ、γ、δ、ε、ζ、ηの6つのタイプに分類され、哺乳動物ではβ1-4、γ1-2、δ1,3-4、ε、ζ、η1-2の合わせて13種類のサブタイプが同定されている(図2)。また、いくつかのサブタイプについてはsplicing variantが報告されている。Splicing variantの一部を除くと、すべてのPLCは酵素活性を司るXドメインとYドメインの他に、さまざまなシグナル関連物質と相互作用するPHドメイン(ζ型を除く)、Ca2+結合能を有するEFハンドモチーフおよびC2ドメインを共通に有する。これらの基本的なドメイン構造に加え、PLCγではSrc相同ドメインのSH2ドメインおよびSH3ドメイン, PLCεではRasGEF(Ras guanine nucleotide exchange factor)様ドメインおよびRA(Ras association)ドメインなど、各タイプに特徴的なドメイン構造がみられる。
体内および脳内での分布
哺乳動物におけるPLCの各サブタイプの発現量は、組織により、また、脳の部位や細胞の種類により大きく異なる。各タイプの高発現部位は以下の通りである。
PLCβ
PLCβ1, 3, 4は脳で発現が高いが、その分布は脳領域により異なる。PLCβ1は主に大脳で、PLCβ3 は小脳尾側部で、PLCβ4は小脳吻側部、視床、脳幹に分布する[1]。PLCβ2は脳での発現は低い。脳以外の部位としては、PLCβ2は造血組織由来細胞で、PLCβ3は肝臓、耳下腺で、PLCβ4は網膜に多く分布する。
PLCγ
PLCγ1は脳および胎生組織で発現が高く、脳内では広く分布している。一方、PLCγ2は造血組織由来細胞で発現が高く、脳内では下垂体前葉や小脳などの限られた領域に選択的に発現している。
PLCδ
PLCδはPLCβやPLCγに比べると相対的に量は少ない。PLCδ1はPLCδタイプの中で最も量が多くかつ広く分布しており、高発現組織は骨格筋、脾臓、精巣、肺などである。脳では主にアストログリアに発現し、ニューロンでは少ない。PLCδ3は腎臓および心臓に、PLCδ4は脳、骨格筋、精巣、腎臓に発現している。
PLCε
PLCεは心臓で最も発現が高く、腎臓、肺、脳がその後に続く。
PLCζ
精巣でのみ発現がみられる。
PLCη
PLCη1およびPLCη2は神経系で発現が高く、大脳皮質、海馬、小脳、嗅球で発現が高い。
活性調節
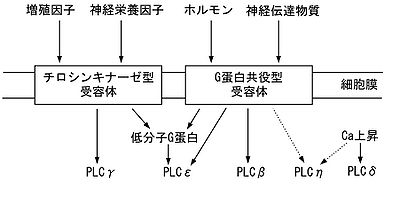
各タイプはそれぞれ異なる活性調節を受ける[2][3][4][5]。精巣にのみ発現するPLCζを除く5つのタイプについて、どのようなシグナルにより活性化されるのかを神経系の場合を念頭において説明する。図3は、各タイプのPLCが細胞膜のどのタイプの受容体の下流にあるのかをおおまかに示したものである。
PLCβ
主な活性化経路は7回膜貫通型三量体Gタンパク質共役型受容体(以下、Gタンパク質共役型受容体)を介したものである。Gq共役型受容体を介して活性化される三量体Gタンパク質のαサブユニットが作用する経路と、Gi共役型受容体刺激により遊離するβγサブユニットが作用する経路とがある。PLCβを活性化しうるαサブユニットはGαqファミリー(脳ではGαqおよびGα11)であり、PLCβのC末の調節ドメインに結合し作用する。PLCβ1-4のいずれも活性化しうるがPLCβ1およびPLCβ4への作用が最も強く、PLCβ2への作用が最も弱い。一方、βγサブユニットはPLCβ2およびPLCβ3に作用するが、PLCβ1への作用は弱く、PLCβ4には作用しない。また、PLCβ2およびPLCβ3は、Racなどの低分子量Gタンパク質による活性化も報告されている。
PLCγ
主な活性化経路は増殖因子や神経栄養因子などに対するチロシンキナーゼ活性を有する受容体を介したものである。リガンドの結合により受容体の自己チロシンリン酸化が起こり、その部位にPLCγがSH2ドメインを介して結合し、その後PLCγ自身もチロシンリン酸化され活性化される。それと同時に、受容体はホスファチジルイノシトール3-キナーゼ(phosphatidylinositol 3-kinase, PI3K)を活性化し、それにより産生されるホスファチジルイノシトール3,4,5-三リン酸(phosphatidylinositol 3,4,5-triphosphate, PIP3)はPLCγを膜へ移動させ活性化を促進する。また、Gタンパク質共役型受容体などを介してPLCγを活性化させる経路、さらにはチロシンリン酸化を介さない経路など、さまざまな活性化経路が報告されている。
PLCδ
主な活性化因子は細胞内Ca2+濃度上昇(1-10μM)であると考えられている。Ca2+イオンはPLCδのPHドメインとPIP2との結合を促進させるなどの作用によりPLCδを膜に移動させ酵素活性を高める。細胞内Ca2+濃度上昇はPLCの下流シグナルでもあることから、膜の受容体を介して他のタイプのPLCが活性化されCa2+濃度上昇が起こると、さらにPLCδが活性化されシグナルが増幅される、という可能性が示唆されている。また、PLCδ1については、トランスグルタミナーゼ活性を有するGTP結合タンパク質の1種Ghによる活性調節が報告されている。
PLCε
PLCεの活性化経路は多様であり、様々な低分子量Gタンパク質やGタンパク質共役型受容体を介する経路が報告されている。RasファミリーのRasやRapはGTP依存的にPLCεのRAドメインに結合し、RhoファミリーのRhoA、RhoB、RhoCはYドメインのPLCε固有のアミノ酸配列に結合し、それぞれPLCεを活性化する。また、β2アドレナリン受容体やプロスタグランジンE1受容体などのGs共役型受容体を介してcAMPが産生されると、cAMP依存性グアニンヌクレオチド交換反応促進因子を介してRap2Bが活性化され、それがPLCεのRAドメインに結合しPLCεを活性化する。また、PLCεは三量体Gタンパク質のGα12やGβγサブユニットによっても活性化されることが報告されている。
PLCη
2005年に発見された最も新しいタイプのPLCであり、その活性化経路については不明の点が多い。PLCη1、PLCη2ともにCa2+に対する感受性が高く、また、PLCβ2やPLCβ3と同様に三量体Gタンパク質のβγサブユニットにより活性化されることからGタンパク質共役型受容体を介する経路が示唆されている。しかし、Gβγの作用が直接的なのか間接的なのかは明らかではない。
PLC下流シグナルの働き
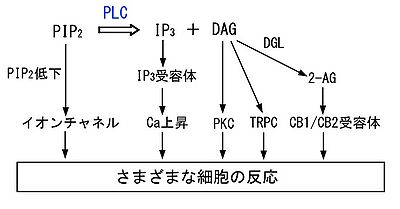
PLCの活性化は、基質であるPIP2の減少と産物であるIP3とDAGの生成をもたらす。これら3つの因子はそれぞれシグナルとして働き、細胞内で多様な反応を引き起こす(図4)。代表的なものを以下に示す。
PIP2
多くのタンパク質は特定のイノシトールリン脂質(PIP2を含む)を認識するドメインを有しており、よってPIP2の濃度変化はそれらのタンパク質の機能に影響をおよぼしうる[6]。PIP2により活性が高められることが報告されているチャネルには、内向き整流K+チャネル(Kir1, Kir2, Kir3, Kir6)、N型電位依存性Ca2+チャネル、M電流を担うK+チャネル(Mチャネル、KCNQ/Kv7)、TRPチャネル(transient receptor potential channel)ファミリー(TRPV1, TRPM5, TRPM7, TRPM8)、リアノジン受容体、などがある。M1ムスカリン性アセチルコリン受容体刺激によるMチャネルの抑制は、PIP2減少によると考えられている。
IP3
PLCにより生成されるIP3は、IP3受容体に結合し小胞体からCa2+を放出させ、細胞内Ca2+濃度上昇をもたらす。Gq共役型受容体刺激により起こる初期のCa2+濃度上昇においては、PLCβを介してのこの経路の役割が大きい。
DAG
PLCにより生成されるDAGは、プロテインキナーゼC(protein kinase C, PKC)を活性化し、様々なタンパク質の機能に影響をおよぼす。DAGはまた、非選択性陽イオンチャネルを構成するTRPファミリーの中のTRPC3、TRPC6、TRPC7を活性化する。これらのチャネルはCa2+透過性があるため、Ca2+を細胞内に流入させ細胞内Ca2+濃度上昇を引き起こしうる。
DAGにジアシルグリセロールキナーゼ(diacylglycerol kinase)が作用するとホスファチジン酸(phosphatidic acid)が、一方、ジアシルグリセロールリパーゼ(diacylglycerol lipase, DGL)が作用すると2-AGがそれぞれ生成され、どちらの分子もシグナルとして働きうる。2-AGは内因性カンナビノイド(endocannabinoid)の1つであり、神経系においてはCB1受容体を介して、免疫系においてはCB2受容体を介して多様な反応を引き起こしうる。
Gq共役型受容体-PLCβを介する反応の例
神経系、特に中枢ニューロンのPLCの働きに関する研究の多くは、Gq共役型受容体–PLCβを介する反応を調べたものである。そこで、海馬ニューロンのムスカリン性受容体を介する反応を例に挙げ説明する。海馬ニューロンにおいて、電気刺激による内在アセチルコリンの遊離、あるいはアセチルコリン受容体アゴニストの投与によりさまざまな反応が引き起こされることが報告されている。その中からPLCβを介すると思われるものを以下に示す。一部の反応については、ノックアウトマウスを用いて、関与する受容体とPLCのタイプが主にM1受容体とPLCβ1であることが証明されている。すべて証明された訳ではないが、他の反応も同様であると思われる。
静止膜電位の変化
ムスカリン受容体刺激は細胞のタイプや条件によりさまざまな膜電位変化(単相性の脱分極、単相性の過分極、両者が混ざったもの)をもたらす[7]。脱分極のメカニズムとしては、非選択性陽イオンチャネルの活性化[8]とK+チャネルの抑制[9]とがある。非選択性陽イオンチャネルの分子実態は不明であるが、TRPファミリーの一員である可能性が高く、TPRC4およびTRPC5の関与が示唆されている[10]。これらのチャネルの活性化経路は不明であるが、PLCの下流の何らかのシグナルが関与していると考えられる。ムスカリン受容体刺激により抑制されるK+チャネルは主にMチャネルであるが[11]、内向き整流K+チャネルやその他のK+チャネルの関与も示唆されている[12]。メカニズムとしては、少なくともMチャネルの場合は、PIP2減少の関与の可能性が高い[13]。過分極のメカニズムとしては、IP3を介する細胞内Ca2+濃度上昇により、アパミン感受性のCa2+依存性K+チャネル(SKチャネル)が活性化されることが考えられる[14]。
後脱分極
ムスカリン受容体アゴニストを投与すると、活動電位発生直後に脱分極がみられるようになる。また、活動電位の後の脱分極が長く続く場合もある。前者はslow afterdepolarization(sADP)、後者はplateau potential(PP)と呼ばれ[15]、いずれも非選択性陽イオンチャネルの活性化[16]およびMチャネルの抑制の関与が示唆[17]されている。
細胞内Ca2+濃度上昇
ムスカリン受容体刺激は細胞内Ca2+濃度上昇をもたらす。メカニズムとしては、IP3を介して小胞体からCa2+が放出されること、PLCの下流の何らかのシグナルにより活性化された非選択性陽イオンチャネルを介してCa2+が流入すること、脱分極により活性化された電位依存性Ca2+チャネルを介してCa2+が流入すること、などが関与しうる。樹状突起のムスカリン受容体を局所的に短時間刺激すると、Ca2+濃度上昇の波が細胞体に向かって伝播するのがみられる。このCa2+ waveにおいてはIP3受容体を介するCa2+放出が重要な役割を担っている[18]。
NMDA受容体に及ぼす影響
NMDA型グルタミン酸受容体はシナプス可塑性の誘導において重要な役割を担っている。ムスカリン受容体刺激はNMDA受容体のチャネル機能に影響を及ぼす。主たる作用は促進作用であるが、条件によっては抑制作用もみられる。促進作用についてはPKC[19]、抑制作用についてはカルモジュリンの関与[20]が報告されている。
シナプス可塑性の誘導および促進
ムスカリン受容体刺激はシナプス可塑性にも影響をおよぼす。CA1錐体細胞への興奮性入力において、ムスカリン受容体刺激は、長期抑圧(long-term depression, LTD)や長期増強(long-term potentiation, LTP)を単独で誘導し、また、電気刺激で誘導されるLTPを促進することが報告されている。LTDの誘導にはCa2+濃度上昇とタンパク合成が必要であること[21]、LTPの誘導にはIP3受容体を介するCa2+放出[22]とPKCが関与すること[23]、LTPの促進については、前述のNMDA受容体に対する促進作用やSKチャネルの抑制が関与すること、などの報告がある。SKチャネル抑制の関与については、M1受容体の活性化によりPKCを介してSKチャネルが抑制され、それによりLTP誘導時の興奮性シナプス後電位(excitatory postsynaptic potential, EPSP)の持続時間が延び、それによりNMDA受容体のチャネル機能が促進される、と説明されている[24]。
内因性カンナビノイド2-AGの放出
シナプス後側のムスカリン受容体刺激はPLCβを介してDAGを、さらにDGLを介して2-AGを生成する。2-AGは細胞外へと拡散し、シナプス前終末のCB1受容体に結合し、伝達物質の放出を抑制する[25][26]。
海馬のムスカリン受容体の場合を例に挙げたが、他の脳領域や他のGq共役型受容体の場合も同様に考えることができる。しかし、どの受容体を介してどのような反応が引き起こされるのかは細胞により大きく異なり、発現しているシグナル関連分子の発現量や分布様式により決まると考えられる。
参考文献
- ↑
Watanabe, M., Nakamura, M., Sato, K., Kano, M., Simon, M.I., & Inoue, Y. (1998).
Patterns of expression for the mRNA corresponding to the four isoforms of phospholipase Cbeta in mouse brain. The European journal of neuroscience, 10(6), 2016-25. [PubMed:9753089] [WorldCat] [DOI] - ↑
Rebecchi, M.J., & Pentyala, S.N. (2000).
Structure, function, and control of phosphoinositide-specific phospholipase C. Physiological reviews, 80(4), 1291-335. [PubMed:11015615] [WorldCat] [DOI] - ↑
Rhee, S.G. (2001).
Regulation of phosphoinositide-specific phospholipase C. Annual review of biochemistry, 70, 281-312. [PubMed:11395409] [PMC] [WorldCat] [DOI] - ↑
Cockcroft, S. (2006).
The latest phospholipase C, PLCeta, is implicated in neuronal function. Trends in biochemical sciences, 31(1), 4-7. [PubMed:16310357] [WorldCat] [DOI] - ↑
Oude Weernink, P.A., Han, L., Jakobs, K.H., & Schmidt, M. (2007).
Dynamic phospholipid signaling by G protein-coupled receptors. Biochimica et biophysica acta, 1768(4), 888-900. [PubMed:17054901] [WorldCat] [DOI] - ↑
Suh, B.C., & Hille, B. (2005).
Regulation of ion channels by phosphatidylinositol 4,5-bisphosphate. Current opinion in neurobiology, 15(3), 370-8. [PubMed:15922587] [WorldCat] [DOI] - ↑
Widmer, H., Ferrigan, L., Davies, C.H., & Cobb, S.R. (2006).
Evoked slow muscarinic acetylcholinergic synaptic potentials in rat hippocampal interneurons. Hippocampus, 16(7), 617-28. [PubMed:16770798] [WorldCat] [DOI] - ↑
Fisahn, A., Yamada, M., Duttaroy, A., Gan, J.W., Deng, C.X., McBain, C.J., & Wess, J. (2002).
Muscarinic induction of hippocampal gamma oscillations requires coupling of the M1 receptor to two mixed cation currents. Neuron, 33(4), 615-24. [PubMed:11856534] [WorldCat] [DOI] - ↑
McQuiston, A.R., & Madison, D.V. (1999).
Muscarinic receptor activity has multiple effects on the resting membrane potentials of CA1 hippocampal interneurons. The Journal of neuroscience : the official journal of the Society for Neuroscience, 19(14), 5693-702. [PubMed:10407010] [PMC] [WorldCat] - ↑
Fowler, M.A., Sidiropoulou, K., Ozkan, E.D., Phillips, C.W., & Cooper, D.C. (2007).
Corticolimbic expression of TRPC4 and TRPC5 channels in the rodent brain. PloS one, 2(6), e573. [PubMed:17593972] [PMC] [WorldCat] [DOI] - ↑
Halliwell, J.V., & Adams, P.R. (1982).
Voltage-clamp analysis of muscarinic excitation in hippocampal neurons. Brain research, 250(1), 71-92. [PubMed:6128061] [WorldCat] [DOI] - ↑
Chiang, P.H., Yeh, W.C., Lee, C.T., Weng, J.Y., Huang, Y.Y., & Lien, C.C. (2010).
M(1)-like muscarinic acetylcholine receptors regulate fast-spiking interneuron excitability in rat dentate gyrus. Neuroscience, 169(1), 39-51. [PubMed:20433901] [WorldCat] [DOI] - ↑
Brown, D.A. (2010).
Muscarinic acetylcholine receptors (mAChRs) in the nervous system: some functions and mechanisms. Journal of molecular neuroscience : MN, 41(3), 340-6. [PubMed:20446119] [WorldCat] [DOI] - ↑
Gulledge, A.T., & Kawaguchi, Y. (2007).
Phasic cholinergic signaling in the hippocampus: functional homology with the neocortex? Hippocampus, 17(5), 327-32. [PubMed:17407133] [WorldCat] [DOI] - ↑
Fraser, D.D., & MacVicar, B.A. (1996).
Cholinergic-dependent plateau potential in hippocampal CA1 pyramidal neurons. The Journal of neuroscience : the official journal of the Society for Neuroscience, 16(13), 4113-28. [PubMed:8753873] [WorldCat] - ↑
Hofmann, M.E., & Frazier, C.J. (2010).
Muscarinic receptor activation modulates the excitability of hilar mossy cells through the induction of an afterdepolarization. Brain research, 1318, 42-51. [PubMed:20079344] [PMC] [WorldCat] [DOI] - ↑
Yue, C., & Yaari, Y. (2004).
KCNQ/M channels control spike afterdepolarization and burst generation in hippocampal neurons. The Journal of neuroscience : the official journal of the Society for Neuroscience, 24(19), 4614-24. [PubMed:15140933] [PMC] [WorldCat] [DOI] - ↑
Power, J.M., & Sah, P. (2002).
Nuclear calcium signaling evoked by cholinergic stimulation in hippocampal CA1 pyramidal neurons. The Journal of neuroscience : the official journal of the Society for Neuroscience, 22(9), 3454-62. [PubMed:11978822] [PMC] [WorldCat] [DOI] - ↑
MacDonald, J.F., Kotecha, S.A., Lu, W.Y., & Jackson, M.F. (2001).
Convergence of PKC-dependent kinase signal cascades on NMDA receptors. Current drug targets, 2(3), 299-312. [PubMed:11554554] [WorldCat] [DOI] - ↑
Grishin, A.A., Benquet, P., & Gerber, U. (2005).
Muscarinic receptor stimulation reduces NMDA responses in CA3 hippocampal pyramidal cells via Ca2+-dependent activation of tyrosine phosphatase. Neuropharmacology, 49(3), 328-37. [PubMed:15993905] [WorldCat] [DOI] - ↑
Kumar, A. (2010).
Carbachol-induced long-term synaptic depression is enhanced during senescence at hippocampal CA3-CA1 synapses. Journal of neurophysiology, 104(2), 607-16. [PubMed:20505129] [PMC] [WorldCat] [DOI] - ↑
Fernández de Sevilla, D., Núñez, A., Borde, M., Malinow, R., & Buño, W. (2008).
Cholinergic-mediated IP3-receptor activation induces long-lasting synaptic enhancement in CA1 pyramidal neurons. The Journal of neuroscience : the official journal of the Society for Neuroscience, 28(6), 1469-78. [PubMed:18256268] [PMC] [WorldCat] [DOI] - ↑
Fernández de Sevilla, D., & Buño, W. (2010).
The muscarinic long-term enhancement of NMDA and AMPA receptor-mediated transmission at Schaffer collateral synapses develop through different intracellular mechanisms. The Journal of neuroscience : the official journal of the Society for Neuroscience, 30(33), 11032-42. [PubMed:20720110] [PMC] [WorldCat] [DOI] - ↑
Buchanan, K.A., Petrovic, M.M., Chamberlain, S.E., Marrion, N.V., & Mellor, J.R. (2010).
Facilitation of long-term potentiation by muscarinic M(1) receptors is mediated by inhibition of SK channels. Neuron, 68(5), 948-63. [PubMed:21145007] [PMC] [WorldCat] [DOI] - ↑
Kano, M., Ohno-Shosaku, T., Hashimotodani, Y., Uchigashima, M., & Watanabe, M. (2009).
Endocannabinoid-mediated control of synaptic transmission. Physiological reviews, 89(1), 309-80. [PubMed:19126760] [WorldCat] [DOI] - ↑
Fukudome, Y., Ohno-Shosaku, T., Matsui, M., Omori, Y., Fukaya, M., Tsubokawa, H., ..., & Kano, M. (2004).
Two distinct classes of muscarinic action on hippocampal inhibitory synapses: M2-mediated direct suppression and M1/M3-mediated indirect suppression through endocannabinoid signalling. The European journal of neuroscience, 19(10), 2682-92. [PubMed:15147302] [WorldCat] [DOI]